南流江河口区春季浮游植物群落结构组成与分布特征
2017-10-09叶又茵项鹏王磊杨燕燕王雨林茂蓝文陆
叶又茵,项鹏,王磊,杨燕燕,王雨,林茂,蓝文陆
(1.国家海洋局第三海洋研究所,福建 厦门361005;2.广西壮族自治区海洋环境监测中心站,广西 北海 536000)
南流江河口区春季浮游植物群落结构组成与分布特征
叶又茵1,项鹏1,王磊1,杨燕燕1,王雨1,林茂1,蓝文陆2*
(1.国家海洋局第三海洋研究所,福建 厦门361005;2.广西壮族自治区海洋环境监测中心站,广西 北海 536000)
通过2016年3月底现场航次11个站点的调查,应用反相高效液色谱(RP-HPLC)并结合二极管阵列检测器分析技术,分析了春季广西南流江河口区浮游植物光合色素组成,进而由CHEMTAX软件估算全粒级浮游植物的群落结构。结果表明:春季含量较高的浮游植物特征光合色素含量以叶绿素b最高,其次为岩黄藻素;浮游植物的优势类群为隐藻,其次为绿藻和硅藻,它们分别平均占据了浮游植物生物量的54.95%、23.36%和17.37%,其他藻类所占比例很低。南流江河口区浮游植物群落结构东西部入海分支有较大差异:东部分支营养盐较西部分支低,隐藻所占生物量比例最高,其次为绿藻和硅藻,浮游植物群结构与分布受营养盐因素影响较大;西部分支营养盐含量明显比东部分支高,绿藻和硅藻的所占比例有所提升,隐藻的生物量所占比则有所下降,浮游植物群落结构与分布受非营养盐因素的影响较大。南流江河口区浮游植物生物量和群落结构除了受营养盐影响外,还与浊度、盐度等密切相关,表明南流江浊度增加已明显影响着生态系统结构与功能,需要密切关注和进一步研究。
光合色素;浮游植物;群落结构;南流江河口
1 引言
在河口水域,复杂多变的理化环境与浮游植物群落组成和分布有着密切关系,其中营养盐氮、磷是控制浮游植物生长最重要的环境因子之一,它和人们活动密切相关[1]。另一方面,浮游植物的群落结构和分布可以反映生态系统对环境变化的响应,也揭示人类活动对河口区的生态影响。随着HPLC色素分析结合矩阵因子化程序CHEMTAX研究浮游植物群落结构的方法在太平洋、大西洋和南大洋等各大海域得到广泛应用,我国学者也开始应用HPLC对河口区域浮游植物群落结构进行研究,如长江口、珠江河口和钦州湾等,以期掌握河口区的浮游植物群落结构特征及其主要影响因素,并为河口区生态保护提供科学基础支撑。
南流江发源于广西大容山,流经玉林、钦州和北海3个市级行政区,是广西南部独自流入大海诸河中流程最长、流域最广、水量最为丰富的河流[2]。近年来,随着南流江流域社会经济的高速发展,将大量营养物质带入江内,使得南流江河口及临近水域营养浓度及其结构发生变化,同时近年来流域内大量的采砂活动明显增多,这些环境的改变是否会对河口及其附近海域的浮游植物群落结构组成产生较大变化并影响河口区生态系统结构和功能受到人们越来越多的关注,但目前该河口区域有关于这方面的调查研究却鲜少报道。本次对南流江江口水域的环境、浮游植物光合色素组成和分布特点进行调查,并应用CHEMTAX分析了浮游藻类群落结构,揭示其组成和分布格局及影响因素,探讨南流江人为活动对河口区的环境和生态影响,以期为南流江河口生态保护和经济可持续发展提供科学依据。
2 材料与方法
2.1 研究站位
南流江在合浦县党江镇和沙岗镇注入廉州湾,目前主要有4个入海口(图1),其中最主要的入海口为在沙岗镇入海的西部入海支流(干流河口)和在党江镇入海的东部入海支流(木案江河口)。2016年3月31日对南流江河口区的11个站点开展了现场航次调查,其中在东部支流设置6个站位(S1~S6测站),在西部支流设置5个站位(S7~S11 测站)。

图1 站点布设Fig.1 Location of sampling stations
2.2 样品的采集与分析
各测站采集表层水样(水面下0.5 m),样品用5 L的采水器采集。
水温、盐度、pH、溶解氧和浊度现场采用水质多参数仪(美国YSI6600)进行监测,无机氮、活性磷酸盐(溶解态,下同)等环境因子的采集与测定方法依据国家《地表水环境质量标准》(GB 3838-2002)[3]进行。
光合色素样品在采集后放置于低温避光处并迅速带回实验室立即过滤。2~3 L水样经孔径 0.7 μm GF/F 滤膜收集,过滤负压小于0.6 atm(1 atm=101 325 Pa)。滤膜对折后放置入铝箔袋中,于液氮中保存。将滤膜夹于滤纸中解冻,吸去多余水分;以2 mL N,N-二甲基甲酰胺(DMF)为提取剂。在-20℃暗处放置2 h以充分提取色素;充分混合后离心(5 min,4 kg,-4℃),取上清液,用13 mm针筒过滤器(Millipore)滤过GF/F 滤膜,收集滤液(2 mL)于棕色色谱小瓶。整个过程均在低光照强度、低温条件下进行,以减少光和色素的降解。
2.3 浮游植物色素分析
2.3.1 光合色素提取
在对样品进行提取的操作中,首先将滤膜外的残余海水吸干,之后将滤膜剪碎;加入3 mL N,N-二甲基甲酰胺 (N,N-dimethylformamide,DMF),于-20℃避光提取1 h[4]。然后在暗室条件下将提取液振荡数十秒后取上清液。再将上清液以13 mm直径的Whatman®GF/F滤膜 (Swinnex Filter Holder) 过滤。取0.6 mL滤过的上清液与0.6 mL浓度为1 mol/L的乙酸铵混合于体积为1.5 mL的棕色色谱瓶中,然后避光保存于-20℃冰箱中,待HPLC分析。本研究采用DMF作为光合色素的有机提取溶剂,主要是由于与如甲醇、丙酮等试剂相比,具有提取速度快,回收率高、提取效率较高等优点[4-6]。
2.3.2 HPLC分析
分析系统为岛津LC20A液相色谱工作站,采用二极管阵列检测器(DAD)检测洗脱峰,扫描波段为300~700 nm,以固定波长440 nm和663 nm记录峰谱特征。采用3.5 μm粒径的Eclipse XDB C8分离柱 (100×4.6 mm; Agilent Technologies, Germany)。流动相A为体积比4∶1的甲醇∶1 mol/L乙酸铵缓冲溶液,流动相B为甲醇。 梯度洗脱程序如表1所示,流动相流速为1 mL/min。每两次样品注射至程序启动间的时间间隔10 min,使色谱柱的极性状态充分平衡[7]。
表1光合色素HPLC分离分析梯度洗脱程序
Tab.1ThelineargradientelutionprocedureofHPLC-pigmentanalysis

2.3.3 光合色素的定性
用于进行定性和定量分析的光合色素标准品购于丹麦DHI公司 (DK-2970 Hørsholm, Denmark),通过标准品的HPLC分析确定各种光合色素的保留时间 (tR) 以及吸收光谱 (300~800 nm) 特征。参照标准光合色素扫描图谱以及文献[5,7-8]所提供的光合色素tR及最大吸收波长等参数来对环境样品进行定性分析。由于本文进行色谱分析时梯度洗脱程序与相关文献所用存在一定的差别,因此tR与文献报道也有所差异,但总体上的顺序不会改变。各主要光合色素的保留时间如图2所示。另外,各光合色素吸收光谱特征图见图2。
2.3.4 光合色素的定量
参考Stoń 和Kosakowska的方法对不同稀释浓度下的各色素标准品进行色谱分析[9],测得各色素在不同浓度下的440 nm波长的光吸收信号。之后与浓度做线性回归,斜率为各色素浓度的换算因子 (fp)。获得各种色素的fp后,根据公式Cp=ApfpVext/VinjVfiltB进行浓度计算。 公式中Cp为色素的浓度,单位为:mg/m3;Ap各色素洗脱峰的面积,单位为:mAU·s;fp为各色素浓度与峰面积线性回归方程的斜率,单位为:mg/mAU;Vext为样品提取液体积,单位为:mL;Vfilt为过滤海水样品的体积,单位为:L;Vinj为高效液相色谱分析时的进样体积,单位为:μL;B为缓冲液的稀释因子。
2.4 利用特征色素分析浮游植物群落组成
据检测到的特征色素种类和显微镜镜检到的藻类类群,将浮游植物类群主要分为硅藻(Diatoms)、甲藻(Dinoflagellates)、隐藻(Cryptophytes)、定鞭藻(Prymnesiophytes)、金藻(Chrysophytes)、绿藻(Chlorophytes)、青绿藻(Prasinophytes)和蓝藻(Cyanobacteria)。浮游植物各类群丰度主要通过CHEMTAX矩阵因子程序对12种特色色素分析得来,表示为叶绿素a生物量(ng/L)。CHEMTAX是从藻类初始特征色素与叶绿素a比值出发,再根据由HPLC分析所得的原始色素数据,通过最速下降算法反复地优化一个包含每一个藻种的色素比率矩阵,来定量地确定浮游植物种群组成和丰度。各浮游植物类群的特征光合色素与叶绿素a比值初始值见文献[1,4,10]所报道的(表2)。
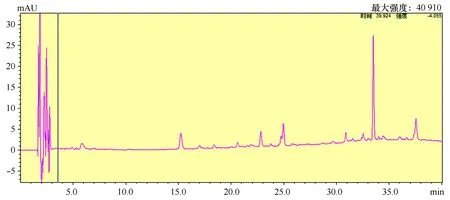
图2 浮游植物光合色素HPLC分析色谱图Fig.2 Chromatogram of HPLC-pigments
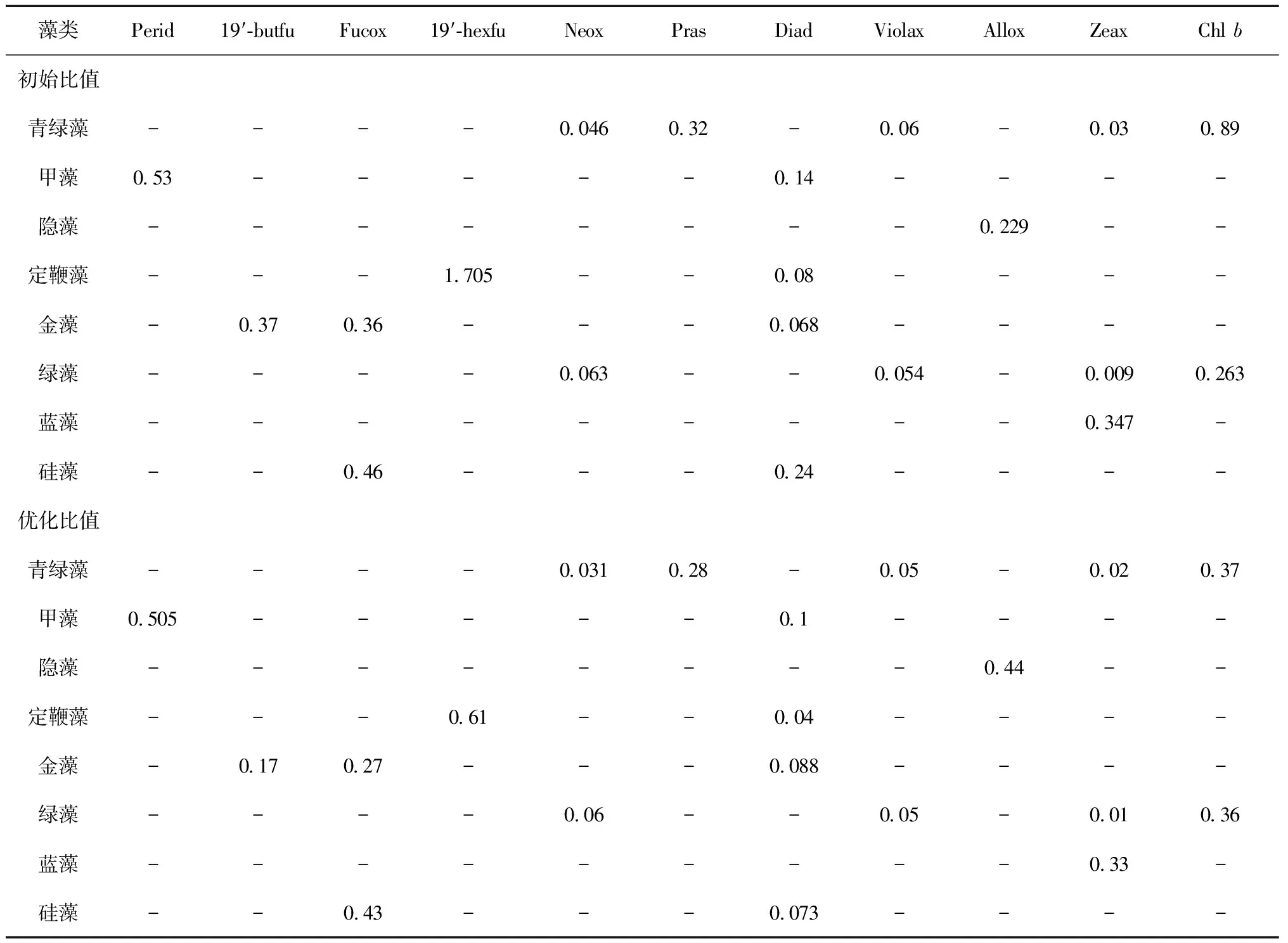
藻类Perid19′⁃butfuFucox19′⁃hexfuNeoxPrasDiadViolaxAlloxZeaxChlb初始比值青绿藻----0046032-006-003089甲藻053-----014----隐藻--------0229--定鞭藻---1705--008----金藻-037036---0068----绿藻----0063--0054-00090263蓝藻---------0347-硅藻--046---024----优化比值青绿藻----0031028-005-002037甲藻0505-----01----隐藻--------044--定鞭藻---061--004----金藻-017027---0088----绿藻----006--005-001036蓝藻---------033-硅藻--043---0073----
注:Perid: 多甲藻黄素,19′-butfu: 19′-丁酰基氧化岩藻黄素,Fucox: 岩藻黄素,19′-hexfu: 19′-已酰基氧化岩藻黄素,Neox: 新黄素,Pras: 青绿素,Diad: 硅甲藻黄素,Violax: 紫黄素,Allox: 别黄素,Zeax: 玉米黄素,Chlb: 叶绿素b,下同。
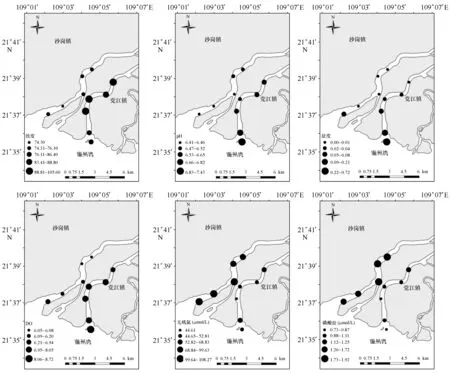
图3 环境参数分布Fig.3 Distribution of environmental parameters

图4 叶绿素a浓度的平面分布Fig.4 Distributions of chlorophyll a

图5 主要光合色素浓度的平面分布Fig.5 Distributions of main pigment concentration

图6 浮游植物主要类群生物量的分布Fig.6 Distribution of main phytoplankton groups’ biomass
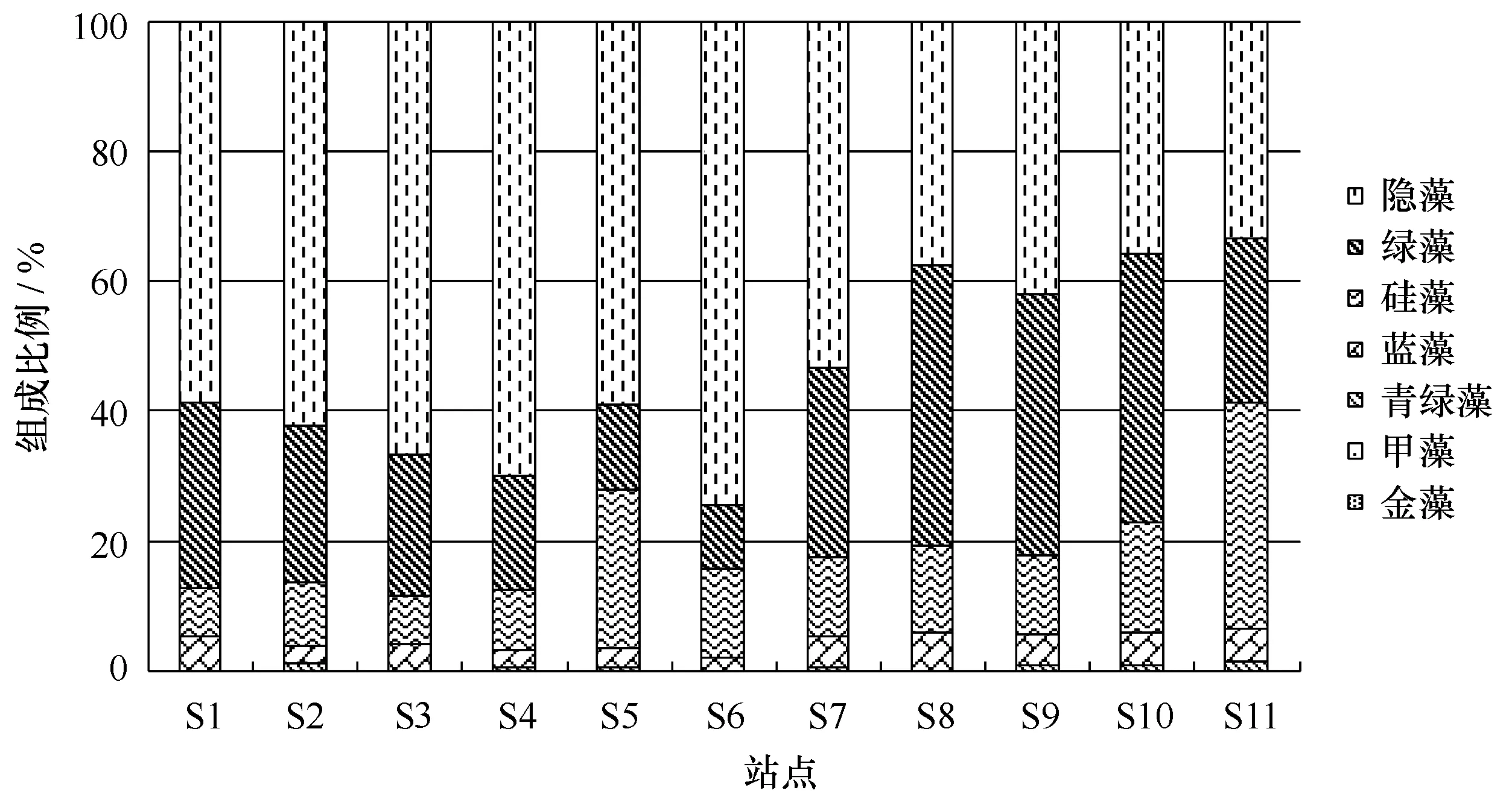
图7 浮游植物不同类群对浮游植物生物量的贡献Fig.7 Contribution of different phytoplankton groups to phytoplankton biomass
2.5 数据处理
采用Pearson系数进行相关性分析,当P<0. 05为显著相关,当P<0. 01 为极显著相关。
3 结果和分析
3.1 环境参数的分布特征
春季南流江河口表层盐度、无机氮和活性磷酸盐的分布见图3。该季南流江河口温度(20.01~20.38℃)、盐度(0~0.72)变化范围很小,除了在入海口的站点盐度大于0.1之外其他站点均小于0.1。水体浊度高(74.3~108),东部支流的浊度高于西部支流。pH值波动范围在6.41~7.43,西部分支的变化范围不大,在东部分支呈现由河口区中部向入海口递增的趋势。溶解氧数值介于6.05到8.73之间,分布趋势与pH值大体一致。无机氮的浓度变化范围为44.61~108.27 μmol/L,西部分支的平均浓度为102.60 μmol/L,远高于东部分支(平均浓度为54.66 μmol/L),东部支流呈现出从河口区中部向入海口先逐步降低再升高的特征,而在西部支流呈现出从河口区中部向入海口略为增加的趋势。磷酸盐的浓度变化范围在0.73~1.92 μmol/L之间,其浓度变化总体趋势与无机氮相似,但在西部支流呈现出从河口区中部向入海口略显逐步降低的趋势。
3.2 特征光合色素的组成与分布
南流江河口叶绿素a浓度分布见图4。春季南流江河口叶绿素a平均浓度为1 761.2 ng/L,东部分支浓度平均值(1 896.93 ng/L)略高于西部分支(1 630.73 ng/L)。叶绿素a浓度最高值出现在东部分支入海口的S5和S6站位(浓度均大于3 400 ng/L),最小值则出现在东部分支的S1站位(808.34 ng/L)。东西部分支的叶绿素a浓度大致呈现由河口区中部向入海口递增的趋势。
南流江河口春季光合色素含量较高的特征色素依次为叶绿素b、岩藻黄素、β-胡萝卜素和别黄木素,其他特征光合色素的含量较低。图5列出了南流江河口春季浮游植物主要特征光合色素含量的空间分布与变化。叶绿素b在西部分支浓度较高,从河口区中部向入海口显示出增加的特征。岩藻黄素和β-胡萝卜素在春季的分布特征与叶绿素b的分布特相似。别黄木素在春季的分布特征与叶绿素b的分布特征相反,东部分支的浓度高于西部分支,在西部分支色素浓度沿盐度的递增而递减,这种情况在东部分支则相反,最高值出现在S6测站。
3.3 浮游植物类群的生物量和空间分布
经CHEMTAX对光合色素数据转化计算,春季南流江河口普遍检出的浮游植物类群为隐藻、绿藻、硅藻和蓝藻,甲藻、金藻和青绿藻仅在个别站位出现。
隐藻是春季南流江河口浮游植物群落中的最高生物量类群,生物量范围为460.68 ~2 573.60 ng/L。总体上来看,隐藻生物量在东西分支差异较大,东部分支生物量(均值为1 236.28 ng/L)远大于西部分支(均值为645.52 ng/L),东部分支生物量从河口区中上部向入海口处递增,而在西部分支上无明显分布趋势(图6)。
与隐藻相反,绿藻西部分支的生物量(均值为553.62 ng/L)远大于东部分支(均值为292.81 ng/L),在东西分支上的分布趋势皆为由河口区中上部向入海口区域递增的趋势(图5)。
硅藻的生物量变化范围为60.49~932.18 ng/L,东西分支生物量差异不大,两分支生物量直至河口处骤然增加,最高值达到932.18 ng/L。
蓝藻生物量总体低于隐藻、绿藻和硅藻,西部分支生物量(均值为85.12 ng/L)高于东部(均值为51.98 ng/L),在分布趋势上与硅藻相同。
其他浮游植物类群的生物量很低,甲藻、金藻和蓝绿藻这几个生物量之和小于100 ng/L。它们在调查区域分布特征不明显,但西部分支平均生物量会略高于东部分支,靠近河口区域的生物量较高,主要的组成为青绿藻。
3.4 浮游植物群落的组成结构与分布
隐藻是春季南流江河口的主要类群,其在绝大部分的调查站点为最大优势类群,对总生物量的贡献为33.45%~74.48%(图7)。春季隐藻在南流江河口西部分支所占的比例较低(33.45%~53.38%),东部分支隐藻所占的比例显著较高,所占比例平均皆大于50%。河口的东部分支靠近河口处隐藻成为了浮游植物的绝对优势类群,其比重达到了70% 以上。在南流江河口的西部分支,绿藻也是浮游植物的优势类群,其在西部分支中的S8、S9和S10测站占浮游植物生物量的比重可高达40%以上。硅藻在西部分支所占比例(12.10%~34.60%)大于东部分支(7.48%~24.38%),硅藻在东部分支的中上游上段所占比例很小(小于10%),在东部分支靠近入海口及西部分支所占比例则达到10% 以上,并于S11测站达到最大值(占 34.60%)。甲藻、金藻和青绿藻在南流何口所有站点浮游植物群落中的贡献比例很小,对浮游植物的贡献比例均小于2%。
4 讨论
4.1 南流江口春季水环境特征及其调控因素
作为北部湾最主要的入海河流以及广西独流入海第一大河,南流江流域的水质、水资源特征等已有部分研究报道,但对于南流江河口段以及南流江河口区域不同入海支流之间的环境分布特征的报道很少[2,11]。
本次调查研究中,南流江河口区盐度波动小(0~0.72)(表3),其浓度远小于长江口门至江阴的河口(0.15~13.7)和钦州湾内湾(0.3~9.31)[12-13],河口区的盐度锋面已南移到廉州湾中,河口段呈现出明显的淡水特征,可见南流江口受当季雨季提前的影响,主要受淡水径流控制。本次调查中还发现春季南流江河口区呈现出高氮磷营养盐、溶解氧和高浊度的环境特征,南流江口磷酸盐、无机氮的浓度明显呈低于长江口门至江阴的河口区,但高于钦州湾内湾的趋势(表3)。南流江口无机氮浓度较高,氮磷比值在45.78~68.68之间,呈现出高氮磷比的结构特征。南流江流域工业欠发达,主要以畜牧养殖和农业种植为主,面源污染是南流江流域的最主要污染源[14-15],本次调查很低的盐度表明已开始进入雨季受明显的降雨影响,降水冲刷大量枯水期积累的面源污染物进入河流,是导致南流江口较高氮磷的主要原因。此外,近年来南流江流域采砂活动明显增多,调查区上游附近也有多处采砂场,导致河口区浊度较高,部分站位水体浊度可达到101.7,对水体环境造成较大影响。
本次调查研究中还发现南流江河口区不同支流之间的水环境差异显著,而且不同支流内氮磷营养盐从河口上段到入海口之间的分布特征也有较为明显的差异。东部支流呈现出高浊度、低营养盐和高溶解氧的环境特征,而西部支流则恰好相反,呈现出较低浊度、较高营养盐和较低溶解氧的特征,表明东部支流比西部支流水质较好。近年来随着南流江下游合浦县附近的公鹅滩、总江口、西边寮-凌屋等处水利工程建设,南流江水资源在本次调查的东西入海支流的分配发生了改变,东部支流主要受南流江干流的影响,而西部支流主要受洪潮江的影响而受干流影响减弱。近年来洪潮江流域畜禽养殖量大,调查区域上游的河道内也有养鸭活动,可能是导致本次调查期间南流江西部支流水质比东部支流差的主要因素。此外,从图2可以看出东部支流在靠近入海口的氮磷有增加的趋势,西部支流的无机氮也有相似的趋势,浓度增加的站点在河口区部分小河汇入口下游附近,汇集了南流江三角洲的水产养殖废水,这很可能是导致南流江河口空间分布特征的主要因素之一。

表3 南流江口、钦州湾和长江口水环境数据比较
4.2南流江口春季浮游植物群落结构特征及其调控因素
此次调查发现南流江口春季浮游植物特征色素以叶绿素b、岩藻黄素、β-胡萝卜素和别黄木素为主;浮游植物类群组成以隐藻占优,对生物量的平均贡献高达54.95%,其次为绿藻(23.36%),硅藻平均比例只有17.37%,其他藻类比例很低,表现出显著的淡水浮游植物群落结构特征。春季南流江口浮游植物群落结构与长江口门至江阴的河口、钦州湾内湾等有着较大的差异,长江口门至江阴的河口浮游植物群落以蓝藻(60.82%)和硅藻(35.16%)两个主要类群共存,钦州湾内湾浮游植物群落除了硅藻占据主要优势外,蓝藻同样占据了较为显著的位置,而南流江口则显著以隐藻和绿藻为主(表4)。

表4 南流江口、钦州湾和长江口类群贡献率
通过比较南流江与其他河口的盐度,可以看出造成南流江浮游植物以淡水群落结构为特征、与其他河口较大差异的原因主要是本次调查期间南流江口很低的盐度,受淡水径流影响显著。本次调查时间虽然仍处3月份,但调查站位盐度都小于1且营养盐浓度较高,表明调查期间南流江口区域主要为淡水的特征,主要是受当年雨季提前的影响,河口区已显示出了丰水期的特征。
在河口区冲淡水携带了大量的营养盐能够促进浮游植物的生长,但同时也输入了大量的泥沙降低了水体的透明度,浮游植物的生长受到了一定程度的限制无法大量繁殖[16-17],结果发现隐藻和绿藻等能够适应高浑浊度的类群在群落中占据主导,这是因为这些类群具有较低的光饱和强度,两者能够适应低光照环境[18],而大部分甲藻、青绿藻等对水体的透明度要求高,因此甲藻、青绿藻在浑浊水域中丰度较低。尤其是隐藻,它可以利用特有光合色素最大化吸收光,即使在低光照条件下,它也可以将外界的有机营养盐作为能量物质[19-21]。因此,与其他藻类相比,隐藻更适应于低光照且高有机质浓度的水体环境,且对富营养化有很强的耐受性[22],成为南流江口春季的主要优势类群。近年来,南流江流域社会经济高速发展,大量营养物质流入河内,同时该流域内采砂活动明显增多,造就了南流江口高浊度高营养盐的生态环境,这很可能是调控南流江口浮游植物群落结构特征的主要因素。由于缺乏历史数据资料,无法判断近年来南流江环境较大变化是否导致了浮游植物群落结构的演变。但从调查中南流江口以隐藻等适应高浊度高营养盐的类群为优势的特征,很可能暗示浮游植物群落结构已受环境的影响,其对近年来流域面源污染增加和采砂活动增加产生了生态响应,应加强此方面的关注。
4.3南流江口浮游植物群落结构分布特征及其调控因素
虽然本次调查中南流江口浮游植物群落都是以隐藻为优势的结构特征,但从图5和图6中可以看出东西支流之间还是有较显著的差异:东部分支浮游植物以隐藻为绝对优势类群;而在西部分支则以隐藻和绿藻作为共同优势类群,呈现出西部支流比东部支流绿藻比例明显上升而隐藻比例明显下降的空间分布特征,生物量也呈现出相似的分布特征。由于不同类群浮游植物对不同环境的适应力不同,浮游植物群落结构也就在不同类群的浮游植物竞争中发生变化[23]。南流江河口东西分支所设站点的温度、盐度差别不大,但营养盐浓度和浊度却有着很大的差别,西部分支检出的N、P浓度均为东部分支的两倍,东部分支浊度略高于西部分支。本次调查中虽然东部支流营养盐明显低于西部支流,但无机氮和磷酸盐浓度在东部支流也很高(无机氮大于44.6 μmol/L,磷酸盐大于0.73 μmol/L)且有上游持续输入补充,而且东部支流和西部支流之间的N/P也没有显著差异,通过营养盐较低的东部支流主要类群生物量与N/P比值之间的相关性分析结果显示为正相关,因此营养盐应该不成为限制东部支流浮游植物的因子和决定浮游植物群落结构空间分布的首要因素(表5)。如3.2节所述,隐藻相对于绿藻和硅藻更能耐受高浊度和高营养盐水体,而在浊度较高的东部支流隐藻生物量和比例均比西部支流高,绿藻正好相反,表明南流江口东西两条入海支流浮游植物主要类群生物量及结构分布差异很可能是由浊度支配。

表5 东部分支浮游植物主要类群与环境因子之间的相关性
注:** 为0.01显著水平下的相关,* 为0.05显著水平下的相关.
此次春季南流江口浮游植物群落结构空间分布的另外一个特征是硅藻在入海口附近的生物量和比例显著提高,其他多数类群也呈现出从河口区中段往入海口附近生物量明显增加的趋势。在西部分支,叶绿素a、硅藻、蓝藻、青绿藻、甲藻和金藻与盐度呈显著正相关(P<0.05),说明浮游植物生物量沿着盐度的增长而增加,这很可能是由于冲淡水带来充足的营养盐与海水开始进行交汇,并且水流变平缓浊度降低,促进了这些类群浮游植物的生长,尤其是海水中的常见优势类群硅藻,其快速占据了较大的结构比重,引起了入海口附近站点群落结构发生了较大的改变(表6)。因此南流江口浮游植物生物量和群落结构的变化主要是受河口区水文物理的调控作用为主,营养盐的调控作用较低。
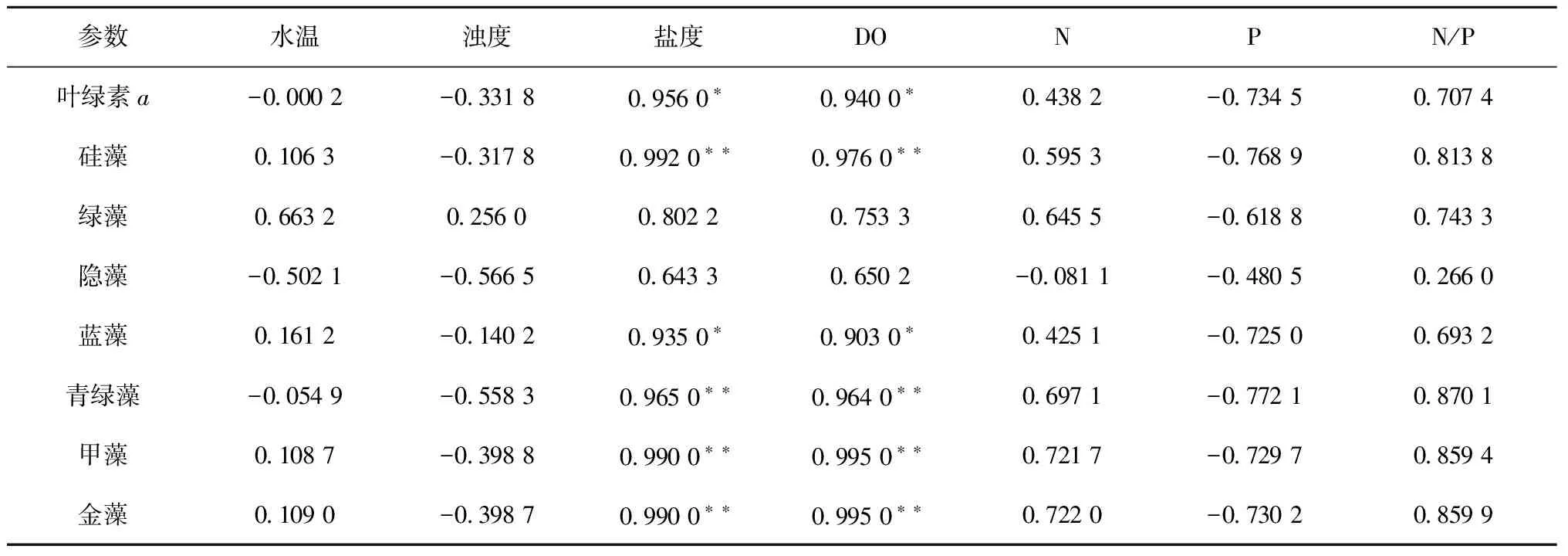
表6 西部分支浮游植物主要类群与环境因子之间的相关性
注:** 为0.01显著水平下的相关,* 为0.05显著水平下的相关.
[1] Zhu Zhuoyi, Ng W M, Liu Sumei, et al. Estuarine phytoplankton dynamics and shift of limiting factors: a study in the Changjiang (Yangtze River) Estuary and adjacent area[J]. Estuarine, Coastal and Shelf Science, 2009, 84(3): 393-401.
[2] 阚兴龙, 周永章. 北部湾南流江流域生态功能区划[J]. 热带地理, 2013, 33(5): 588-595.
Kan Xinglong, Zhou Yongzhang. Ecological function regionalization of the Nanliu River basin of Beibu Gulf[J]. Tropical Geography, 2013, 33(5): 588-595.
[3] 中国国家标准化管理委员会. GB 3838-2002, 地表水环境质量标准[S]. 北京: 中国环境科学出版社, 2002.
China National Standardization Administration Commission. GB 3838-2002, Environmental quality standards for surface water[S]. Beijing: China Environmental Science Press, 2002.
[4] Furuya K, Hayashi M, Yabushita Y. HPLC Determination of phytoplankton pigments using N, N-dimethylformamide[J]. Journal of Oceanography, 1998, 54(2): 199-203.
[5] Zapata M, Rodríguez F, Garrido J L. Separation of chlorophylls and carotenoids from marine phytoplankton: a new HPLC method using a reversed phase C8column and pyridine-containing mobile phases[J]. Marine Ecology Progress Series, 2000, 195: 29-45.
[6] 陈纪新, 叶翔, 陈小鹏, 等. 有机试剂提取浮游植物光合色素的研究[J]. 厦门大学学报:自然科学版, 2005, 44(1): 102-106.
Chen Jixin, Ye Xiang, Chen Xiaopeng, et al. Study on extraction of photosynthetic pigments from phytoplankton by organic solvents[J]. Journal of Xiamen University: Natural Science, 2005, 44(1): 102-106.
[7] Mendes C R, Cartaxana P, Brotas V. HPLC determination of phytoplankton and microphytobenthos pigments: comparing resolution and sensitivity of a C18and a C8method[J]. Limnology and Oceanography: Methods, 2007, 5(10): 363-370.
[8] Van Heukelem L, Thomas C S. Computer-assisted high-performance liquid chromatography method development with applications to the isolation and analysis of phytoplankton pigments[J]. Journal of Chromatography A, 2001, 910(1): 31-49.
[9] Stoń J, Kosakowska A. Qualitative and quantitative analysis of Baltic phytoplankton pigments[J]. Oceanologia, 2000, 42(4): 449-471.
[10] Mackey M D, Mackey D J, Higgins H W, et al. CHEMTAX-A program for estimating class abundances from chemical markers: application to HPLC measurements of phytoplankton[J]. Marine Ecology Progress Series, 1996, 144: 265-283.
[11] 韦蔓新, 何本茂, 童万平. 广西南流江口海域盐度的锋面特征及其与环境因子的关系[J]. 台湾海峡, 2006, 25(4): 526-532.
Wei Manxin, He Benmao, Tong Wanping. Frontal characteristic of the salinity and its relations to environmental factors in Nanliujiang Estuary, Guangxi[J]. Journal of Oceanography in Taiwan Strait, 2006, 25(4): 526-532.
[12] 江志兵, 刘晶晶, 李宏亮, 等. 丰水期长江感潮河口段网采浮游植物的分布与长期变化[J]. 生态学报, 2013, 33(18): 5917-5925.
Jiang Zhibing, Liu Jingjing, Li Hongliang, et al. Distribution and long-term changes of net-phytoplankton in the tidal freshwater estuary of Changjiang during wet season[J]. Acta Ecologica Sinica, 2013, 33(18): 5917-5925.
[13] 蓝文陆, 王晓辉, 黎明民. 应用光合色素研究广西钦州湾丰水期浮游植物群落结构[J]. 生态学报, 2011, 31(13): 3601-3608.
Lan Wenlu, Wang Xiaohui, Li Mingmin. Phytoplankton community structure in Qinzhou Bay during flood season by analysis of HPLC photosynthetic pigment signatures[J]. Acta Ecologica Sinica, 2011, 31(13): 3601-3608.
[14] 吕俊. 南流江干流水污染发展趋势[J]. 广西水利水电, 2008(1): 26-28.
Lv Jun. Main stream water pollution trend of Nanliu river[J]. GX Water Resources & Hydropower Engineering, 2008(1): 26-28.
[15] 代俊峰, 张学洪, 王敦球, 等. 北部湾经济区南流江水质变化分析[J]. 节水灌溉, 2011(5): 41-44.
Dai Junfeng, Zhang Xuehong, Wang Dunqiu, et al. Analysis of water quality change characteristic of Nanliu River in Beibu Gulf[J]. Water Saving Irrigation, 2011(5): 41-44.
[16] Harrison P J, Thompson P A, Calderwood G S. Effects of nutrient and light limitation on the biochemical composition of phytoplankton[J]. Journal of Applied Phycology, 1990, 2(1): 45-56.
[17] Tian R C, Hu F X, Martin J M. Summer nutrient fronts in the Changjiang (Yantze River) estuary[J]. Estuarine, Coastal and Shelf Science, 1993, 37(1): 27-41.
[18] Ryther J H. Photosynthesis in the ocean as a function of light intensity[J]. Limnology and Oceanography, 1956, 1(1): 61-70.
[19] Lewitus A J, Caron D A, Miller K R. Effects of light and glycerol on the organization of the photosynthetic apparatus in the facultative heterotrophPyrenomonassalina(Cryptophyceae)[J]. Journal of Phycology, 1991, 27(5): 578-587.
[20] Gervais F. Light-dependent growth, dark survival, and glucose up take by Cryptophytes isolated from a freshwater chemocline[J]. Journal of Phycology, 1997, 33(1): 18-25.
[21] Cauwet G. DOM in the coastal zone[M]//Hansell D A, Carlson C A. Biogeochemistry of Marine Dissolved Organic Matter. California: Academic Press, 2002: 579-609.
[22] Barone R, Naselli-Flores L. Distribution and seasonal dynamics of Cryptomonads in Sicilian water bodies[J]. Hydrobiologia, 2003, 502(1/3): 325-329.
[23] Örnólfsdóttir E B, Lumsden S E, Pinckney J L. Nutrient pulsing as a regulator of phytoplankton abundance and community composition in Galveston Bay, Texas[J]. Journal of Experimental Marine Biology and Ecology, 2004, 303(2): 197-220.
The structure and distribution of phytoplankton community in the Nanliu River Estuary during spring
Ye Youyin1, Xiang Peng1, Wang Lei1, Yang Yanyan1, Wang Yu1, Lin Mao1, Lan Wenlu2
(1.ThirdinstituteofOceanography,StateOceanicAdministration,Xiamen361005,China; 2.MarineEnvironmentalMonitoringCenterofGuangxi,Beihai536000,China)
The composition and distribution of phytoplankton community were investigated during spring in 2016. Phytoplankton samples were analyzed by RP-HPLC combined with DAD (diode array detector) to determine photosynthetic pigments composition in the study area. Pigments data were converted into phytoplankton composition by software CHEMTAX based on least square method and steepest descent algorithm. Our results showed that chlorophyllb(Chlb), fucoxanthin were the major pigments in the Nanliu River Estuary. Cryptomonas dominated in the phytoplankton community, contributing to 54.95% of the phytoplankton biomass during spring in the Nanliu River Estuary, followed by chlorophytes and diatoms with 23.36% and 17.37%, respectively. The rest of other phytoplankton was rare, which only took less than 10% of all phytoplankton biomass. There were vary greatly in the composition of phytoplankton community between eastern and western branch of Nanliu River. In eastern branch, the nitrate of was lower than western, and cryptomonas dominated in the phytoplankton community, followed by chlorophytes and diatoms, nitrate was the main influence factors to the composition and distribution of phytoplankton community. In western branch, the proportion of chlorophytes and diatoms increased, non-nitrate factor was the main influence factors to the phytoplankton community. Except nitrate, the western phytoplankton community also influenced by turbidity and salinity. The results indicate that turbidity significant influence the structure and function of ecological system.
photosynthetic pigments; phytoplankton; community structure; Nanliu River
10.3969/j.issn.0253-4193.2017.10.010
Q948.8
:A
:0253-4193(2017)10-0111-13
2017-04-26;
:2017-08-04。
国家海洋局第三海洋研究所基本科研业务费(海三科2015022);全球变化与海气相互作用专项——海洋生物样品库升级与扩建“专项海洋生物系统分类”(GASI-01-02-04);国家基金青年科学基金项目“西北冰洋植物群落的时空及其对环境变化的响应”(41506217); 国家自然科学基金项目(41466001);广西科技计划项目(桂科AA17129001)。
叶又茵(1988—),女,福建省厦门市人,从事海洋植物生态学研究。E-mail:yeyouyin@tio.org.cn
*通信作者:蓝文陆,男,高级工程师,从事海洋环境监测与生态学研究工作。E-mail:dr.lan@139.com
叶又茵,项鹏,王磊,等.南流江河口区春季浮游植物群落结构组成与分布特征[J].海洋学报,2017,39(10):111—123,
Ye Youyin, Xiang Peng, Wang Lei,et al. The structure and distribution of phytoplankton community in the Nanliu River Estuary during spring[J]. Haiyang Xuebao,2017,39(10):111—123, doi:10.3969/j.issn.0253-4193.2017.10.010
