不同培养体系培养的间充质干细胞成骨再生相关基因的比较
2017-09-29赵刚刘微微高伟玮马洁
赵刚,刘微微,高伟玮,马洁
不同培养体系培养的间充质干细胞成骨再生相关基因的比较
赵刚,刘微微,高伟玮,马洁
(天津市康婷生物工程有限公司,天津 天津 300385)
目的 比较血小板裂解物和胎牛血清培养的骨髓间充质干细胞、脐带间充质干细胞和胎盘间充质干细胞成骨再生相关基因的表达情况。方法 采用a-MEM+胎牛血清和a-MEM+血小板裂解物+抗坏血酸培养骨髓来源间充质干细胞、脐带来源间充质干细胞和胎盘来源间充质干细胞。CCK8法检测两种培养体系培养的三种间充质干细胞的增殖能力;流式鉴定两种培养体系培养的P3代间充质干细胞表型;RT-qPCR法检测P3代间充质干细胞骨再生关键因子(RUNX2、Osterix、OPN)的基因表达情况。结果 两种培养体系培养的P3代间充质干细胞流式鉴定阳性率均高于98%,阴性率均低于2%;a-MEM培养液+血小板裂解物+抗坏血酸培养出的间充质干细胞,其决定成骨再生相关基因的表达均显著性高表达。结论 a-MEM培养液+血小板裂解物+抗坏血酸培养体系培养出的间充质干细胞可作为骨组织再生的种子细胞应用于骨缺损修复。
间充质干细胞;多向分化;骨缺损
骨组织工程技术被认为是治疗大面积骨缺损的有效手段,其中种子细胞是骨组织工程的重要内容[1-2]。经研究证实间充质干细胞具有多向分化潜能,体外在一定条件下可诱导分化为成骨细胞、脂肪细胞、软骨细胞、神经细胞等,因其具有良好的成骨分化性能而受到研究人员的重点关注[3-6]。然而,间充质干细胞应用于骨组织工程治疗骨缺损,需要将其诱导分化为成骨细胞后方可应用。间充质干细胞体外诱导分化为成骨细胞需要一个较长的过程,并且在诱导分化的过程中间充质干细胞的增殖能力、活力等都有所下降,不利于其发挥治疗骨缺损的作用[7-9]。因此,本研究从间充质干细胞的培养体系入手,改进间充质干细胞的培养体系,通过细胞水平、分子水平检验培养的骨髓间充质干细胞(BMSCs)、脐带间充质干细胞(UC-MSCs)和胎盘间充质干细胞(P-MSCs)中成骨再生关键因子的表达情况,为骨组织工程的种子细胞培养方式的选择提供真实可信的实验依据。
1 材料与方法
1.1 主要试剂 a-MEM培养基、磷酸缓冲液(Hyclone公司);胎牛血清(百灵公司);青链霉素(华北制药);CCK8(上海同仁);I型胶原酶、胰蛋白酶、碱性磷酸酶试剂盒、茜素红(sigma);Trizol(invitrogen公司);real-time PCR试剂盒SYBR Premix Ex TaqTMII、反转录试剂盒PrimScriptTM RT Master Mix(TakaRa公司);CD14-PE、CD34-PE、CD44-PE、CD45-PE、CD90-PE、CD105-PE(BD公司);Ficoll淋巴分离液(GE公司)。
1.2 方法
1.2.1 细胞培养 骨髓间充质干细胞的分离培养:用磷酸缓冲液冲洗骨髓,1 500 rpm离心5 min,去上清;加入与沉淀等体积的磷酸缓冲液,混合均匀;按照骨髓:Ficoll=1:1的体积比例,将骨髓缓慢加入Ficoll液面上,2 000 rpm离心20 min;吸取间白膜层单核细胞,加入磷酸缓冲液冲洗,1 500 rpm离心5 min,弃上清;分别用a-MEM+10%FBS+青链霉素(a-MEM+FBS)和a-MEM+5%血小板裂解物+50 mmol/L抗坏血酸+青链霉素(a-MEM+PL)于5%CO2培养箱中培养;4 d后第1次换液,以后每3天换1次液。待细胞长至80%培养瓶面积时传代。
脐带间充质干细胞的分离培养:无菌条件下剥离脐带组织的外膜和脐带组织内动、静脉,分离出华通氏胶并剪碎至2~3 mm3,将剪碎的华通氏胶组织块贴于培养瓶底面,2 h后向培养瓶内添加适量的两种培养液,1 w之后换液;根据组织块周围爬出细胞的情况消化传代。
胎盘间充质干细胞的分离培养:无菌条件下去除胎盘组织羊膜,分离出靠近胎儿侧胎盘小叶组织并剪碎至4~5 mm3,用磷酸缓冲液冲洗组织至发白,向组织中加入1%的IV型胶原酶于37℃消化4 h,1 500 rpm离心10 min,磷酸缓冲液重悬沉淀,再次于1 500 rpm离心5 min,收集沉淀;采用两种培养液重悬沉淀并计数,将细胞接种至培养瓶中于37℃,5%CO2培养箱中培养;3 d后第1次换液,以后每3天换液1次。待细胞长至80%培养瓶面积时传代。
1.2.2 细胞增殖能力 取P3代上述三种MSCs,并以2×103个/孔接种至96孔板,采用CCK8法连续7 d测定其吸光值。
1.2.3 细胞表型的鉴定 三种间充质干细胞表型鉴定:取P3代间充质干细胞,通过流式细胞仪检测三种细胞表面标志物CD14、CD34、CD44、CD45、CD90和CD105的表达。
1.2.4 分子水平比较 采用Trizol法提取两种培养体系培养的P3代三种MSCs的RNA,按照反转录试剂盒合成cDNA,然后进行RT-qPCR。

表1 3种细胞骨再生相关基因PCR引物Table 1 The PCR primer of osteogenesis-related genes
RT-qPCR反应条件:95℃预变性5 min;95℃变性30 s;55退火30 s;72延伸45 s;39个循环。
2 结果
2.1 显微镜下观察两种培养体系培养的三种MSCs形态P3代细胞通过倒置显微镜观察到三种MSCs在两种培养体系下均呈长梭状,呈旋涡式生长。见图1。
图1 三种MSCs倒置显微镜下观察到的细胞形态Figure 1 Three MSCs cell morphology
2.2 三种MSCs增殖能力比较 两种培养体系培养的三种P3代MSCs传代后1~3 d处于潜伏期,此时细胞没有明显的增殖;3~5 d进入对数生长期;5 d之后细胞进入平台期。见图2。
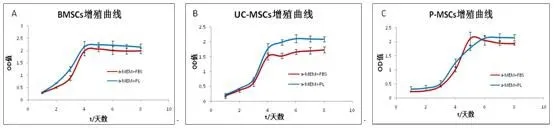
图2 两种培养体系培养的三种MSCs增殖曲线Figure 2 Three MSCs Cell growth curve
2.3 流式细胞仪检测两种培养体系下培养的三种MSCs两种培养体系培养的三种MSCs表面标志物阳性率均高于98%,阴性率均低于2%。见图3。
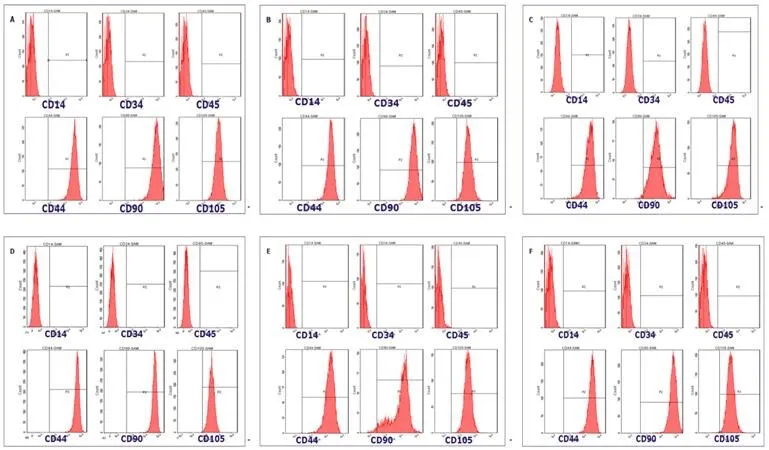
PL培养的BMSCs、UC-MSCs和P-MSCs流式检测结果)Figure 3 The Passage three MSCs flow cytometry analysis
2.4 RT-qPCR检测两种培养体系培养的三种MSCs成骨再生相关因子的基因表达 a-MEM+血小板裂解物培养的三种MSCs成骨再生分化蛋白OPN基因均显著性高表达,骨成熟的调控基因RUNX2和Osterix基因亦均显著性高表达。见图4。
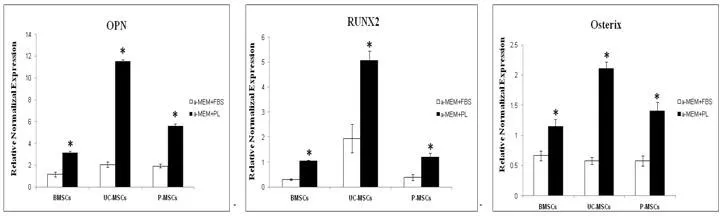
*P<0.01 PL compared with FBS图4 Q-PCR检测两种培养体系培养的三种MSCs OPN、RUNX2和Osterix基因的表达Figure 4 The OPN,RUNX2 and osterix gene expression from the three MSCs cultured by different medium
3 讨论
目前,骨组织工程被认为是最有希望治愈大面积的骨缺损。骨组织工程是由支架材料和种子细胞构成。种子细胞的选择十分重要,而MSCs具有低免疫原性、多向分化的潜能且具有良好的成骨分化性能,被认为是潜在的一类种子细胞。经研究骨组织修复需要几个关键的因子的参与。骨桥蛋白(OPN)是骨再生早期的代表性因子;RUNX2和Osterix是骨再生过程中极为重要的两个转录因子,是调控成骨细胞分化和成熟的调控基因[10-12]。
有报道称脂肪来源的MSCs经成骨诱导后在不同动物模型大面积骨缺损的修复中均显示出良好的成骨效果[14-15]。但是MSCs经过成骨诱导后,其细胞增殖能力、活力等都明显降低[3,8]。如果将MSCs应用于骨组织工程,其细胞内决定成骨再生的基因处于低表达状态,不能及时发挥其成骨能力。
因此,本研究采用血小板裂解物替代传统的胎牛血清来培养BMSCs、UC-MSCs和P-MSCs,应用含血小板裂解物的培养体系培养的MSCs依然保持着长梭形,局部呈漩涡式生长。由此可以看出采用血小板裂解物培养的MSCs与传统的胎牛血清培养的MSCs从形态上没有显著性差异。通过流式鉴定比较两种培养体系培养的MSCs,在表型方面无显著性差异,说明采用血小板裂解物培养的三种MSCs依然保持着细胞的干性。RT-qPCR的方法检验两种培养体系培养出的三种MSCs成骨再生相关基因RUNX2、Osterix和OPN的表达,可以看出含血小板裂解物的培养体系培养的细胞,其调控成骨再生的调控基因(RUNX2、Osterix)和骨再生的早期因子基因(OPN)的表达均显著性高于胎牛血清培养的MSCs。由此说明含血小板裂解物的培养体系可促进MSCs成骨再生关键因子的高表达。
综上所述,本研究比较两种培养体系培养的MSCs,发现含有血小板裂解物的培养体系培养出的MSCs不仅维持了细胞的干性,而且还促进了MSCs内成骨再生关键因子基因的高表达。
[1] 吴宓勋,韦金奇,王璐,等.不同来源间充质干细胞成骨分化时序性过程的比较研究[J].临床口腔医学杂志,2015,31(5):259-262.
[2] 曲志国,野向阳,林辉,等.人脐带间充质干细胞诱导成骨及治疗骨缺损[J].中国组织工程研究与临床康复,2011,15(45):8503-8507.
[3] 赵基栋,苗宗宁,钱寒光,等.人胎盘间充质干细胞促进血管生成[J].中国组织工程研究,2013,17(23):4216-4223.
[4] 牛婷,李爱斌,曹景云,等.胎盘间充质干细胞的应用研究[J].中国组织工程研究,2015,19(32):5236-5242.
[5] Seyedi F,Farsinejad A,Nematollahi-Mahani SA,et al.Suspension culture alters insulin secretion in induced human umbilical cord matrix-derived mesenchymal cells[J].Cell journal,2016,18(1):52-61.
[6] Nan C,Guo L,Zhao Z,et al.Tetramethylpyrazine in-duces differentiation of human umbilical cord-derived mesenchymal stem cells into neuron-like cells in vitro[J]. International Journal of Oncology,2016,48(6):2287-2294.
[7] Kelvin O,Akinwale E,Ibiyinka A,et al.A two-year audit of non-vascularized iliac crest bone graft for mandibular reconstruction: technique, experience and challenges[J].J Korean Assoc Ora Maxillofac Surg,2014,40:272-277.
[8] Lai RF,LI ZJ,Zhang Y,et al.Bone regeneration enhanced by antigen-extracted xenogeneic cancellous bone graft with rhBMP-2 in rabbits mandibular defect repair[J].Engineering,2013,5:108-113.
[9] Chen K,Hao J,Kanako N,et al.Effects of low intensity pulsed ultrasound stimulation on bone regeneration in rat parietal bone defect model[J].Open Journal of Regenerative Medicine,2013,2(1):8-14.
[10] Elisa M,Massimo B,Sandra RZ,et al.Transcriptomics comparison between porcine adipose and bone marrow mesenchymal stem cells during in vitro osteogenic and adipogenic differentiation[J].PLoS ONE,2012,7(3):32481.
[11]Fei C,Guo J,Zhao Y,et al.Notch-Hes pathway mediates the impaired osteogenic differentiation of bone marrow mesenchymal stromal cells from myelodysplastic syndromes patients through the down-regulation of Runx2[J].American Journal of Translational Research,2015,7(10):1939-1951.
[12]Dilogo IH,Kamal AF,Gunawan B,et al.Autologous mesenchymal stem cell (MSCs) transplantation for critical-sized bone defect following a wide excision of osteofibrous dysplasia[J]. International Journal of Surgery Case Reports,2015,17:106-111.
[13]Wankhade UD,Shen M,Kolhe R,et al.Advances in adipose-derived stem cells isolation, characterization,and application in regenerative tissue engineering[J]. Stem Cells International, 2016(5):3206807.
[14]Li F,Zhou C,XU L, et al.Effect of stem cell therapy on bone mineral density: a meta-analysis of preclinical studies in animal models of osteoporosis[J].PLoS ONE,2016,11(2):0149400.
[15]Herrmann M,Verrier S,Alini M.Strategies to stimulate mobilization and homing endogenous stem and progenitor cells for bone tissue repair[J].Frontiers in Bioengineering and Biotechnology,2015,3(79):11 pages.
Comparison on the osteogenesis regeneration genes of different mesenchymal stem cells cultured by different culture medium
Zhao Gang,Liu Wei-wei,Gao Wei-wei,Ma Jie
(Tianjin Kangting Biotechnology Company Limited,Tianjin,Tianjin,00385,China)
Objective The purpose of this study was to find the difference of the osteogenesis genetypes that Bone marrow mesenchymal stem cells(BMSCs),human umbilical cord mesenchymal stem cells(UC-MSCs)and human placental mesenchymal stem cells were cultured by Platelet lysate and fetal bovine serum.Methods The three MSCs was cultured in a-MEM medium containing 10%fetal bovine serum and containin 5%platelet lysate.Cell growth curve was drawn by CCK8 detected,and the cell surface antigens were measured using flow cytometry.To further explore the difference in osteogenesis genetypes,including RUNX2,Osterix and osteopontin(OPN),were analyzed by RT-qPCR.Results Cell growth curve analysis indicated that three MSCs were in the exponential stage at 3 days following incubation through two curture medium.Flow cytometry analysis showed that more than 98%cells were positive for CD44,CD90 and CD105.RT-qPCR showed that the three MSCs in the different medium PL group higher expression levels of osteogenic markers including RUNX2,Osterix and OPN when compared with FBS.Conclusion The MSCs could be as bone tissue regeneration seed cells which cultured by PL medium for the treatment of bone defects.
Mesenchymal stem cells;Multiple differentiation;Bone defects
10.3969/j.issn.1009-4393.2017.27.007
天津市自然科学基金(14JCYBJC43900)通讯作者:马洁,E-mail:biocare@ktibs.com
