重组人粒细胞-巨噬细胞集落刺激因子对人THP-1单核细胞抗阿萨希毛孢子菌活性增强作用的研究
2017-09-29杨蓉娅
丛 林,廖 勇,杨蓉娅,祝 贺
重组人粒细胞-巨噬细胞集落刺激因子对人THP-1单核细胞抗阿萨希毛孢子菌活性增强作用的研究
丛 林,廖 勇,杨蓉娅,祝 贺
目的 研究重组人粒细胞-巨噬细胞集落刺激因子(recombinant human granulocyte-macrophage colony-stimulating factor,rh GM-CSF)对单核细胞吞噬、杀伤阿萨希毛孢子菌(Trichosporon asahii, T. asahii)功能的影响。方法 不同浓度的rh GM-CSF(100 U/ml、200 U/ml及400U/ml)与人THP-1单核细胞预孵育48 h后,加入T.asahii临床株共培养1 h,应用瑞氏-姬姆萨染色,倒置显微镜下观察人THP-1单核细胞对T. asahii的吞噬情况;菌落计数法评估人THP-1单核细胞对T. asahii的杀伤情况。结果 rh GM-CSF预孵育可使人THP-1单核细胞对T. asahii的吞噬率从20%提高到84%左右。人THP-1单核细胞对T. asahii的吞噬率随rh GM-CSF浓度增高而升高,具有浓度依赖性。200 U/ml及400 U/ml的rh GM-CSF预孵育组,每毫升T. asahii菌落形成单位较对照组明显减少(P<0.05)。结论 rh GM-CSF可明显增强人THP-1单核细胞对T. asahii的吞噬、杀伤活性。
单核细胞;阿萨希毛孢子菌;粒-巨噬细胞集落刺激因子(GM-CSF)
[J Pract Dermatol, 2017, 10(4):205-208]
阿萨希毛孢子菌(Trichosporon asahii, T. asahii)是一种酵母样真菌,可导致播散性毛孢子菌病[1]。随着糖皮质激素的大量应用及恶性肿瘤、血液病、艾滋病等免疫功能低下人群的增多,该病发病率逐年上升。研究表明,T. asahii感染人体的结局,主要与宿主的免疫防御状态和菌株敏感性等因素相关。吞噬细胞是人类固有免疫系统的重要细胞,也是清除病原微生物的重要效应细胞。吞噬细胞包括中性粒细胞、单核/巨噬细胞和树突状细胞等。中性粒细胞占外周血白细胞比例的70%左右,在宿主抗真菌免疫中占有重要地位。不过,播散性毛孢子菌病主要发生于由于恶性血液病等导致中性粒细胞减少的患者,在这类患者中单核细胞就成为宿主抗T. asahii血源性感染的主要吞噬细胞。但单核细胞的吞噬功能明显弱于巨噬细胞,且其数量只占外周血白细胞总数的3%~8%,这可能是其难以抵挡T. asahii入侵,导致血源性、播散性感染的原因之一。研究表明,应用γ-干扰素可明显增强单核/巨噬细胞吞噬、杀伤T. asahii的活性,提示可应用γ-干扰素等细胞因子辅助治疗播散性毛孢子菌病[2]。粒细胞-巨噬细胞集落刺激因子(granulocytemacrophage colony-stimulating factor,GM-CSF) 作 为一种重要的集落刺激因子,可促进造血干细胞向中性粒细胞和单核/巨噬细胞分化、增殖。研究表明,GM-CSF可增强单核/巨噬细胞杀伤白念珠菌、烟曲霉等多种病原真菌的活性[3,4]。GM-CSF既可刺激造血系统,使中性粒细胞和单核细胞数量增多,又可以增强其功能,理论上可增强宿主抗病原真菌感染的免疫防御功能。本实验研究了GM-CSF对单核细胞吞噬、杀伤T. asahii活性的影响,探讨应用GM-CSF辅助治疗T. asahii感染的可能性。
1 材料与方法
1.1 细胞与菌株
人THP-1单核细胞株购自中国协和医科大学基础医学细胞中心。本研究采用的T. asahii临床株(菌株号:BZP07005),分离自陆军总医院全军皮肤损伤修复研究所收治的播散性毛孢子菌病患者皮损组织。该临床株经API20C系统生化鉴定及IGS1基因扩增鉴定并确认。
1.2 主要试剂
重组人粒细胞-巨噬细胞集落刺激因子(recombinant hman granulocyte-macrophage colonystimulating factor,rh GM-CSF)冻干粉(≥ 1×107U/mg)(以色列ProSpec-Tany公司),SDA琼脂培养基粉、YPD培养基粉、磷酸盐缓冲液(PBS)、胎牛血清、RPMI 1640液体培养基(均为Hyclone公司),瑞氏-姬姆萨染液(南京建成科技有限公司),Trixon-100(sigma)、链霉素 100 µg /ml和青霉素 100 µg /ml (碧云天生物技术有限公司)。
1.3 方法
1.3.1 人THP-1单核细胞株的培养、传代人THP-1单核细胞用含10%胎牛血清及含链霉素(100 µg/ml)和青霉素(100 µg /ml)的RPMI 1640液体培养基,于37℃,5% CO2培养箱中培养、传代。在超净工作台中用吸管将培养瓶中的细胞吹打均匀,移入10 ml离心管中,离心5 min(800 r/min),弃上清,加入适量新培养液,用吸管吹打成细胞悬液,移入培养瓶中,置于37℃,5% CO2培养箱中培养、传代。取对数生长期的THP-1细胞,用RPMI 1640液体培养基洗涤两次,并重悬于RPMI 1640液体培养基、制备单细胞悬液。应用细胞计数板进行细胞计数,调整细胞浓度至1×106个/ml。台盼蓝拒染法检测人THP-1单核细胞的活细胞数量>95%。
1.3.2T. asahii的传代、培养及菌液制备 将-80℃保存的T. asahii临床株接种于SDA真菌培养基,培养24 h,使其复苏活化,然后转种于YPD液体培养基中,置于摇床培养12 h(37℃、150 r/min),使其形成含95%孢子的菌悬液,离心5 min(6 000 r/min)收集T.asahii孢子,用PBS洗涤3次,在振荡器上剧烈振荡,使之形成单个孢子悬液,并重悬于RPMI 1640细胞培养液中。应用细胞计数板进行细胞计数,调整菌液浓度到 1×107CFU/ml。
1.3.3 GM-CSF储存液及工作液的配制 ①将含有rh GM-CSF冻干粉的微量离心管高速离心(10 000 r/min)20 s,使黏在管盖或管壁上的蛋白聚集于管底。②1 mg rh GM-CSF冻干粉溶于10 ml灭菌双蒸水中(浓度为100 µg/ml)。-20℃保存备用。③用含10%胎牛血清的RPMI 1640液体培养液倍比稀释为0.1 µg/ml(1 000 U/ml)的工作液,4℃保存备用。
1.3.4 实验分组 参照文献[5],实验组共分为3组,实验组1:RPMI 1 640液体培养基+终浓度为100 U/ml的rh GM-CSF;实验组2:RPMI 1640液体培养基+终浓度为200 U/ml的rh GM-CSF;实验组3:RPMI 1640液体培养基+终浓度为400 U/ml的rh GM-CSF;对照组为不含rh GM-CSF的RPMI 1 640液体培养基。各组与人THP-1单核细胞预孵育48 h后加入T. asahii菌悬液,使人THP-1单核细胞与T. asahii菌悬液相互作用。
1.3.5 rh GM-CSF对人THP-1单核细胞吞噬T. asahii的影响 将1 cm×1 cm 大小的圆形盖玻片置于24孔板,加入500 μl浓度为 1×105/ml 的人THP-1单核细胞。参照文献[5],实验组加入终浓度为100、200、400 U/ml的rh GM-CSF,于37℃、5% CO2细胞培养箱中预孵育48 h。对照组加入不含rh GM-CSF的RPMI 1640液体培养基。48 h后,每孔加入500 μl重悬于RPMI 1640液体培养基浓度为5×105CFU/ml的T. asahii菌悬液,37℃、5%CO2条件下共培养1 h,吸弃上清液,PBS轻柔洗涤2遍,取出圆形盖玻片置于载玻片上,加入瑞氏-姬姆萨染液进行染色、固定,自然风干后在显微镜下观察THP-1细胞对T. asahii的吞噬现象,每组计数100个细胞,设2个复孔,实验重复3次。吞噬率=吞噬有T. asahii的THP-1细胞个数/THP-1细胞总数×100%。
1.3.6 rh GM-CSF对人THP-1单核细胞杀伤T. asahii功能的影响 参照文献[5],96孔板每孔加浓度为1×105/ml的人THP-1单核细胞悬液100 µl,同时各实验组分别加入终浓度为100、200、400 U/m的rh GMCSF,置于37℃、5%CO2培养箱中孵育48 h,对照组加入不含rh GM-CSF的RPMI 1640液体培养基。48 h后,弃上清液,用RPMI 1640液体培养基洗涤2遍,每孔加浓度为5×106CFU/ml的T. asahii菌悬液100µl,37℃、5% CO2条件下共培养1 h。吸取上清液转移到另一96孔板;原96孔板每孔加入100 µl 2%的TritonX-100[6]作用10 min,裂解THP-1细胞;取细胞裂解后释放出的T. asahii的上清液与裂解前上清液混合,混匀后倍比稀释100倍。吸取200 µl,加入15 ml 50℃的SDA真菌培养基中,凝固后于37℃真菌培养箱倒置培养48 h,观察每个平皿形成的菌落数,计算每毫升的T. asahii菌落形成单位(CFU/ml)及对T. asahii的生长抑制率。T. asahiiCFU/ml=菌落数×稀释倍数(100)×5,T. asahii生长抑制率=(对照组平均CFU/ml-实验组平均CFU/ml)/对照组平均CFU/ml×100%。每组设2个复孔,实验重复3次。
1.4 统计学方法
采用SPSS 18.0软件进行统计学分析。结果以均数±标准差表示。用单因素方差分析(ANOVA)进行各组均数间的两两比较。
2 结果
2.1 不同浓度rh GM-CSF对人THP-1单核细胞吞噬T.asahii的增强作用
实验结果显示,rh GM-CSF预孵育可使THP-1细胞对T. asahii的吞噬率(相互作用1 h)从20%左右提高到84%左右。THP-1细胞对T. asahii的吞噬率随rh GM-CSF浓度增加而升高,具有浓度依赖性。各实验组与对照组比较吞噬T. asahii的THP-1细胞数量差异有统计学意义(P< 0.05)。各实验组之间两两比较差异亦有统计学意义(P< 0.05)。实验分组及各组THP-1细胞对T. asahii的吞噬作用见表1。
2.2 不同浓度rh GM-CSF对人THP-1单核细胞杀伤T.asahii的增强作用
裂解与T.asahii相互作用1 h后的人THP-1单核细胞,释放被其吞噬的T. asahii,接种至SDA培养基,观察平皿上形成的菌落数。结果显示,200 U/ml及400 U/ml rh GM-CSF预孵育组,每毫升T. asahii菌落形成单位较对照组明显减少(P< 0.05),两组对T. asahii的生长抑制率分别达到27.89%和55.46%。100 U/ml rh GM-CSF组每毫升T. asahii菌落形成单位较对照组亦有所减少,但无统计学差异(P>0.05)。各实验组之间两两比较亦有差异(P< 0.05)。实验分组及各组菌落数见表2。
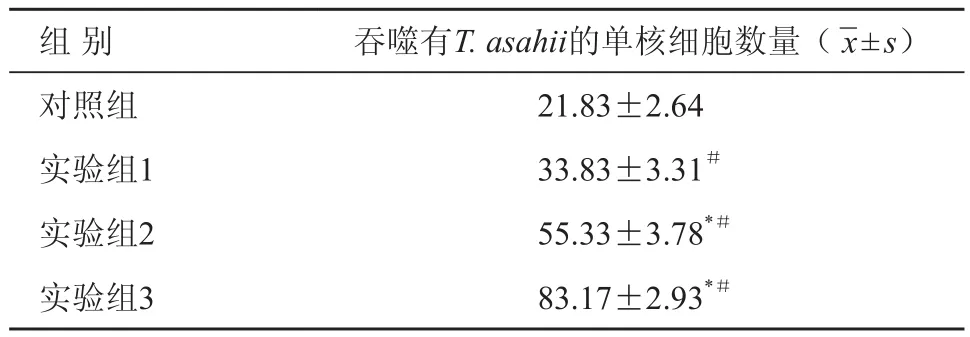
表1 rh GM-CSF对人THP-1单核细胞吞噬T. asahii的影响
3 讨论
T. asahii感染所致的播散性毛孢子菌病主要发生于伴有中性粒细胞减少的血液病患者[1]。单核细胞只占外周血白细胞总数的3%~8%,数量较少[6]。在中性粒细胞减少的患者,少量的单核细胞可能难以抵挡T.asahii的入侵,这可能是导致T. asahii血源性、播散性感染的原因之一。研究表明,固有免疫细胞的吞噬功能是其发挥抗感染防御作用的重要机制,而单核细胞的吞噬功能明显弱于巨噬细胞[7]。研究表明,人外周血中性粒细胞对T. asahii的吞噬作用弱于对白念珠菌的吞噬作用,中性粒细胞与T. asahii相互作用15 min的吞噬率仅有10%左右[8]。笔者前期的预实验显示,人THP-1单核细胞与T. asahii相互作用1h的吞噬率仅有20%左右,提示人THP-1单核细胞对T. asahii的吞噬作用较弱。延长THP-1细胞与T. asahii的相互作用时间可以提高单核细胞的吞噬率,人THP-1单核细胞与T. asahii相互作用3h的吞噬率可达80%左右。但是镜下观察发现T. asahii繁殖速度明显快于THP-1细胞增殖速度,并使THP-1细胞的活力受到影响(活细胞数下降到80%以下)。可见,当T. asahii大量繁殖时单核细胞将难以抵抗T. asahii感染。那么,能否通过药物干预,增强宿主单核细胞对T. asahii的吞噬、杀伤活性,从而增强其抗感染能力呢?
本课题组的前期研究表明,γ干扰素可明显增强巨噬细胞吞噬、杀伤T. asahii的活性[2],提示可应用γ干扰素等细胞因子辅助治疗T. asahii所致的播散性感染疾病。Sasaki等[9]研究了巨噬细胞集落刺激因子(macrophage colony-stimulating factor,M-CSF) 对外周血单核细胞抗T. asahii活性的影响。结果显示,M-CSF可明显增强单核细胞对T. asahii的杀伤作用,提示M-CSF可作为播散性毛孢子菌病的辅助治疗药物。另有学者发现GM-CSF可明显增强中性粒细胞对T. asahii的吞噬作用[8]。GM-CSF作为一种重要的集落刺激因子,可促进造血干细胞向中性粒细胞和单核/巨噬细胞分化、增殖。GM-CSF既可刺激造血系统,使中性粒细胞和单核、巨噬细胞数量增多,又可以增强其功能,理论上可增强宿主吞噬细胞的免疫防御功能[10]。目前,国内外少见GM-CSF对单核细胞抗T.asahii活性影响的相关报道。

表2 rh GM-CSF对人THP-1单核细胞杀伤T. asahii的影响
笔者的研究结果显示,rh GM-CSF可浓度依赖性的增强人THP-1单核细胞对T. asahii的吞噬及杀伤作用。应用rh GM-CSF与人THP-1单核细胞预孵育后,THP-1细胞对T. asahii的吞噬率可提高到84%左右。本研究通过裂解吞噬有T. asahii的THP-1细胞,应用平皿培养法计算从THP-1细胞中释放出的T. asahii能够形成的菌落数,发现应用200 U/ml、400 U/ml的rh GM-CSF预孵育可明显增强人THP-1单核细胞对T.asahii的杀伤作用。
目前,国内外有大量关于GM-CSF增强中性粒细胞和(或)单核细胞对多种病原真菌(如白念珠菌、烟曲霉及新生隐球菌等)抗感染活性的实验研究[10-13]。相关动物实验也显示,GM-CSF能够明显降低念珠菌病、曲霉菌病及进行性隐球菌肺部感染等动物模型的真菌负荷量及生存率[14-16]。相对于GM-CSF增强宿主抗真菌感染免疫功能的大量体内外实验研究,GMCSF临床用于抗真菌感染的文献报道相对较少。rh GM-CSF于1991年由美国食品药品管理局批准上市[4,17]。有学者应用rh GM-CSF辅助治疗了急性白血病并发曲霉菌或念珠菌深部感染的8例患者。结果显示,这些患者的病死率明显低于未应用rh GM-CSF的对照组[18]。Vazquez等[19]应用rh GM-CSF辅助治疗了11例艾滋病并发对氟康唑耐药的口咽部念珠菌感染患者,其中7例患者病情明显好转,提示rh GM-CSF可作为一种免疫佐剂辅助治疗艾滋病并发真菌感染者。Peter BG等[20]的研究显示,应用GM-CSF可降低大剂量化疗后出现系统性真菌感染的风险和真菌感染相关病死率。一项系统回顾分析研究显示,GM-CSF等集落刺激因子可显著降低化疗所致中性粒细胞减少患者出现严重感染的发生率及病死率,从而改善患者的预后[21]。一项前瞻性多中心开放随机研究比较了预防性应用GM-CSF、G-CSF对异体造血干细胞移植患者侵袭性真菌病发病率及病死率的影响。结果显示,与GM-CSF相比,预防性应用GM-CSF在降低100 d移植相关病死率、100 d累计病死率和600 d侵袭性真菌感染病死率上更为有效,原因可能是GM-CSF可增强单核/巨噬细胞的吞噬功能,且在刺激外周血生成中性粒细胞/单核细胞的数量上优于G-CSF[22]。研究者建议,在异体造血干细胞移植患者出现中性粒细胞减少期间,可预防性应用GM-CSF,以降低侵袭性真菌感染的发生率及病死率[22]。
综上所述, rh GM-CSF预孵育可明显增强人THP-1单核细胞对T. asahii的吞噬、杀伤活性。提示应用rh GM-CSF辅助治疗T. asahii播散性感染可能是一种有效的治疗策略。
[1] Colombo AL, Padovan ACB, Chaves GM. Current knowledge ofTrichosporon spp. and trichosporonosis [J]. Clin Microbiol Rev,2011, 24(4):682-700.
[2] 聂建巍, 杨蓉娅, 丛林, 等. 干扰素γ对小鼠巨噬细胞株RAW264.7吞噬, 杀伤阿萨希毛孢子菌的影响 [J]. 中华皮肤科杂志, 2012,45(12):32-35.
[3] 张华丽. 粒细胞-巨噬细胞集落刺激因子在抗白念珠菌感染中的作用 [J]. 华中医学杂志, 2003, 27(6):342-343.
[4] Roilides E, Holmes A, Blake C, et al. Antifungal activity of elutriated human monocytes against Aspergillus fumigatus hyphae:enhancement by granulocyte-macrophage colony-stimulating factor and interferon-gamma [J]. J Infec Dis, 1994, 170(4):894-899.
[5] 张华丽, 陈兴平. IFN-γ、GM-CSF增强巨噬细胞抗白念珠菌活性的研究 [J]. 中国麻风皮肤病杂志, 2009, 25(12):871-873.
[6] Brummer E, Maqbool A, Stevens DA. Protection of peritoneal macrophages by granulocyte/macrophage colony-stimulating factor (GM-CSF) against dexamethasone suppression of killing ofAspergillus, and the effect of human GM-CSF [J]. Microbes Infect,2002, 4(2):133-138.
[7] Dale DC, Boxer L, Liles WC. The phagocytes: neutrophils and monocytes [J]. Blood, 2008, 112(4):935-945.
[8] Richardson MD, Chung I. GM-CSF-modulated phagocytosis ofTrichosporon beigeliiby human neutrophils [J]. J Med Microbiol,1997, 46(4):321-325.
[9] Sasaki E, Tashiro T, Kuroki M, et al. Effects of macrophage colonystimulating factor (M-CSF) on anti-fungal activity of mononuclear phagocytes againstTrichosporon asahii[J]. Clin Exp Immunol,2000, 119(2):293-298.
[10] Antachopoulos C, Roilides E. Cytokines and fungal infections [J]. Br J Haematol, 2005, 129(5):583-596.
[11] Smith PD, Lamerson CL, Banks SM, et al. Granulocyte-macrophage colony-stimulating factor augments human monocyte fungicidal activity forCandida albicans[J]. J Infec Dis, 1990, 161(5):999-1005.[12] Roilides E, Holmes A, Blake C, et al. Antifungal activity of elutriated human monocytes againstAspergillus fumigatushyphae:enhancement by granulocyte-macrophage colony-stimulating factor and interferon-gamma [J]. J Infec Dis, 1994, 170(4):894.
[13] Gaviria JM, van Burik JAH, Dale DC, et al. Comparison of interferon-γ, granulocyte colony-stimulating factor, and granulocyte-macrophage colony-stimulating factor for priming leukocyte-mediated hyphal damage of opportunistic fungal pathogens[J]. J Infec Dis, 1999, 179(4):1038-1041.
[14] Mayer P, Sehutze E, Lam C, et al. Recombinant murine granulocytemacrophage colony-stimulating factor augments neutrophil recovery and enhances resistance to infections in myelosuppressed mice [J]. J Infec Dis, 1991, 163(3):584-590.
[15] Schelenz S, Smith DA, Bancroft GJ. Cytokine and chemokine responses following pulmonary challenge withAspergillus fumigatus: obligatory role of TNF-alpha and GM-CSF in neutrophil recruitment [J]. Med Mycol 1999, 37(3):183-194.
[16] Chen GH, Teitz-Tennenbaum S, Neal LM, et al. Local GM-CSF-dependent differentiation and activation of pulmonary dendritic cells and macrophages protect against progressivecryptococcal lung infection in mice [J]. J Immunol, 2016:1501512
[17] 王宗涛, 刘旭. 粒/巨噬细胞集落刺激因子基础与临床的研究 [J].实用肿瘤学杂志, 1999, 13(1):79-82.
[18] Rowe JM. Treatment of acute myeloid leukemia with cytokines:effect on duration of neutropenia and response to infections [J]. Clin Infec Dis, 1998, 26(6):1290-1294.
[19] Vazquez JA, Hidalgo JA, De Bono S. Use of sargramostim (rh-GMCSF) as adjunctive treatment of fuconazole-refractory oropharyngeal candidiasis in patients with AIDS: a pilot study [J]. HIV Clin Trials,2000, 1(3):23-29.
[20] Peters BG, Adkins DR, Harrison BR, et al. Antifungal effects of yeast-derived rhu-GM-CSF in patients receiving highdose chemotherapy given with or without autologous stem cell transplantation: a retrospective analysis [J]. Bone Marrow Transplantation, 1996, 18(1):93-102.
[21] Ye SG, Ding Y, Li L, et al. Colony-stimulating factors for chemotherapy-related febrile neutropenia are associated with improved prognosis in adult acute lymphoblastic leukemia [J]. Mol Clin Oncol, 2015, 3(3):730-736.
[22] Wan L, Zhang Y, Lai Y, et al. Effect of granulocyte-macrophage colony-stimulating factor on prevention and treatment of invasive fungal disease in recipients of allogeneic stem-cell transplantation: A prospective multicenter randomized phase IV trial [J]. J Clin Oncol,2015, 33(34):3999-4006.
Effects of GM-CSF on the activities of human monocyte-like THP-1 cells againstT. asahiiinfection
CONG Lin,LIAO Yong,YANG Rong-ya,et al
Institute of Skin Damege and Repair, PLA Army General Hospital, Beijing, 100700, China
Objective To investigate the effects of recombinant human Granulocyte-Macrophage Colony-Stimulating Factor (rh GMCSF) on the phagocytosis and fungicidal activities of human monocyte-like THP-1 cells againstTrichosporon asahii(T. asahii) infection.Methods Human monocyte-like THP-1 cells were incubated with various concentrations (100, 200, 400U/ml) of rh GM-CSF or medium alone for 48 h, then co-cultured withT. asahiifor 1 h. The phagocytosis activities of THP-1 cells againstT. asahiiwere observed by inverted microscope after stained with Wright-Giemsa stain. The fungicidal activities of THP-1 cells againstT. asahiiwere assessed by counting the number of colony forming units (CFU/ml). Results The phagocytic rate of THP-1 cells toT. asahii(1 h) increased from 20% to 84%after pre-incubated with rh GM-CSF. The phagocytosis rate of human THP-1 cells toT. asahiiincreased with the increase of rh GM-CSF concentration in a concentration dependent manner. For 200 U/ml and 400 U/ml rh GM-CSF preincubation groups, eachT. asahiicolony forming unit was signifcantly less than the control group. Conclusion GM-CSF can augment the phagocytosis and fungicidal activities of human monocyte-like THP-1 cells againstT. asahii. The application of rh GM-CSF may be helpful to overcome theT. asahiiinfections and represents as a useful therapeutic strategy.
Monocytes;Trichosporon asahii;Granulocyte-macrophage colony-stimulating factor
R739.9
A
1674-1293(2017)04-0205-04

丛 林
2017-03-16
2017-06-03)
(本文编辑 祝贺)
10.11786/sypfbxzz.1674-1293.20170404
北京市科技新星项目(Z161100004916139);全军医学科技青年培育项目(14QNP010)
100700北京,中国人民解放军陆军总医院全军皮肤损伤修复研究所(丛林,廖勇,杨蓉娅,祝贺)
丛林,博士,主治医师,研究方向:真菌感染与感染免疫学,E-mail: conglin369@163.com
杨蓉娅,E-mail: yangrya@sina.com
