何首乌抗性淀粉促进靶向结肠微丸体外药物释放研究
2017-09-29李闻涛阮婧华曹佩雪杨小生
李闻涛 ,万 科 ,杨 莹 ,阮婧华 ,3 ,曹佩雪 ,杨小生
(1.陕西省医疗器械质量监督检验院,陕西 西安 712046; 2.贵州省中科院天然产物化学重点实验室,贵州 贵阳550016; 3.贵阳中医学院第一附属医院,贵州 贵阳 550002)
研究
何首乌抗性淀粉促进靶向结肠微丸体外药物释放研究
李闻涛1,万 科2,杨 莹2,阮婧华2,3,曹佩雪2,杨小生2
(1.陕西省医疗器械质量监督检验院,陕西 西安 712046; 2.贵州省中科院天然产物化学重点实验室,贵州 贵阳550016; 3.贵阳中医学院第一附属医院,贵州 贵阳 550002)
目的探讨何首乌抗性淀粉(RS)作为靶向结肠微丸材料的可行性。方法 考察生理条件下RS与微晶纤维素(MCC)不同比例微丸溶出速率的变化;以苦参碱(MT)为模型药物,挤出滚圆法制备微丸,观察相关指标。结果 RS对微丸的释放有显著的影响。药物体外释放研究表明,当RS/MCC小于0.5时微丸得率、球形和脆碎度分别 >80.00%,>0.95,<0.12%。RS高含量的微丸对pH变化和酶解的耐受性显著提高。在微生物大肠杆菌作用下,微丸迅速崩解,在30 min内药物溶出超过82%。结论 何首乌抗性淀粉是一种有前途的口服传递系统,可在结肠靶位发挥药效。
抗性淀粉;结肠靶向;成型性;药物释放肠靶向;成型性;药物释
R282.71;R285.5
A
1006-4931(2017)17-0006-04
结肠微生物数量和种类巨大(与胃肠道其他部位相比),且个体间pH和转移时间差别小,故结肠作为药物靶向部位具有较好可靠性[1]。选择pH敏感或对结肠微生物敏感的聚合物作为固体制剂的载体或包衣材料,可有效地靶向药物至所需释放部位[1-2]。淀粉是一种安全、无毒的药用辅料,但天然淀粉不完全适合一些特定用途,需要进行物理、化学和酶性修饰。因此,淀粉衍生物已被用于片剂、微粒和包衣膜控制药物释放速率[3]。抗性淀粉(RS)又称抗酶解淀粉,对pH变化不敏感,可抵抗胃内及十二指肠消化,在胃肠道上半部位降解速率慢;在胃肠道下半部,受肠道微生物的影响大,尤其可被结肠微生物降解吸收,因而可用于靶向结肠药物传递系统。本课题组研究发现,何首乌淀粉以直链为主,相对分子质量大,极易制备得到高含量RS。本研究中以抗菌消炎中药苦参碱为模型药,考察RS与微晶纤维素(MCC)不同比例对微丸成型及药物释放的影响,探讨何首乌RS作为靶向结肠微丸辅料的可行性。现报道如下。
1 仪器、试药与方法
1.1 仪器与试药
仪器:WFH-203型紫外分析仪,1100型高效液相色谱仪(美国安捷伦公司);E50型轴向单螺杆挤出机,S-250型滚圆机,WBF-1G型多功能流化床,均购于重庆英格制药机械有限公司;78X6A型片剂四用测定仪(上海黄海药检仪器有限公司);WD-A型药物稳定性检查仪(天津药典标准仪器厂);FEI Quanta 250型扫描电子显微镜(美国FEI公司);HGC-24A型氮气吹干仪(天津市恒奥科技发展有限公司);Centrifuge 5418型小型高速离心机(德国Eppendorf公司);KQ300DA型数控超声清洗器(昆山市超声清洗器有限公司)。
试药:RS(含量为 56.2% ,自制);苦参碱(MT,纯度为98.0%,宝鸡市永嘉天然植物开发有限公司,批号为201501);MCC(江西益普生药业有限公司,批号为20161201);羟丙基甲基纤维素(HPMC,湖州展望药业有限公司,批号为20160516)。其他试剂均为分析纯。
1.2 方法
1.2.1 湿材制备
将MT和辅料RS,MCC按表1处方比例混匀,过80目筛,再加入适量3%浓度的HPMC水溶液制得软材,混合,膏体放入真空保干器静置1 h,使水分达平衡。均在室温[(21 ±3)℃ 、相对湿度(40±5)%]下进行操作。
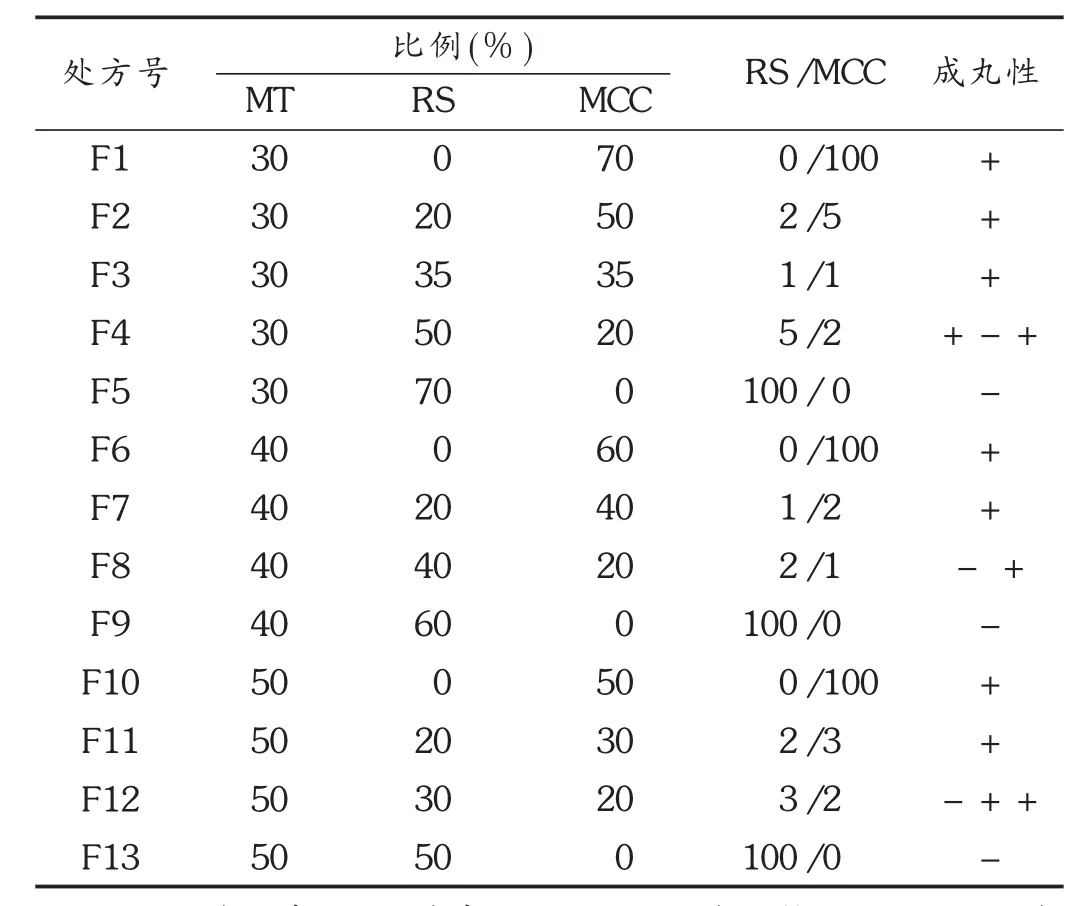
表1 挤出滚圆微丸设计处方
1.2.2 丸芯制备
挤出-滚圆的主要工艺因素为挤出速度、滚圆转速和滚圆时间。挤出速度和滚圆时间主要影响成球性能。挤出速度低,软材暴露时间长,导致物料失水,使部分微丸呈棒状;速度过高,直接影响微丸收率。滚圆时间过短,微丸的外观不圆整,且收率较低,但时间过长微丸圆整度会变差。滚圆转速对微丸成型影响较大,转速过小,会导致向心力和摩擦力变小,造成微丸的外观呈棒状;转速过大,微丸彼此摩擦力增大,容易裂碎,导致收率降低。通过前期试验最终确定了制备工艺,即挤出速度 40 r/min,滚圆转速 1 000 r/min,滚圆时间 15 min,湿丸 40 ℃烘干 24 h,整粒(0.6~0.9 mm),即得。均在室温下[温度(21 ±3)℃,相对湿度(40 ±5)%]操作。
1.2.3 体外溶出度测定
测定微丸溶出度按2015年版《中国药典(四部)》通则 0931 第一法转篮法[1]。分别选择 pH 为 1.2,6.8,7.4的缓冲溶液 900 mL、转速 100 r/min、温度(37 ± 0.5)℃下进行体外溶出试验。于不同时间点取样2 mL,每次取样后立即补充同温度及体积的新鲜介质。样品经0.45 μm微孔滤膜过滤作为供试品溶液,计算MT含量。
1.2.4 酶解耐受试验
胰酶是指从猪、牛、羊等动物胰脏提取得到的多种酶混合物,在中性、弱碱性条件下以胰酶和淀粉酶作用较强[4]。取适量微丸加入至 20 mL 胰酶溶液(0.15 g/mL,含 1%SDS)中,37 ℃ 温孵,不同时间点(20,60,120,180 min)取样2 mL。每次取样后立即补充同温度及体积的新鲜介质。为了停止酶活性,样品加入80%乙醇2 mL。样品经0.45 μm微孔滤膜过滤作为供试品溶液,采用高效液相色谱(HPLC)法分析。
1.2.5 微生物降解释放试验
选择结肠大量存在的微生物大肠杆菌为考察对象[5]。大肠杆菌(E.coli ATCC 25922)在 Luria-Bertani培养基培养(37℃),预培养,使菌种成倍扩增,达到使用要求[OD6000.8(6.0 ×108cfu /mL)~0.7(5.5 ×108cfu /mL)]。取40 mL培养物(原始 pH =6.5),加入100 mg微丸,持续搅拌下 37 ℃孵育。不同时间点(20,60,120,180 min)取样 1 mL(终点 pH = 5.5),3 000 r/min 离心 15 min,0.45 μm滤膜过滤作为供试品溶液,HPLC法分析。
1.2.6 微丸物理特性测定
得率:选取粒径在355~850 μm间的微丸进行检测。取药典用药筛(国标R40/3),收集过2号筛且不能过3号筛微丸,称质量。按公式计算,yield=100×(W/theoreticalweight),其中 W是实际质量。
球形:样品放置于玻璃片上,使用配有Motic Images Plus 2.0软件软件的三目显微镜观察直径、形态以及球形。球形采用公式(Riley′s sphericity index,ΨR)计算,ΨR= ( Di/Dc)1/2,其中 Di是目镜下最大微丸的直径,Dc为目镜下最小微丸的直径(n=50)。
脆碎度:使用玻璃珠联合脆碎度测定仪测定。记录微丸初始质量(W1);选择使用直径为5 mm的250粒玻璃珠,加入样品,25 r/min条件下持续 4 min;收集微丸,并过 3号药筛;记录最后质量(W2)。脆碎系数(F)记为损失质量的百分比,F(%)=100×(W1-W2)/W1。
1.3 统计学处理
各独立试验均重复3次。采用SPSS 21.0统计学软件分析,进行Duncan′s多组间样本差异显著性分析。
2 结果
2.1 RS-MCC不同比例对微丸成形的影响
MCC对微丸成形有较好的促进作用,是目前最常用的微丸药用辅料。由图1可知,MCC用量越大,微丸成形性越好:当MCC辅料占比大于0.5时,圆整度、得率明显增加。RS同时可抗环境降解和淀粉粘合。当RS占比小于0.6时,所得到的微丸都是可接受的,得率、球形和脆碎度分别>80%,>0.95和<0.12%。结果见表2。其中,含RS微丸脆碎度与MCC微丸相比有显著差异,可能是由于RS淀粉粘性使得微丸物质间粘附更紧密[6]。
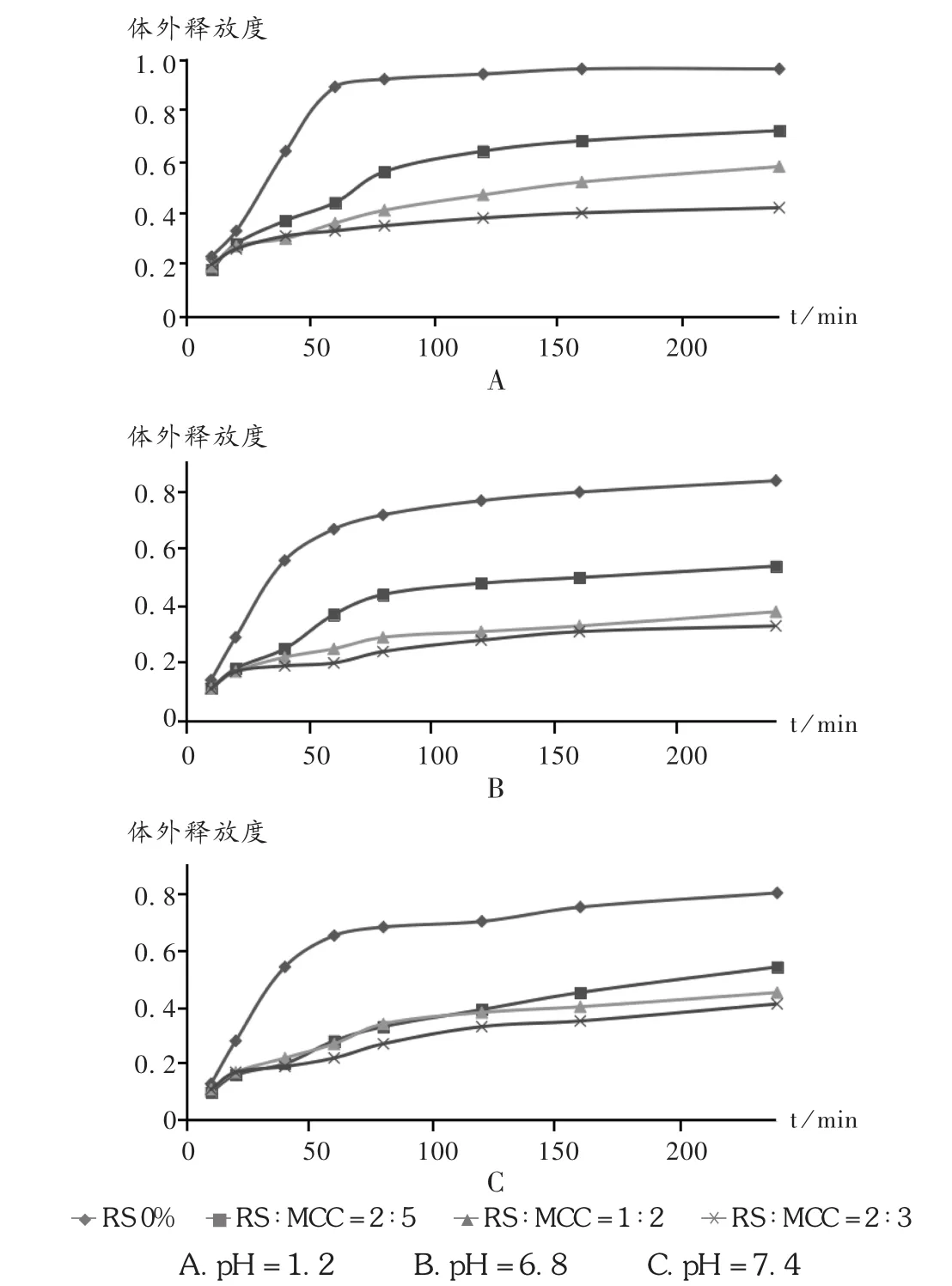
图1 RS/MCC对pH变化体外释放度影响(n=3)
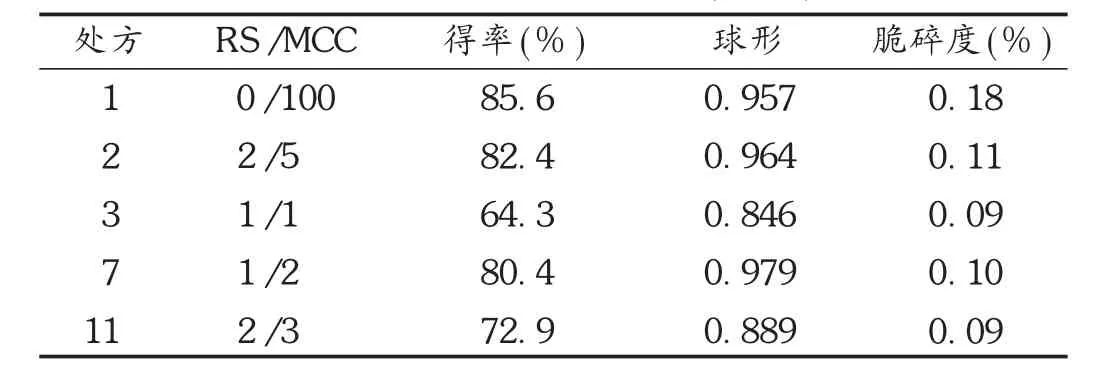
表2 微丸物理性能评估(n=3)
2.2 RS对pH变化时体外释放度的影响
选择模拟胃肠道不同部位的介质(pH为1.2,6.8,7.4)考察药物的释放变化。选择处方 F10,F2,F7,F11,即 RS/MCC 为 0,2∶5,1∶2,2∶3 进行溶出度试验。由图 1可见,F11在各个介质中均显示最低的释放速率。4个样品前20 min释放基本无差异,可能是由于RS中含有少量未回生的直链淀粉溶解度较大,增加了短时间内的快速释放。60 min后溶出差异逐渐显现:无RS组微丸已崩解,药物基本释放完全;RS高含量组(F11)溶出度与20 min释放差异不明显,微丸仍保持原形,推测是由于RS可抵抗pH变化造成的影响,不产生降解或溶解,维持了微丸的原状[7];吸水造成的有限程度溶胀形成了药物释放的阻滞层,从而有效防止微丸溶蚀,降低了释放速度。可见,高含量RS的微丸对胃肠道上部生理条件的耐受能力较强。但是内加和外加粘合剂、是否需要塑化等问题仍需要进一步研究。
2.3 RS对酶解耐受试验的影响
试验结果显示,由于普通直链淀粉和抗性淀粉RS1,RS2的存在,前20 min药物释放较快;60 min后各处方出现明显差异,RS含量高组方F11的释放速率最低。推测可能是RS和HPMC的原位溶胀,促进了网状结构的重组,抑制了酶的进入。制备RS的前提是取淀粉酶中不降解的直链淀粉,因而试验结果与预估一致。
2.4 RS对微生物降解释放的影响
各组方在微生物条件下的降解以及随后药物的释放,采用 E.coli作为模型微生物进行研究。E.coli是人结肠原有微生物大肠细菌,存在概率高,同时也是一种有氧菌,极易培养。图2显示了4个处方药物的释放情况。与模拟胃肠道pH介质、酶解试验结果相比,含有RS组方微丸降解快,1 h微丸崩解,3 h药物释放超过90%。
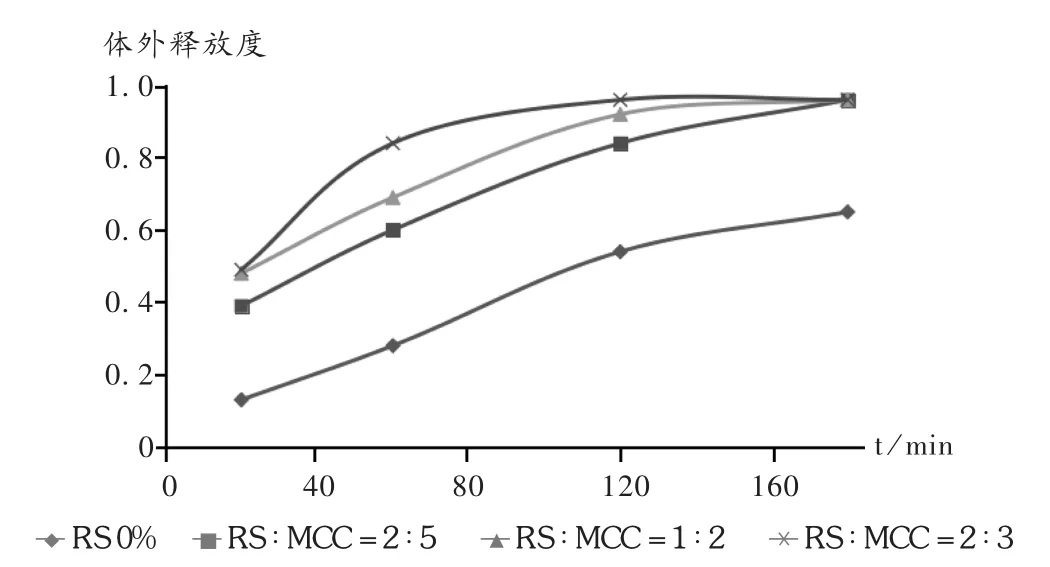
图2 RS/MCC对微生物降解释放的影响
3 讨论
对于治疗各种肠道疾病,如溃疡性结肠炎、Crohn′s疾病、结肠癌等,靶向药物至结肠是非常理想的。药物传递系统应有能力保护药物,避免胃和小肠部位发生药物释放和吸收,保护药物生理活性,确保只在结肠释放药物[7-9]。RS在胃和小肠内很难被消化或吸收的特性使其成为结肠药物传递系统的一种很有吸引力的载体。此外,RS可能是一种理想的肠道微生物药物传递形式。由于可生物降解酶只存在于结肠,因此使用可生物降解的聚合物,将药物在胃和小肠环境中被屏蔽,并将药物输送到结肠,受到微生物的同化,通过酶降解或分解聚合物后分子量下降,失去机械强度,从而释放药物[9]。
前期研究发现,何首乌RS具有含量高,对胃肠道pH生理环境的抵抗能力强的特点,优于普通玉米或小麦RS;结合多单元药物传递系统(如微丸)的优势,如可重现的胃-肠道转运时间、混合微丸的可变性、个体用药适用的多元混合微丸以及低风险的药物突释[10]。因此选择RS微丸作为靶向结肠的主要载体,并研究其对微丸成形、药物靶向释放的影响。通过微丸成形工艺研究,可见RS在微丸的挤出-滚圆过程中粘附性适中,对得率、球形和脆碎度均有较好的促进作用。这可能与其物理性质有关:抗性淀粉分子结构与普通淀粉无变化,分子量和聚合度较小,可推知RS基本保留了淀粉的粘合特性,而较低的聚合度有利于微丸滚圆过程中的断裂和成圆[11-12];何首乌RS以RS3回生淀粉为主,具有较高的热稳定性,对于高压挤出产生的热能具有一定的抵抗性,可有效地保护药物。药物在模拟生物条件下的释放结果较好验证了何首乌RS的靶向结肠特性。通过结果可知,药物在胃液(pH = 1.0)、小肠液(pH = 6.8)中,随着RS含量的增加释放量明显下降。酶解环境中RS高含量的处方药物释放速率慢,推测与RS致密结构有关:α-淀粉酶随机作用于直链淀粉和支链淀粉的直链部分α-1,4糖苷键,单独使用时最终生成寡聚葡萄糖、α-极限糊精和少量葡萄糖。由于高直链淀粉双螺旋高致密结构,尤其是RS3回生淀粉,α-淀粉酶一般难以接近糖苷键。这一点对于防止药物在胃肠道上部过早释放较为关键[2,11]。玉米、小麦RS不能被体内微生物降解,而本研究结果表明RS可在微生物降解释放药物,推测这可能与RS来源于药用植物何首乌的块根有关,原因还有待进一步研究[13-14]。
RS是一种新兴的膳食纤维,是近年来食品、保健品领域的研究热点,具有类似溶解性纤维的生理功能,在小肠中不被消化,但在大肠中能部分被肠道微生物菌群发酵,产生多种短链脂肪酸,具有改善肠道环境、防止糖尿病、促进维生素和矿物质的吸收等功效[15]。目前,国外关于多种食品及作物中RS的制备及方法的研究已比较成熟,且有部分产品已上市[16]。对贵州量产中药何首乌淀粉进行了系列研究,发现所得RS含量较高,在胃肠道上部降解速率小,对多种酶也有抑制作用。体外释放条件评估含有RS微丸靶向结肠的效果,推测RS微丸具有较好的靶向结肠释放作用。RS的纯度(RS3占比)、内加或包衣仍需要进一步研究。
[1]Yang L.Biorelevant dissolution testing of colon-specific delivery systems activated by colonic microflora[J].Journal of Controlled Release,2008,125(2):77-86.
[2]Meneguin AB,Cury BC,Evangelista RC.Films from resistant starch-pectin dispersions intended for colonic drug delivery[J].Carbohydrate Polymers,2014,99(1):140-149.
[3]Teacǎ CA,Bodirlǎu R,Spiridon I.Effect of cellulose reinforcement on the properties of organic acid modified starch microparticles/plasticized starch bio-composite films[J].Carbohydrate Polymers,2013,93(1):307-315.
[4]Sousa T, Yadav V, Zann V, et al.On the Colonic Bacterial Metabolism of Azo-Bonded Prodrugs of 5-Aminosalicylic Acid[J].J Pharm Sci,2014,103(10):1-5.
[5]Araujo V,Gamboa A,Caro N,et al.Release of Prednisolone and Inulin from a New Calcium-Alginate Chitosan-Coated Matrix System for Colonic Delivery[J] .J Pharm Sci, 2013, 102(8):2748-2759.
[6]Jiang SS,Liu CZ,Wang XJ,et al.Physicochemical properties of starch nanocomposite films enhanced by self-assembled potato starch nanoparticles[J].Food Science and Technology,2016,69(2):251-257.
[7]Philip AK,Philip B.Colon targeted drug delivery systems:a review on primary and novel approaches[J].Oman Med J,2010,25(2):79-87.
[8]Akala EO,Elekwachi O,Chase V,et al.Organic redox-initiated polymerization process for the fabrication of hydrogels for colonspecific drug delivery[J].Drug Dev Ind Pharm,2003,29(4):375-386.
[9]López-Molina D,Chazarra S,How CW,et al.Cinnamate of inulin as a vehicle for delivery of colonic drugs[J].International Journal of Pharmaceutics,2015,479(1):96-102.
[10]Lustig-Gustafsson C,Johal HK,Podczeck F,et al.The influence of water content and drug solubility on the formulation of pellets by extrusion and spheronisation[J].Eur J Pharm Sci,1999,8(2):147-152.
[11]Perera A,Meda V,Tyler RT.Resistant starch:A review of analytical protocols for determining resistant starch and of factors affecting the resistantstarch content of foods[J].Food Research International,2010,43(8):1959-1974.
[12]Fuentes-Zaragoza E,Riquelme-Navarrete MJ,Sánchez-Zapata E,et al.Resistant starch as functional ingredient:A review[J].Food Research International,2010,43(4):931-942.
[13]Ozturk S,Koksel H,Kahraman K,et al.Effect of debranching and heat treatments on formation and functional properties of resistant starch from high-amylose corn starches[J].European Food Research and Technology,2009,229(1):115-125.
[14]Zhang Y,Zeng H,Wang Y,et al.Structural characteristics and crystalline properties of lotus seed resistant starch and its prebiotic effects[J].Food Chemistry,2014,155(15):311-318.
[15]Coviello T,Matricardi P,Marianecci C.Polysaccharide hydrogels for modified release formulations[J] .J Controlled Release,2007,119(1):5-24.
[16]苏雪锋,黄继红,侯银臣,等.抗性淀粉研究进展[J].食品工业,2014,35(12):208-211.
Study on Resistant Starch of Polygonum Multiflorum for Promoting Drug Release in Vitor of Targeted Colon Pellets
Li Wentao1,Wan Ke2,Yang Ying2,Ruan Jinghua2,3,Cao Peixue2,Yang Xiaosheng2
(1.Shaanxi Medical Equipment Quality Supervision and Inspection Institute,Xi′an,Shaanxi,China 712046; 2.Key Laboratory of Chemistry for Natural Products of Guizhou Province and Chinese Academy of Sciences,Guiyang,Guizhou,China 550016; 3.The First Affiliated Hospital of Guiyang Chinese Medicine University,Guiyang,Guizhou,China 550002)
ObjectiveTo investigate the feasibility of resistant starch(RS)of Polygonum multiflorum as a targeted colon pellet material.Methods Under the physiological conditions,the dissolution rate of RS and microcrystalline cellulose(MCC)in different proportions of pellets was investigated,with Matrine(MT)as the model drug,the pellets were prepared by extrusion-spheronization technology,and the relevant indexes were observed.Results RS had shown significant effect on the release of pellets.In vitro drug release showed that when the RS /MCC was less than 0.5,the yield,sphericity and crispness of the pellets were > 80.00%,> 0.95 and < 0.12%,respectively.High content of RS in pellets could significantly improve the tolerance to pH changes and enzymatic hydrolysis.Under the action of microbial Escherichia coli,the pellets rapidly disintegrated and dissolved more than 82% in 30 min.Conclusion RS of Polygonum multiflorum is a promising oral delivery system,which can exert efficacy in the colon target.
resistant starch;colonic targeting;moldability;drug release
10.3969 /j.issn.1006-4931.2017.17.002
国家自然科学基金[81360486];贵州省中药现代化科技产业研究开发专项项目[黔科合SY字〔2014〕3081-2号]。
李闻涛(1978-),女,硕士研究生,副高,研究方向为药品及医疗器械质量研究,(电话)029-33585395(0)(电子信箱)931482202@ qq.com。
阮婧华(1976-),女,博士研究生,副研究员,研究方向为药物新制剂及靶向传递研究,(电话)0851-83808806(0)(电子信箱)ruanjinghua@ aliyun.com。
2017-05-09;
2016-06-05)
