1-磷酸鞘氨醇受体1-3在Ⅰ型糖尿病ED大鼠阴茎海绵体组织中的表达*
2017-09-29冯海航刘继红
刘 康 崔 凯 李 瑞 冯海航 刘继红** 文 博, 饶 可**
1. 华中科技大学同济医学院附属同济医院泌尿外科(武汉 430030);2. 南方医科大学附属深圳宝安医院泌尿外科;3. 广州医科大学附属深圳沙井医院泌尿外科
·论 著·
1-磷酸鞘氨醇受体1-3在Ⅰ型糖尿病ED大鼠阴茎海绵体组织中的表达*
刘 康1崔 凯1李 瑞1冯海航2刘继红1**文 博2,3**饶 可1**
1. 华中科技大学同济医学院附属同济医院泌尿外科(武汉 430030);2. 南方医科大学附属深圳宝安医院泌尿外科;3. 广州医科大学附属深圳沙井医院泌尿外科
目的 探讨1-磷酸鞘氨醇受体1-3(S1PR1-3)在糖尿病性勃起功能障碍大鼠阴茎海绵体组织中的表达。方法 20只成年雄性SD大鼠随机分为正常对照组和糖尿病组, 成功造模2个月后,测定两组大鼠阴茎海绵体内压/平均动脉压(Max ICP/MAP),采用Western blot分析S1PR1-3、eNOS、RhoA、ROCK1、ROCK2的表达。 结果 与对照组相比,糖尿病组大鼠勃起功能显著降低(P<0.05);糖尿病组大鼠阴茎海绵体S1PR1、S1PR3、eNOS蛋白表达水平下降(P<0.05),而S1PR2、RhoA、ROCK1、ROCK2的表达升高(P<0.05)。结论 Ⅰ型糖尿病可导致大鼠勃起功能障碍,可能与S1PR1、S1PR3表达下调,eNOS/NO/cGMP信号通路受抑制以及S1PR2受体表达升高,激活RhoA/Rho激酶信号通路有关。
1-磷酸鞘氨醇受体; rho相关激酶类; 一氧化氮合酶; 勃起功能障碍; 糖尿病
糖尿病是引起男性勃起功能障碍(erectile dysfunction,ED)最常见的危险因素之一。据报道,约30%~80%糖尿病患者患有不同程度ED,患病率是正常男性的3倍,而且糖尿病患者出现勃起功能障碍的时间较正常男性提前约10年,其症状也更加严重,对患者的生活质量造成严重影响[1,2]。1-磷酸鞘氨醇(sphingosine-1-phosphate,S1P)和1-磷酸鞘氨醇受体(sphingosine-1-phosphate receptor,S1PR)在人体的心血管、内分泌、免疫、神经等多个系统中发挥着重要作用[3],目前,1-磷酸鞘氨醇及其受体在ED的机制研究中逐渐受到重视,在高血压、神经损伤、雄激素缺乏等诱导ED中均发现S1PR1-3的表达异常[4-6],而阴茎海绵体组织中S1PR1-3的表达在糖尿病诱导ED中的作用机制尚不清楚,本实验比较S1PR1-3在糖尿病大鼠及正常大鼠阴茎海绵体组织中的表达,研究S1PR1-3与糖尿病诱导ED的关系以及其对大鼠勃起功能的影响。
资料和方法
(一)实验动物
8周龄无特异病原(specific-pathogen-free, SPF)雄性sprague-dawley(SD)大鼠20只,均购自湖北省疾病预防控制中心,体质量为180~210g,在同一SPF无菌环境下正常饲养适应1周,随机分为两组。正常对照组(CO)8只,予以常规饲料喂养;糖尿病(DM)组12只,禁食12h后,予以60mg/kg链佐菌素(STZ)腹腔注射,给药后禁水不禁食4h。腹腔注射72h后,取尾静脉血测量血糖≥16.7mmol/L提示造模成功,造模成功大鼠可见明显多饮多尿症状,注意精心喂养,勤换垫料,防止感染死亡,8周后正常对照组大鼠全部存活,糖尿病大鼠体质量明显减轻,毛色晦暗,2只大鼠因腹腔感染死亡。
(二)主要试剂及仪器
链佐菌素(streptozotocin, STZ)、柠檬酸、柠檬酸钠(Sigma公司,美国),STZ溶液的配置:取适量STZ溶解到0.1mmol/L柠檬酸-柠檬酸钠缓冲液(pH=4.2),终浓度为1%,即配即用;eNOS抗体(Abcam 公司,英国);RIPA裂解液(江苏碧云天生物公司);S1PR1抗体、 S1PR2抗体、RhoA抗体、ROCK1抗体、ROCK2抗体、β-actin(武汉三鹰生物技术有限公司);S1PR3抗体(Santa Cruz公司,美国);羊抗兔和羊抗鼠二抗(武汉科瑞生物科技有限公司);罗氏血糖仪及试纸(ACCU-CHEK);Powerlab四通道生理记录仪(AD Instruments 公司,澳大利亚)。
二、实验方法
(一)体质量及血清学检测
所有大鼠购回适应饲养一周,随机分组之后禁食12h,测量体质量,使用罗氏血糖仪(ACCUCHEK)采取断尾取血法测量空腹血糖;16周龄时,同样方法再次测量两组大鼠体质量及空腹血糖值。
(二)阴茎海绵体内压/平均动脉压(Max ICP/ MAP)测定
在甘南,郑军里碰到了藏区牧民中难得一见的“转场”迁徒,各种生动感人甚至壮观浩荡的人情牧歌都在其中了。从准备到启程、远征,这种场面都是生活在那个地区的人们难得一见的壮举,想必这对郑军里的视觉和心灵有很大的震撼。毫无疑问,这批作品即以“转场”为中心,描绘了他见到的感兴趣的藏区牧民们的人情生活,有着向往远方的牧歌情调。《一路向西》《齐心协力奔远方》《阳刚》等都表现了这种特定场面中的壮观与抒情。那种新生活的小趣味也尽在其中,如现在牧民女的通讯与娱乐也离不开手机了,持手机放牧的《音讯传来》即描绘了这种生活。
参照本课题组已报道的实验方法[7]。大鼠麻醉后,进行颈总动脉插管,连接压力换能器并由PowerLab/4SP 系统(AD Instrument 澳大利亚)采集信号,之后,暴露海绵体神经,作为电刺激部位,将穿刺针插入阴茎海绵体固定并连接压力换能器,采集信号。连接PowerLab工作台,设置电刺激参数为频率15Hz、脉冲1.2ms,分别给予2.5V、5V、7.5V电压刺激海绵体神经,每次1min,间隔为3min。记录2.5V、5V、7.5V电压下海绵体压力(ICP)及平均动脉压(MAP),结果以Max ICP/MAP表示。
(三)Western印迹测定S1PR1-3、eNOS、RhoA、ROCK1及ROCK2在大鼠阴茎海绵体组织中的表达
参照本课题组前期实验采用的方法[7]。一抗选用兔抗大鼠S1PR1(1:500)、S1PR2(1:500)、S1PR3(1:500)、eNOS(1:1000)、RhoA(1:500)、ROCK1(1:1000)、ROCK2(1:1000)抗体,鼠抗大鼠β-actin(1:1000)抗体,二抗选用辣根过氧化物酶标记的羊抗兔和羊抗鼠二抗(1:5000),采用ECL化学发光并采集图像进行处理,使用QuantityOne软件分析图像结果。
三、统计学分析
实验结果以x±s表示,采用单因素方差分析和t检验,用SPSS 22.0软件进行分析,P<0.05表示差异有统计学意义。
结 果
一、实验前后两组大鼠体质量、血糖比较
两组大鼠饲养适应1周,实验前,测量两组大鼠体质量及血糖并比较,差异无统计学意义,见表1。链佐菌素注射后,两组大鼠均饲养8周,糖尿病组大鼠因感染死亡2只,体质量较正常对照组大鼠明显减轻,差异具统计学意义(P<0.05)。糖尿病大鼠血糖水平明显高于正常对照组大鼠,差异具统计学意义(P<0.05),见表1。
二、两组大鼠Max ICP/MAP比
分别用2.5V、5V、7.5V电压刺激大鼠海绵体神经,电压刺激时糖尿病组较正常对照组Max ICP/MAP显著降低(P<0.05)。图1是各组大鼠在2.5V、5V、7.5V刺激下海绵体测压的ICP和MAP的监测记录和比较结果。
二、Western印迹测定两组大鼠阴茎海绵体组织中S1PR1-3、eNOS、RhoA、ROCK1及ROCK2的表达水平
结果显示:糖尿病组S1PR2、RhoA、ROCK1和ROCK2较正常对照组明显增高,而S1PR1、S1PR3及eNOS水平明显低于正常对照组(均P<0.05),见图2和图3。

表1 两组大鼠实验前后体质量及血糖比较
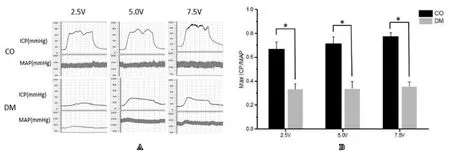
图1 2.5V、5V、7.5V电刺激后两组大鼠阴茎海绵体内Max ICP/MAP比值变化
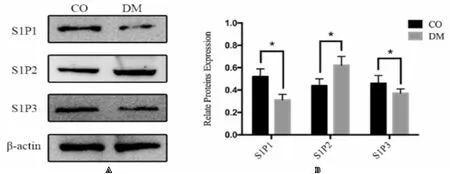
图2 S1PR1-3在两组大鼠阴茎海绵体中的表达
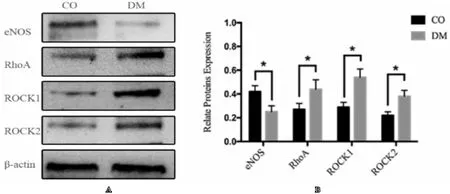
图3 eNOS、RhoA/Rho激酶在两组大鼠阴茎海绵体中的表达
讨 论
勃起功能障碍是成年男性的常见疾病,与ED有关的危险因素包括:年龄增长、躯体疾病(如高血压、糖尿病、高脂血症、肥胖、神经疾病等)、精神心理因素、用药史、手术外伤史及不良的生活方式等。40~70岁男性有一半以上患有不同程度的ED,严重影响患者的生活质量[8]。现有的研究表明,ED的发生机制极其复杂,涉及众多信号通路,如NO/cGMP信号通路、RhoA/Rho激酶信号通路、cAMP信号通路、H2S、CO、K+通道、血管活性肠肽、降钙素基因相关肽、前列腺素、内皮素等均参与阴茎海绵体平滑肌的舒张和收缩[9]。目前认为NO/cGMP通路在阴茎勃起中起主要作用,而eNOS主要分布于血管内皮细胞及平滑肌细胞,是阴茎海绵体中NO的重要来源。可以认为eNOS对松弛阴茎海绵体平滑肌促进阴茎勃起起着至关重要的作用。而RhoA/Rho激酶信号通路参与多种危险因素诱导ED的发生过程[10],对阴茎海绵体平滑肌收缩,维持阴茎疲软起着关键作用[11]。在糖尿病大鼠中,阴茎海绵体组织中eNOS表达下降,同时RhoA/Rho激酶信号通路上调,阴茎海绵体平滑肌收缩因素增强而舒张因素减弱,从而导致ED的发生。
S1P是一种具有重要生理功能的两性生物信号分子,主要分布于血液、淋巴液等体液以及各类血细胞中,既可以在细胞内作为第二信使直接调节生物学行为,也可以被分泌到细胞外,结合其相应表面受体,调节各种生理活动。S1P受体是G蛋白偶联受体家族成员之一,包括S1PR1~S1PR5,与G蛋白偶联发挥作用[12]。
S1P与S1PR1结合,可以诱导内皮细胞生成NO,起到舒张血管的作用。di Villa Bianca等[13]对人体阴茎组织的研究发现,S1P是通过调节eNOS磷酸化,增加NO的合成与释放,促进阴茎的勃起。进一步研究发现,在内皮细胞中,S1P/S1PR1可以通过激活PI3K/ Akt信号通路,上调eNOS表达,增加NO含量,最终舒张血管平滑肌[14]。在去势大鼠模型和自发性高血压大鼠模型中,均发现阴茎海绵体组织S1PR1、eNOS及P-eNOS表达降低[4,6]。本实验在糖尿病大鼠中也有类似变化,S1PR1、eNOS表达均明显低于正常对照组,由此推测可能机制为Ⅰ型糖尿病大鼠阴茎海绵体组织中S1PR1表达降低,从而抑制eNOS/NO/cGMP信号通路,最终致使大鼠ED的发生。
S1PR2在体内的分布与S1PR1类似,但S1PR2在成年期机体的血管平滑肌组织中的表达较S1PR1高,作用更突出。在平滑肌细胞中,S1P结合S1PR2与G12/13蛋白偶联后,可以激活RhoA/Rho激酶信号通路,促进肌球蛋白轻链磷酸化,导致血管平滑肌收缩[15];在内皮细胞中,S1P结合S1PR2后可抑制PI3K/Akt信号通路,进而下调eNOS表达,导致NO生成减少,血管平滑肌舒张受阻[16];此外,S1P/S1PR2还可以通过增加磷酸化细胞外信号调节激酶1 /2(pERK1/2)的表达,激活L型钙通道(L- Ca2+)使细胞内Ca2+升高,同时抑制eNOS活性,减少NO合成[17]。对去势大鼠勃起功能研究发现,S1PR2、RhoA、ROCK1、ROCK2在阴茎海绵体组织中表达均增加[7]。在糖尿病大鼠模型中,本实验也发现相同的变化,我们推测,S1P与S1PR2结合之后,一方面可以激活RhoA/Rho激酶信号通路,另一方面,可以抑制PI3K/Akt信号通路和pERK1/2途径,进而抑制eNOS表达,降低NO含量,损害勃起功能。
S1PR3具有双向调节作用,既可以通过PI3K/Akt信号通路促进eNOS磷酸化,增加NO合成和释放,起到舒张血管的作用,也可以通过激活Rho相关信号通路导致血管收缩。在自发性高血压大鼠模型和去势大鼠模型研究中,S1PR3在阴茎海绵体中的表达均明显高于对照组[4],而本实验中,糖尿病大鼠组S1PR3表达明显低于对照组,eNOS水平同样较对照组降低。根据以上研究,我们认为,在Ⅰ型糖尿病大鼠体内,阴茎海绵体组织中S1PR3 表达下降,导致eNOS含量降低,最终影响勃起功能。
本实验具有一定的局限性,对于S1P/S1PR如何调控各信号通路没有进行深入的探索,而且,实验中没有进行干预治疗,如果能够使用相应受体的激动剂或者抑制剂或是采用分子生物学方法进行干预,将会使我们对S1P/S1PR与Ⅰ型糖尿病ED的关系有更加清晰的认识;此外,本实验还缺少细胞水平研究,进一步验证体内的发现。我们将在后续研究中逐渐完善这些内容。
综上所述,Ⅰ型糖尿病引起勃起功能障碍可能与阴茎海绵体组织内S1PR1、S1PR3表达下调,eNOS/ NO/ cGMP信号通路受抑制以及S1PR2表达升高,激活RhoA/Rho激酶信号通路有关。S1PR1-3可能是糖尿病诱导ED发生过程中调节NO/cGMP信号通路和RhoA/Rho激酶信号通路的一个重要调控位点。本实验为研究糖尿病诱导ED发生机制及治疗提供了新的思路。
1 Johannes CB, Araujo AB, Feldman HA, et al. Incidence of erectile dysfunction in men 40 to 69 years old: longitudinal results from the Massachusetts male aging study. J Urol 2000; 163(2): 460-463
2 Phé V, Rouprêt M. Erectile dysfunction and diabetes: A review of the current evidence-based medicine and a synthesis of the main available therapies. Diabetes Metab 2012; 38(1): 1-13
3 Maceyka M, Harikumar KB, Milstien S, et al. Sphingosine-1-phosphate signaling and its role in disease. Trends Cell Biol 2012; 22(1): 50-60
4 Wang B, Jiang J, Fan Z, et al. Expression of sphingosine-1-phosphate 1-3 on penile cavernous tissue in hypertensive and normotensive rats. Urology 2014; 84(2): 490 e7-e13
5 Cho MC, Park K, Chai JS, et al. Involvement of sphingosine-1-phosphate/RhoA/Rho-kinase signaling pathway in corporal fibrosis following cavernous nerve injury in male rats. J Sex Med 2011; 8(3):712-21.
6 陈学勤, 夏纪毅, 程波, 等. 1-磷酸鞘氨醇受体1-3(S1P1-3)在去势雄性大鼠阴茎海绵体组织中的表达. 中华男科学杂志 2016; 22(5): 393-400
7 崔凯, 李瑞, 王涛, 等. 雄激素调控RhoA/Rho激酶改善去势大鼠勃起功能障碍的机制研究. 华中科技大学学报•医学版 2016; 45(2): 145-148, 153
8 Maeda H, Toyooka N, Kinukawa T, et al. Magnetic resonance images of hematospermia. Urology 1993; 41(5): 499-504
9 刘继红, 栾阳. 男性勃起功能障碍的分子生物学研究进展. 中华男科学杂志 2015; 21(2): 99-106
10 饶可, 刘继红. Rhoa/Rho激酶在男性勃起功能障碍机制中的研究进展. 中国男科学杂志 2008; 22(11): 65-67, 71
11 Sopko NA, Hannan JL, Bivalacqua TJ. Understanding and targeting the Rho kinase pathway in erectile dysfunction. Nature Reviews. Nat Rev Urol 2014; 11(11): 622-628
12 Blaho VA, Hla T. An update on the biology of sphingosine 1-phosphate receptors. J lipid Res 2014; 55(8): 1596-1608
13 di Villa Bianca Rd, Sorrentino R, Sorrentino R, et al. Sphingosine 1-phosphate induces endothelial nitric-oxide synthase activation through phosphorylation in human corpus cavernosum. J Pharmacol Exp Ther 2006; 316(2): 703-708
14 Kimura T, Tomura H, Mogi C, et al. Role of scavenger receptor class B type I and sphingosine 1-phosphate receptors in high density lipoprotein-induced inhibition of adhesion molecule expression in endothelial cells. J Biol Chem 2006; 281(49): 37457-37467
15 Watterson KR, Ratz PH, Spiegel S. The role of sphingosine-1-phosphate in smooth muscle contraction. Cell Signal 2005;17(3): 289-298
16 Liu W, Liu B, Liu S, et al. Sphingosine-1-phosphate receptor 2 mediates endothelial cells dysfunction by PI3K-Akt pathway under high glucose condition. Eur J Pharmacol 2016; 776: 19-2517 Liu W, Lan T, Xie X, et al. S1P2 receptor mediates sphingosine-1-phosphate-induced fibronectin expression via MAPK signaling pathway in mesangial cells under high glucose condition. Exp Cell Res 2012; 318(8): 936-943
(2017-01-28收稿)
Expressions of sphingosine-1-phosphate receptors 1-3 in the cavernous tissues of diabetes mellitus ED rats*
Liu Kang1, Cui Kai1, Li Rui1, Feng Haihang2, Liu Jihong1**, Wen Bo2,3**, Rao Ke1**
1. Department of Urology, Tongji Hospital, Tongji Medical College, Huazhong University of Science and Technology, Wuhan 430030, Hubei, China; 2. Department of Urology, the People's Hospital of Baoan District, Southern Medical University; 3. Department of Urology, the People's Hospital of Shajing District, Guangzhou Medical University;
Corresponding author: Liu Jihong, E-mail: jhliu@tjh.tjmu.edu.cn;
Wen Bo, E-mail: Tjwb001@126.com; Rao Ke, E-mail: raokeke2009@163.com
Objective To investigate the expressions of sphingosine-1-phosphate receptors 1-3 in the cavernous tissues of diabetes mellitus-induced erection dysfunction rats and its molecular mechanism. Methods 20 eight-week-old healthy male SD rats were randomly divided into 2 groups: Control Group (CO, n=8) and Diabetes mellitus group (DM, n=12,). Diabetes rats were firstly constructed. After 2 months, the maximum intracavernous pressure/mean arterial pressure (Max ICP/MAP) of rat models were determined and the expressions of S1PR1-3、eNOS、RhoA、ROCK1 and ROCK2 in the penis were detected by Western blot. Results The erectile function was significantly decreased in DM rats, compared to that of age-matched control rats (P<0.05); the expressions of S1PR1、S1PR3 and eNOS were lower in group DM than those in group CO (P<0.05), whereas the expressions of S1PR2、RhoA、ROCK1、ROCK2 were higher in group DM (P<0.05). Conclusion Diabetes mellitus could result in significant reduction of Max ICP/MAP in male rats. Lower expressions of S1P1and S1PR3 in the penis and inhibition of the eNOS/NO/cGMP signaling pathways, as well as higher expression of S1PR2 and activation of the RhoA/Rho kinase signaling pathways may contribute to this pathological process.
sphingosine-1-phosphate receptors; rho-Associated Kinases; Nitric Oxide Synthase ; erectile dysfunction; Diabetes Mellitus
10.3969/j.issn.1008-0848.2017.04.001
R698.1; R587.1
资助:深圳市科技计划项目(JCYJ20160427190559022)
**通讯作者:刘继红,E-mail: jhliu@tjh.tjmu.edu.cn;文博,E-mail: Tjwb001@126.com;饶可,E-mail: raokeke2009@163.com
