结直肠癌组织中CyPJ的表达及其临床意义
2017-09-29张红波陈剑胡金晨王熙勋贾荣保姜立新
张红波陈剑胡金晨王熙勋贾荣保姜立新
结直肠癌组织中CyPJ的表达及其临床意义
张红波1陈剑2胡金晨1王熙勋1贾荣保1姜立新1
目的 观察亲环素J(CyPJ)在结直肠癌组织中的分布和表达,探讨其在结直肠癌发生发展中的临床意义。方法 收集2015年5月至2016 年4月期间青岛大学附属烟台毓璜顶医院胃肠外一科61 例结直肠癌患者的手术切除的组织标本。采用免疫组织化学染色法检测CyPJ蛋白在61例结直肠癌组织及相应癌旁组织中的表达水平。应用SPSS 23.0统计学软件分析结直肠癌组织中CyPJ的蛋白表达率及其与结直肠癌分各种临床病理的关系。计数资料比较采用卡方检验或Fisher确切概率法,以P<0.05为差异具有统计学意义。结果 CyPJ蛋白在结直肠癌组织表现为高表达,且癌旁组织也可见阳性表达,但颜色相对较浅。CyPJ蛋白的表达主要位于细胞质,少量表达于细胞核。结直肠癌组织及癌旁组织中 CyPJ蛋白的阳性表达率分别为78.7%(48/61)、39.3%(24/61),两者比较,差异有统计学意义(χ2=19.520,P<0.001)。CyPJ蛋白在结直肠癌组织中的表达水平与TNM分期、肿瘤浸润深度及淋巴结转移比较,差异均有统计学意义(χ2=13.585,11.767,13.613,P均<0.001);而与其他临床病理因素如肿瘤大小、肿瘤部位、肿瘤分化程度性别、年龄、及有无远处转移比较,差异无统计学意义(χ2=1.010,0.061,0.119,1.130,2.646,0.416,P均>0.05)。结论 CyPJ蛋白在结直肠癌组织中强表达,提示其可能与结直肠癌的发生、发展及转移密切相关。
结直肠肿瘤; 发展; 转移; 亲环素J
结直肠癌(colorectal cancer,CRC)是全球范围内最常见的恶性肿瘤之一。在各种恶性肿瘤中,结直肠癌发病率男性位居第三位、女性位居第二位,死亡率男性和女性分别位居第四位和第三位[1]。最新研究显示,在我国,结直肠癌是消化系统中最常见的恶性肿瘤之一,其发病率和死亡率仅次于肺癌,均居恶性肿瘤的第2位,其中直肠癌约占所有结直肠癌的70%,仅2015年新发病例就达376 300例,死亡病例191 000例[2]。目前为止手术仍是治疗结直肠癌最有效的方法,尽管在肿瘤的预防、治疗方面取得了长足进展,但其发病率、死亡率仍居高不下,其主要原因是肿瘤的侵袭、转移以及复发。近年来,基因和分子水平上的研究已成为结直肠癌发病机制和诊疗研究的热点,亲环素(cyclophilins,CyPs)与肿瘤的相关的研究已受到越来越多的关注。
CyPs也称为亲免蛋白,是一类在进化过程中结构高度保守且分布广泛的低分子量多功能蛋白家族,具有脯氨酞顺一反异构酶活性和催化脯氨酸肽键的顺反转换,这对蛋白质折叠和多结构域蛋白的组装都是很重要;同时也是重要的免疫抑制剂药物环孢菌素A(cyclospodnA,CsA)的蛋白受体[3-4]。亲环素家族的成员,如CYPA[5-7]、CYPB[8-9]和CYPJ[10]等在多种消化道恶性肿瘤组织中高表达,在肿瘤的发生发展过程中起到重要作用,其致肿瘤机制尚不完全清楚。
CyclophilinJ(简称CyPJ,又称PPIL3)最早于2001年从人类胎儿大脑组织CyPJ的基因序列与CyPA的相似度约为62%[11]。CyPJ主要存在于细胞质和细胞核中,具有肽脯氨酰顺反异构酶活性和核酸酶活性[12-13]。已有研究表明,CyPJ在肝癌[13]、脑胶质瘤[14]等恶性肿瘤组织中高表达;CyPJ与癌细胞生长增殖、转移、抗调亡等密切相关,可能参与恶性肿瘤发生发展。然而,CyPJ在结直肠癌发面的研究仍处于一片空白。本研究旨在采用免疫组化方法观察CyPJ在结直肠癌及癌旁正常组织的表达情况,以明确其是否在结直肠癌组织中过表达,并分析了CyPJ临床病理特征的关系。
资料与方法
一、标本来源
收集2015年05月至2016年04月期间“青岛大学附属烟台毓璜顶医院胃肠外一科”收住入院的结直肠癌患者61例入组所有患者均经结直肠癌手术后石蜡切片病理确诊,男性、女性患者分别是31和30例,年龄23~77岁,平均年龄(59.20±12.83)岁,采用AJCC第七版(2010)结直肠癌分期标准,Ⅰ期患者8例(13.1%),Ⅱ期23例(37.7%),Ⅲ期25例(41.0%),Ⅳ期5例(8.2%)。其中结肠癌患者有36例(59.0%),直肠癌患者25例(41.0%)。患者术前均未行新辅助治疗。收集手术切除的结直肠癌组织及癌旁组织(距离阴性切缘≥5 cm)。
二、主要试剂
通用型SP免疫组织化学染色试剂盒、DAB显色试剂盒及山羊抗兔IgG均购自北京中杉金桥生物技术有限公司。兔抗人PPIL3多克隆抗体购自英国Abcam公司。
三、实验方法
采用链酶抗生物素蛋白一过氧化物酶免疫组织化学(SP)法:将收集的标本经4%多聚甲醛固定,常规石蜡包埋、切片。操作步骤严格按照试剂说明书进行(北京中衫金桥有限公司):将切片标本置于65 ℃烤箱烘烤2 h,依次进行二甲苯溶液脱蜡,梯度酒精水化,枸橼酸盐缓冲液抗原热修复,3% H2O2消除过氧化物酶活性,一抗CYPJ抗体1:50,用随试剂赠送的阳性片作为阳性对照,以PBS替代一抗作为阴性对照。4 ℃冰箱孵育过夜,二抗山羊抗兔抗体(北京中衫金桥有限公司)1:200,37 ℃孵育30 min,二氨基联苯胺(DAB)染色,常规苏木素轻度复染,脱水透明封片。
四、免疫组织化学染色结果观察及判断标准
由2名有经验的病理科医师双盲状态下独立判定。CYPJ蛋白表达为细胞质内棕色或棕褐色沉着。低倍镜(×200)下染色强度:不染色为0分;淡黄色为1分;黄色为2分;棕褐色为3分。每张切片上选取5个高倍视野(×400),计算5个视野的平均阳性细胞百分率。计数阳性细胞比例,依次为:小于10%为0分;11~25%为1分;26~50%为2分;大于50%为3分。两者得分相乘,即为最后得分。0分为阴性;1~3分为弱阳性;4~6分为阳性;7~9分为强阳性。将阳性和强阳性定义为阳性,弱阳性、阴性定义为阴性。
五、统计学分析
应用SPSS 23.0统计软件对数据进行分析。CyPJ蛋白表达率及其与各临床病理因素间两两比较采用卡方检验,三组及三组以上比较时用Fisher确切概率法。P<0.05为差异有统计学意义。
结 果
一、免疫组织化学染色检测CYPJ蛋白表达情况
CyPJ蛋白在CRC癌组织表现为高表达水平,且癌旁组织也可见CyPJ蛋白阳性表达,但颜色相对较浅。CyPJ蛋白的表达主要位于细胞质,少量表达于细胞核(图1)。CRC组织中CyPJ蛋白的阳性反应呈染色均一的黄色或棕褐色色颗粒,61例CRC患者组织中 CyPJ蛋白的阳性表达率为78.7%(48/61),CRC癌旁组织CyPJ蛋白的阳性表达率为39.3%(24/61)。CRC组织中CyPJ表达阳性率明显高于癌旁正常黏膜组织,差异有统计学意义(χ2=19.520,P<0.001),(见表1)。
二、CRC组织中CyPJ蛋白表达水平与患者临床病理因素的关系
通过CRC组织中CyPJ蛋白表达水平与患者临床病理因素比较可得出以下结论:CRC组织中CyPJ蛋白的表达与不同TNM分期、有无淋巴结转移及肿瘤浸润深度的患者比较,差异均有统计学意义(χ2=13.585,13.613,11.767,P均<0.05);而与性别、年龄、肿瘤大小、肿瘤部位、肿瘤分化程度及有无远处转移的比较,差异无统计学意义(χ2=1.010,0.061,0.119,1.130,2.646,0.416,P均>0.05),见表2。
讨 论

图1 A图示 CRC肿瘤组织中CyPJ蛋白阳性表达于胞浆,并且可见少量在细胞核周聚集,颜色加重;B图示癌旁组织中CyPJ蛋白阳性表达细胞浆和细胞核;C图示 CRC肿瘤组织中CyPJ阴性表达;D图示癌旁组织中CyPJ阴性表达(SP×400)
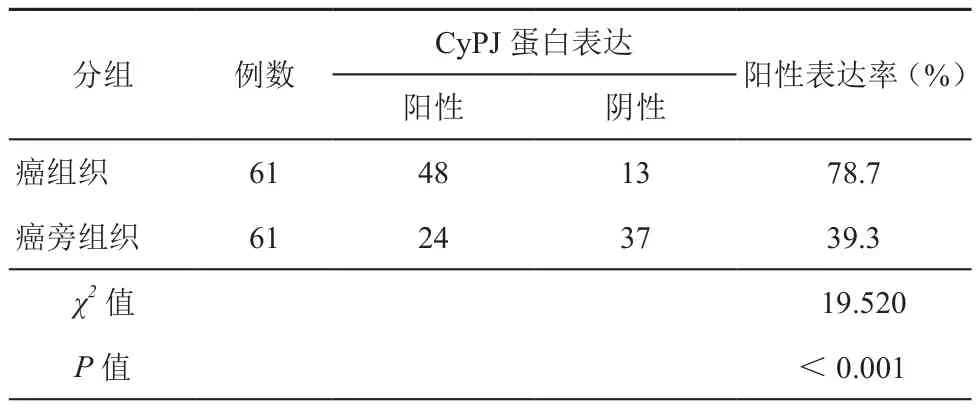
表1 CyPJ蛋白在结直肠癌组织及癌旁正常组织中的表达差异(例)
近年来,由于各种生物研究技术的不断提高,对其生物特性及与疾病相关的研究逐渐增加。在蛋白质组学及基因水平研究结果表明,CyPJ在多种恶性肿瘤中存在差异表达,可能对某些恶性肿瘤诊治具有重要价值。但CyPJ在结直肠癌的研究尚处于空白,结合已有关于CyPJ研究成果,可以推断CyPJ在结直肠癌表达情况值得深入研究。
近年来陆续发现CyPJ与多种恶性肿瘤密切相关,如脑胶质瘤、肝癌、神经母细胞瘤、宫颈癌、乳腺癌、甲状腺癌等[15-18]。Qi等[14]运用基因芯片杂交技术CyPJ基因是脑胶质瘤脑组织的差异表达基因,Northern blot检测结果表明CYPJ在人脑胶质瘤中高表达。Chen等[13]通过Northern blot、半定量RT-PCR、实时荧光定量RT-PCR和免疫组化方法分别检测CyPJ在肝癌组织在肿瘤组织中比癌旁正常组织表达水平显著上升,而且与肝癌病理分级有关。本实验实时荧光定量RT-PCR检测结直肠癌组织CyPJ mRNA在癌组织与癌旁组织相对表达量。在体外和体内实验中分别应用RNA干扰技术或亲环素抑制剂后均可导致显著抑制癌细胞的生长和增殖,促进凋亡。这说明CyPJ是一个具有促肿瘤生长特性的蛋白。在肿瘤的发生发展过程中伴随着细胞周期的调控过程,二者关系密切。
CyclinD1是细胞周期的启动因子,在细胞周期G1/S期起着关键作用,并在G1期存在cyclinD1表达,CDK4/6与cyclinD1结合并可激活其本身,进而磷酸化下游蛋白质,如Rb,后者磷酸化后可释放转录因子E2F,促进下游基因的转录[19-20]。最新研究表明,具有PPIase活性的 CyPJ的过表达可能促进肿瘤生长并且通过上调细胞周期蛋白D1促进细胞周期转换从G1到S期。G1/S期在细胞周期中起着主导作用,是期限制点[13]。据研究发现CyPJ在内源性大麻素诱导的人神经母细胞瘤SH-SY5Y细胞的凋亡中下调[15]。凋亡素存在于正常细胞的细胞质,而在癌细胞中,其可迁移到细胞核引起细胞凋亡[21]。Huo等[22]研究表明PPIL3表达水平的改变可以导致Apoptin的细胞核及细胞质相互转移,并且怀疑还有一些其他因素参与Apoptin和PPIL3之间的相互作用。有研究发现,CyPJ和CyPA均是是药物抗性相关基因,能促进肝癌患者化疗药物的耐药性升高;而作为CyPA和CyPJ共同抑制剂的CsA与吉非替尼的组合治疗晚期NSCLC患者比单独应用吉非替尼的更加有效[23-24]。这表明CyPJ可能成为治疗癌症的新靶点,用于开发更加有效的治疗癌症的药物。已有研究亲环素家族成员CYPA和CYPB与结直肠癌相关研究显示,它们在结直肠癌发生发展过程中发挥重要作用。结合以上研究可以猜测CYPJ在结直肠癌中可能也发挥着重要作用,因此本实验做了CYPJ在结直肠癌组织中表达的初步研究。
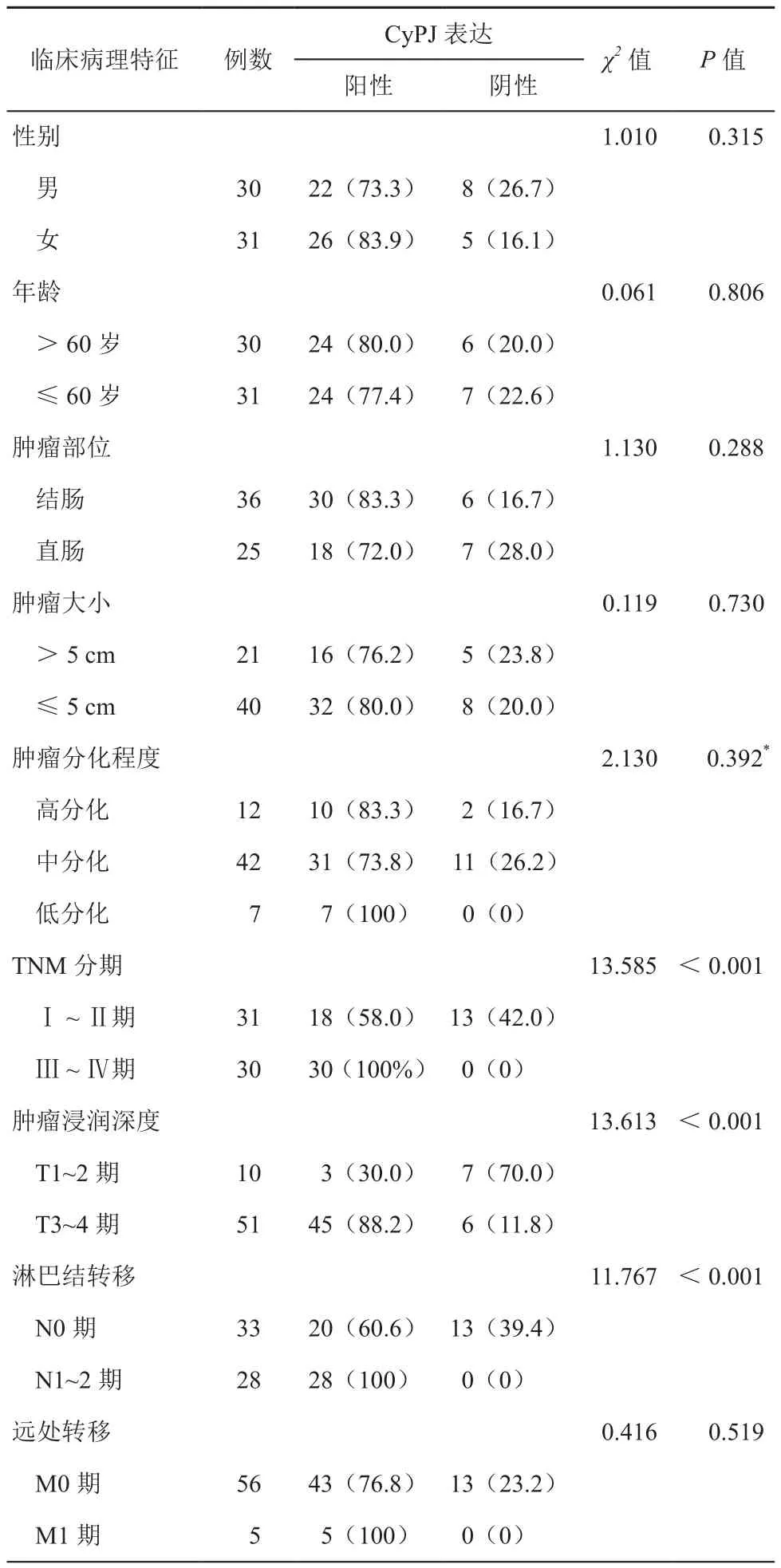
表2 61例CRC患者临床病理因素与CYPJ蛋白阳性表达率的关系[例(%)]
本实验首先应用免疫组化学法,检测61例患者CRC肿瘤组织及相应的癌旁正常组织中CyPJ蛋白表达水平。本研究结果显示,CyPJ蛋白在结直肠癌组织中的表达水平显著高于癌旁正常组织,有统计学差异,然而在癌旁组织中阳性表达率也较高,考虑可能由于样本量较少、一定读片主观性差别、距离肿瘤组织距离较近,有待于进一步增加样本量,我们进一步分析结直肠癌组织中表达水平与患者各种临床病理特征关系,结果提示癌组织中CyPJ表达上调与肿瘤分期、肿瘤浸润深度及淋巴结转移相关,而CyPJ表达水平与其他临床病理因素无明显相关,如年龄、肿瘤部位等(P>0.05),以上结果提示我们CyPJ可能与结直肠癌发生发展及淋巴转移密切相关。
综上所述,CyPJ蛋白和CyPJ mRNA在结直肠癌组织中均表达上调。其中CyPJ蛋白阳性表达水平与肿瘤浸润深度、淋巴结转移和TNM分期显著相关。这表明CyPJ过表达与结直肠癌的发生、发展及转移可能有密切的联系,可能成为结直肠癌治疗和诊断的新靶点。但这只是初步研究,而CyPJ在结直肠癌中发生发展过程中所起的具体作用有待进一步研究。
[ 1 ] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012 [J].CA: a cancer journal for clinicians, 2015, 65(2): 87-108.
[ 2 ] Chen W, Zheng R, Baade PD, et al. Cancer statistics in China,2015 [J]. CA: a cancer journal for clinicians, 2016, 66(2): 115-132.
[ 3 ] Schiene-Fischer C, Aumüller T, Fischer G. Peptide bond cis/trans isomerases: a biocatalysis perspective of conformational dynamics in proteins [M]. Molecular Chaperones. Springer, 2011, 328: 35-67.
[ 4 ] Handschumacher RE, Harding MW, Rice J, et al. Cyclophilin: a specific cytosolic binding protein for cyclosporin A [J]. Science,1984, 226(4674): 544-547.
[ 5 ] Feng W, Xin Y, Xiao Y, et al. Cyclophilin A Enhances Cell Proliferation and Xenografted Tumor Growth of Early Gastric Cancer [J]. Digestive diseases and sciences, 2015, 60(9): 2700-2711.
[ 6 ] Zhang H, Chen J, Liu F, et al. CypA, a gene downstream of HIF-1alpha, promotes the development of PDAC [J]. PloS one,2014, 9(3): e92824.
[ 7 ] Peng Y, Li X, Wu M, et al. New prognosis biomarkers identified by dynamic proteomic analysis of colorectal cancer [J]. Molecular BioSystems, 2012, 8(11): 3077-3088.
[ 8 ] Meng DQ, Li PL, Xie M. Expression and role of cyclophilin B in stomach cancer [J]. Genetics and molecular research : GMR, 2015,14(2): 5346-5354.
[ 9 ] Jeong K, Kim H, Kim K, et al. Cyclophilin B is involved in p 300-mediated degradation of CHOP in tumor cell adaptation to hypoxia [J]. Cell Death & Differentiation, 2014, 21(3):438-450.
[ 10 ] Chen J, Liefke R, Jiang L, et al. Biochemical Features of Recombinant Human Cyclophilin J [J]. Anticancer research, 2016,36(3): 1175-1180.
[ 11 ] Zhou Z, Ying K, Dai J, et al. Molecular cloning and characterization of a novel peptidylprolyl isomerase (cyclophilin)-like gene (PPIL3)from human fetal brain [J]. Cytogenetics and cell genetics, 2001,92(3-4): 231-236.
[ 12 ] 祁震宇, 惠国桢, 李瑶, 等. 脑胶质瘤相关的全长新基因 PPIL-3的克隆和蛋白质特性的研究 [J]. 中华神经外科杂志, 2009, 25(3):213-217.
[ 13 ] Avila MA, Chen J, Chen S, et al. Cyclophilin J Is a Novel Peptidyl-Prolyl Isomerase and Target for Repressing the Growth of Hepatocellular Carcinoma [J]. PloS one, 2015, 10(5): e0127668.
[ 14 ] Qi ZY, Hui GZ, Li Y, et al. cDNA microarray in isolation of novel differentially expressed genes related to human glioma and clone of a novel full-length gene [J]. Chinese medical journal, 2005, 118(10):799-805.
[ 15 ] Pasquariello N, Catanzaro G, Marzano V, et al. Characterization of the endocannabinoid system in human neuronal cells and proteomic analysis of anandamide-induced apoptosis [J]. The Journal of biological chemistry, 2009, 284(43): 29413-29426.
[ 16 ] Wang J, Tai L S, Tzang CH, et al. 1p31, 7q21 and 18q 21 chromosomal aberrations and candidate genes in acquired vinblastine resistance of human cervical carcinoma KB cells [J].Oncology reports, 2008, 19(5): 1155-1164.
[ 17 ] Camp NJ, Lin WY, Bigelow A, et al. Discordant Haplotype Sequencing Identifes Functional Variants at the 2q33 Breast Cancer Risk Locus [J]. Cancer research, 2016, 76(7): 1916-1925.
[ 18 ] Selmansberger M, Feuchtinger A, Zurnadzhy L, et al. CLIP2 as radiation biomarker in papillary thyroid carcinoma [J]. Oncogene,2015, 34(30): 3917-3925.
[ 19 ] Bendris N, Lemmers B, Blanchard JM. Cell cycle, cytoskeleton dynamics and beyond: the many functions of cyclins and CDK inhibitors [J]. Cell cycle, 2015, 14(12): 1786-1798.
[ 20 ] Lim S, Kaldis P. Cdks, cyclins and CKIs: roles beyond cell cycle regulation [J]. Development, 2013, 140(15): 3079-3093.
[ 21 ] Rollano Penaloza OM, Lewandowska M, Stetefeld J, et al. Apoptins:selective anticancer agents [J]. Trends in molecular medicine, 2014,20(9): 519-528.
[ 22 ] Huo DH, Yi LN, Yang J. Interaction with Ppil3 leads to the cytoplasmic localization of Apoptin in tumor cells [M]. Biochemical and biophysical research communications. 2008, 372(1): 14-18.
[ 23 ] Shou J, You L, Yao J, et al. Cyclosporine A sensitizes human non-small cell lung cancer cells to gefitinib through inhibition of STAT3 [J]. Cancer letters, 2016, 379(1): 124-133.
[ 24 ] Chen S, Zhang M, Ma H, et al. Oligo-microarray analysis reveals the role of cyclophilin A in drug resistance [J]. Cancer chemotherapy and pharmacology, 2008, 61(3): 459-469.
Expression and clinical significance of CyPJ in colorectal carcinoma
Zhang Hongbo1, Chen Jian2,Hu Jinchen1, Wang Xixun1, Jia Rongbao1, Jiang Lixin1.
epartment of Gastrointestinal Surgery,2Central Laboratory, Yantai Yuhuangding Hospital of Qingdao University, Yantai 264000, China
Jiang Lixin, Email: jianglixin1969@hotmail.com
Objective To investigate the expression and distribution of CyPJ in the colorectal cancer (CRC) and to explore its clinical signifcance in the development and progression of CRC. Methods The clinical data and surgical specimens of 61 patients with colorectal carcinoma who were treated from May 2015 to April 2016 that were collected from the Department of Gastrointestinal Surgery, Qingdao University Affliated Yantai Yuhuangding Hospital. Detected by immunohistochemical staining technique in 61 cases of CyPJ protein expression in colorectal carcinoma and paracarcinoma tissues levels. The relationship of the expression of CyPJ with the clinicopathological features of colorectal carcinoma was analyzed using SPSS 23. 0 statistical analysis software. The count data were evaluated using the chi-square test and Fisher exact probability. P<0. 05 was considered as signifcant difference. Results Expression of CyPJ protein in colorectal cancer tissues is overexpressed and the positive expression of paracarcinoma tissues is visible,but the color lighter. Expression of CyPJ protein is mainly located in the cytoplasm, with little distribution in the nucleus. The positive expression rates of CyPJ protein in the CRC and paracarcinoma tissues were 78. 7% (48/61)and 39. 3% (24/61), respectively, with a signifcant difference (χ2=19. 520, P<0. 05). The expression of CyPJ protein in patients with CRC was however associated with the TNM stage, depth of tumor invasion and lymph node metastasis (χ2=13. 585, 11. 767, 13. 613, P<0. 05), but No signifcant correlation was found between the expression of CyPJ and age, sex, tumor size, tumor site, tumor differentiation anddistant metastasis (χ2=1. 010, 0. 061, 0. 119, 1. 130, 2. 646, 0. 416, P>0. 05). Conclusion CyPJ protein is overexpressed in colorectal carcinoma, suggests that it may be associated with the occurrence, development and metastasis of colorectal carcinoma.
Colorectal neoplasms; Development; Metastasis; Cyclophilin J
2017-02-27)
(本文编辑:杨明)
10.3877/cma.j.issn.2095-3224.2017.05.007
山东省优秀中青年科学家科研奖励基金(No.2008BSA06001)
工作单位:264000 烟台市,青岛大学附属烟台毓璜顶医院胃肠外一科1;中心实验室2
姜立新,Email:jianglixin1969@hotmail.com
张红波, 陈剑, 胡金晨, 等. 结直肠癌组织中CyPJ 的表达及其临床意义[J/CD]. 中华结直肠疾病电子杂志, 2017, 6(5):387-391.
