在维吾尔族人群中探究miR-10b对结肠癌转移的作用与机制
2017-09-29苏莎莎赫晓磊高峰
苏莎莎 赫晓磊 高峰
在维吾尔族人群中探究miR-10b对结肠癌转移的作用与机制
苏莎莎 赫晓磊 高峰
目的 探究在多种肿瘤中均发挥重要调节作用的miR-10b 对维吾尔族结肠癌细胞转移的影响。方法 采用miR-10b过表达或抑制的结肠癌细胞系SW620,在细胞水平验证miR-10b对细胞转移能力的影响及对KLF4的调控作用。在临床样本组织中检测miR-10b的表达以佐证miR-10b功能。结果 维吾尔族结肠癌组织按照确诊时有无淋巴结或远处转移分为转移组(14例)和未转移组(16例),结肠癌转移组miR-10b的表达较强(t=-5.372,P<0.05)。在SW620细胞中转染miR-10b抑制剂以敲低miR-10b,与对照细胞相比,miR-10b表达水平的降低使SW620细胞的侵袭以及迁移能力明显降低(t=26.56,10.40,P均<0.05)。在SW620细胞中转染miR-10b抑制剂以下调其表达,通过实时定量RT-PCR及Western Blot检测细胞中 KLF4 mRNA水平和蛋白水平的改变,结果显示miR-10b表达水平的降低,细胞内KLF4 mRNA水平和蛋白水平升高(t=3.78,P<0.05),提示miR-10b对KLF4 mRNA的调节是从转录和翻译两个水平发生作用的。我们敲降miR-10b的表达或者增加KLF4的表达,通过检测E-cadherin、cyclins D1以及p53的改变,发现miR-10b可能通过影响涉及EMT、细胞周期和细胞凋亡的某些独立的信号通路,对结肠癌的细胞功能发挥重要作用。结论 在维吾尔族人群中miR-10b能够促进结肠癌细胞SW620的增殖与迁移,参与结肠癌的侵袭与转移。
结直肠肿瘤; 肿瘤转移; 微小RNA10b; 维吾尔族
结直肠癌(colorectal cancer,CRC)是世界发病率第二的恶性肿瘤,以每年超过1 000 000 的新增病例和608 700 的死亡病例,成为威胁人类健康的主要肿瘤之一[1]。理解结直肠癌的发生机制,对我们寻找新的治疗方法,提高患者 5 年生存率,降低转移和复发率以及化疗的耐药性都有很大的帮助[2]。
微小RNA(microRNA,miRNA)是一种广泛存在于真核生物体内,长度约为20~24 nt的,不编码蛋白的核酸序列。miRNA在基因表达的过程中主要是通过促进靶基因的降解和(或)抑制其翻译而发挥负向调控基因表达的作用,且miRNA 已被证明在多种生物学过程中发挥重要的调控功能[3]。
microRNA-10b(miR-10b)是一种在多种肿瘤中表达异常的miRNA,已有研究表明,它在不同的肿瘤中发挥了多种不同调节功能[4-5],其机制与联系尚不明确。新疆是一个多民族聚集地,由于其宗教文化信仰的不同,他们的生活方式、饮食习惯、膳食结构等方面与汉族明显不同。各民族结直肠肿瘤发病率及病死率不尽相同。本研究拟探索miR-10b在新疆维吾尔族结肠癌转移和增殖中的调控机制,揭示结肠癌发病的分子机制,为新的诊断治疗靶点提供依据和线索。
资料与方法
一、组织标本
于2015年1月至2016年12月收集新疆维吾尔自治区人民医院消化科30例维吾尔族大肠癌组织按照确诊时有无淋巴结或远处转移分为转移组(14例)和未转移组(16例)。所有标本经内镜取材,所有结肠黏膜组织分别保存于液氮中。
二、细胞培养
结肠癌上皮细胞株SW620来源于一名51岁男性高加索人种大肠腺癌患者,为Duke′s D期,SW620细胞分离自该患者左锁骨上淋巴结的转移灶,具有较强的细胞的侵袭迁移能力,购自美国模式培养物集库存(American Type Culture Collection,ATCC)。细胞培养于RPMI1640培养基(美国Invitrogen公司),37℃,5%的CO2条件下培养,标准胎牛血清(FBS)浓度为10%,贴壁生长。
三、转染
转染前一天,以3~4×105/ml的细胞密度接种6孔培养板。转染时,细胞要达到30~50%的融合。在适量不包含血清的Opti-MEM低血清培养基稀释siRNA或者质粒,轻轻混匀。使用前轻轻混合Lipofectamine 2000,然后稀释适量的试剂到Opti-MEM低血清培养基,轻轻混匀后在室温下孵育5分钟。溶液1:240 μl无血清培养基+10 μl。孵育5分钟后,混合稀释的寡聚物和稀释的Lipofectamine 2000,轻轻混合,在室温下孵育20分钟,以便允许复合物的形成。与此同时,将6孔板中的细胞用无血清培养基冲洗细胞两遍后,加入无血清培养基。将充分混合的复合物加入到每一个包含细胞和培养基的孔中。通过轻轻地前后摇动培养板混合。在37 ℃,5%的CO2中孵育4~6小时如果后,更换含有10%血清的培养基
四、免疫蛋白印迹(Western Blot)
按蛋白质提取试剂盒(南京凯基生物科技发展有限公司)说明书提取SW680细胞总蛋白质,采用二喹林甲酸(BCA)法进行蛋白浓度测定,常10%SDS-PAGE,利用半干电转移仪(美国Bio-Rad公司)转PVDF膜(美国Milipore公司)1.3 A,7 min;以10%脱脂奶粉封闭2 h,TBS洗5 min×3次;KLF4抗体(1:5 000),与PVDF膜孵育,室温下轻柔摇动2 h。TBS-T洗涤3×5 min;TBS再洗涤5 min。采用增强化学发光(ECL)显影,显影、漂洗、定影、冲洗、晾干,UVI凝胶成像系统摄像,Quantity One图像分析软件分析条带灰度值,用目的蛋白/GAPDH代表目的蛋白的相对表达量。实验结果重复3次以上。所有抗体均购自美国Abcam公司。
五、PCR检测
结肠粘膜总RNA按Trizol说明书操作提取纯化。按照Hairpin-it TM miRNAs qPCR kit(上海吉玛制药技术有限公司)说明书操作,反转录合成cDNA。引物序列如下:miR-10b上游5′-GGATACCCTGTAGAACCGAA-3′,下 游5′-CAGTGCGTGTCGTGGAGT-3′,KLF4上游5′-CGAACCCACACAGGTGAGAA-3′, 下 游5′-TACGGTAGTGCCTGGTCAGTTC-3′;GADPH上 游5′-GACCACAGTCCATCCCATCAC-3′, 下 游5′-CCACCACCCTGTTGCTGTA-3′。
六、统计学分析
采用SPSS 13.0软件对数据进行分析,均以P<0.05表示差异有显著统计学意义。荧光定量PCR、增殖、转移以及细胞周期、凋亡实验,两独立样本均数比较采用t检验(independent-samples T test)。多组间比较采用单因素方差分析(One-way ANOVA),先进行方差齐性分析,如方差齐,比 较 采 用SNK法(Student- Neuman-Keuls)。方差不齐者采用基于方差不齐的多重比较方法Dunnctt′sT3法进行。
结 果
一、维吾尔族结肠癌组织中miR-10b表达水平与肿瘤转移有关
将30例维吾尔族结肠癌组织按照确诊时有无淋巴结或远处转移分为转移组(14例)和未转移组(16例),结果表明两组miR-10b的表达强度差异有统计学意义,结肠癌转移组miR-10b的表达较强(t值=-5.372,P值<0.001)(图1,表1)。
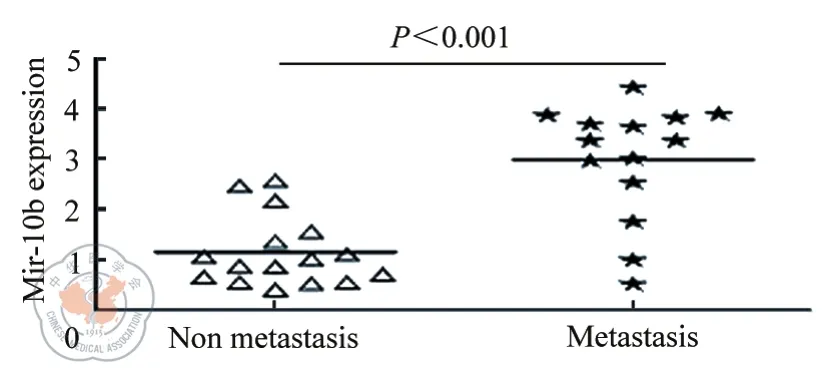
图1 荧光定量PCR检测miR-10b在大肠癌组织中的表达情况
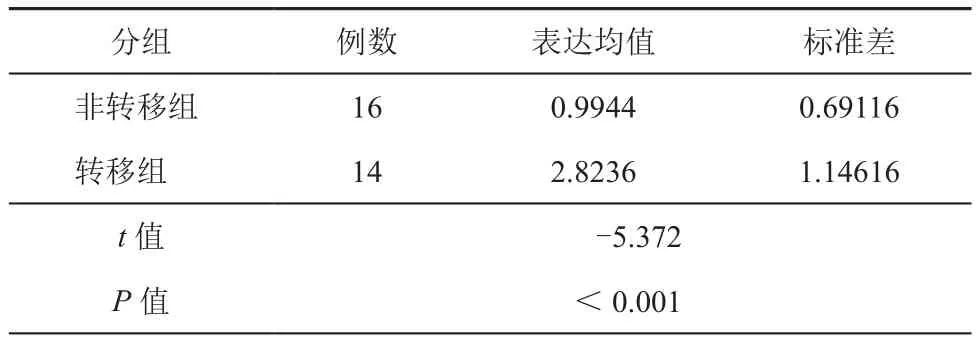
表1 荧光定量PCR检测miR-10b在大肠癌组织中的表达情况
二、miR-10b表达缺失可以抑制大肠癌细胞的侵袭和迁移
在SW620细胞中转染miR-10b抑制剂以敲低miR-10b,然后通过transwell实验检测细胞的侵袭和迁移能力的变化。与对照细胞相比,miR-10b表达水平的降低使SW620细胞的侵袭以及迁移能力明显降低(图2,表2)。
三、miR-10b调节内源KLF4基因的表达
我们在SW620细胞中转染miR-10b inhibitor以下调其表达,24小时后收集细胞总RNA,通过实时定量qRT-PCR检测细胞中 KLF4 mRNA水平的改变,以GAPDH的mRNA为参照。结果显示miR-10b表达水平的降低,细胞内KLF4 mRNA水平升高(图3)(t=3.78,P<0.001)。我们同时用Western Blot研究KLF4蛋白水平的改变,发现其变化与KLF4 mRNA水平的变化是一致的(图3)。这提示miR-10b对KLF4 mRNA的调节是从转录和翻译两个水平发生作用的。
四、miR-10b影响大肠癌细胞转移和细胞增殖可能存在的机制
我们通过改变miR-10b和KLF4的表达,用Western Blot分析与EMT、细胞周期和凋亡关系密切的调控因子表达水平是否存在相应的变化。(图4A和4B),人为地敲降miR-10b的表达或者增加KLF4的表达,均能使E-cadherin表达上调,而细胞周期及凋亡过程中重要的调控因子,cyclins D1和p53,表达则下降。当在下调miR-10b的同时降低KLF4的表达,我们发现上述由miR-10b下调引起的E-cadherin、cyclins D1以及p53的改变,均出现不同程度的减弱(图4C)。综上所述,miR-10b可能通过影响涉及EMT、细胞周期和细胞凋亡的某些独立的信号通路,对大肠癌的细胞功能发挥重要作用。
讨 论
结肠癌的发生是一个涉及多种癌基因如原癌基因及抑癌基因多个阶段的过程,是多种癌基因协同作用的结果。miRNAs作为一类对基因表达具有重要调控作用的非编码基因,近年来受到广泛的关注。miRNAs通过直接调控其靶基因的方式参与调节多种信号通路,从而发挥了对疾病的复杂的调控作用[6]。近年来,对于miRNA调节肝细胞肝癌、膀胱癌乳腺癌以及前列腺癌的研究多有报道[7-10],然而miRNAs在结肠癌中的功能的研究仍然较少。本研究首次发现新疆维吾尔族结肠癌患者miR-10b的表达情况,并进一步探讨miR-10b 在结肠癌细胞中可能通过直接靶向调控KLF4进一步影响侵袭与迁移、EMT、细胞周期和细胞凋亡的某些独立的信号通路,对结肠癌的细胞功能发挥重要作用。
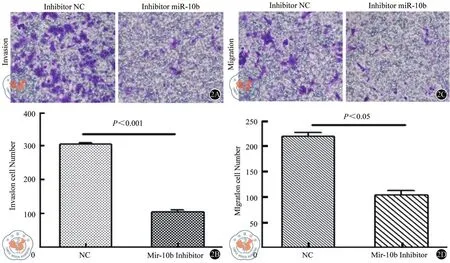
图2 倒置显微镜下观察SW620细胞在Transwell小室侵袭和迁移的情况
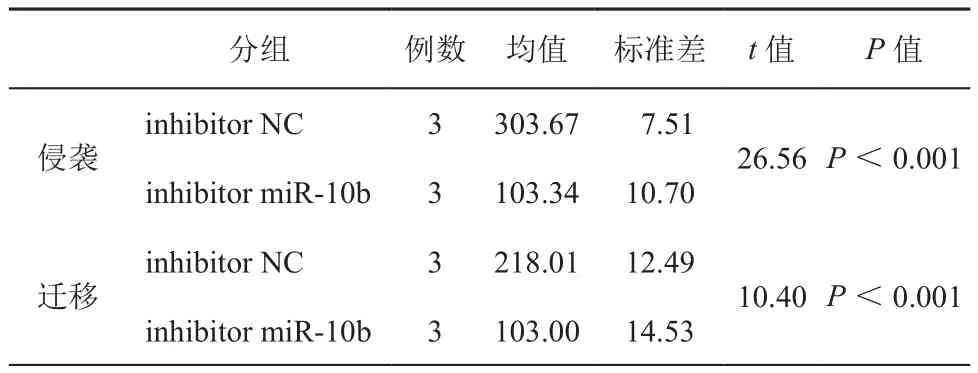
表2 Transwell小室侵袭和迁移实验穿膜细胞计数
MiR-10b定位于2号染色体短臂3区1带1亚带的HOXD基因簇之间,而HOX家族作为一类特殊的转录调节因子,不仅维持着正常组织的增殖分化,而且在肿瘤的发生及侵袭转移过程中也起着重要作用,因此推测miR-10b与肿瘤的侵袭转移关系密切。研究显示,miR-10b可以参与造血干细胞分化[11]、载脂蛋白B合成[12]等细胞生命活动。此外,研究发现miR-10在多种恶性肿瘤中过表达。miR-10b在肝脏恶性肿瘤中的表达水平明显高于肝脏良性肿瘤及未发生瘤变的其他肝脏组织[13];miR-10b在胰腺癌组织中表达增高,且表达水平与恶性程度相关[14];miR-10b在人脑恶性胶质母细胞瘤中高表达,且其表达水平与侵袭相关因子uPAR和RHOC的mRNA和蛋白水平密切相关[15-16];miR-10b在核仁磷酸蛋白(nueleophosmin,NPM1)突变的急性髓性白血病患者的骨髓中表达量明显高于NPM1非突变的患者[17]。此外,包括miR-10b在内的7个miRNA表达水平与胃癌预后明显相关[18]。以上研究表明而miR-10b与人类恶性肿瘤密切相关。本研究中发现维吾尔族结肠癌患者转移组较非转移组miR-10b的表达增强,通过在SW620细胞中转染miR-10b inhibitor以敲低miR-10b,miR-10b表达水平的降低使SW620细胞的侵袭以及迁移能力明显降低,miR-10b提示维吾尔族结肠癌的侵袭及转移过程中发挥一定作用。
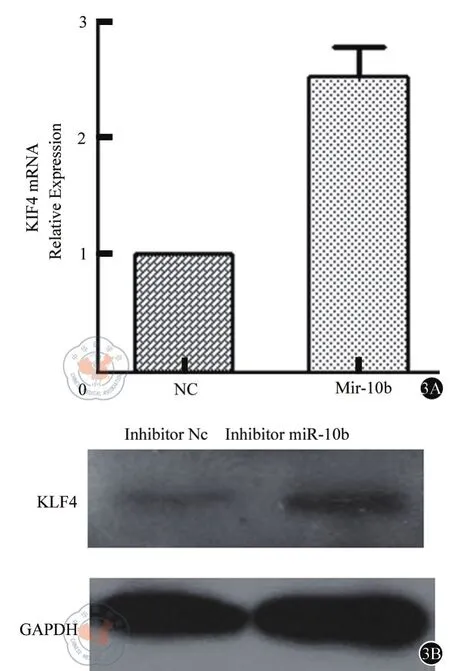
图3 A 实时定量RT-PCR检测KLF4 mRNA水平的变化3B Western Blot检测KLF4 蛋白水平的变化
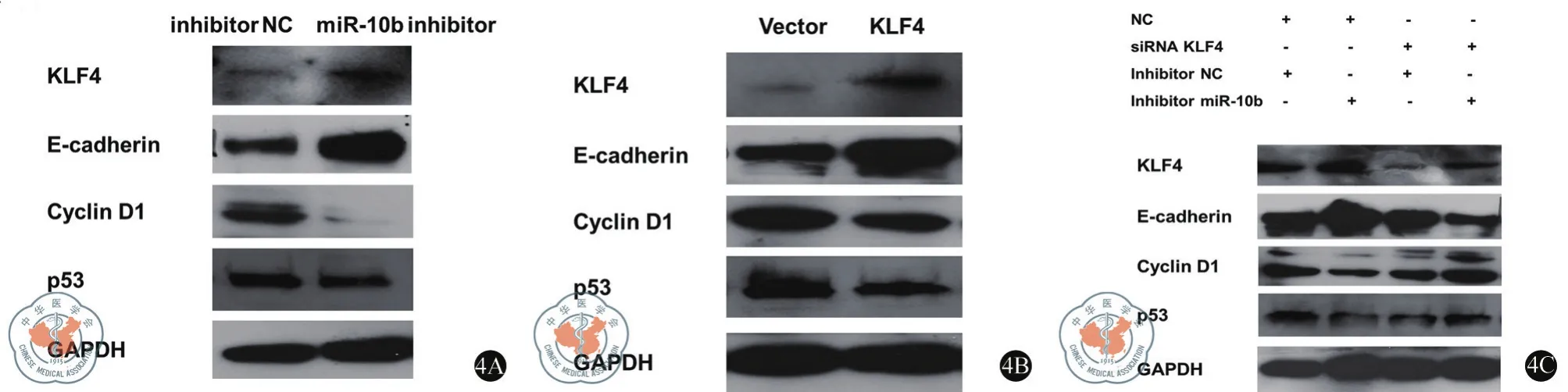
图4 miR-10b对大肠癌的细胞功能发挥作用可能存在的机制在SW620细胞中分别转染miR-10b inhibitor(A),KLF4 plasmids(B)以及相应的对照,48小时后通过Western Blot检测KLF4,E-cadherin,cyclins D1及p53的表达。(C)在SW620细胞中同时转染KLF4 siRNA 及miR-10b inhibitor,然后用Western Blot检测KLF4,E-cadherin,cyclins D1及p53的表达
Krüppel样因子4(KLF4;或称肠道富集的Krüppel样因子)是属于Krüppel蛋白家族的一种含有锌指结构的转录因子。KLF4具有多种生理功能,在肿瘤的发生发展中KLF4基因具有抑癌基因和癌基因的双重功能,可以影响细胞周期的调控、凋亡以及细胞分化[19-21]。相当一部分研究发现在多种人类肿瘤,包括食管癌,胃癌,大肠癌和膀胱癌,KLF4的表达经常发生缺失,这提示其可能具有抑癌作用。据报道,KLF4可抑制多种癌症转移的发生,如大肠癌、食管癌、胰腺癌细胞等[22-27]。并且在结肠癌中,KLF4可通过诱导细胞周期阻滞抑制细胞增殖;通过影响细胞增殖、凋亡和癌细胞的浸润,从而调节食管癌的发生。KLF4在癌细胞的转移和增殖过程中可能起抑癌基因的作用,这恰恰与miR-10b发挥的癌基因作用相反。本研究中,我们在SW620细胞中转染miR-10b抑制剂以下调其表达,结果显示miR-10b表达水平的降低,细胞内KLF4 mRNA水平及蛋白水平升高,这提示miR-10b对KLF4 mRNA的调节是从转录和翻译两个水平发生作用的。进一步人为地敲降miR-10b的表达或者增加KLF4的表达,均能使E-cadherin表达上调,而cyclin D1以及p53的表达则下降。当在下调miR-10b的同时降低KLF4的表达,我们发现上述由miR-10b下调引起的E-cadherin、cyclins D1以及p53的改变,均出现不同程度的减弱。提示,miR-10b可能通过影响涉及EMT、细胞周期和细胞凋亡的某些独立的信号通路,对大肠癌的细胞功能发挥重要作用。
临床样本中miRNAs 表达水平的定量能够真实的反映在临床患者中特定的miRNA与肿瘤之间的关系,然而不同的病例之间个体差异较大,在样本量不足的情况下并不能将结果一概而论。细胞实验结果证明miR-10b能够促进结肠癌细胞的转移,而在临床样本中定量结果显示在转移组中miR-10b的表达量高于非转移组,初步说明miR-10b的临床意义可能与我们的研究结果一致。
通过本课题研究发现,在维吾尔族人群中miR-10b能够促进结肠癌细胞SW620的增殖与迁移,参与结肠癌的侵袭与转移。
[ 1 ] Jemal A, Bray F, Center MM, et al. Global cancer statistics [J]. CA:a cancer journal for clinicians, 2011, 61(2): 69-90.
[ 2 ] Siegel RL, Miller KD, Jemal A. Cancer statistics, 2015 [J]. CA: a cancer journal for clinicians, 2015, 65 (1), 5-29.
[ 3 ] Inui M, Martello G, Piccolo S. MicroRNA control of signal transduction [J]. Nature reviews Molecular cell biology, 2010, 11(4):252-263.
[ 4 ] L Ma, J Teruya-Feldstein, RA Weinberg, et al.Tumour invasion and metastasis initiated by microRNA-10b in breast cancer [J]. Nature,2007, 449 (6) 682-688.
[ 5 ] G Gabriely, M Yi, RS Narayan, et al. Human glioma growth is controlled by microRNA-10b [J]. Cancer Res, 2011 (71): 3563-3572.
[ 6 ] Ha TY. The Role of MicroRNAs in Regulatory T Cells and in the Immune Response [J]. Immune network, 2011, 11(1): 11-41.
[ 7 ] Ichimi T, Enokida H, Okuno Y, et al. Identification of novel microRNA targets based on microRNA signatures in bladder cancer [J]. International Journal of Cancer, 2009, 125(2): 345-352.
[ 8 ] Iorio MV, Ferracin M, Liu CG, et al. MicroRNA gene expression deregulation in human breast cancer [J]. Cancer research, 2005,65(16): 7065-7070.
[ 9 ] Li W, Xie L, He X, et al. Diagnostic and prognostic implications of microRNAs in human hepatocellular carcinoma [J]. International Journal of Cancer, 2008, 123(7): 1616-1622.
[ 10 ] Ozen M, Creighton C J, Ozdemir M, et al. Widespread deregulation of microRNA expression in human prostate cancer [J]. Oncogene,2007, 27(12): 1788-1793.
[ 11 ] DE Geiman, H Ton-That, JM Johnson, et al. Transactivation and growth suppression by the gut-enriched Kruppel-like factor(Kruppel-like factor 4) are dependent on acidic amino acid residues and protein-protein interaction [J]. Nucleic Acids Res, 2000, (28) :1106-1113.
[ 12 ] X Chen, DC Johns, DE Geiman, et al. Kruppel-like factor 4 (gut-enriched Kruppel-like factor) inhibits cell proliferation by blocking G1/S progression of the cell cycle [J]. Biol Chem, 2001, (276): 30423-30428.[ 13 ] DT Dang, KE Bachman, CS Mahatan, et al. Decreased expression of the gut-enriched Kruppel-like factor gene in intestinal adenomas of multiple intestinal neoplasia mice and in colonic adenomas of familial adenomatous polyposis patients [J]. FEBS Lett, 2000, (476)203-207.
[ 14 ] Ton-That H,Kaestner KH, Shields JM, et al. Expression of the gut-enriched Kruppel-like factor gene during development and intestinal tumorigenesis [J]. FEBS Lett, 1997, 419 (2-3): 239-243.
[ 15 ] Shie JL, Chen ZY, O′Brien MJ, et al. Role of gut-enriched Kruppel-like factor in colonic cell growth and differentiation [J]. Am J Physiol Gastrointest Liver Physiol, 2000, 279 (4): G806-814.
[ 16 ] Zhao W, Hisamuddin IM, Nandan MO, et al. Identification of Krüppel-like factor 4 as a potential tumor suppressor gene in colorectalcancer [J]. Oncogene, 2004, 23(2): 395-402.
[ 17 ] Wei D, Gong W, Kanai M,et al. Drastic down-regulation of Kruppel-like factor 4 expression is critical in human gastric cancer development and progression [J]. Cancer Res, 2005, 65(7):2746-2754.
[ 18 ] Katz JP, Perreault N, Goldstein BG, et al. Loss of Klf4 in mice causes altered proliferation and differentiation and precancerous changes in the adult stomach [J]. Gastroenterology, 2005, 128(4):935-945.
[ 19 ] Dang DT, Chen X, Feng J, et al. Overexpression of Krüppel-like factor 4 in the human colon cancer cell line RKO leads to reduced tumorigenecity [J]. Oncogene, 2003, 22(22): 3424-3430.
[ 20 ] Geiman DE, Ton-That H, Johnson JM, et al. Transactivation and growth Suppression by the gut-enriched Krüppel-like factor(Krüppel-like factor 4) are dependent on acidic amino acid residues and protein-protein interaction [J]. Nucleic Acids Res, 2000, 28(5):1106-1113.
[ 21 ] Chen X, Johns DC, Geiman DE, et al. Krüppel-like factor 4 (gutenriched Krüppel-like factor) inhibits cell proliferation by blocking G1/S progression of the cell cycle[J]. J Biol Chem, 2001, 276(32):30423-30428.
[ 22 ] Dang DT, Bachman KE, Mahatan CS, et al. Decreased expression of the gut-enriched Krüppel-like factor gene in intestinal adenomas of multiple intestinal neoplasia mice and in colonic adenomas of familial adenomatous polyposis patients [J]. FEBS Lett,2000, 476(3): 203-207.
[ 23 ] Ton-That H, Kaestner KH, Shields JM, et al. Expression of the gut-enriched Krüppel-like factor gene during development and intestinal tumorigenesis [J]. FEBS Lett, 1997, 419(2-3): 239-243.
[ 24 ] Zhao W, Hisamuddin IM, Nandan MO, et al. Identification of Krüppel-like factor 4 as a potential tumor suppressor gene in colorectal cancer [J]. Oncogene, 2004, 23(2): 395-402.
[ 25 ] Wei D, Gong W, Kanai M, et al.Drastic down-regulation of Krüppel-like factor 4 expression is critical in humangastric cancer development and progression [J]. Cancer Res, 2005, 65(7):2746-2754.
[ 26 ] Katz JP, Perreault N, Goldstein BG, et al. Loss of Klf4 in mice causes altered proliferation and differentiation and precancerous changes in the adult stomach [J]. Gastroenterology, 2005, 128(4):935-945.
[ 27 ] Yang Y, Goldstein BG, Chao HH, et al. KLF4 and KLF5 regulate proliferation, apoptosis and invasion in esophageal cancer cells [J].Cancer Biol Ther, 2005,4(11):1216-1221.
Functions and regulation of miR-10b in Uyger colorectal cancer metastasis
Su Shasha, He Xiaolei,Gao Feng.
Department of Gastroenterology, Xinjiang Uyger Muncipal People′Hospital, Urumchi Xinjiang 830000, China
Gao Feng, Email: xjgf@sina.com
Objective To investigate the role of miR-10b in metastasis of colon cancer of Uyger patients. Methods miR-10b expression was tested on CRC samples which were divided into metastatic groups and non-metastic groups of Uyger petients.The miR-10b-overexpressed or down-regulated SW620 cells were used to test the effects of miR-10b on invasion and migration of SW620 cells and to observe how miR-10b regulating KLF4. The miR-10b/klf4-overexpressed or down-regulated SW620 cells were used to test E-cadherin, cyclins D1 and p53 expression to test the involved mechanism in the regulatory function of miR-10b on metastasis and proliferation in CRC cells. Results miR-10b was over-expressed in metastatic CRC samples, compared with non-metastic ones of Uyger patients (t=-5.372, P<0.005). Inhibition of miR-10b in SW620 cells led to a notable reduction in invasion and migration assay compared with control cells (t=26.56,10.40, P<0.05). We transfected miR-10b inhibitor into SW620 cells, an in crease of KLF4 mRNA level and protein level in SW620 cells was observed (t=3.78, P<0.05). miR-10b knockdown and KLF4 overexpression upregulated E-cadherin expression. Correlated with the modulated expression of miR-10b: the inhibition of miR-10b caused downegulation of cyclins D1 and p53, which were partly abrogated after co-transfecting with miR-10b and siRNA KLF4. Conclusions Expression of miR-10b is up-regulated in the metastasis CRC tissues and cells. miR-10b controls the metastasis and proliferation of CRC cells. miR-10b may exert itseffect on metastasis and prolieration of CRC cells by regulating the expression of KLF4.miR-10b appears to modulate several independent signaling pathways that involved EMT, cell cycle and apoptosis.
Colorectal neoplasms; Neoplasm metastasis; miR-10b; Uyger
2017-04-27)
(本文编辑:王松)
10.3877/cma.j.issn.2095-3224.2017.05.006
830000 新疆维吾尔自治区人民医院消化科
高峰,Email:xjgf@sina.com
苏莎莎, 赫晓磊, 高峰, 等. 在维吾尔族人群中探究miR-10b 对结肠癌转移的作用与机制[J/CD]. 中华结直肠疾病电子杂志, 2017, 6(5): 381-386.
