通心络对大鼠心肌缺血再灌注损伤中肥大细胞脱颗粒诱导的炎症反应的作用机制*
2017-09-28李绍旦张俊修杨明会
黄 婷 李绍旦 李 涵 张俊修 刘 毅 杨明会△
(1.北京中医药大学,北京 100029;2.中国人民解放军总医院,北京 100853)
通心络对大鼠心肌缺血再灌注损伤中肥大细胞脱颗粒诱导的炎症反应的作用机制*
黄 婷1,2李绍旦2李 涵2张俊修2刘 毅2杨明会2△
(1.北京中医药大学,北京 100029;2.中国人民解放军总医院,北京 100853)
目的 观察通心络对肥大细胞干预的缺血再灌注模型大鼠心肌损伤的保护作用并探讨其机制。方法
将36只健康成年雄性SD大鼠随机分成假手术组、模型组、通心络组。通过可逆性左冠状动脉前降支结扎法建立心肌缺血再灌注模型,大鼠心肌缺血1 h,再灌注2 h;假手术组仅穿线不结扎。通心络组大鼠予通心络灌胃,假手术组和模型组给予等量的0.9%氯化钠注射液灌胃。1周后采用HE染色方法观察心肌组织病理改变,取腹主动脉血检测血常规、生化、血清脾酪氨酸激酶(Syk)、细胞外信号调节激酶(ERK)的磷酸化水平以及5-羟色胺(5-HT)等指标。结果 通心络组大鼠5-HT的表达及Syk的磷酸化水平较模型组均明显降低,ERK的磷酸化水平较模型组明显升高(P<0.01)。结论 通心络通过降低5-HT及Syk的磷酸化水平,升高ERK的磷酸化水平,抑制肥大细胞脱颗粒诱导的炎症反应,减轻心肌损伤,进而保护心肌组织。
通心络 心肌缺血再灌注 肥大细胞脱颗粒 炎症反应
在冠脉缺血基础上恢复血流时,组织细胞损伤反而加重,甚至发生不可逆性损伤,此现象称为心肌缺血再灌注损伤(MIRI),对于挽救缺血心肌,减轻心肌组织微血管的损伤,降低病死率是一大难题[1]。根据其病位和临床表现,应属于中医学“胸痹”“真心痛”“心悸”范畴,基本病机为本虚标实;标实为气滞、血瘀、痰饮、寒凝、热结等,本虚包括气血阴阳的虚损。中药复方通心络以吴以岭院士“由络以通、交会生化”的络病理论为指导,以全蝎、蜈蚣、蝉蜕搜积通络,水蛭、土鳖虫剔除络瘀,桂枝、薤白、降香疏络畅气,人参、黄芪补气通络,全方渗灌气血、濡养代谢[2]。本研究从模型大鼠心肌凋亡程度以及肥大细胞脱颗粒诱导的炎症反应等方面,探讨通心络对受损心肌的保护作用及机制。现报告如下。
1 材料与方法
1.1 材料 1)实验动物。SPF级SD雄性大鼠36只,购自军事医学科学院动物中心,许可证号SCXK-(军)2012-0004);体质量(240±20) g,每笼 5 只饲养于独立通气笼具系统内。温度(22±1) ℃,湿度(50±5) %,每天光照与黑夜时间各12 h。实验期间造模、取材等操作均在超净工作台内进行,添加饲料、换水、灌药等由专人负责管理。2)药物及试剂。通心络超微粉(石家庄以岭药业股份有限公司,批号SY1605001);乌拉坦(国药集团化学试剂有限公司,批号T2011110);4%多聚甲醛(盛生物技术有限责任公司,批号AR-0211);苏木素染液、伊红染液(北京雪邦科技有限公司);5-羟色胺(5-HT)ELISA检测试剂盒(上海乔羽生物科技有限公司,批号YM-R30326);脾酪氨酸激酶(Syk)ELISA检测试剂盒(上海乔羽生物科技有限公司,批号YMR10956);细胞外信号调节激酶(ERK)ELISA检测试剂盒(上海乔羽生物科技有限公司,批号YM-R51811)。3)主要仪器。超净工作台(北京长城空气净化工程公司);电子秤(长沙湘平科技发展有限公司,EPS2001);小动物心电图机 (北京福田电子医疗仪器有限公司,FX211);动物呼吸机(上海奥尔科特生物科技有限公司,ALC-V9); 高速离心机 (Perkin Elmer VICTOR X5);Multiskan MK3 酶标仪 (Thermo Fisher Scientific公司);恒温箱(天津泰斯特仪器有限公司,DH3600);显微镜(日本尼康,Nikon Ci-S)
1.2 分组及给药 选取心电图正常大鼠36只,采用随机数字表法分成假手术组、模型组、通心络组,每组12只。通心络组大鼠予通心络超微粉以1.0 g/(kg·d)并溶于0.9%氯化钠注射液2 mL灌胃,假手术组和模型组给予等量的0.9%氯化钠注射液灌胃,分别连续灌胃1周。
1.3 模型制备 心肌缺血再灌注模型参考文献[3]。给药1周后。大鼠以5 mL/kg腹腔注射20%乌拉坦麻醉后,采用面罩覆盖口鼻连接呼吸机,设定呼吸频率80 次/min、潮气量 15 mL/kg、呼吸比 1∶1。 胸部备皮、碘伏消毒。于大鼠左侧胸壁3~4肋间纵向切开皮肤约2 cm,止血钳钝性分离,开胸,暴露心脏,剥离心包膜,在肺动脉圆锥与左心耳之间,左心耳下缘约2~3 mm处结扎,冠脉与结扎线之间使用5号白线隔开,假手术组只穿线,不接扎。进针深度约1~1.5 mm,宽约2.0 mm,用弯止血钳将胸部皮肤和肌肉夹紧关闭胸腔,呼吸机维持10~15 min,待大鼠自主呼吸恢复观察心电图改变。造模成功标志:室壁运动减弱,结扎下部心肌组织颜色变白,心电图可见胸前各个导联的ST段抬高、T波高耸为。冠脉结扎1 h后,连接呼吸机,逐层打开胸腔,松开结扎线,完成再灌注。
1.4 标本采集与检测 大鼠再灌注2 h后,采集心电图,腹主动脉取血5 mL,摘取心脏,予4%多聚甲醛保存。HE染色:将心肌组织样本脱水、包埋切成4 μm的薄片,常规染色,光镜观察。取1 mL血标本检测血常规,高速离心机分离血清,检测生化指标;予ELISA试剂盒分别检测血清Syk、ERK的磷酸化水平、5-HT水平。
1.5 统计学处理 应用SPSS20.0统计软件。所有数据均进行正态性和方差齐性检验。多组间比较采用单因素方差分析,方差齐时釆用LSD法、Dunnett法进行两两比较;方差不齐时,进行Welch近似方差分析,采用Tamhane’s T2法进行两两比较。若不服从正态分布,则进行非参数检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠心电图改变比较 假手术组再灌2 h后与造模后比较,部分大鼠心电图肢体导联Ⅱ、Ⅲ、ST段轻度的抬高,Ⅱ导联出现病理性Q波。模型组大鼠心电图肢体导联Ⅱ、ST段有不同程度的抬高,肢体导联Ⅲ、T波倒置,部分大鼠再灌注后出现心律失常。通心络组大鼠再灌2 h后,部分心电图T波抬高回落约0.06 s,QRS波群宽大畸形的概率低于模型组,模型组大鼠再灌注后T波回落较少,部分甚至上抬。
2.2 各组大鼠心肌标本组织HE染色比较 假手术组大鼠心肌纤维大致排列规则,部分肌纤维可见嗜酸性变及心肌断裂现象,肌核居中卵圆形或梭形,其形态及结构正常,部分心肌间质水肿及出血改变。模型组大鼠心肌纤维凝固型坏死、核碎裂、消失,胞质均质红染或规则粗颗粒状,间质水肿,不同程度的炎性细胞浸润,心肌细胞核呈卵圆形或梭形,其形态及结构未见明显异常改变,部分心肌梗死灶外围出现充血出血带。通心络组大鼠部分心肌纤维凝固型坏死,胞浆嗜酸性变,可见横纹不清,甚至消失,呈红染均质状,炎性细胞浸润程度较模型组减轻。见图1。

图1 各组大鼠心肌标本HE染色形态学改变(HE染色,20倍)
2.3 各组大鼠血常规检测结果比较 见表1。与模型组相较,通心络组大鼠白细胞(WBC)数量显著降低(P<0.01);假手术组大鼠 WBC 数量显著降低(P<0.01)。通心络组大鼠血小板(PLT)水平与假手术组、模型组相比均降低(P<0.05或 P<0.01)。
2.4 各组大鼠血生化Ca2+、CK、LDH水平比较 见表2。与假手术组相比,模型组大鼠血清Ca2+、CK、LDH水平升高(P<0.05或P<0.01);与模型组相比,通心络组血清Ca2+、CK、LDH水平降低,差异有统计学意义(P<0.05或 P<0.01)。
表1 各组大鼠血常规结果比较(109/L
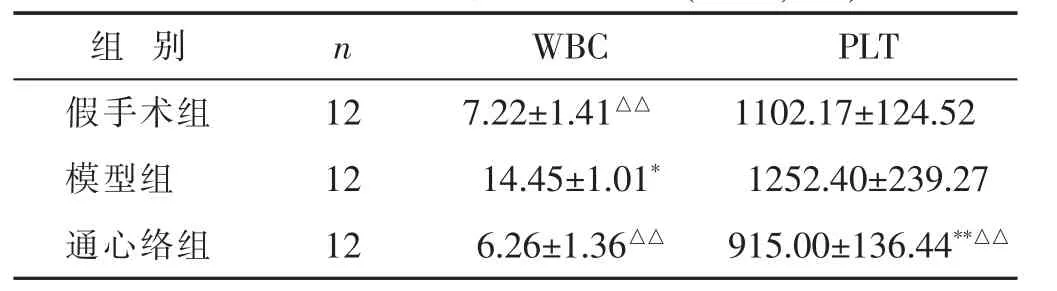
表1 各组大鼠血常规结果比较(109/L
与假手术组比较,*P<0.05,**P<0.01;与模型组比较,△P<0.05,△△P<0.01。下同。
组 别 n WBC PLT假手术组 12 7.22±1.41△△ 1102.17±124.52模型组 12 14.45±1.01* 1252.40±239.27通心络组 12 6.26±1.36△△ 915.00±136.44**△△
表 2 各组大鼠血清 Ca2+、CK、LDH 水平比较(

表 2 各组大鼠血清 Ca2+、CK、LDH 水平比较(
组 别 n LDH(IU/L)Ca2+(mmol/L) CK(IU/L)假手术组 12 983.84±178.09△△模型组 12 1948.04±597.83**2.38±0.03△ 5330.98±223.99△2.51±0.10* 8326.95±1236.06*通心络组 12 1235.40±271.44△2.27±0.02**△△ 4401.38±980.91△
2.5 各组血清Syk、ERK、5-HT水平比较 见表3。与假手术组相比,模型组与通心络组大鼠的血清Syk、5-HT水平均降低,且大鼠血清ERK水平均升高(P<0.05或P<0.01);通心络组与模型组相比,大鼠血清Syk、5-HT水平显著降低,ERK水平显著升高(P<0.01)。
表 3 各组大鼠血清Syk、ERK、5-HT 水平比较(pg/mL
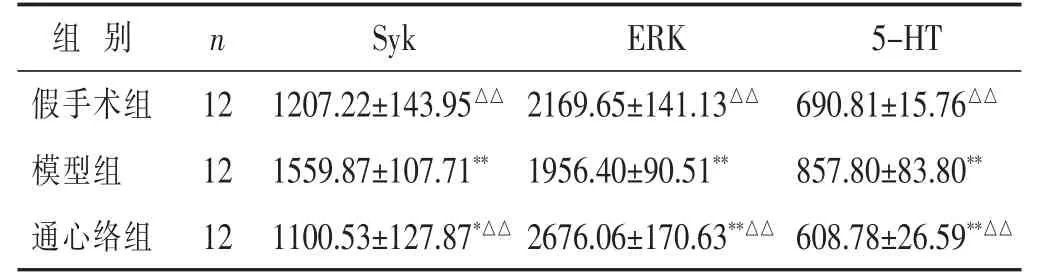
表 3 各组大鼠血清Syk、ERK、5-HT 水平比较(pg/mL
组 别 n Syk ERK 5-HT假手术组 12 690.81±15.76△△模型组 12 857.80±83.80**1207.22±143.95△△ 2169.65±141.13△△1559.87±107.71** 1956.40±90.51**通心络组 12 608.78±26.59**△△1100.53±127.87*△△ 2676.06±170.63**△△
3 讨 论
随着现代医学技术的发展,一些动脉搭桥术、溶栓疗法、经皮腔内冠脉血管成形术等应用于心肌缺血的治疗,随之带来心肌缺血再灌注损伤(MIRI)的发生率逐年升高,成为临床治疗的一大难题。心肌缺血再灌注的炎症反应进一步加重心肌损伤[3],其中肥大细胞脱颗粒介导的炎症反应较为突出。
肥大细胞(Mast Cell)[4]广泛分布在皮肤及内脏黏膜下的微血管周围,存在血液中的MC,含有肝素、组织胺、5-羟色胺等,抗原刺激时,膜表面受体活化,使Syk和Fyn蛋白酪氨酸激酶活化,形成肥大细胞脱颗粒的初始信号[5]。TPS、c-Fos是主要由 MC 分泌的炎症介质[6],经肥大细胞脱颗粒释放到细胞外,因其在MC的贮存和表达中具有高度选择性,故可作为MC激活及其脱颗粒的标志[7]。肥大细胞脱颗粒反应依赖于Ca2+浓度[8],释放组胺、5-羟色胺等介质,激活炎症反应,破坏胞膜线粒体等微观结构,加重心肌损伤[9]。肥大细胞脱颗粒上游的Syk、ERK水平的变化与心肌Ca2+损伤严重程度相关,Syk磷酸化水平升高,MC激活脱颗粒化,加重炎症反应[10];研究发现抑制MC的激活,血清中ERK磷酸化水平升高,可保护受损心肌[11]。
中药复方通心络以“络以通为用”的治疗原则[12],运用搜剔疏通类药物,改善微循环;既往课题组研究发现通心络超微粉渗灌气血,濡养脏腑[13],可保护血管内皮损伤,减少心梗无再流面积,减轻心肌再灌注损伤[14];通过多途径、多环节、多靶点影响疾病的进程,改善心肌受损严重程度和预后[15]。
本研究结果显示,通心络组大鼠心肌组织的凋亡指数,较模型组显著降低;表明通心络超微粉可减轻心肌细胞的凋亡; 血清中TPS、c-Fos、Syk、5-HT水平在模型组显著升高,在通心络组显著降低,表明通心络可减轻心肌损伤中的炎症反应;血清中ERK水平在通心络组升高,表明通心络超微粉可促进细胞自我修复功能,综上述通心络超微粉可减轻心肌缺血再灌注过程中肥大细胞脱颗粒介导的炎症反应,保护受损心肌。为临床疾病的防治和治疗有指导意义。
[1]吴以岭.脉络学说构建及其指导血管病变防治研究[J].中国中西医结合杂志,2017,37(2):147-148.
[2]成玲俐,吴素华,李志梁,等.大鼠心肌缺血再灌注损伤动物模型的建立与评估[J].中国实验诊断学,2010,14(8):1163-1165.
[3]黄婷,杨明会,李绍旦,等.肥大细胞脱颗粒和心肌缺血再灌损伤及通络药物干预的研究进展[J].云南医药杂志,2017,38(2):62-65.
[4]乔钰惠,孟增慧,郭丽君,等.心肌缺血再灌注损伤的机制和治疗[J].基础医学与临床,2015,35(12):1666-1671.
[5]白文武.通心络促进心肌梗死后小鼠缺血心肌血管生成的作用及其机制研究[D].济南:山东大学,2014.
[6]李寰,郭伟,梁远红,等.色甘酸钠对大鼠心肌梗死后心肌凋亡及凋亡蛋白的影响[J].中国动脉硬化杂志,2013,21(5):414-418.
[7]燕红玲,何韶衡.类胰蛋白酶的检测及临床意义[J].医学研究生学报,2009,22(8):871-874.
[8]Pinxteren JA,O′Sullivan AJ,Larbi KY,et al.Thirty years of stimulussecretion coupling: from Ca(2+) to GTP in the regulation of exocytosis[J].Biochimie,2000,82(4):385-393.
[9]江一峰,殷莲华,金惠铭.肥大细胞和类胰蛋白酶与心血管疾病[J].中国动脉硬化杂志,2006,14(1):80-82.
[10]李菊香,万磊.通心络胶囊对大鼠急性缺血再灌注损伤心肌的保护作用及信号转导[J].中成药,2010,32(4):562-565.
[11]刘东方.肥大细胞脱颗粒机制研究进展[J].国外医学:临床生物化学与检验学分册,2004,25(2):137-139.
[12]魏聪,常丽萍,赵珊珊.脉络学说指导防治“脉络-血管系统病”的理论探微[J].疑难病杂志,2015,14(11):1101-1103.
[13]张俊修,霍旺,王朋,等.心之络病“孙络疏失”模型大鼠心肌组织病理变化研究[J].中国中医急症,2014,23(5):785-787,791.
[14]Li XD,Yang YJ,Geng YJ,et al.Tongxinluo reduces myocardial noreflow and ischemiareperflision injury by stimulating the phosphorylation of eNOS via the PKA pathway[J].American Journal of Physiology-Heart and Circulatory Physiology,2010,299(4):H1255-H1261.
[15]王思颖,李绍旦,刘毅,等.通心络对心肌梗死模型大鼠心肌损伤保护作用及机制的研究[J].环球中医药,2016,9(6):650-653.
Effects of Tongxinluo Decoction on Inflammatory Response Induced by Degranulation of Mast Cells in Rats with Myocardial Ischemia Reperfusion Injury
HUANG Ting,LI Shaodan,LI Han,et al. Beijing Uni-versity of Chinese Medicine,Beijing 100029,China.
Objective: To discuss the protective effect and mechanism of Tongxinluo Decoction on myocardial injury induced by mast cells in rats with ischemia reperfusion injury,and explore its mechanism.Methods: 36 healthy adult male SD rats were randomly divided into the sham operation group,the model group,and Tongxinluo Decoction group.Myocardial ischemia reperfusion model was established by ligation of the left anterior descending coronary artery,myocardial ischemia for 1 H,and reperfusion for 2 H;while the sham group was punctured without ligation.The rats in Tongxinluo Decoction group
intragastric administration with Tongxinluo Decoction,and the model group and the sham group were intragastric administration with saline.After 1 weeks,changes of pathological in myocardium were observed by HE staining;routine blood test,blood biochemical examination,serum Phosphorylation level of Syk and ERK and 5-HT were detected.Results:The expression of 5-HT and Syk phosphorylation levels of Tongxinluo Decoction group were significantly lower than those in the model group,and the phosphorylation level of ERK increased significantly,compared with the model group(P<0.01).Conclusion:Tongxinluo Decoction can inhibit the inflammatory reaction induced by mast cell degranulation by reducing the phosphorylation level of 5-HT and Syk and increasing the phosphorylation level of ERK,reduce myocardial injury and then protect myocardial tissue.
Tongxinluo Decoction;Myocardial ischemia reperfusion;Mast cell degranulation;Inflammatory reaction
R285.5
A
1004-745X(2017)09-1514-04
10.3969/j.issn.1004-745X.2017.09.003
2017-05-09)
国家重点基础研究发展计划(973计划)(2012CB518601)
△通信作者(电子邮箱:ymh9651@sina.com)
