冠心康对ApoE-/-动脉粥样硬化小鼠血清血脂及炎性微环境的影响*
2017-09-28徐华英王建茹杜文婷章怡祎
徐华英 王建茹 王 凤 杜文婷 章怡祎 刘 萍
(上海中医药大学附属龙华医院,上海 200032)
冠心康对ApoE-/-动脉粥样硬化小鼠血清血脂及炎性微环境的影响*
徐华英 王建茹 王 凤 杜文婷 章怡祎 刘 萍△
(上海中医药大学附属龙华医院,上海 200032)
目的 观察冠心康对ApoE-/-动脉粥样硬化小鼠的血清白细胞介素-6(IL-6)、白细胞介素-8(IL-8)、肿瘤坏死因子-α(TNF-α)表达的影响,探讨冠心康抗动脉粥样硬化的作用机制与炎性因子之间的关系。方法以ApoE-/-小鼠给予高脂饲料建立动脉粥样硬化模型。30只ApoE-/-小鼠随机分为模型组、冠心康组、辛伐他汀组;10只同遗传背景的C57BL/6J小鼠作为正常组。冠心康组以冠心康煎剂灌胃,辛伐他汀组以辛伐他汀水溶液进行灌胃。各组干预12周时取材。每周检测小鼠体质量;生化仪检测血清血脂;酶联免疫吸附反应(ELISA)检测血清IL-6、IL-8、TNF-α蛋白的表达情况。免疫组化法检测小鼠主动脉CD68蛋白的检测。结果干预12周后,用药组的小鼠体质量均低于模型组(P<0.05)。与模型组比较,冠心康组与辛伐他汀组的血清TC、TG、LDL-C 下降(P<0.05),HDL-C 升高(P<0.05)。 用药组的血清 IL-8、TNF-α 表达比模型组均下降,差异有统计学意义(P<0.05);IL-6表达则升高(P<0.05)。与模型组比较,用药组的CD68蛋白表达下降,差异有统计学意义(P<0.05)。结论 冠心康可能通过调节血清血脂及炎性因子的表达,降低血管内皮细胞的损伤,从而发挥抗动脉粥样硬化的作用。
动脉粥样硬化 冠心康 炎性因子 肿瘤坏死因子-α(TNF-α)
动脉粥样硬化是心血管疾病的病理学标志,又是疾病的前期基础。近年来研究发现,对于动脉粥样硬化的发生和进展中,炎症标志物常伴随脂质的代谢紊乱而出现。在动脉粥样硬化的不同阶段,血管内皮细胞、平滑肌细胞、巨噬细胞等产生白细胞介素(Interleukin),白介素作为多种细胞所产生的细胞因子,广泛作用于细胞的免疫调节、增殖分化以及组织炎症反应中。其中,白介素-8(IL-8)和白介素-6(IL-6)参与炎症期细胞因子的表达,而IL-6同时又能够激活巨噬细胞分化[1]。 肿瘤坏死因子-α(TNF-α)是主要由 T 细胞和巨噬细胞产生的促炎因子,在动脉粥样硬化的发展中起重要作用,TNF-α的过表达与中风、动脉粥样硬化等病理状况密切相关[2]。本研究以ApoE-/-小鼠建立动脉粥样硬化模型,通过冠心康的给药干预,观察动脉粥样硬化小鼠的体质量及血脂变化,小鼠血清IL-6、IL-8、TNF-α蛋白变化及小鼠主动脉CD68蛋白表达,探讨冠心康抗动脉粥样硬化的可能机制。
1 材料与方法
1.1 动物 雄性APoE-/-小鼠30只,SPF级,6~8周龄,体质量(18±2)g,由上海南方模式有限公司提供,动物合格证号:SCXK(沪)2014-0002。相同遗传背景的雄性C57BL/6J小鼠10只,6~8周龄,体质量18~20 g,作为正常组,购自中国科学院上海斯莱克实验动物有限公司,动物许可证号:SYXK(沪)2014-0002。
1.2 药物与试剂 冠心康水煎液由上海中医药大学附属龙华医院中药房提供,生黄芪30 g,全瓜蒌15 g,薤白12 g,制半夏12 g,益母草 30 g,丹参12 g,水煎 2次,纱布过滤,混合加热后浓度按43.2 g/kg进行浓缩,4℃保存备用。辛伐他汀片(舒降之)由杭州默沙东有限公司提供。规格20 mg。批号:国药准字J20130068。伊红苏木精试剂盒,碧云天生物技术研究所;IL-6、IL-8、TNF-α试剂盒,江苏凯基生物技术股份有限公司;CD68抗体(批号ab125212),英国Abcam公司;免疫组化试剂盒,武汉博士德生物工程有限公司;DAB显色剂,北京中杉金桥有限公司。
1.3 实验仪器 SL202N电子天平,上海民桥精密科学仪器有限公司;全自动生化检测仪,日本东芝公司;组织包埋机,德国Leica公司;TP1020全自动组织脱水机,德国Leica公司;RM2335手动石蜡切片机,德国Leica公司;Synergy H1 MF型酶标分析仪,美国Bio Tek公司;超纯水仪,美国MilliPore公司;倒置荧光显微镜,日本Nikon公司。
1.4 分组与造模 30只雄性ApoE-/-小鼠按完全随机设计的方法分为冠心康组、辛伐他汀组和模型组,每组10只。另取10只相同遗传背景的C57BL/6J小鼠作为正常组。30只ApoE-/-小鼠高脂饮食(高脂饲料配方:脂肪21%,胆固醇0.15%,基础饲料为78.85%)8周,建立动脉粥样硬化模型。正常组喂以普通饲料,不进行造模。1.5 给药方法 模型建立以后,冠心康组给予冠心康水煎剂灌胃(43.2 g/kg灌胃);辛伐他汀组给予辛伐他汀水溶液灌胃(1.5 μg/g灌胃);模型组给予与用药组相同剂量的生理盐水灌胃。每日1次,共灌胃给药12周,取材前1 d晚上禁食不禁水。
1.6 标本采集与检测
1.6.1 小鼠的一般状态及体质量变化 观察小鼠的一般状态。每周测量1次小鼠的体质量。监测从造模1周至造模后及用药干预12周的小鼠体质量变化。
1.6.2 小鼠血清血脂检测 小鼠摘眼球取血,血液室温静置后,3500 r/min离心15 min,将分离后的上清液进行分装,全自动生化仪检测各组小鼠的血脂水平。胆固醇(TC)、三酰甘油(TG)采用 GPO-PAP 酶法,高密度脂蛋白胆固醇 (HDL-C)、低密度脂蛋白胆固醇(LDL-C)采用直接法检测。
1.6.3 小鼠主动脉病理的检测 小鼠主动脉进行剥离后置于4%多聚甲醛,置于4℃冰箱固定12~24 h,常规梯度脱水后进行石蜡包埋,将血管组织横断面切片,切片厚度为4~6 μm,将展片、捞片后的组织附于载玻片于37℃恒温箱过夜固定后行HE染色。在显微镜下观察组织形态学变化并进行拍照。
1.6.4 小鼠血清IL-6、IL-8、TNF-α 蛋白的检测 小鼠摘眼球取血,血液室温静置后,3500 r/min离心15 min,将分离后的上清液进行分装,参照ELISA试剂盒说明书进行IL-6、IL-8、TNF-α蛋白的检测。
1.6.5 小鼠主动脉CD68蛋白的检测 免疫组化法检测小鼠主动脉CD68蛋白的检测。按试剂盒说明进行免疫组化染色,并进行封片。每张切片在400倍的光镜下随机挑选5个视野,进行拍照后采用Image-Pro Plus6.0软件进行半定量分析蛋白表达的平均光密度,区域面积。平均积分光密度除以阳性着色面积,乘以100为阳性表达率。
1.7 统计学处理 应用SPSS22.0统计学软件。计量资料描述服从正态分布或近似正态分布以(±s)表示,多组数据比较(各组间),符合正态分布的采用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 各组小鼠一般情况及体质量比较 见表1。各组小鼠均精神充沛,灵活好动,饮食、二便正常,毛发整洁光滑,各药物组小鼠与模型组、正常组无明显差异。于高脂喂养8周时随机处死2只ApoE-/-小鼠,进行主动脉HE染色,已确定造模成功。在实验过程中正常组和模型组小鼠自然死亡各1只。正常组小鼠体质量与其他组别小鼠比较明显偏低(P<0.05)。经药物干预后,与模型组比较,冠心康组和辛伐他汀组小鼠的体质量呈逐渐下降趋势(P<0.05);模型组小鼠体质量呈逐渐上升趋势(P<0.05)。
表1 各组小鼠药物干预前后体质量水平比较(g)
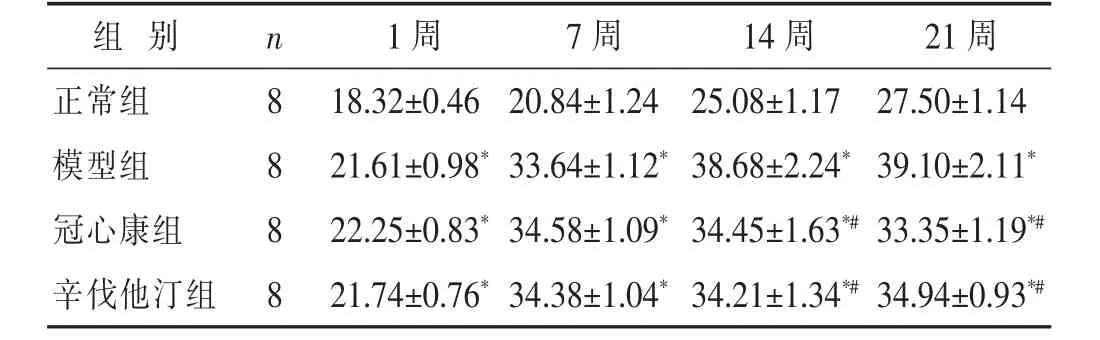
表1 各组小鼠药物干预前后体质量水平比较(g)
与正常组比较,*P<0.05;与模型组比较,#P<0.05;与辛伐他汀组比较,△P<0.05。 下同。
组 别 n 1周 7周 14周 21周正常组 8模型组 8冠心康组 8 18.32±0.46 20.84±1.24 25.08±1.17 27.50±1.14 21.61±0.98*33.64±1.12*38.68±2.24*39.10±2.11*22.25±0.83*34.58±1.09*34.45±1.63*#33.35±1.19*#辛伐他汀组 821.74±0.76*34.38±1.04*34.21±1.34*#34.94±0.93*#
2.2 各小鼠血脂水平比较 见表2。药物干预12周后,与正常组比较,模型组小鼠血清TC、TG、LDL-C显著升高,HDL-C显著降低,差异具有统计学意义(P<0.05)。与模型组比较,辛伐他汀组小鼠血清TC、TG、LDL-C显著降低,HDL-C显著升高,差异具有统计学意义(P<0.05)。冠心康组小鼠血清较模型组TC、LDLC显著降低,HDL-C显著升高,差异具有统计学意义(P<0.05),模型组与冠心康组组间TG比较,差异无统计学意义(P>0.05)。与辛伐他汀组比较,冠心康组小鼠血清 TG、LDL-C 更高(P<0.05),两组间 TC、HDL-C比较,差异无统计学意义(P>0.05)。
表2 各组小鼠血脂水平比较(mmol/L)
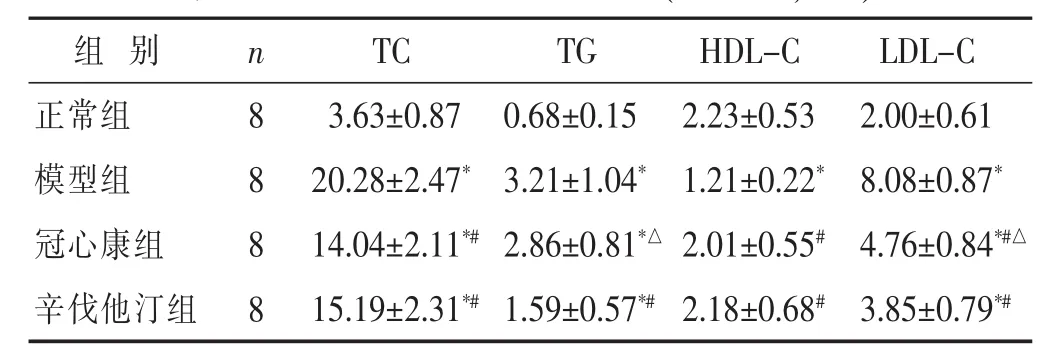
表2 各组小鼠血脂水平比较(mmol/L)
与正常组比较,*P<0.05;与模型组比较,#P<0.05;与辛伐他汀组比较,△P<0.05。 下同。
组 别 n TC TG HDL-C LDL-C正常组 8模型组 8冠心康组 8 3.63±0.87 0.68±0.15 2.23±0.53 2.00±0.61 20.28±2.47*3.21±1.04* 1.21±0.22* 8.08±0.87*14.04±2.11*#2.86±0.81*△ 2.01±0.55# 4.76±0.84*#△辛伐他汀组 815.19±2.31*#1.59±0.57*#2.18±0.68# 3.85±0.79*#
2.3 各组小鼠主动脉病理的影响 见图1。正常组小鼠主动脉内皮相对光滑、无斑块形成,平滑肌细胞排列整齐。模型组小鼠主动脉壁存在不同程度的内膜增厚,并有纤维帽的形成,主动脉管壁厚度不均一,动脉粥样硬化病灶较为明显,斑块内部结构粗糙,平滑肌细胞萎缩明显。其中模型组可见胆固醇结晶的形成。冠心康组及辛伐他汀组小鼠内膜增厚及脂质沉积程度减轻,平滑肌细胞萎缩不明显,斑块内部结构相对不粗糙,病变程度较模型组减轻。
2.4 各组小鼠血清IL-6、IL-8、TNF-α比较 见表3。药物干预12周后,与正常组比较,模型组小鼠血清IL-6、IL-8、TNF-α显著升高,差异具有统计学意义(P<0.05)。与模型组比较,冠心康组、辛伐他汀组IL-8、TNF-α显著降低,IL-6显著升高,差异具有统计学意义(P<0.05)。 冠心康组小鼠血清 IL-6、IL-8、TNF-α与辛伐他汀组比较,差异无统计学意义(P>0.05)。
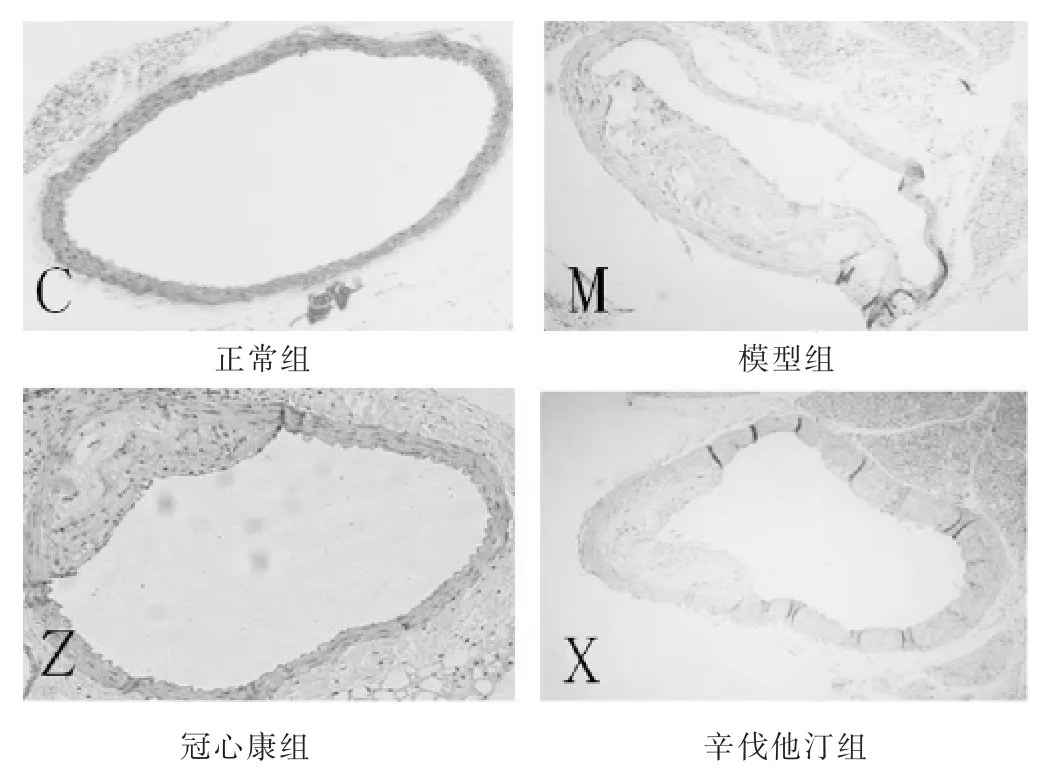
图1 各组小鼠主动脉形态学(HE染色,100倍)
表 3 各组小鼠血清 IL-6、IL-8、TNF-α 比较(pg/mL
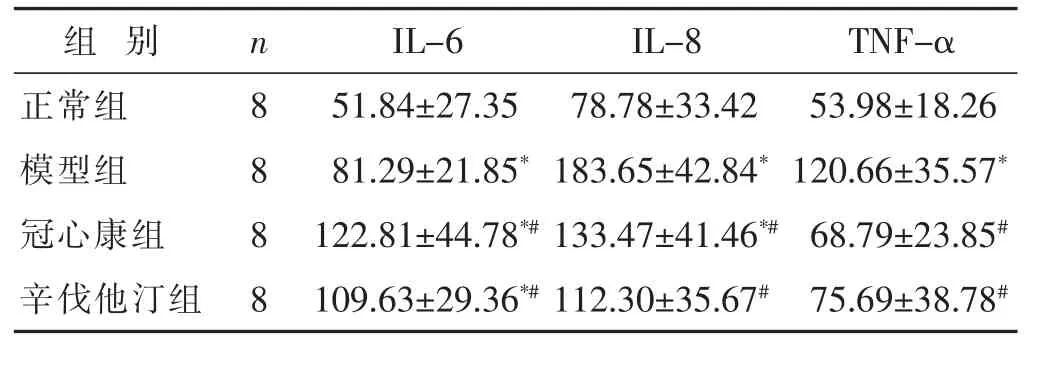
表 3 各组小鼠血清 IL-6、IL-8、TNF-α 比较(pg/mL
组 别 n IL-6 IL-8 TNF-α组 8模型组 8冠心康组 8 51.84±27.35 78.78±33.42 53.98±18.26 81.29±21.85*183.65±42.84*120.66±35.57*122.81±44.78*#133.47±41.46*#68.79±23.85#辛伐他汀组 8109.63±29.36*#112.30±35.67# 75.69±38.78#
2.5 各组小鼠主动脉CD68蛋白表达的比较 见图2,表4。CD68蛋白为细胞膜/胞浆染色,阳性染色呈深棕色,颜色越深,阳性表达率越明显。本实验研究结果发现,模型组小鼠血管中CD68阳性表达率为(32.44±3.89)%,与正常组的阳性表达率(13.37±1.90)%相比升高,巨噬细胞浸润明显,差异具有统计学意义(P<0.05)。冠心康组、辛伐他汀组小鼠中动脉的CD68阳性表达率为(19.40±2.05)%,(17.53±1.53)%。 与模型组比较,阳性表达率降低(P<0.05)。用药组小鼠血管组织中的巨噬细胞浸润减轻。

图2 用药干预12周后各组小鼠主动脉CD68蛋白的表达(IHC 染色,400倍)
表4 各组小鼠主动脉CD68蛋白的表达(%s)

表4 各组小鼠主动脉CD68蛋白的表达(%s)
组 别 n IL-6正常组 8模型组 8冠心康组 8 13.37±1.90 32.44±3.89*19.40±2.05*#辛伐他汀组 817.53±1.53*#
3 讨 论
心血管疾病,包括缺血性卒中和心脏病发作,是全球死亡和发病的主要原因。研究显示,其基础病理学动脉粥样硬化被定义为动脉壁的慢性炎性疾病[3]。本病的发生与脂质代谢紊乱、血管内皮细胞的炎症反应密切相关。炎症贯穿动脉粥样硬化的各个阶段。同时,以脂代谢紊乱、血清高LDL水平等危险因素的相互作用亦可以扩大炎症的进程。研究表明,IL-8是由单核/巨噬细胞、中性粒细胞等多种细胞分泌,属于CXC亚科的一种促炎趋化因子,与动脉粥样硬化的发病等密切相关[4]。有研究发现,其水平的升高,可以增加临床冠心病患者中的心血管事件[5]。本实验中发现,ApoE-/-动脉粥样硬化小鼠的血清IL-8水平升高,经药物干预后与模型组相比,用药组的小鼠血清中IL-8水平均下降,表明冠心康组及辛伐他汀组都可以降低ApoE-/-小鼠血清IL-8的表达,具有抗炎作用。
TNF-α是主要由巨噬细胞和T细胞产生的促炎细胞因子,其在许多生理学免疫过程中起关键作用,但是当产生过量时,其可能对宿主造成严重损害。TNF-α的过度表达与许多病理状况有相关,比如溃疡性结肠炎,糖尿病、多发性硬化,中风,动脉粥样硬化等[6]。多实验研究也表明,阻滞TNF-α信号传导与动脉粥样硬化发展减少有相关性,可以减少动脉粥样硬化的发展趋势[7-8]。在胰岛素抵抗的患者中,抗TNF-α治疗具有增加胰岛素敏感性,具有调节肥胖等代谢疾病的效力[9-10]。笔者的实验表明,用药干预后小鼠的TNF-α水平明显降低,冠心康组与辛伐他汀组都能够降低血清TNF-α的表达水平,进一步表明其抗炎效应。
IL-6属于细胞因子,认为是一种参与炎症期细胞因子表达而引起局部炎症,同时激活巨噬细胞的分化和浸润而加快动脉粥样硬化的发生有关[11]。但近年研究表明,IL-6又被证明可以增加全身葡萄糖耐量和胰岛素的敏感性,降低体质量、逆转脂肪肝等,从而发挥肥胖中的预后价值[12-15]。同时,IL-6又能促进M2型巨噬细胞的极化[1]。 而 M2 型巨噬细胞则发挥抗炎效应[16]。在笔者的研究中,中药复方冠心康和辛伐他汀组干预后小鼠IL-6都有所升高,这与用药干预组的小鼠在体质量、脂代谢等水平上的改善结果相一致。
动脉粥样硬化属于中医学“胸痹”“心痛”等范畴。结合临床特征,现代医家认为其主要病机是本虚和痰浊、气滞、血瘀等标实为主的相互共同作用的结果,本项目组结合中医基础理论及前期的临床研究,认为气虚痰瘀证候是冠心病、动脉粥样硬化的主要证型,提出益气活血、祛痰降浊的治疗方法,由此构成基本方药冠心康。本方由生黄芪、丹参、制半夏、全瓜蒌、薤白、益母草组成,方中黄芪、丹参、益母草益气活血,制半夏、薤白、全瓜蒌祛痰降浊,有补有通,标本兼治。前期研究表明,中药复方冠心康具有调节血脂、调节肝脏胆固醇稳态、抑制 MCP-1、NF-κΒ 表达等作用[17-19]。 本研究中,笔者选择他汀类药物作为阳性对照药,他汀具有阻断胆固醇合成和调节炎症反应的能力,选用ApoE-/-小鼠作为动脉粥样硬化模型可以较好反映动脉粥样硬化的形成过程。本实验研究显示,用药干预后小鼠动脉粥样硬化组织的巨噬细胞浸润减少,冠心康可以控制小鼠体质量的过度增长,并可以改善ApoE-/-小鼠脂代谢紊乱,调节血清 IL-6、IL-8、TNF-α 的表达,具有调脂及控制体质量、改善炎性环境,从而发挥抗动脉粥样硬化。动脉粥样硬化的发病因素多样,病情发展和转变的原因复杂,对动脉粥样硬化过程中炎性因子与其他信号转导分子间的关系如何,中药复方对炎性因子的具体作用靶点,以及中药复方的多靶点、多调控问题,以后仍需进一步深入研究。
[1]Braune J,Weyer U,Hobusch C,et al.IL-6 regulates M2 polarization and local proliferation of adipose tissue macrophages in obesity[J].Journal of immunology,2017,198(7):2927.
[2]Hashizume M,Mihara M.Atherogenic effects of TNF-α and IL-6 via uP-regulation of scavenger receptors[J].Cytokine,2012,58(3):424-430.
[3]Taleb S.Inflammation in atherosclerosis[J].Archives of cardiovascular diseases,2016,109(12):708-715.
[4]Boekholdt SM,Peters RJ,Hack CE,et al.IL-8 plasma concentrations and the risk of future coronary artery disease in apparently healthy men and women:the EPIC-Norfolk prospective population study[J].Arteriosclerosis, thrombosis, and vascular biology,2004,187(2):1503-1508.
[5]Inoue T,Komoda H,Nonaka M,et al.Interleukin-8 as an indePendent predictor of long-term clinical outcome in patients with coronary artery disease[J].International journal of cardiology,2008,124(3):319.
[6]Guirado A,LoPez Sanchez JI,Ruiz-Alcaraz AJ,et al.Cheminform abstract:synthesis and biological evalu ation of 4-Alkoxy-6,9-dichloro[1,2,4]triazolo[4,3-a]quinoxalines as inhibitors of TNF-α and IL-6 [J].Euro Pean Journal of Medicinal Chemistry,2012,54(50):87-94.
[7]Elhage R,Maret A,Pieraggi MT,et al.Differential effects of interleukin-1 receptor antagonist and tumor necrosis factor binding protein on fatty-streak formation in apolipoprotein E-deficient mice[J].Circulation,1998,97(3):242-244.
[8]Kleemann R,Zadelaar S,Kooistra T.Cytokines and atherosclerosis: a comprehensive review of studies in mice[J].Cardiovascular research,2008,79(3):360-376.
[9]Yazdani-Biuki B,Stelzl H,Brezinschek HP,et al.Improvement of insulin sensitivity in insulin resistant subjects during prolonged treatment with the anti-TNF-α antibody infliximab[J].EuroPean journal of clinical investigation,2004,34(9):641-642.
[10]Araújo EP,De Souza CT,Ueno M,et al.Infliximab restores glucose homeostasis in an animal model of diet-induced obesity and diabetes[J].Endocrinology,2007,148(12):5991-5997.
[11]Ridker PM,Rifai N,StamPfer MJ,et al.Plasma concentration of interleukin-6 and the risk of future myocardial infarction among apparently healthy men[J].Circulation,2000,101(15):1767-1772.
[12]Sadagurski M,Norquay L,Farhang J,et al.Human IL6 enhances lePtin action in mice[J].Diabetologia,2010,53(3):525.
[13]Wunderlich FT,Strhle P,Knner AC,et al.Interleukin-6 signaling in liver-parenchymal cells suppresses hepatic inflammation and improves systemic insulin action[J].Cell metabolism,2010,12(3):237.
[14]Mauer J,Chaurasia B,Goldau J,et al.Signaling by IL-6 promotes alternative activation of macrophages to limit endotoxemia and obesity-associated resistance to insulin [J].Nature immunology,2014,15(5):423-430.
[15]Ma Y,Gao M,Sun H,et al.Interleukin-6 gene transfer reverses body weight gain and fatty liver in obese mice [J].Biochimica et bioPhysica acta,2015,1852(5):1001.
[16]Fujisaka S,Usui I,Kanatani Y,et al.Telmisartan improves insulin resistance and modulates adiPose tissue macrophage polarization in high-fat-fed mice[J].Endocrinology,2011,152(5):1789-1799.
[17]章怡祎,刘萍,励冬斐,等.冠心康对APoE基因敲除小鼠动脉粥样硬化的影响[J].上海中医药杂志,2012,58(11):80-83.
[18]胡俊萍,毛美娇,陈富荣,等.冠心康对载脂蛋白E基因敲除动脉粥样硬化小鼠主动脉粥样斑块及MCP-1、NF-B表达的影响[J].中国中医药信息杂志,2012,19(5):41-44.
[19]章怡祎,刘萍,张娜,等.冠心康对高脂血症大鼠肝脏胆固醇稳态分子表达的动态影响[J].上海中医药杂志,2016,62(11):69-73.
Effect of Guanxinkang Decoction on Serum Lipids and Inflammatory Microenvironment in APoE-/-Atherosclerotic Mice
XU Huaying ,WANG Jianru,WANG Feng,et al.Longhua Hospital of Shanghai Univer-sity of Traditional Chinese Medicine,Shanghai 200032,China.
Objective: To observe the effect of Guanxinkang Decoction on the serum lipids and the expression of IL-6,IL-8 and tumor necrosis factor-α (TNF-α) in APoE-/-atherosclerotic mice,and to investigate the relationship between anti-atherosclerosis mechanism and inflammatory factors of Guanxinkang Decoction.Methods:APoE-/-mice were given high fat diet to establish atherosclerosis model.Thirty APoE-/-mice were randomly divided into the model group,traditional Chinese medicine group and western medicine group.Ten C57BL/6J mice with same genetic background were used as the normal group.TCM group was treated with Guanxinkang Decoction,and the western medicine group was fed with simvastatin aqueous solution.Each group was drawn at 12 weeks of intervention.Mouse weight was measured weekly.Detection of serum lipids by biochemical analyzer.The expression of IL-6,IL-8 and TNF-α in serum was detected by enzyme-linked immunosorbent assay (ELISA).CD68 protein in mouse aorta was detected by immunohistochemistry.Results: After 12 weeks of intervention,the body weight of the mice in the treated groups was lower than that in the model group (P<0.05).Compared with the model group,the serum levels of TC,TG and LDL-C in the traditional Chinese medicine group and the western medicine group decreased(P<0.05) and HDL-C increased(P<0.05).The difference was statistically significant(P<0.05).The expression of IL-6 was increased(P<0.05),and the expression of IL-8 and TNF-α in the treated groups decreased(P<0.05).Compared with the model group,the expression of CD68 protein in the treated groups decreased,and the difference was statistically significant (P<0.05).Conclusion: Guanxinkang Decoction may regulate the expression of serum lipids and inflammatory factors,reduce the damage of vascular endothelial cells,and thus play the role of anti-atherosclerosis.
Atherosclerosis;Guanxinkang Decoction;Inflammatory factors;Tumor necrosis factor-α(TNF-α)
R285.5
A
1004-745X(2017)09-1509-05
10.3969/j.issn.1004-745X.2017.09.002
2017-06-24)
国家自然科学基金项目(81573739);上海市中医药三年行动计划项目(ZY3-CCCX-3-3039)
△通信作者(电子邮箱:liuPing23@sina.com)
