人血清中寨卡病毒微量中和抗体检测方法的建立和应用
2017-09-28纪洵敏苏娟易丽娜彭拓华谈琦琪张欢孙九峰吴徳张贤昌柯昌文
纪洵敏 苏娟 易丽娜 彭拓华 谈琦琪 张欢 孙九峰 吴徳 张贤昌 柯昌文
510440 广州,广东省生物制品与药物研究所(纪洵敏、彭拓华、张贤昌);511430 广州,广东省疾病预防控制中心病原微生物检验所(苏娟、谈琦琪、张欢、吴徳、柯昌文);511430 广州,广东省公共卫生研究院(易丽娜、孙九峰)
·技术方法·
人血清中寨卡病毒微量中和抗体检测方法的建立和应用
纪洵敏 苏娟 易丽娜 彭拓华 谈琦琪 张欢 孙九峰 吴徳 张贤昌 柯昌文
510440 广州,广东省生物制品与药物研究所(纪洵敏、彭拓华、张贤昌);511430 广州,广东省疾病预防控制中心病原微生物检验所(苏娟、谈琦琪、张欢、吴徳、柯昌文);511430 广州,广东省公共卫生研究院(易丽娜、孙九峰)
目的建立人血清寨卡病毒(ZIKV)微量中和抗体检测方法,并用10例经核酸检测和/或病毒分离确诊的寨卡输入病例的急性期和恢复期血清样本进行分析验证。方法采用分离自输入寨卡病例的寨卡病毒株开展组织培养微量中和抗体测定,在BHK21、VERO和VERO-E6 3种细胞系中选择感染寨卡病毒后能产生典型CPE的细胞系制备病毒储备液,滴定病毒滴度;使用100TCID50的病毒液与连续4倍稀释的经56℃30 min灭活的血清于37 ℃中和2 h,然后加入细胞悬液。5%二氧化碳培养箱孵育,逐日观察CPE。结果BHK21、VERO和VERO-E63种细胞系对寨卡病毒感染的敏感度不同,其中VERO细胞最为敏感,可出现典型的CPE;应用VERO细胞系建立寨卡病毒微量中和抗体检测方法能准确反映寨卡确诊病例急性期和恢复期血清中和抗体水平,并能作为一种特异性诊断方法。结论寨卡病毒微量中和抗体检测方法不仅可用于人感染寨卡病毒的实验室诊断,还可用于人群血清流行病学调查。
寨卡病毒归属于黄病毒科黄病毒属,主要通过伊蚊传播[1],也可通过母婴、血液和性传播[2]。自首次于乌干达发现以来,已经在东南亚、非洲和南美洲多次暴发。2015年3月,寨卡病毒病在南美洲暴发;到2016年3月,寨卡病毒病已经蔓延到美洲的至少33个国家和地区[3],截止至2017年3月寨卡病毒已经蔓延到全球的84个国家和地区[4]。该病也因经济贸易全球化、人员交往和旅游输出到一些非流行地区[5]。感染寨卡病毒的患者大约有20%临床症状较轻,其症状与其他虫媒病毒相类似,例如登革病毒和基孔肯雅病[6]。与其他病毒不同的是,寨卡病毒能引起胎儿的先天畸形例如小头畸形[7]和格林巴利综合征[8-9],也可能出现脑膜炎、脊髓炎和眼部畸形等疾病[10-11]寨卡病毒的实验室诊断方法主要有病毒分离、病毒核酸检测和血清学检测[12]。使用病毒核酸检测诊断疑似寨卡病毒病病例,rRT-PCR检测结果阳性可以确诊,然而rRT-PCR检测结果阴性并不能排除感染的可能性;黄病毒间交叉反应常见,因此基于抗原抗体反应的酶联免疫分析血清学检测易出现假阳性结果[13]。为此,本研究试图建立一种能诊断寨卡病毒感染的微量中和抗体检测方法,并可以用于人群寨卡病毒感染的血清流行病学调查,评估寨卡病毒病的流行状况和风险。
1 材料与方法
1.1主要材料
1.1.1 血清样本: 10对寨卡病毒病例的急性期和恢复期血清样本来自2016年10例急性期血清、唾液和尿液标本经核酸和/或病毒分离确诊的输入寨卡病毒病患者(表1)。5对登革病毒病例的急性期和恢复期血清样本,其中有4对来自潮州2015年病例血清,有1对来自广州2014年病例血清。
1.1.2 细胞: BHK21细胞、Vero-E6细胞和Vero细胞的传代细胞系,均为广东省疾病预防控制中心细胞库保存的细胞株,用含10%(Fetal bovine serum,FBS)的MEM培养基培养传代。
1.1.3 病毒寨卡病毒株: 为广东省疾病预防控制中心用乳鼠分离自输入寨卡病例的毒株,编号为Z16019。
1.1.4 试剂和仪器: Viral RNA kit,购自德国Qiagen公司;ZIKA荧光定量PCR试剂盒(达安基因公司);甲基纤维素和结晶紫(美国Sigma公司);胎牛血清(FBS)和MEM(美国Gibco公司);Ⅱ级生物安全柜(美国Thermo scientific公司);倒置显微镜(莱卡公司),荧光定量PCR分析仪(美国Bio-Rad公司);实时无标记细胞功能分析仪(RTCA系统)(ACEA Biosciences,美国)。
1.2方法
1.2.1 微量中和实验方法的建立:细胞系的选择,根据虫媒病毒感染细胞的特点,选择BHK21,Vero,Vero-E6 3种细胞系用于寨卡病毒感染试验。将已用维持液作1∶4稀释寨卡病毒液200 μl接种于已铺有3种细胞的培养管中,孵育1 h后,补加细胞维持液,培养7 d,用实时无标记细胞功能分析仪对3种感染寨卡病毒的细胞进行实时监测,每d观察细胞(Cytopathic effect,CPE),并于第7天收获培养液进行寨卡病毒核酸的rRT-PCR检测,以确定病毒的增殖情况。结合CPE的结果和病毒增殖情况确定微量中和试验的细胞系。同时使用细胞实时监测RTCA系统监控细胞凋亡,RTCA系统是基于微电子传感技术,将微电极阵列整合在细胞培养板底部,用以构建实时、动态、定量跟踪细胞形态和增殖分化改变的细胞阻抗检测传感系统。通过实时动态的电极阻抗检测可以获得细胞生理功能相关的生物学信息,其电极阻抗通过细胞指数值(Cell index,CI)表示[14]。BHK21、Vero-E6和Vero 3种细胞接种到E-Plates中通过测定CI值,实时监测感染ZIKV后3种细胞的CPE情况和凋亡曲线。测定时设立3个独立重复孔并计算3孔CI值的平均值,绿色表示正常细胞,红色表示感染寨卡病毒的细胞。
1.2. 2 病毒储备液的制备和病毒滴度的测定:取保存的寨卡病毒接种于可出现典型CPE和病毒载量高的细胞系,制备病毒储备液,感染病毒的细胞出现CPE>95%时,收获病毒液,反复冻融3次,3 000 r/min,4 ℃离心30 min后收取上清液并保存。病毒滴度的测定:取1管病毒储备液做10倍系列稀释为10-1到10-8,将各稀释度的病毒接种于Vero细胞,并设正常细胞对照, 于5%CO2孵箱37 ℃培养7 d,逐日观察并记录出现CPE孔数,按Reed-Muench法计算寨卡病毒的TCID50浓度,重复测定3次,病毒储备液的病毒浓度取3次结果的平均值。
1.2. 3 血清微量中和抗体测定: 将血清于56 ℃水浴灭活后4倍倍比稀释至1∶1 024,每个稀释度作2个复孔,每孔50 μl;将病毒稀释至100TCID50/50 μl每孔加入50 μl病毒使用液并混匀,同时设血清对照、病毒对照和正常细胞对照。放入5%CO2孵箱37 ℃中和1 h后,再加入细胞悬液,置5%CO2孵箱37 ℃培养7 d,每日观察CPE,并记录结果。
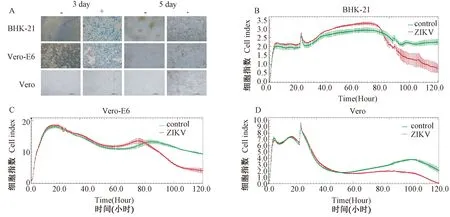
A: 3种细胞感染寨卡病毒3 d和5 d的细胞形态,“-”表示正常细胞,“+”表示寨卡病毒感染的细胞;B:BHK-21细胞感染寨卡病毒后细胞实时监测结果;C:Vero-E6 细胞感染寨卡病毒后细胞实时监测结果;D:Vero 细胞感染寨卡病毒后细胞实时监测结果.B、C和D都采用RTCA系统实时监测染毒后细胞的生长状态,绿色表示正常细胞,红色表示感染寨卡病毒的细胞图1 感染寨卡病毒的BHK-21, Vero, Vero-E6 3种细胞系的CPE和凋亡变化曲线A: The cell morphology on three cell-lines infected with ZIKV at 3 and 5 days. “-” means the normal cells, “+” means the cells infected with ZIKV. B: The results of the real-time monitoring on BHK-21 cells infected with ZIKV. C: The results of the real-time monitoring on Vero-E6 cells infected with ZIKV. D: The results of the real-time monitoring on Vero cells infected with ZIKV. Growth condition of the cells after infected with ZIKV were monitored by RTCA system at B, C and D. Green color means normal cells, Red means the cells infected with ZIKVFig.1 The CPE and apoptotic curves of BHK-21, Vero, Vero-E6 cells infected with ZIKA virus
2 结果
2.1寨卡病毒感染BHK-21,Vero,Vero-E63种细胞系的特点 ZIKA病毒感染BHK-21,Vero,Vero-E6 3种细胞系后均出现了典型的CPE,表现为细胞收缩变圆,间隔变大,细胞脱落、漂浮,未感染的对照细胞未出现CPE。但通过逐日观察发现,感染ZIKA病毒的3种细胞系出现CPE的时间和程度不同,其中Vero细胞最早产生CPE,而BHK21细胞产生CPE最迟,且不典型;根据细胞代谢和凋亡的电阻变化开展实时无标记细胞功能分析仪的结果也证实了显微镜每日的观察结果,Vero细胞系的细胞指数CI值在细胞感染病毒后36 h后开始下降,48 h下降到最低点(见图1)。通过对收获的病毒储备液进行RT-PCR检测发现,Vero细胞的病毒培养储备液Ct值低于BHK21和Vero-E6,分别为16.19、25.64和23.25,因此选用Vero细胞系制备病毒储备液并开展血清微量中和试验。
2.2病毒储备液的制备和病毒滴度测定对用VERO细胞系培养制备的病毒储备液进行浓度测定,通过Reed-Muench公式算出,能使50%细胞出现病变的最高病毒稀释度为10-4.7,即病毒浓度为104.7TCID50/50 μl。
2.3病例血清微量中和抗体的测定结果用微量中和抗体检测方法对10例确诊寨卡病例的急性期和恢复期血清进行抗体测定,根据细胞病变计算能保护50%细胞不出现CPE的病例血清最高稀释度,即为血清微量中和抗体效价。结果见表1,10例恢复期病例血清中有9例中和抗体效价大于1∶64,其几何平均滴度(GMT)为1∶97。
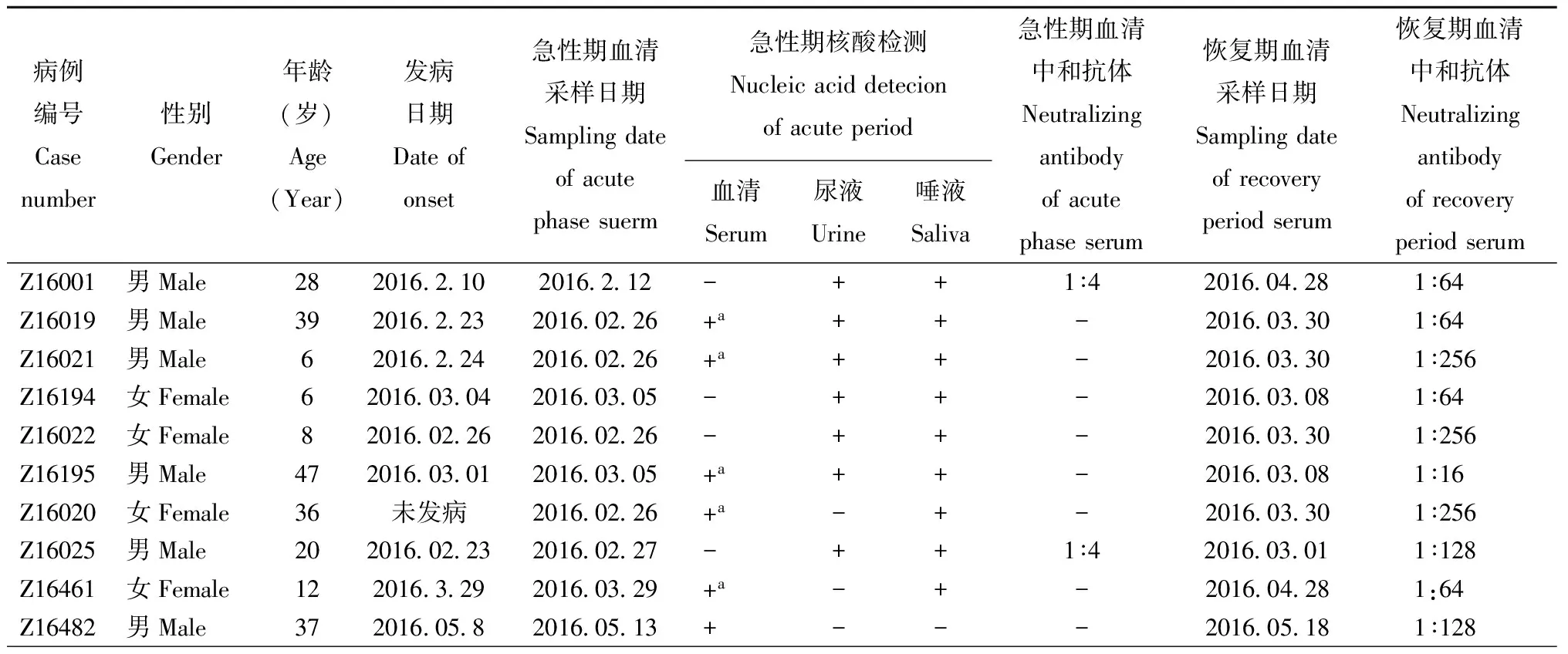
表1 10例确诊寨卡病例的中和抗体、核酸和病毒培养检测结果
注: “a”表示分离到寨卡病毒株;“+”表示阳性;“-”表示阴性
Notes: “a”Indicates the isolated Zika virus strains; “+” indicates positive; “-” indicates negative

表2 5例登革病例中和抗体结果
注: “+”表示阳性;“-”表示阴性
Note: “+” indicates positive; “-” indicates negative
2.4登革病毒病例血清微量中和抗体测定结果登革病毒感染血清与寨卡病毒可能存在交叉反应,因此挑选5例登革病毒感染病例急性期与恢复期血清对该方法进行特异性验证。结果为5例登革病毒急性期与恢复期血清对寨卡病毒无中和抗体效价(见表2)。
3 讨论
2015年5月以来,寨卡病毒疫情在南美洲暴发,至今已威胁到了美洲、非洲乃至亚洲的许多国家和地区[15]。有研究显示寨卡病毒对新生儿健康危害很大,在妊娠期感染寨卡病毒的孕妇有可能使胎儿感染寨卡病毒,从而导致新生儿出现小头畸形的先天性神经病变。巴西自寨卡疫情暴发以来,新生儿小头畸形的病例急剧增加[16]。另外,也有研究指出,寨卡病毒感染的患者可能会出现神经系统并发症,主要表现为格林巴利综合征[17-18]。本次疫情流行范围大、病例多且对对全球公共卫生造成了严重影响,而我国也出现了输入性寨卡病毒病病例,尽管可以采用病毒核酸基因扩增的方法诊断寨卡病毒病毒病,但要全面了解寨卡病毒病的人群流行强度,特别是掌握其输入非流行区的传播风险和特征,都需要开展准确可靠的人群血清流行病学调查,因此我们结合广东省10例输入寨卡病毒病病例的急性期和恢复期血清样本,建立和评价了可测定人血清中抗寨卡病毒的微量中和抗体方法。
首先,我们观察发现寨卡病毒能够引起BHK21细胞、Vero细胞和Vero-E6细胞出现CPE,以Vero细胞最早出现CPE,同时使用RTCA系统对这3种细胞进行实时监测,结果与显微镜观察结果一致,结合使用实时荧光定量PCR对感染细胞的病毒含量进行相对定量,因Vero细胞内病毒的Ct值最低,综合判定Vero细胞对寨卡病毒最为敏感。最后对9例经病毒核酸检测或/和病毒分离确诊的寨卡输入病例的急性期和恢复期血清样本进行分析,并对1例通过密切接触者筛查发现的隐形感染者的病毒血症期血清和1个月后收集的血清样本进行分析,2例病例显示了典型的恢复期和急性期抗体水平的4倍以上增高,7例病例和1例密切接触者的微量中和抗体由阴性转阳,最高抗体滴度达1∶256。几何平均滴度为1∶97,因此寨卡微量中和方法能够准确且简便地反映寨卡确诊病例的中和抗体水平,并能作为一种特异性诊断方法。
有研究表明,之前感染过黄病毒或者接种过黄热病、日本脑炎或者蜱传播脑炎疫苗,能增强继发黄病毒感染[19],鉴于在受ZIKV影响最严重的地区,DENV抗体的流行率高,有研究表明,预先存在DENV抗体的地区可能有助于ZIKV的快速传播,并可能与病毒血症和新生儿小头畸形等临床症状有关[20]。运用ELISA方法检测血清和脑脊髓液中抗寨卡IgM抗体,由于交叉反应,可能会产生一个假阳性结果,而微量中和抗体检测方法也存在交叉反应的风险,且单一病原的中和抗体检测并不能确诊是否为寨卡病毒病例,往往需要多种病原的比较,抗体水平有明显升高才有确诊意义。因此我们采用登革型病毒感染急性期与恢复期血清对该方法的特异性进行验证,其结果显示登革病毒病例血清对寨卡病毒无中和抗体效价,此结果证实使用寨卡病毒病例急性期和恢复期双份血测定中和抗体能有效的诊断寨卡病毒感染[21]。本实验建立血清中寨卡病毒微量中和抗体检测方法,该方法具有特异性强,易于标准化,可用于寨卡病例血清学诊断,后续我们将用该方法对广东高危地区进行寨卡血清流行病学调查。
[1] Grard G, Caron M, Mombo IM, et al. Zika virus in Gabon (Central Africa)—2007: a new threat from Aedes albopictus? [J]. PLoS Negl Trop Dis, 2014, 8(2): e2681. doi:10.1371/journal.pntd.0002681.
[2] Oliveira A, Malinger G, Ximenes R, et al. Zika virus intrauterine infection causes fetal brain abnormality and microcephaly: tip of the iceberg? [J]. Ultrasound Obstet Gynecol, 2016, 47(1): 6-7. doi:10.1002/uog.15831.
[3] Petersen LR, Jamieson DJ, Powers AM, et al. Zika Virus [J]. N Engl J Med, 2016, 374(16): 1552-1563. doi:10.1056/NEJMra1602113.
[4] McArthur MA. Zika Virus: Recent Advances towards the Development of Vaccines and Therapeutics [J]. Viruses, 2017, 9(6):143. doi:10.3390/v9060143.
[5] Wu D, Sun J, Zhong H, et al. A family cluster of imported ZIKV cases: Viremia period may be longer than previously reported [J]. J Infect, 2016, 73(3): 300-303. doi:10.1016/j.jinf.2016.06.008.
[6] Petersen E, Wilson ME, Touch S, et al. Rapid Spread of Zika Virus in The Americas—Implications for Public Health Preparedness for Mass Gatherings at the 2016 Brazil Olympic Games [J]. Int J Infect Dis, 2016, 4411-4415. doi:10.1016/j.ijid.2016.02.001.
[7] Mlakar J, Korva M, Tul N, et al. Zika Virus Associated with Microcephaly [J]. N Engl J Med, 2016, 374(10): 951-958. doi:10.1056/NEJMoa1600651.
[8] Rasmussen SA, Jamieson DJ, Honein MA, et al. Zika Virus and Birth Defects—Reviewing the Evidence for Causality [J]. N Engl J Med, 2016, 374(20): 1981-1987. doi:10.1056/NEJMsr1604338.
[9] Quicke KM, Bowen JR, Johnson EL, et al. Zika Virus Infects Human Placental Macrophages [J]. Cell Host Microbe, 2016, 20(1): 83-90. doi:10.1016/j.chom.2016.05.015.
[10] Alam A, Imam N, Farooqui A, et al. Recent trends in ZikV research: A step away from cure [J]. Biomed Pharmacother, 2017, 911152-1159. doi:10.1016/j.biopha.2017.05.045.
[11] Marquezan MC, Ventura CV, Sheffield JS, et al. Ocular Effects of Zika Virus - A review [J]. Surv Ophthalmol, 2017. doi:10.1016/j.survophthal.2017.06.001.
[12] 张硕, 李德新. 寨卡病毒和寨卡病毒病 [J]. 病毒学报, 2016, (01): 121-127.
[13] Rabe IB, Staples JE, Villanueva J, et al. Interim Guidance for Interpretation of Zika Virus Antibody Test Results [J]. MMWR Morb Mortal Wkly Rep, 2016, 65(21): 543-546. doi:10.15585/mmwr.mm6521e1.
[14] Tian D, Zhang W, He J, et al. Novel, real-time cell analysis for measuring viral cytopathogenesis and the efficacy of neutralizing antibodies to the 2009 influenza A (H1N1) virus [J]. PLoS One, 2012, 7(2): e31965. doi:10.1371/journal.pone.0031965.
[15] Aliota MT, Bassit L, Bradrick SS, et al. Zika in the Americas, year 2: What have we learned? What gaps remain? A report from the Global Virus Network [J]. Antiviral Res, 2017. doi:10.1016/j.antiviral.2017.06.001.
[16] Victora CG, Schuler-Faccini L, Matijasevich A, et al. Microcephaly in Brazil: how to interpret reported numbers? [J]. Lancet, 2016, 387(10019): 621-624. doi:10.1016/s0140-6736(16)00273-7.
[17] 程瑾, 叶玲玲, 郝继英,等. 寨卡疫情危害及其防控应对 [J]. 生物技术通讯, 2016, (1): 110-113.
[18] Parra B, Lizarazo J, Jimenez-Arango JA, et al. Guillain-Barre Syndrome Associated with Zika Virus Infection in Colombia [J]. N Engl J Med, 2016,375(16):1513. doi:10.1056/NEJMoa1605564.
[19] Boldescu V, Behnam MAM, Vasilakis N, et al. Broad-spectrum agents for flaviviral infections: dengue, Zika and beyond [J]. Nat Rev Drug Discov, 2017,16:565-586. doi:10.1038/nrd.2017.33.
[20] Bardina SV, Bunduc P, Tripathi S, et al. Enhancement of Zika virus pathogenesis by preexisting antiflavivirus immunity [J]. Science, 2017, 356(6334): 175-180. doi:10.1126/science.aal4365.
[21] Roehrig JT, Hombach J, Barrett AD. Guidelines for Plaque-Reduction Neutralization Testing of Human Antibodies to Dengue Viruses [J]. Viral Immunol, 2008, 21(2): 123-132. doi:10.1089/vim.2008.0007.
Establishmentandapplicationofmicro-neutralizationtesttodetermineneutralizingantibodyagainstZIKAvirusinsera
JiXunmin,SuJuan,Yilina,PengTuohua,TanQiqi,ZhangHuan,SunJiufeng,WuDe,ZhangXianchang,KeChangwen
GuangdongProvincialInstituteofBiologicalProductsandMateriaMedica,Guangzhou510440,China(JiXM,PengTH,ZhangXC);GuangdongProvincialCenterforDiseaseControlandPrevention,Guangzhou511430,China(SuJ,TanQQ,ZhangH,WuD,KeCW);GuangdongProvincialInstituteofPublicHealth,Guangzhou511430,China(YiLN,SunJF)
KeChangwen,Email:kecw1965@aliyun.com;ZhangXianchang,Email: 3162409845@qq.com
ObjectiveTo develop a micro-neutralization test for determination of neutralizing antibody against ZIKA virus (ZIKV) in human sera and to verify the acute and convalescent serum samples of 10 ZIKA virus-infected cases diagnosed by nucleic acid detection and/or virus isolation.MethodsZIKV isolated from ZIKA cases was used to determine micro-neutralization antibody. The virus solution was prepared by infecting BHK21, VERO and VERO-E6 cell lines and viral titer was tested; 100 TCID50viral solution and 4 times diluted sera which were inactivated at 56 ℃ for 30 min were neutralized, then added the cell suspension and incubated in 5% CO2incubator at 37 ℃ for 7 d. The CPE was observed every day.ResultsThe sensitivity of BHK21, VERO and VERO-E6 was different after infection with ZIKA virus. VERO cell line was the most sensitive and showed typical CPE. VERO cell line was used to establish a micro-neutralization test for determination of neutralizing antibody against ZIKA virus in sera.ConclusionsThe neutralizing antibody test for zika virus in sera is a special and usefulmethod to diagnose human infection of ZIKV and to conduct population based epidemiological investigation.
Neutralizing antibody; ZIKA virus; VERO cell line
微量中和抗体;寨卡病毒;VERO细胞系
2017-03-02)
(本文编辑:陈培莉)
纪洵敏与苏娟对本文同等贡献
柯昌文,Email:kecw1965@aliyun.com;张贤昌,Email:3162409845@qq.com
10.3760/cma.j.issn.1003-9279.2017.04.020
广东省科技计划项目(20160250);中美新发传染病合作项目(EID)子项目12(NU2GGH000961-05-00)
JiXunminandSuJuanarethefirstauthorswhocontributedequallytothisarticle
Fundprograms: The Science and Technology Plan Project of Guangdong Province (20160250); The China-U.S. Collaborative Program on Emerging Infectious Diseases (EID) Subproject 12 (NU2GGH000961-05-00)
