厦门地区孕妇戊型肝炎病毒血清流行病学调查
2017-09-28卓卫马心静朱春雷谌泰春李春莺牛建军黄悦黄守杰郑子峥吴婷
卓卫 马心静 朱春雷 谌泰春 李春莺 牛建军 黄悦 黄守杰 郑子峥 吴婷
361015 厦门市湖里区妇幼保健院(卓卫、朱春雷、谌泰春、李春莺);361102 厦门,分子疫苗学与分子诊断学国家重点实验室 国家传染病诊断试剂与疫苗工程技术研究中心 厦门大学公共卫生学院(马心静、牛建军、黄悦、黄守杰、郑子峥、吴婷);361004 厦门大学附属中山医院(牛建军)
·论著·
厦门地区孕妇戊型肝炎病毒血清流行病学调查
卓卫 马心静 朱春雷 谌泰春 李春莺 牛建军 黄悦 黄守杰 郑子峥 吴婷
361015 厦门市湖里区妇幼保健院(卓卫、朱春雷、谌泰春、李春莺);361102 厦门,分子疫苗学与分子诊断学国家重点实验室 国家传染病诊断试剂与疫苗工程技术研究中心 厦门大学公共卫生学院(马心静、牛建军、黄悦、黄守杰、郑子峥、吴婷);361004 厦门大学附属中山医院(牛建军)
目的调查厦门地区孕妇戊型肝炎病毒(Hepatitis E virus, HEV)感染率及特征。方法2014年9月至2015年6月,收集在厦门市湖里区妇幼保健院建卡、产检的910名孕妇血清;对计划于该院分娩的孕妇(前瞻性亚组)收集第二份产检血清。使用ELISA法检测血清抗-HEV IgM和抗-HEV IgG抗体;对抗-HEV IgM阳性血样进行HEV RNA检测,抗-HEV IgG阳性血样进行IgG定量检测。结果910名孕妇中8人抗-HEV IgM阳性(0.88%, 95%CI0.45%~1.73%),其中3人HEV RNA阳性,病毒载量介于600~700 copies/ml;140人抗-HEV IgG阳性(15.38%, 95%CI13.19%~17.68%),几何平均浓度0.385 Wu/ml(95%CI0.332~0.445 Wu/ml);抗-HEV IgG抗体阳性率存在年龄累积效应。前瞻性亚组共随访150名孕妇,其中4人随访期间出现血清抗-HEV IgM或IgG阳转,新发感染率10.7/100人年(95%CI3.39~25.7/100人年),未观测到不良妊娠结局出现。结论厦门地区孕妇HEV感染率较低,但孕期HEV新发感染风险远高于一般人群,应进一步扩大样本量,明确孕期发生HEV感染的疾病负担。
戊型肝炎(Hepatitis E,HE,简称戊肝)是由戊型肝炎病毒(Hepatitis E virus, HEV)引起的急性病毒性肝炎,是发展中国家病毒性肝炎的主要类型。我国戊肝报告发病数自2012年连续4年超过甲肝,报告死亡人数自2005年起连续11年高于甲肝[1]。全球每年大约有2 000万人感染HEV[2],5.66万人死于此病[3]。孕妇是HEV感染的高危人群之一,孕妇妊娠期发生急性戊型肝炎者病死率高达25%,且常伴不良妊娠结局[4-5]。本次调查收集了厦门地区910名孕妇血样进行HEV感染相关指标检测,分析厦门地区孕妇HEV感染情况,同时基于前瞻性亚组的系列血清检测结果,初步评估孕妇孕期HEV新发感染率。
1 对象与方法
1.1研究对象2014年9月至2015年6月于福建省厦门市湖里区妇幼保健院建卡孕妇,对计划于该院分娩的孕妇纳入前瞻性亚组进行再次随访。本研究所留用样本为医院常规检测后剩余血样,收集过程告知病人并征得同意。
1.2标本及数据收集由经过统一培训的医护人员收集满足入组条件孕妇初次建卡时产检血样(Visit 1,下简称V1);对计划在该院分娩的孕妇待其中期(孕20周~28周)产检时收集其第二份产检血样(Visit 2,下简称V2)。对收集的全部血样进行实验室检测。根据检测结果,对于孕期存在或新发HEV感染的孕妇(系列血清中任一份血清抗-HEV IgM阳性,或系列血清中抗-HEV IgG阳转或抗-HEV IgG 4倍及以上升高者)收集妊娠结局信息(包括是否出现妊娠合并症/并发症、分娩孕周、新生儿性别、体重及是否存在先天性异常)。
1.3实验室检测
1.3.1 抗体检测:包括抗-HEV IgM定性、抗-HEV IgG定性及定量检测。戊型肝炎病毒IgM抗体(HEV-IgM)检测试剂盒(酶联免疫法)[国食药监械(准)字213第3 400 240号]、戊型肝炎病毒IgG抗体(HEV-IgG)检测试剂盒(酶联免疫法)(20153401411)购自北京万泰生物药业股份有限公司,按照试剂盒说明书进行检测。抗-HEV IgG定性检测阳性血样进一步进行定量,使用WHO标准品绘制工作曲线计算待测血样抗-HEV IgG几何平均浓度(Geometric Mean Concentration,GMC),单位为WHO U/ml(Wu/ml)。
1.3.2 核酸检测:本研究采用实时荧光定量聚合酶链式反应(RT-PCR)进行HEV RNA检测。
1.4相关标准与定义
1.4.1 抗-HEV IgG定量标准:抗-HEV IgG定量检测下限为0.077 Wu/ml;为便于分析,抗-HEV IgG阴性样品抗体浓度设定为0.0385 Wu/ml[6]。
1.4.2 HEV感染:抗-HEV IgM阳性表明该孕妇正发生HEV感染;抗-HEV IgG阳性表明该孕妇曾发生HEV感染;系列血清抗-HEV IgM或IgG发生阳转,或抗-HEV IgG抗体浓度出现4倍及以上升高定义为HEV新发感染[7,8]。
1.5统计分析使用SPSS16.0进行统计分析;使用SAS进行GMC计算、Cochran-Armitage趋势性检验。所有统计检验均使用α=0.05的双侧检验,P<0.05认为差异有统计学意义。率的置信区间使用双侧95%置信区间。对于连续性变量,若服从正态分布,则使用平均值±标准差描述,不服从正态分布使用中位数±四分位数间距描述,分类变量指标用各类的例数及百分数。均数比较采用t检验或秩和检验,率的比较采用χ2检验或Fisher精确概率法;采用线性相关分析年龄与经对数转换后的抗体水平间关联性;阳性率趋势检验采用Cochran-Armitage趋势性检验法。
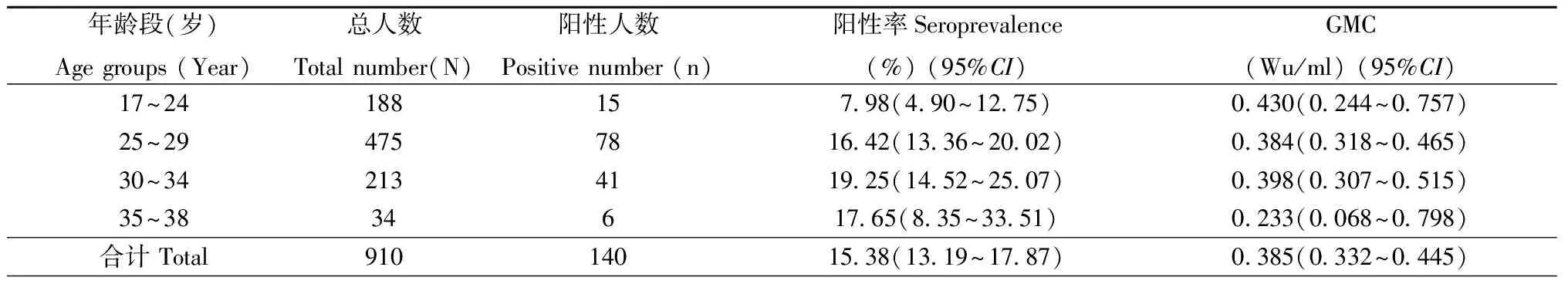
表1 不同年龄孕妇人群抗-HEV IgG阳性率及抗体水平
注: GMC表示几何平均浓度
Note: GMC denotes geometric mean concentration
2 结果
2.1研究对象特征2014年9月至2015年6月共953名孕妇在福建省厦门市湖里区妇幼保健院建卡,除去信息不完整者,最终910名孕妇纳入研究,平均年龄28岁±5岁,孕周12+0周±1+6周。前瞻性亚组共随访150名孕妇,平均年龄27岁±5岁,基线平均孕周11+3周±2+0周。
2.2HEV现况感染率、累积感染率及抗体水平910名孕妇中,8人抗-HEV IgM检测阳性,阳性率0.88%(95%CI0.45%~1.73%),其中7人合并抗-HEV IgG阳性。抗-HEV IgM阳性人群中,HEV RNA阳性者3名,拷贝数介于600~700 copies/ml,2人同时合并抗-HEV IgG阳性。经ELISA定性检测后,140人(15.38%,95%CI13.19%~17.87%)抗-HEV IgG检测阳性,且抗-HEV IgG阳性率随年龄增大而升高,差异具有统计学意义(P=0.004)(表1);对这140例血样定量检测结果显示,GMC为0.385 Wu/ml(95%CI0.332~0.445 Wu/ml),各年龄组间抗体浓度未见统计学差异(表1)。
2.3妊娠期间HEV新发感染本次调查前瞻性亚组共收集到150名孕妇双份血清。前瞻性亚组150名随访孕妇与未纳入随访的760名孕妇基线年龄、孕周及HEV抗体阳性率均衡可比(表2)。147名V1血清抗HEV IgM阴性孕妇中1人V2时发生阳转;123名V1血清抗HEV IgG阴性孕妇中3人V2时发生阳转;27名V1血清抗HEV IgG阳性孕妇中25人持续阳性,未发现GMC出现4倍及以上升高;2名V1血清抗HEV IgG阳性孕妇V2时转阴(表3)。综合系列血清数据,共有4名孕妇孕期新发HEV感染,新发感染率为10.7/100人年(95%CI3.39~25.7/100人年),均为隐性感染。

表2 前瞻性亚组与非随访亚组孕妇基线特征分布a
注:a. 数据均为例数(百分比);b.前瞻性亚组与未随访亚组孕妇基线年龄、孕周及HEV抗体阳性率均无统计学差异
Note: a. Data are number (%). b. No significant differences were observed between prospective subgroup and non-prospective subgroup with nonparametric tests or Chi-square test
2.4妊娠伴随状态及妊娠结局收集前瞻性亚组中存在HEV感染或新发感染的7位孕妇的妊娠结局信息,包括系列血清抗-HEV IgM持续阳性者3人,抗-HEV IgM阳转1人,抗-HEV IgG阳转3人。本次调查共收集到6名孕妇分娩结局及部分生化检测结果,1名孕妇失访。所有孕妇均为足月正常分娩,未发现不良妊娠结局。孕前无基础疾病,且孕期未出现合并症/并发症;产检生化结果显示ALT及AST值正常;未发现活动性乙肝感染。
注: V1/V2表示Visit 1/Visit 2
Note: V1/V2 denotes Visit 1/Visit 2
3 讨论
本研究是针对孕期HEV感染状况进行的前瞻性研究,国内未见同类研究报道。本研究数据表明2014—2015年间厦门地区孕妇人群的HEV现况感染率、累计感染率及抗体水平分别为0.88%(95%CI0.45%~1.73%)、15.38%(95%CI13.19%~17.68%)及0.385 Wu/ml(95%CI0.332~0.445 Wu/ml),孕妇孕期新发感染率约为10.7/100人年(95%CI3.39~25.7/100人年)。与一般人群规律相似,孕妇人群中抗HEV IgG阳性率随年龄增长总体呈上升趋势[9]。暂未发现HEV相关不良妊娠结局的发生。
本次调查报道孕妇HEV感染率(0.88%)与同年江苏省及2013年云南省报道流行率相近,低于同年山东省报道的2.6%;孕妇HEV累计感染率为15.38%,与江苏省南京地区及山东省孕妇人群阳性率相当,略高于江苏省、云南省报道数据[10-13]。普通人群抗-HEV IgG阳性率约为20.0%~40.0%[14],这些数据均表明相比于普通人群,我国绝大多数孕妇抗-HEV IgG抗体阴性,处于易感状态。
孕妇是HEV感染的高危人群,历次戊肝大流行时期,孕妇是病死率最高的群体,病死率可达20%以上[15,16]。杨松静等报道了厦门地区2000—2005年孕、产妇死亡情况,孕期肝病死亡居第三顺位,而戊肝是孕期肝病的主要病因[17]。本次调查发现孕妇孕期新发HEV感染率约为10.7/100人年(95%CI3.39~25.7/100人年),约为一般人群7倍(1.43/100人年,95%CI1.18~1.71/100人年)[7],提示该人群存在较高的HEV感染风险。目前关于孕期感染HEV高风险的机制尚不明确,但推测与孕期雌、孕等激素的高分泌有关[18]。虽然多数孕妇感染HEV后并无明显临床症状,但数据显示孕妇一旦出现急性肝炎及HEV相关暴发性肝衰竭,病死率明显增高,尤其孕中晚期[18]。本研究中的孕妇发生HEV感染的时间均在孕早期至孕中期(小于孕24周),未观察到相关临床症状也可能与感染孕周较小有关。此外,亦有学者提出孕妇的不良妊娠结局与HEV基因型别密切相关[18-19]。本研究中HEV RNA阳性人群病毒载量低,且标本冻存时间较长,未能获得核酸分型数据,无法获知厦门地区孕妇人群中的HEV感染型别,这是本研究的缺陷。
本研究中对横断面研究中8例及前瞻性亚组中4例抗HEV IgM阳性血清进行核酸检测,共4例标本检出HEV RNA,其中V1阳性3例,V2阳性1例,均呈弱阳性,病毒载量介于600~700 copies/ml。根据本研究RT-PCR中所使用的标准品与世界卫生组织HEV RNA标准品间校准比率,病毒量约为6~7×103IU/ml。目前国内HEV核酸多嵌套基因分型结果,定量结果报告相对较少,尤其孕妇群体,国内外文献报告集中在献血人群。近年国外学者报道了部分国家和地区HEV RNA筛查阳性献血员血清病毒载量,介于10 IU/ml~2.3×106IU/ml[20-21]。结合本次调查数据表明,不同地区间及不同个体间病毒载量存在较大差异,因缺乏国内可比性数据,孕妇人群病毒拷贝数高低尚无法定论。
综上所述,本次调查发现厦门地区孕妇群体抗HEV IgG阳性率较低,多数孕妇处于易感状态,且该人群HEV新感染率远高于一般人群,当地卫生诊疗机构应加强孕期监测,保障孕妇健康。此次调查受随访亚组样本量及随访时间的限制,未发现相关不良妊娠结局,若要进一步明确孕期HEV感染的潜在风险,需在扩大样本量的基础上对整个孕期进行随访。
[1] 国家卫生计生委疾病预防控制局. 传染病预防控制[EB/OL][2017-05-03]. http://www.nhfpc.gov.cn/jkj/ s2907/ new_list.shtml.
[2] Rein DB, Stevens GA, Theaker J, et al. The global burden of hepatitis E virus genotypes 1 and 2 in 2005[J]. Hepatology, 2012, 55(4): 988-997. doi:10.1002/hep.25505.
[3] Lozano R, Naghavi M, Foreman K, et al. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010[J]. Lancet, 2012, 380(9859): 2095-2128. doi:10.1016/S0140-6736(12)61728-0.
[4] World Health Organization. WHO position paper-Hepatitis E vaccine[Z]. 2015.
[5] Kamar N, Bendall R, Legrand-Abravanel F, et al. Hepatitis E[J]. Lancet, 2012, 379(9835): 2477-2488. doi:10.1016/S0140-6736(11)61849-7.
[6] Zhu FC, Zhang J, Zhang XF, et al. Efficacy and safety of a recombinant hepatitis E vaccine in healthy adults: a large-scale, randomised, double-blind placebo-controlled, phase 3 trial[J]. Lancet, 2010, 376(9744): 895-902. doi:10.1016/S0140-6736(10)61030-6.
[7] Zhang J, Zhang XF, Zhou C, et al. Protection against hepatitis E virus infection by naturally acquired and vaccine-induced immunity[J]. Clin Microbiol Infect, 2014, 20(6): 397-405. doi:10.1111/1469-0691.12419.
[8] Huang S, Zhang X, Jiang H, et al. Profile of acute infectious markers in sporadic hepatitis E[J]. PLoS One, 2010, 5(10): e13560. doi:10.1371/journal.pone.0013560.
[9] Dong C, Dai X, Liang J, et al. Seroprevalence of hepatitis e virus varies considerably among chinese provinces[J]. Hepat Mon, 2012, 12(6): 386-390. doi:10.5812/hepatmon.6194.
[10] Cong W, Sui JC, Zhang XY, et al. Seroprevalence of hepatitis E virus among pregnant women and control subjects in China[J]. J Med Virol, 2015, 87(3): 446-450. doi:10.1002/jmv.24058.
[11] Gu G, Huang H, Zhang L, et al. Hepatitis E virus seroprevalence in pregnant women in Jiangsu, China, and postpartum evolution during six years[J]. BMC Infect Dis, 2015, 15: 560. doi:10.1186/s12879-015-1308-y.
[12] 周璇, 黄红玉, 段红蕾, 等. 南京地区中孕孕妇戊型肝炎病毒感染血清流行病学调查[J]. 中国产前诊断杂志, 2015, 7(1): 26-30. doi:10.13470/j.cnki.cjpd.2015.01.006.
[13] Huang F, Ma T, Li L, et al. Low seroprevalence of hepatitis E virus infection in pregnant women in Yunnan, China[J]. Braz J Infect Dis, 2013, 17(6): 716-717. doi:10.1016/j.bjid.2013.02.006.
[14] 周乙华, 庄辉. 中国戊型肝炎流行病学研究进展[J]. 中华流行病学杂志, 2010, 31(12): 1414-1416. doi:1O.3760/cmmj.issn.0254-6450.2010.12.021.
[15] World Health Organization. Weekly bulletin on outbreaks and other emergencies[EB/OL] [2017-05-03]. http://apps.who.int/iris/bitstream/10665/255032/1/AOE15-814417.pdf?ua=1.
[16] Perez-Gracia MT, Suay-Garcia B, Mateos-Lindemann ML. Hepatitis E and pregnancy: current state[J]. Rev Med Virol, 2017, 27(3):e1929. doi:10.1002/rmv.1929.
[17] 杨松静. 2000年~2005年厦门地区孕产妇死亡情况分析[J]. 中国优生与遗传杂志, 2007,15(12): 61-64. doi:10.13404/j.cnki.cjbhh.2007.12.003.
[18] Navaneethan U, Al Mohajer M, Shata MT. Hepatitis E and pregnancy: understanding the pathogenesis[J]. Liver Int, 2008, 28(9): 1190-1199. doi:10.1111/j.1478-3231.2008.01840.x.
[19] Kamar N, Dalton HR, Abravanel F, et al. Hepatitis E virus infection[J]. Clin Microbiol Rev, 2014, 27(1): 116-138. doi:10.1128/CMR.00057-13.
[20] Hogema BM, Molier M, Sjerps M, et al. Incidence and duration of hepatitis E virus infection in Dutch blood donors[J]. Transfusion, 2016, 56(3): 722-728. doi:10.1111/trf.13402.
[21] O'Riordan J, Boland F, Williams P, et al. Hepatitis E virus infection in the Irish blood donor population[J]. Transfusion, 2016, 56(11): 2868-2876. doi:10.1111/trf.13757.
SeroepidemiologicstudyofhepatitisEvirusinfectioninpregnantwomeninXiamen
ZhuoWei,MaXinjing,ZhuChunlei,ChenTaichun,LiChunying,NiuJianjun,HuangYue,HuangShoujie,ZhengZizheng,WuTing
XiamenHuliDistrictMaternityandChildCareHospital,Xiamen361015,China(ZhuoW,ZhuCL,ChenTC,LiCY);TheStateKeyLaboratoryofMolecularVaccinologyandMolecularDiagnostics,NationalInstituteofDiagnosticsandVaccineDevelopmentinInfectiousDiseases,SchoolofPublicHealth,XiamenUniversity,Xiamen361102,China(MaXJ,NiuJJ,HuangY,HuangSJ,ZhengZZ,WuT);ZhongshanHospital,XiamenUniversity,Xiamen361004,China(NiuJJ)
WuTing,Email:wuting@xmu.edu.cn
ObjectiveTo investigate the seroprevalence and epidemiological characteristics of hepatitis E virus (HEV) infection in pregnant women in Xiamen.MethodsSera samples of 910 pregnant women were collected from September 2014 to June 2015 in Xiamen Huli District Maternity and Child Care Hospital. Those who intended to give birth in target hospital were included in a subgroup which was asked to collect the second serum sample. All samples were tested for anti-HEV IgM and IgG antibody by enzyme linked immunosorbent assay (ELISA). HEV RNA was tested by reverse transcription-polymerase chain reaction (RT-PCR) for the positive samples of anti-HEV IgM antibody, meanwhile, the quantitative detections for anti-HEV IgG were conducted in specimens positive for anti-HEV IgG.ResultsOf the 910 pregnant women, 8 (0.88%, 95%CI0.45%-1.73%) were anti-HEV IgM positive. HEV RNA was found in 3 cases through RT-PCR and viral load values were between 600 and 700 copies/ml; 140 (15.38%, 95%CI13.19%-17.68%) were anti-HEV IgG positive and geometric mean concentration of the samples was 0.385 Wu/mL (95%CI0.332-0.445 Wu/ml). The positive rate of anti-HEV IgG increased with age (P=0.004). In the subgroup, 150 pregnant women were included and followed up, 4 of those were defined as ‘new HEV infection cases’ and the incidence was evaluated as 10.7/100 person-year (95%CI3.39-25.7/100 person-year).ConclusionsThere were a low percentage of HEV carriers in pregnant women in Xiamen, but the risk of new primary infection in pregnant women during pregnancy was much higher than the general population, suggesting that it is necessary to expand sample size to clarify the burden of HEV infection during pregnancy.
Hepatitis E virus; Pregnant women; Seroprevalence; New infection
戊型肝炎病毒;孕妇;血清学调查;新发感染
2017-05-08)
(本文编辑:吕新军)
卓卫和马心静对本文同等贡献
吴婷,Email:wuting@xmu.edu.cn
10.3760/cma.j.issn.1003-9279.2017.04.009
国家自然科学基金(81373061);福建省自然科学基金(2016J05201);厦门市科技专项(3502Z20144022)
ZhuoWeiandMaXinjingcontributedequallytothisarticle.
Fundprograms: National Natural Science Foundation(81373061); Natural Science Foundation of Fujian Province, China (2016J05201); Science and Technology Project of Xiamen, Fujian Province, China (3502Z20144022)
