ARID1A基因突变体的构建及其在肝癌细胞中的过表达鉴定
2017-09-28肖花廖启成汪海燕刘威龙吴驰黄健刘嘉林
肖花 廖启成 汪海燕 刘威龙 吴驰 黄健 刘嘉林
518112 深圳市第三人民医院(肖花、汪海燕、刘威龙、吴驰、黄健、刘嘉林);341000 赣州,赣南医学院(廖启成)
·论著·
ARID1A基因突变体的构建及其在肝癌细胞中的过表达鉴定
肖花 廖启成 汪海燕 刘威龙 吴驰 黄健 刘嘉林
518112 深圳市第三人民医院(肖花、汪海燕、刘威龙、吴驰、黄健、刘嘉林);341000 赣州,赣南医学院(廖启成)
目的构建人类染色体重塑复合物SWI/SNF(Switch/Sucrose NonFermentable)中重要组份ARID1A(A-T rich interaction domain)的突变过表达载体,并检测野生型ARID1A基因及突变型ARID1A基因在肝癌细胞株HepG2中的表达情况。方法采用overlap PCR技术构建在野生型质粒pcDNA6-ARID1A基础上构建结构域缺失突变体pcDNA6-ARID1A/ΔARID以及pcDNA6-ARID1A/Δ DUF3518;利用脂质体转染技术将野生型质粒以及构建的突变型质粒转染到肝癌细胞HepG2中进行过表达;通过Real-time PCR以及Western blot技术对野生型及突变型ARID1A在肝癌细胞中的表达情况进行鉴定。结果经双酶切后SDS-PAGE分析以及测序验证,成功构建了真核表达载体pcDNA6-ARID1A的突变型质粒pcDNA6-ARID1A/ΔARID以及pcDNA6-ARID1A/Δ DUF3518;通过Real-time PCR以及Western blot的方法验证,ARID1A及ARID1A/ΔARID在肝癌细胞株HepG2中成功过表达,而ARID1A/Δ DUF3518蛋白可能降解。结论成功构建ARID1A功能域缺失型突变体,并在肝癌细胞株HepG2中稳定过表达ARID1A及ARID1A/ΔARID;ARID1A/Δ DUF3518蛋白的缺失暗示DUF3518结构域可能起着稳定蛋白结构的功能。
肝癌是我国男性中第四常见的肿瘤,在导致癌症相关死亡的肿瘤中排名第三,而在<60岁的的人群中,肝癌是最常见、最容易导致死亡的恶性肿瘤。据统计,2015年中国约有466 100例新发肝癌患者,而其中约有422 100人死于肝癌。虽然目前肝癌的治疗方法不少,如手术切除、微波消融、经肝动脉化疗栓塞(TACE)、化疗及分子靶向治疗等,但其治疗效果仍不理想,预后较差。其根本原因为目前肝癌的发生发展机制尚不完全清楚,而且缺乏有效的早期诊断及治疗的分子靶标。因此,深入研究肝癌的分子机制,寻找肝癌相关的原癌基因及抑癌基因,对寻找肝癌早期诊断及治疗的分子靶标具有重要意义。
恶性肿瘤其实质就是细胞生长与死亡之间的稳态平衡发生紊乱的结果。影响恶性肿瘤发生发展的基因主要有两类,即原癌基因以及抑癌基因。其中,抑癌基因是一类抑制细胞过度生长、增殖从而遏制肿瘤形成的基因,在正常细胞生命周期中发挥着重要作用。常见的抑癌基因包括转录调节因子Rb、p53,信号通路抑制因子PTEN等等。
ARID1A(A-T Rich Interaction Domain 1A)是由Gregory等[1]在1996年新发现的一种DNA结合蛋白,这种蛋白在细胞核内有选择性地与富含AT碱基的DNA序列结合,但是该蛋白的DNA结合结构域与其他DNA结合蛋白缺乏序列相似性。已有研究发现,ARID1A基因在卵巢癌、子宫内膜癌等多种人类癌细胞中具有抑癌作用[2-6],同时还有研究表明ARID1A通过调节PI3K/AKT通路的磷酸化水平而达到抑制肿瘤细胞增殖的作用[7],但是ARID1A在肝癌的发生发展中的作用尚未见报道。本研究拟在野生型ARID1A质粒的基础上,构建ARID1A/ΔARID以及ARID1A/ΔDUF3518的真核表达载体,并使其在肝癌株HepG2中稳定过表达,以期为进一步研究ARID1A在肝癌的发生发展中的作用奠定基础。
1 材料与方法
1.1材料
1.1.1 质粒:野生型pcDNA6-ARID1A质粒由美国约翰霍普金斯大学医学院(Johns Hopkins University School of Medicine)Bin Guan馈赠[8]。
1.1.2 细胞株:人肝癌细胞株HepG2由本实验室保存。
1.1.3 试剂:质粒抽提试剂盒、RNA抽提试剂盒以及琼脂糖凝胶电泳胶回收试剂盒均购自德国Qiagen公司;DMEM培养基、胎牛血清(FBS)、Opti-MEM培养基、显影液(SuperSignal® West Pico)和胰蛋白酶均购自Thermo公司;常用限制性内切酶、T4连接酶、大肠杆菌感受态细胞DH-5α、逆转录试剂盒(PrimeScriptTMRT reagent kit with gDNA Eraser)以及SYBR Premix Ex Taq试剂盒均购自日本TaKaRa公司;脂质体Lipo2000转染试剂以及anti-V5 tag抗体购自Invitrogen公司;β-actin抗体购自CST公司。
1.2方法
1.2.1 引物的设计合成及ARID1A结构域缺失突变体的构建:根据pcDNA6-ARID1A的质粒图谱,ARID1A基因两端均有一个XhoI酶切位点,因此利用XhoI酶切该质粒后,回收载体部分,再进行载体自连,即可得到空载体pcDNA6;而ARID结构域以及DUF3518结构域两端分别具有HpaI和EcoRI以及EcoRV和XbaI酶切位点,切这些酶切位点在整个质粒中是唯一的,因此根据这些位点利用Primer Primer 5设计突变体pcDNA6-ARID1A/ΔARID和pcDNA6-ARID1A/Δ DUF3518的引物,引物及序列如表1 所示,采用overlap PCR方法,分别扩增ARID和DUF结构域两端的小片段(4个片段分别含有HpaI和EcoRI以及EcoRV和XbaI酶切位点),再以两端小片段作为模板,扩增得到不含有ARID或者DUF结构域的片段,重新连接回到质粒上,即完成ARID或者DUF结构域缺失突变体的构建。

表1 引物及序列
1.2.2 细胞的培养及转染: 肝癌HepG2细胞用含有10%胎牛血清的DMEM培养基,于37°C、5% CO2的环境中培养。收集处于对数生长期的细胞,使细胞浓度达到2.0×105/ml,按2 ml/孔的量将细胞铺于6孔板中,待次日细胞密度达到80%~90%时进行转染。细胞分为5组:未作处理的细胞(未进行转染)、对照组细胞(转染空质粒pcDNA6)、第1实验组细胞(转染野生型质粒pcDNA6-ARID1A)、第2实验组细胞(转染突变型质粒pcDNA6-ARID1A/ΔARID)以及第3实验组细胞(转染突变型质粒pcDNA6-ARID1A/Δ DUF3518)。最后,按照脂质体Lipo2000试剂盒说明书的操作步骤进行转染。
1.2.3 转染细胞内ARID1A及其突变体mRNA的表达水平分析: 利用NCBI Primer Blast设计检测ARID1A基因的特异性引物,引物序列为:Forward:5’-AAGGGGAGATGTACAGCGTG-3’; Reverse: 5’-GGTCATGTCATTACGCCCCT-3’。由于该引物对应的扩增片段位于ARID结构域和DUF结构域之间,因此同样可以用于转染突变体ARID1A/ΔARID和ARID1A/Δ DUF3518的细胞中RNA的检测一。分别收集1.2.2中的对照组和实验组细胞,利用RNA提取试剂盒,按照说明书步骤分别提取总RNA,并利用逆转录试剂盒将总RNA逆转录为cDNA。利用SYBR Premix Ex Taq试剂盒进行实时荧光定量PCR。PCR反应条件为:95°C 15 s;95°C 10 s、60°C 30 s,40个循环;95°C 15 s;60°C 1 min、95°C 15 s。以β-actin作为内参基因,对ARID1A基因及其突变体的mRNA水平进行相对定量。
1.2.4 转染细胞内ARID1A及其突变体蛋白的表达水平分析: 分别收集1.2.2中的对照组和实验组细胞,用细胞裂解液在冰上作用10 min,4℃、13 200×g离心20 min,收集总蛋白,进行SDS-PAGE电泳,将凝胶上的蛋白点转移至PVDF膜上,用含有5% BSA的TBST溶液在室温封闭1 h,然后按照1∶1 000比例加入一抗(anti-V5 tag以及anti-β-actin),于4°C孵育过夜。随后利用TBST洗膜5次,每次5 min,再加入辣根过氧化物酶标记的二抗(1∶1 000稀释),室温震荡孵育1 h,同上述方法洗膜。最后,加入显影液SuperSignal® West Pico,并于DNR化学发光微成像分析系统(DNR BioImaging Systems)上显影拍照。
2 结果
2.1ARID1A蛋白二级结构ARID1A基因表达的蛋白包含2 285个氨基酸残基,是一个分子量较大的蛋白。我们首先基于NCBI的蛋白库(http://www.ncbi.nlm.nih.gov)对ARID1A可能包含的二级结构域进行预测,结果显示该蛋白不仅含有ARID家族经典的DNA结合结构域,其C端还含有一个未知功能的DUF3518结构域(如图1)。同时我们利用一款在线软件Protein DisOrder prediction System对ARID1A蛋白的无序度进行分析,这一分析软件主要原理是无序区域中的氨基酸残基的高静电荷导致的静电排斥,以及疏水性导致蛋白无法形成紧密结构。利用该软件预测结果与NCBI给出的结果基本一致,都预测了ARID 结构域以及DUF3518 结构域的存在。这两个结构域如何影响ARID1A对肝癌的抑制作用,目前也没有任何研究报道。我们在野生型ARID1A的基础上分别构建这两个结构域缺失的突变体ARID1A/ΔARID以及ARID1A/Δ DUF3518),如图1所示,以深入研究该结构域在肝癌发生发展中的作用。
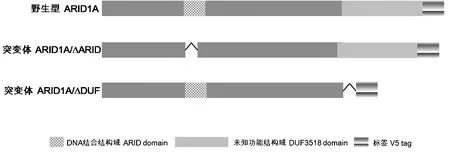
图1 ARID1A及其突变体一级序列结构示意图Fig.1 Schematic diagram showing the primary structure of ARID1A mutants used in the study
2.2ARID1A结构域缺失突变体的构建利用限制性内切酶XhoI对pcDNA6-ARID1A进行消化反应,电泳结果如图2A显示一条大小在7 000 bp左右的条带(ARID1A基因)和一个大小在5 000 bp左右的条带(pcDNA6载体),将其中载体片段回收自连,即可得到pcDNA6 vector质粒。利用限制性内切酶EcoRV和XbaI对pcDNA6-ARID1A进行双酶切反应,电泳结果如图2B所示,可以得到一个大小在10 000 bp左右的条带(pcDNA6载体和部分ARID1A基因片段)和一个2 000 bp左右的条带(含有DUF3518结构域的基因片段),回收10 000 bp的条带作为载体,同时利用overlap PCR扩增一段不含有DUF3518结构域的片段,代替该2 000 bp片段,连接回10 000 bp载体上,及构建得到pcDNA6- ARID1A/Δ DUF3518质粒。利用限制性内切酶HpaI和EcoRI对pcDNA6-ARID1A进行双酶切反应,电泳回收11 200 bp左右的条带(如图2C),同样的方法可构建pcDNA6- ARID1A/Δ ARID质粒。质粒纯化后电泳鉴定大小正确(如图2D),并且通过测序确定野生型及突变型ARID1A序列正确,重组质粒构建成功,可以用于后续试验。

图3 转染细胞内ARID1A及其突变的mRNA(A)和蛋白(B)相对表达量Fig.3 The mRNA (A) and protein (B) expression level of ARID1A and the mutants in transfected HCC cells

注:A. XhoI 酶切;B. EcoRV和XbaI双酶切;C. HpaI和EcoRI双酶切;D.质粒图2 pcDNA6-ARID1A酶切后及质粒凝胶电泳图 Note:A. XhoI digestion; B.EcoRV and xbaI digestion;C.HpaI and EcoRI digestion;D. Plasmids Fig.2 Electrophoresis of enzyme digested pcDNA6-ARID1A and plasmids
2.3转染细胞内ARID1A及其突变的mRNA和蛋白相对表达量如图3A所示,对照组(空白细胞及转染了空载体pcDNA6的细胞)中ARID1A基因的mRNA相对表达量均在0.002(2-ΔCt)以下,而实验组(转染了野生型及突变型ARID1A质粒的细胞)中ARID1A或突变体基因的相对表达量均有显著提高,结果具有显著差异,提示ARID1A野生型或突变型质粒转染成功并在肝癌细胞株HepG2中成功转录。由于无论野生型还是突变型ARID1A蛋白,在其C端均带有一个V5 tag(如图1),因此可以利用anti-V5 tag抗体鉴定野生型或者突变型ARID1A蛋白表达水平。蛋白免疫印迹实验结果如图3B,对照组(空白细胞及转染了空载体pcDNA6的细胞)中没有检测出带有V5 tag的ARID1A,而实验组(转染了野生型ARID1A及ARID1A/Δ ARID质粒的细胞)中检测到明显的条带,提示外源性野生型ARID1A及ARID1A/Δ ARID突变体的成功过表达;然而有意思的是并没有检测到ARID1A/Δ DUF3518蛋白的表达,结合图3B的结果,ARID1A/Δ DUF3518的mRNA水平有显著提高,而蛋白水平没有明显变化,暗示DUF3518结构域的缺失很可能影响了整体蛋白的稳定性,导致突变体蛋白的降解。
3 讨论
ARID1A基因表达产物蛋白BAF250a在细胞质和细胞核中均有分布,但处于细胞核内的ARID1A蛋白并不稳定[9]。ARID1A是单链蛋白,包括2 285个氨基酸残基,对其二级结构预测发现它主要包含两个功能域(图1)[10],一个是1 014到1 101位氨基酸残基构成的的DNA结合结构域ARID,该片段的三维结构已于2004年由Kim S等人通过NMR技术成功解析,并且发现该片段与DNA的相互作用时,其loop区以及H4,H5螺旋上的部分残基发生明显的化学位移,暗示着这几个位点在ARID1A作为SWI/SNF复合物重要组份调控染色体的重塑的过程中起到重要作用[11]。另外一个结构域暂时被命名为DUF3518,跨度为1 975到2 231位氨基酸残基,即未知功能的结构域(Domain of Unknown Function),目前尚无关于该结构域功能方面的研究报道,不过有人推测其可能与ARID结构域之间存在相互作用,并且影响ARID与DNA的结合。
ARID1A自从被发现并认定是一种新型抑癌基因以来,研究者们在多种不同类型的癌细胞中开展了关于其影响癌症发生发展的机制研究,发现ARID1A并非通过单一机制影响癌症的发生发展,在不同的癌细胞中其发挥作用的途径也不尽相同,主要有以下几个方面:多数研究发现,ARID1A沉默之后,可以激活PI3K通路,导致细胞增殖加速[7];还有研究发现,ARID1A基因沉默,上皮细胞标志蛋白E-cad水平降低,细胞的迁移和浸润能力增强[12];最近两年关于ARID1A的研究则集中在其参与DNA的损伤修复这一细胞重要的生命活动中[13-14]。然而关于ARID1A的两个结构域在癌症发生发展中的功能鲜有研究报道。我们前期工作基础中发现在110例肝癌患者中存在28个位点的高频突变,其中错义突变位点有17个[15],占到一半以上,并且有7个突变位点位于ARID1A功能域上(ARID结构域以及DUF结构域)。因此,深入研究ARID1A的两个功能域ARID和DUF3518在癌症发生发展中的作用具有重要意义。
本实验在野生型pcDNA6-ARID1A的基础上成功构建pcDNA6-ARID1A/ΔARID和pcDNA6-ARID1A/ΔDUF3 518两个突变型质粒,并通过Real-time PCR技术对转染后的细胞进行鉴定,结果表明野生型和突变型质粒均可以在肝癌细胞HepG2中成功转录。然而Western blot实验结果却发现,野生型pcDNA6-ARID1A和突变体pcDNA6-ARID1A/ΔARID能够过表达,而pcDNA6-ARID1A/ΔDUF3518却没有显示出明显的条带,暗示该突变体蛋白很可能很快降解,因此我们推测DUF3518结构域起着稳定蛋白结构的功能。这些结果为我们深入研究ARID1A影响肝癌发生发展的分子机制奠定了重要基础。
[1] Huang J, Zhao Y L, Li Y, et al. Genomic and functional evidence for an ARID1A tumor suppressor role [J]. Genes Chromosomes Cancer, 2007, 46(8): 745-750.doi:10.1002/gcc.20459.
[2] Gui Y. Frequent mutations of chromatin remodeling genes in transitional cell carcinoma of the bladder [J]. Nat Genet, 2011, 43(9): 875-878.doi:10.1038/ng.907.
[3] Guichard C, Amaddeo G, Imbeaud S, et al. Integrated analysis of somatic mutations and focal copy-number changes identifies key genes and pathways in hepatocellular carcinoma [J]. Natu Genet, 2012, 44(6): 694-698.doi:10.1038/ng.2256.
[4] Maeda D, Mao T L, Fukayama M, et al. Clinicopathological Significance of Loss of ARID1A Immunoreactivity in Ovarian Clear Cell Carcinoma [J]. Int J Mol Sc, 2010, 11(12): 5120-5128.doi:10.3390/ijms11125120.
[5] Wang K, Kan J, Yuen S T, et al. Exome sequencing identifies frequent mutation of ARID1A in molecular subtypes of gastric cancer [J]. Nat genetics, 2011, 43(12): 1219-1223.doi:10.1038/ng.982.
[6] Wiegand KC, Shah SP, AL-agha OM, et al. ARID1A mutations in endometriosis-associated ovarian carcinomas [J]. N Engl J Med, 2010, 363(16): 1532-1543.doi:10.1056/NEJMoa1008433.
[7] Liang H, Cheung LW, Li J, et al. Whole-exome sequencing combined with functional genomics reveals novel candidate driver cancer genes in endometrial cancer [J]. Genome R, 2012, 22(11): 2120-2129.doi:10.1101/gr.137596.112.
[8] Guan B, Wang TL, Shih IM. ARID1A, a Factor That Promotes Formation of SWI/SNF-Mediated Chromatin Remodeling, Is a Tumor Suppressor in Gynecologic Cancers [J]. Cancer Res, 2011, 71(21): 6718-6727.doi:10.1158/0008-5472.CAN-11-1562.
[9] GuanB, Gao M, Wu CH, et al. Functional Analysis of In-frame Indel ARID1A Mutations Reveals New Regulatory Mechanisms of Its Tumor Suppressor Functions [J]. Neoplasia, 2012, 14(10): 986-993. doi:10.1593/neo.121218.
[10] Chen L, Wei S, Bi X, et al. Recent advances in the ARID family: focusing on roles in human cancer [J]. Oncotargets Ther, 2014, 7(default): 315-324.doi:10.2147/OTT.S57023.
[11] Kim S, Zhang Z, Upchurch S, et al. Structure and DNA-binding sites of the SWI1 AT-rich interaction domain(ARID)suggest determinants for sequence-specific DNA recognition [J]. J Biol Chem, 2004, 279(16): 16670-16676.doi:10.1074/jbc.M312115200.
[12] Yan HB, Wang XF, Zhang Q, et al. Reduced expression of the chromatin remodeling gene ARID1A enhances gastric cancer cell migration and invasion via downregulation of E-cadherin transcription [J]. Carcinogenesis, 2014, 35(4): 867-876.doi:10.1093/carcin/bgt398.
[13] Shen J, Peng Y, Wei L, et al. ARID1A Deficiency Impairs the DNA Damage Checkpoint and Sensitizes Cells to PARP Inhibitors [J]. Cancer Discovery, 2015, 5(7): 752-767.doi:10.1158/2159-8290.CD-14-0849.
[14] Watanabe R, Uia, Kanno S, et al. SWI/SNF factors required for cellular resistance to DNA damage include ARID1A and ARID1B and show interdependent protein stability [J]. Cancer Res, 2014, 74(9): 2465-2475.doi:10.1158/0008-5472.CAN-13-3608.
[15] Huang J, Deng Q, Wang Q, et al. Exome sequencing of hepatitis B virus-associated hepatocellular carcinoma [J]. Nat Genet, 2012, 44(10): 1117-1121.doi:10.1038/ng.2391.
ConstructionofARID1Agenemutantsandidentificationoftheoverexpressioninhepatocellularcarcinomacells
XiaoHua,LiaoQicheng,WangHaiyan,LiuWeilong,WuChi,HuangJian,LiuJialin
ShenzhenThirdPeople’sHospital,Shenzhen518112,China(XiaoH,WangHY,LiuWL,WuC,HuangJ,LiuJL);GannanMedicalUniversity,Ganzhou341000,China(LiaoQC)
LiuJialin,Email:szliujialin@126.com
ObjectiveTo construct the mutants of ARID1A gene, which is an important component in human chromosomal remodeling complex Switch/Sucrose Non Fermentable (SWI/SNF), and identify their overexpression in liver cancer HepG2 cells.MethodsOverlap PCR was used to construct domain truncated mutantss pcDNA6-ARID1A/ΔARID and pcDNA6-ARID1A/ΔD UF3518 based on wild type plasmids pcDNA6-ARID1A. Lipofectionmethod was used to transfect the wild type and mutants into HepG2. Real-time PCR and western blotting were used to confirm the overexpression of ARID1A and the mutants.ResultsSDS-PAGE and sequencingresult confirmed the successful construction of pcDNA6-ARID1A/ΔARID and pcDNA6-ARID1A/ΔDUF3518. Real-time PCR and western blottingresult confirmed the overexpression of both mRNA and protein of wild type ARID1A and ARID1A/ΔARID. The mRNA levels indicated that ARID1A/Δ DUF3518 were overexpressed, but the protein levels were quite low.ConclusionsFunctional domain truncated mutants of ARID1A were successfully constructed. Overexpression of wild type ARID1A and ARID1A/ΔARID in liver cancer HepG2 cells was successful. Loss of ARID1A/ΔDUF3518 protein suggest that DUF3518 may contribute to the protein structure stability.
ARID1A; Functional domain; Truncated mutation; Overexpression; Liver neoplasms; Cell culture
ARID1A基因;功能域;缺失突变;过表达;肝肿瘤; 细胞培养
2017-08-11)
(本文编辑:马学军)
刘嘉林,Email: szliujialin@126.com
10.3760/cma.j.issn.1003-9279.2017.04.015
深圳市肝胆疾病研究重点实验室项目(ZDSYS201504301534057);深圳市科技计划项目(JCYJ20160427183548637)
Fundprograms: Shenzhen Key Laboratory of Hepatobiliary Diseases(ZDSYS201504301534057);Shenzhen Science and Technology Plan Project(JCYJ20160427183548637)
