HCMV感染致培养脐静脉内皮细胞活化和氧化应激的作用
2017-09-28脱厚珍车晶晶刘磊王佳伟冯子敬陈珺李继梅张拥波王得新
脱厚珍车晶晶刘磊王佳伟冯子敬陈珺李继梅张拥波王得新
100150 北京,首都医科大学附属北京友谊医院神经内科(脱厚珍、车晶晶、冯子敬、陈珺、李继梅、张拥波、王得新);100730北京,首都医科大学附属同仁医院神经内科(刘磊、王佳伟)
·论著·
HCMV感染致培养脐静脉内皮细胞活化和氧化应激的作用
脱厚珍 车晶晶 刘磊 王佳伟 冯子敬 陈珺李继梅 张拥波 王得新
100150 北京,首都医科大学附属北京友谊医院神经内科(脱厚珍、车晶晶、冯子敬、陈珺、李继梅、张拥波、王得新);100730北京,首都医科大学附属同仁医院神经内科(刘磊、王佳伟)
目的初步探讨人巨细胞病毒(HCMV)感染致内皮细胞损伤的机制。方法体外培养人脐静脉内皮细胞(HUVEC),以HCMV AD169株感染HUVEC, 24 h后通过实时定量PCR方法检测细胞粘附分子VCAM-1 mRNA的表达。通过硝酸还原酶法检测细胞培养基中一氧化氮(NO)含量的变化。结果HUVEC感染HCMV后24 h, VCAM-1 mRNA的表达水平较对照组明显增加,两组间差异具有统计学意义(P<0.05)。感染HCMV后0~36 h的不同时间点,感染组细胞培养上清中NO含量均较对照组增加,呈现时间依赖性,各时间点两组间差异均具有统计学意义(P<0.01)。结论HCMV感染可增强内皮细胞氧化应激活动,可能在血管内皮细胞活化损伤过程中起重要作用。。
炎症或感染所致的内皮损伤及血管平滑肌细胞的增殖可能是动脉粥样硬化(Atherosclerosis,AS)发生以及手术后再狭窄的主要原因。既往研究表明,人巨细胞病毒(Human cytomegalovirus, HCMV)感染与AS的发生发展密切相关[1-4]。HCMV感染导致内皮损伤的机制尚不完全清楚。在AS形成和发展中存在强的氧化应激反应,是否HCMV感染可通过增强细胞氧化应激反应促进细胞损伤尚需实验证实。本实验以体外培养的人脐静脉内皮细胞(HUVEC)为研究对象,观察HCMV感染对血管内皮细胞粘附分子的表达和氧化应激的影响,初步探讨HCMV感染致内皮细胞损伤的机制。
1 材料与方法
1.1标本来源人胚胎肺成纤维细胞(Human embryonic lung fibroblasts,HELFs)购自中国协和医科大学基础所细胞资源中心,HCMVAD169株由解放军军事医学科学院野战输血研究所许金波研究员馈赠,按常规方法进行病毒传代、滴定。人脐静脉内皮细胞(Human umbilical vein endothelial cells,HUVECs)购自美国ScienCell公司,按常规方法进行复苏、传代,取4~6代细胞用作实验。
1.2实验分组实验组按100TCID50/ml接种HCMV AD169病毒株于HUVEC,37 ℃吸附1 h,弃上清液,洗涤后,每孔加入ECM维持液(含2%胎牛血清),于感染后1 h、2 h、3 h、4 h、6 h、8 h、10 h、12 h、18 h、24 h、36 h分别收集细胞悬液,在感染24 h时间点,用冷PBS洗涤2次,收集细胞,待提取总RNA。对照组为非感染正常培养细胞。
1.3细胞外NO的检测提取细胞悬液,按照NO检测试剂盒(购自南京建成生物工程研究所)说明,通过硝酸还原酶法检测细胞外NO含量。加入显色剂后,以蒸馏水调零,550 nm,0.5 cm光径测各管吸光光度值。按以下公式计算NO浓度:
1.4实时定量PCR(Real-TimePCR)检测VCAM-1mRNA的表达
1.4.1 细胞总RNA的提取: 向培养板中加入TRIzol试剂(购自美国Invitrogen公司)裂解细胞,用氯仿-异丙醇-乙醇方法提取细胞总RNA,于紫外分光光度计下测定A260/A280,取1 μl RNA在1%的琼脂糖凝胶中电泳,观察RNA是否降解。RNA保存在-80 ℃。
1.4.2 逆转录反应: 用XXXX试剂盒(购自美国Invitrogen公司)进行逆转录反应。取总RNA 2 μg在冰浴中加入Oligo(dT)(500 μg/ml)和2.5 mmol/L dNTP各 1 μl,用DEPC水补充至12 μl。在65 ℃混合5 min后快速至冰浴1 min以上。短暂离心后加入5×First-strand Buffer 4 μl,0.1 mol/L DTT 2 μl,Rnase OutTM 1 μl,轻轻混匀后,42 ℃ 2 min,然后加入SuperScriptTM Ⅱ 1 μl,轻轻混匀,42 ℃反应50 min,70 ℃灭活15 min。逆转录所得cDNA于-20 ℃保存备用。
1.4.3 实时定量PCR:(Real-Time PCR)反应 用XXX试剂盒(购自美国ABI公司)。以3-磷酸甘油醛脱氢酶(GAPDH)为内对照,用相对定量方法计算mRNA量。引物由上海生工生物技术有限公司合成,序列和扩增片段长度见表1。

表1 GAPDH和各目的基因引物序列及扩增产物长度
配制real-time PCR反应体系,20 μl体系包括ABI SYBR Green I MasterMix 10 μl、PCR Forward Primer(10 μmol/L)0.5 μl、PCR Reverse Primer(10 μmol/L)0.5 μl、cDNA溶液5 μl,加DEPC水4 μl至终体积20 μl。用PCR扩增仪(美国ABI 9700)上按照以下条件进行循环:预变性95 ℃ 30 s; PCR反应 VCAM-1 95 ℃ 5 s,60 ℃ 1 min,40个循环;溶解阶段95 ℃ 15 s, 60 ℃ 1 min,95℃15 s确认扩增曲线和溶解曲线,得出相对定量的基因表达图,进行结果分析。配置3%的琼脂糖凝胶,以GelRed作为显色剂,以1∶4比例加入Loading Buffer,电泳条件为140V恒压电泳35 min,紫外灯下观察PCR产物电泳结果。上述实验重复3次以上。
1.5统计学方法采用SPSS16.0进行统计学分析。数据用均数±标准差表示,两组均数的比较采用两独立样本的t检验,各组均数的比较行单因素方差分析(ANOVA),以P<0.05表示差异具有统计学意义,P<0.01表示差异具有统计学意义。
2 结果
2.1HUVEC感染HCMV后VCAM-1mRNA的表达HUVEC感染HCMV后24 h, VCAM-1的表达量显著增加(图1)。感染组和对照组VCAM-1 mRNA的相对表达量分别为:1.634±0.072,1.000±0.102,组间差异均有统计学意义(P<0.01,t检验)。提示HCMV感染可上调内皮细胞粘附分子表达,导致内皮细胞活化。

图1 HUVEC感染HCMV24 h后VCAM-1 mRNA的表达情况(aP<0.01)Fig.1 The expression of VCAM-1 mRNA 24 h after HCMV infection(aP<0.01)
2.2HUVEC感染HCMV后细胞外NO产生情况在HUVEC感染HCMV后1~36 h不同时间点,感染组内皮细胞外NO产生量均较对照组增加,且呈现时间依赖性(表2,图2)。提示HCMV感染可以使内皮细胞外NO产生增加,氧化应激活动增强。

表2 HCMV感染后不同时点,HUVEC细胞NO产生情况
注:与对照组相比,aP<0.01
Notes:Compared with Control Group,aP<0.01
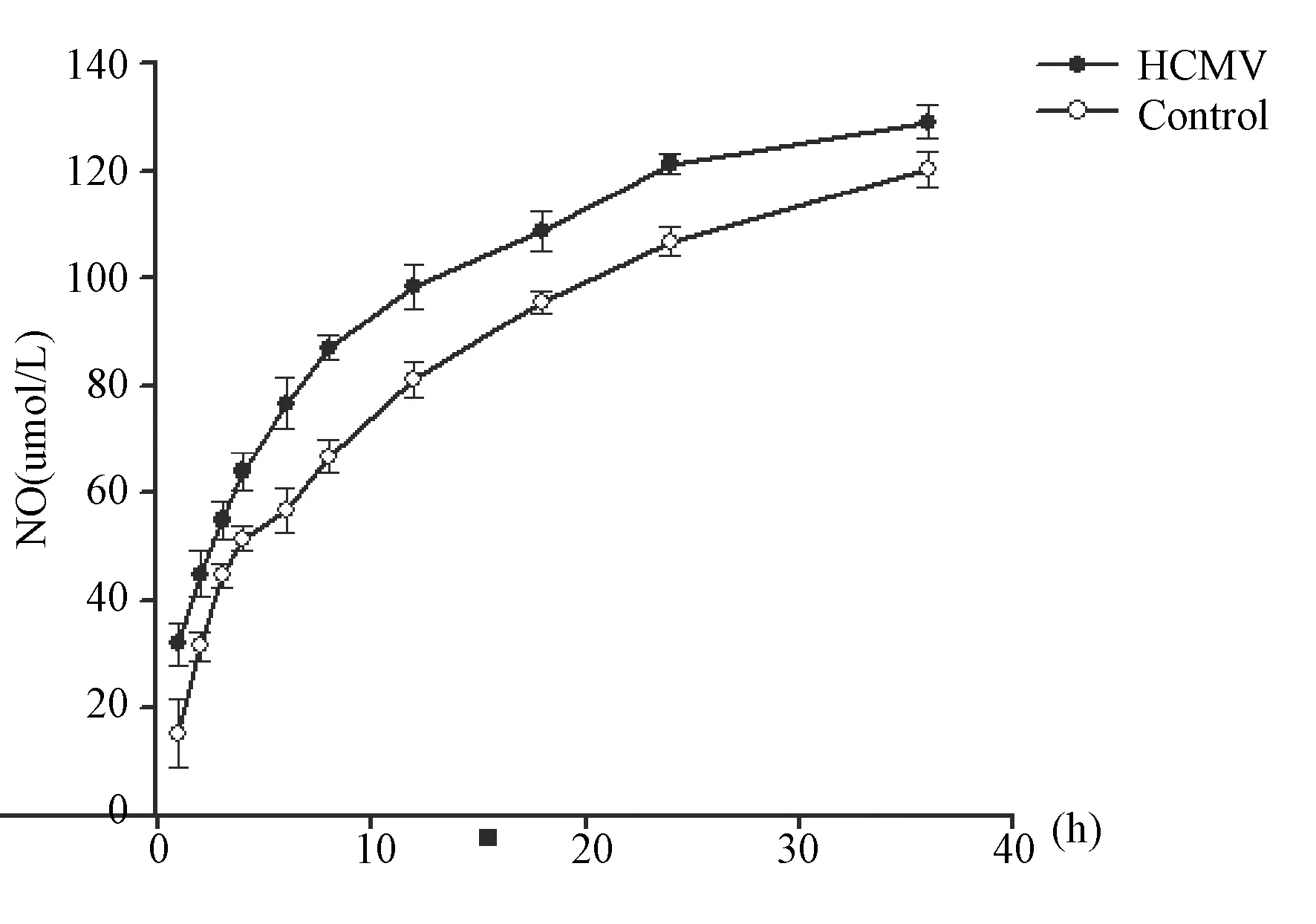
图2 HCMV感染HUVEC后不同时点细胞NO产生情况Fig.2 NO formation after HCMV infetction
3 讨论
近年来,以动脉粥样硬化(AS)为基础的心脑血管疾病的发生率和死亡率逐年上升,炎症和感染对AS的形成起了重要作用。HCMV感染在AS发生发展中的作用已得到广泛认可[1]。研究发现,粘附分子表达增加,血管内皮细胞活化,可促使血管内皮细胞与单核细胞、淋巴细胞等炎症细胞粘附,并分泌多种细胞因子,导致内皮细胞受损,从而启动AS的发生。本研究采用实时定量PCR方法检测HCMV感染HUVEC 24 h后VCAM-1基因表达情况,发现感染组VCAM-1的mRNA表达量较对照组显著上调,提示HCMV感染可导致血管内皮细胞活化。程敏等[5]研究也发现,HCMV感染能上调内皮细胞表面ICAM-1的表达。Ghielmetti等[6]在研究异体移植排斥反应时,用HCMV感染猪内皮细胞,结果发现,HCMV感染可上调猪内皮细胞VCAM-1的表达。本研究结果与文献报道一致[7]。
HCMV感染导致血管内皮细胞活化,并进一步导致内皮损伤的机制目前众说纷纭,易立等[4]发现,APOE-/-小鼠感染CMV病毒后,可加速其颈动脉粥样硬化斑块形成,其他文献报道氧化应激机制可能在其中起重要作用[8-12]。研究发现,HCMV感染可引起血管内皮细胞粘附分子表达增加,从而启动AS的发生,而活性氧(ROS)是核因子NF-κB特异型途径的共同上游信号信使,其生成水平增加能激活NF-κB;ROS在体内或细胞内蓄积导致的脂质氧化是AS病变形成早期最显著的病变。导致ROS生成增加的因素,也可引起血管内皮粘附分子表达增加,导致细胞活化,内皮损伤。 ROS包括超氧阴离子(O2-)、过氧化氢(H2O2)、羟自由基(OH)、一氧化氮(NO)等。本研究发现HCMV感染HUVEC后导致内皮细胞外NO生成增加,并且呈现出时间依赖性。 HCMV感染可同时增加VCAM-1 mRNA表达和NO生成的结果提示HCMV感染可增强内皮细胞氧化应激活动,可能在血管内皮细胞活化损伤过程中起重要作用[13-14]。
本实验初步从细胞水平探讨了HCMV感染对内皮细胞损伤的作用并对可能存在的氧化应激机制进行了初步探讨。但HCMV感染是先上调血管内皮细胞细胞损伤并进一步激活氧化应激,抑或HCMV通过激活氧化应激活动导致内皮细胞活化损伤,尚需今后深入研究。
[1] Fabricant CG, Fabricant J, Litrenta MM,et al. Virus-induced atherosclerosis[J]. J Exp Med, 1978, 148(1):335-340.
[2] 易立, 脱厚珍, 赵日光,等.巨细胞病毒感染加重载脂蛋白E基因敲除小鼠动脉粥样硬化[J]. 首都医科大学学报, 2010,31(2):160-165. doi:10.3969/j.issn.1006-7795.2010.02.003.
[3] Sorlie PD,Adam E,Melnick SL,et al. Cytomegalovirus/Herpesvirus and carotid atherosclerosis; The ARIC study[J]. J Med Virol,1994,42(1):33-37.
[4] 易立, 王得新, 赵伟秦,等. 颅内动脉粥样硬化血管壁中人巨细胞病毒即刻早期基因的表达[J].中华实验和临床病毒学杂志,2004,18(1):66-68. doi: 10.3760/cma.j.issn.1003-9279.2004.01.017.
[5] 程敏,闻良珍,凌霞珍,等, 人巨细胞病毒感染对脐静脉内皮细胞粘附分子和核转录因子表达的影响[J]. 中华微生物学和免疫学杂志, 2003,23(7):502-506. doi: 10.3760/j:issn:0254-5101.2003.07.003.
[6] Ghielmetti M, Millard AL, Haeberli L, et al. Human CMV infection of porcine endothelial cells increases adhesion receptor expression and human leukocyte recruitment[J]. Transplantation, 2009,87(12):1792-800. doi: 10.1097/TP.0b013e3181a75a41.
[7] MacManiman JD, Meuser A, Botto S, et al. Human cytomegalovirus-encoded pUL7 is a novel CEACAM1-like molecule responsible for promotion of angiogenesis[J]. MBio, 2014, 5(6):e02035. doi: 10.1128/mBio.02035-14.
[8] Eisele PS, Salatino S, Sobek J, et al.The peroxisome proliferator-activated receptor γ coactivator 1α/β (PGC-1) coactivators repress the transcriptional activity of NF-κB in skeletal muscle cells[J]. J Biol Chem, 2013, 288(4): 2246-2260. doi: 10.1074/jbc.M112.375253.
[9] Lee WJ, Ou HC, Hsu WC, et al. Ellagic acid inhibits oxidized LDL-mediated LOX-1 expression, ROS generation, and inflammation in human endothelial cells[J]. J Vasc Surg, 2010,52(5):1290-1300. doi: 10.1016/j.jvs.2010.04.085.
[10] Eisele PS, Salatino S, Sobek J, et al.The peroxisome proliferator-activated receptor γ coactivator 1α/β (PGC-1) coactivators repress the transcriptional activity of NF-κB in skeletal muscle cells[J]. J Biol Chem, 2013, 288(4): 2246-2260. doi: 10.1074/jbc.M112.375253.
[11] 易立,赵日光,脱厚珍等. 氟伐他汀对巨细胞病毒感染所致的血管重塑的影响[J]. 中华实验和临床病毒学杂志, 2014, 28(3):194-196.doi: 10.3760/cma.j.issn.1003-9270.2014.03.
[12] Jia YJ, Liu J, Han FF, et al. Cytomegalovirus infection and atherosclerosis risk: a meta-analysis[J]. J Med Virol. 2017. doi: 10.1002/jmv.24858. [Epub ahead of print]
[13] Singh KK, Shukla PC, Quan A, et al. BRCA1 is a novel target to improve endothelial dysfunction and retardatherosclerosis[J]. J Thorac Cardiovasc Surg, 2013,146(4):949-960.e4. doi: 10.1016/j.jtcvs.2012.12.064.
[14] Lee YL, Liu CE, Cho WL, et al. Presence of cytomegalovirus DNA in leucocytes is associated with increased oxidative stress and subclinical atherosclerosis in healthy adults[J]. Biomarkers, 2014, 19(2):109-113. doi: 10.3109/1354750X.2013.877967..
RoleofHCMVinfectionintheactivationandoxidativestressofculturedhumanumbilicalveinendothelialcells
TuoHouzhen,CheJingjing,LiuLei,WangJiawei,FengZijing,ChenJun,LiJimei,ZhangYongbo,WangDexin
DepartmentofNeurology,BeijingFriendshipHospital,CapitalMedicalUniversity,Beijing100050,China. (TuoHZ,CheJJ,FengZJ,ChenJ,LiJM,ZhangYB,WangDX);DepartmentofNeurology,TongrenHospital,CapitalMedicalUniversity,Beijing100730,China.(LiuL,WangJW)
TuoHouzhen,Email:tuohzh@sina.cn
ObjectiveTo investigate the role of the activation and oxidative stress of cultured human umbilical vein endothelial cells (HUVEC) after HCMV infection.MethodsHUVECs were divided into four groups: control, HCMV(+), after HCMV AD169 infection, and the supernatant of the culture was extracted, and the cells were lysed. The levels of vascular cellular adhesion molecule-1 (VCAM-1) in HUVEC were measured by real-time PCR. And the content of nitrogen monoxide (NO) of the supernatant was detected by nitrate reductasemethod accordingly.ResultsTwenty-four hours after infection, the mRNA expression of VCAM-1 in HUVECs of HCMV infected group increased obviously compared to control, and NO quantity increased accordingly and time-dependently. There was significant difference between groups(P<0.01).ConclusionsHCMV increases the mRNA expression of VCAM-1 and quantity of NO, which may contribute to the formation of AS.
Atherosclerosis; Cytomegalovirus; Vascular cellular adhesion molecule-1; HUVECs; Oxidative stress
动脉粥样硬化;巨细胞病毒;脐静脉内皮细胞;血管内皮粘附分子-1;氧化应激
2017-05-12)
(本文编辑:陈培莉)
脱厚珍,Email:tuohzh@sina.cn
10.3760/cma.j.issn.1003-9279.2017.04.005
国家自然科学基金(30772287、81241039); 北京市科技新星计划(2005B42)
Fundprograms: National Natural Science Foundation(30772287,81241039); Beijing New-Star Plan of Science and Technology(2005B42)
