Beclin 1和MAP1-LC3在家兔激素性股骨头缺血坏死中表达的实验研究
2017-09-27王文选赵振群刘万林白锐
王文选,赵振群,刘万林*,白锐
(1.内蒙古医科大学第二附属医院手足显微外科,内蒙古 呼和浩特 010030;2.内蒙古医科大学第二附属医院小儿骨科,内蒙古 呼和浩特 010030)
实验研究
Beclin 1和MAP1-LC3在家兔激素性股骨头缺血坏死中表达的实验研究
王文选1,赵振群2,刘万林2*,白锐2
(1.内蒙古医科大学第二附属医院手足显微外科,内蒙古 呼和浩特 010030;2.内蒙古医科大学第二附属医院小儿骨科,内蒙古 呼和浩特 010030)
目的观察家兔激素性股骨头缺血坏死模型中自噬相关基因Beclin 1和微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,MAP1-LC3)的表达情况,探讨自噬在激素性股骨头缺血坏死中的作用。方法成年日本大耳白兔40只,随机分为实验组(n=28)与对照组(n=12)。实验组肌肉注射甲基强的松龙7.5 mg/kg,2次/周,共8周;对照组肌肉注射生理盐水2 mL/只,2次/周,共8周。8周后处死家兔,取双侧股骨头。左侧股骨头制成普通病理切片后进行HE染色,用免疫组化法检测Beclin 1和MAP1-LC3的表达;右侧股骨头迅速置于液氮中保存,蛋白提取后,采用Western blot方法检测股骨头中Beclin 1及MAP1-LC3蛋白的表达。结果HE染色显示家兔激素性股骨头坏死模型制造成功。免疫组化:实验组Beclin 1和MAP1-LC3的阳性率分别为96.43%、92.86%,明显高于对照组16.67%、8.33%,差异具有统计学意义(P<0.05)。Western blot检测:实验组与对照组比较Beclin 1及MAP1-LC3蛋白表达增高,差异具有统计学意义(P<0.05)。结论肾上腺皮质激素造成的家兔早期股骨头缺血坏死模型中,自噬基因Beclin 1和MAP1-LC3的表达增高,表明自噬参与了激素性股骨头缺血坏死的发病。
糖皮质激素;骨坏死;自噬;Beclin 1;微管相关蛋白1轻链3
激素性股骨头缺血坏死(steroid-induced avascular necrosis of femoral head,SANFH)是指因长期或短期大量使用肾上腺皮质激素(以下简称激素)后造成股骨头活性成分死亡所引起的病理过程。SANFH占非创伤性股骨头缺血坏死病因的首位。关于SANFH的发病机制已有多种假说,包括:骨内压增高、骨的灌注下降、脂肪栓塞、高凝状态等[1]。近年来,国内外学者把焦点集中于Ⅰ型程序性细胞死亡-细胞凋亡在SANFH中的作用的研究[2-3],研究表明细胞凋亡参与了SANFH的发病[4-9]。
自噬现象最早是Ashford和Porten于1962年在肝细胞中观察到的,他们将高血糖素加入鼠的肝灌流液中,结果在电镜下发现肝细胞的溶酶体增多并发生自食现象,De Duve将该现象命名为“autophagy(自噬)”。自噬是机体选择性降解细胞内成分的基本过程,当细胞遭受应激时,自噬可维持细胞的存活,但是当这种应激超过一定水平时,自噬还可导致非凋亡形式的自噬性程序性细胞死亡,因其有别于凋亡而被称为Ⅱ型程序性细胞死亡[10]。已有研究表明,激素既可以诱导骨细胞发生凋亡又可以诱导骨细胞发生自噬[11-12],但研究只是局限于激素导致的骨质疏松模型中以及经激素刺激体外培养的骨细胞中。国内外未见到在SANFH模型中研究自噬表达的相关报道。研究表明自噬基因Beclin 1可以调节自噬活性[13],微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,MAP1-LC3)作为自噬的标志性分子,已经被广泛应用于自噬活性的检测。因此,本实验通过检测家兔SANFH模型的股骨头组织中Beclin 1及MAP1-LC3的表达,探讨自噬在SANFH中的作用,从而可能为治疗SANFH提供新的分子靶标。
1 资料与方法
1.1 实验动物及分组 成年日本大耳白兔(北京富豪动物养殖中心提供,合格证编号:20100137)40只,体重为(2.32+0.14)kg,随机分为实验组(n=28)与对照组(n=12),雌雄不限。实验组肌肉注射甲基强的松龙7.5 mg/kg,2次/周,共8周;对照组肌肉注射生理盐水2 mL/只,2次/周,共8周。8周后用空气栓塞法处死两组家兔,取双侧股骨头,沿冠状面剖开。左侧股骨头置于4%多聚甲醛溶液固定24 h,右侧股骨头立即置于液氮中保存。
1.2 实验方法
1.2.1 微波脱钙 将左侧股骨头组织放入小烧杯内,加入10%乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)脱钙液,以微波2档(温度为40~60℃)间歇脱钙,每次辐射1 min,每次辐射之间都将烧杯移至室温冷却15 min,并更换新液。脱钙时间为1 min/次,20次/d,共7 d;以大头针能够刺进骨密质为完成脱钙标准。
1.2.2 组织形态学观察 左侧股骨头经4%多聚甲醛溶液固定24 h后,在10%EDTA脱钙液中微波脱钙7 d,梯度乙醇脱水,石蜡包埋,制成厚5 μm切片。取左侧一半股骨头做常规HE染色,待中性树胶封片后将上述切片分别置于100倍及400倍光镜下观察组织病理学改变;左侧另一半股骨头用作免疫组化实验。
1.2.3 免疫组化方法检测股骨头Beclin 1及MAP1-LC3的表达 采用SABC法,滴加兔抗兔Beclin 1多克隆抗体和兔抗兔MAP1-LC3多克隆抗体,20℃放置2 h,滴加辣根过氧化酶标记的山羊抗兔IgG,37℃放置20 min,使用二氨基联苯胺(diaminobenzidine,DAB)显色试剂盒(AR1022)显色,磷酸盐缓冲液(phosphate buffered solution,PBS)代一抗作阴性对照,苏木素复染,梯度酒精中脱水、透明,中性树胶封片后在显微镜下观察。股骨头组织免疫组化结果的分析:所有组织切片均采用盲法由两位病理科医生独立阅片,以胞浆内或细胞膜上出现棕黄色颗粒为阳性细胞。随机观察10个高倍镜视野,每个视野计数50个细胞。根据阳性细胞的比率和染色深度分别进行评估,最后综合评定。
1.3 Western blot检测股骨头骨组织中Beclin 1和MAP1-LC3蛋白的表达水平 将右侧股骨头电子天平迅速称重,于液氮中研碎后加入细胞裂解液冰上裂解30 min,收集到的上清即为总蛋白,然后用二辛可宁酸(bicinchonininc acid,BCA)法测定蛋白浓度。总蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE),然后电转移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜,用浓度5%的脱脂奶粉室温封闭2 h,三羟甲基氨基甲烷盐酸盐吐温缓冲液(tris-buffered saline with tween,TBST)洗膜后分别加入兔抗兔Beclin 1多克隆抗体和兔抗兔MAP1-LC3多克隆抗体,4℃孵育过夜,加入含有山羊抗兔二抗(1︰500)孵育2 h。经电化学发光(electro-chemi-luminescence,ECL)显色,X线片放射自显影,扫描,照片。用凝胶图像扫描系统对显影胶片进行吸光度的扫描。用ImageJ 2x软件分析各条条带的灰度值,然后将目的蛋白灰度值与内参β-actin的灰度值进行比较,根据条带的相对灰度值进行统计学分析,实验结果重复3次以上。
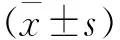
2 实验结果
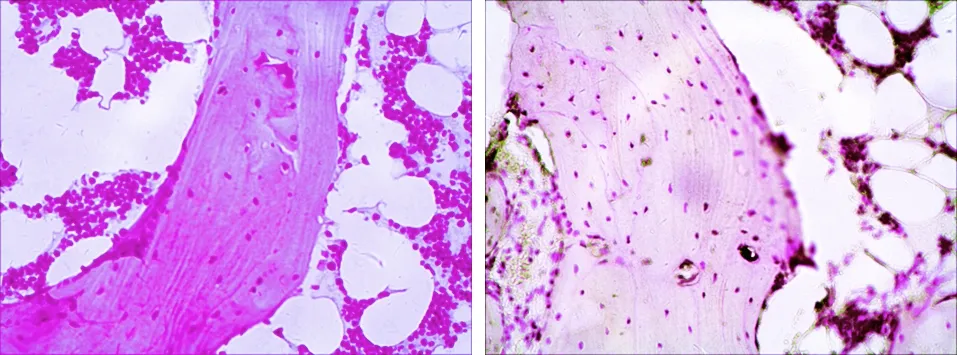
2.1 组织学观察 对照组(见图1a、1c):骨小梁结构清晰完整,粗大且排列规则,髓腔中脂肪细胞较少,造血细胞丰富,空骨陷窝少见;实验组(见图1b、1d):骨小梁稀疏变细、甚至断裂,髓腔中脂肪细胞增多、肥大,造血细胞数量减少,空骨陷窝数量明显多于对照组。家兔股骨头组织病理学改变显示,SANFH模型制造成功。
2.2 免疫组化结果 细胞浆或者细胞膜内出现黄色或棕黄色颗粒即为Beclin 1和MAP1-LC3阳性细胞(见图2~3)。Beclin 1在实验组中表达的阳性率为96.43%,而在对照组中表达的阳性率为16.67%;MAP1-LC3在实验组中表达的阳性率为92.86%,而在对照组织中表达的阳性率为8.33%(见表1)。Beclin 1和MAP1-LC3在实验组中的表达均较对照组高,差异有统计学意义(P<0.05)。
2.3 Western blot检测 采用Western blot法检测股骨头骨组织中Beclin 1和MAP1-LC3蛋白的表达水平,根据目的蛋白分子量大小,在相应位置出现目的条带(见图4)。结果显示以β-actin做内参,Beclin 1和MAP1-LC3蛋白在实验组的相对灰度值分别为(1.604 7±0.007 0)、(2.582 0±0.005 7),高于对照组中的相对灰度值(0.792 1±0.006 2)、(0.989 4±0.003 6),差异有统计学意义(t值分别为194.641、526.210,P<0.05)。表明Beclin 1和MAP1-LC3蛋白在实验组中的表达较对照组增高。
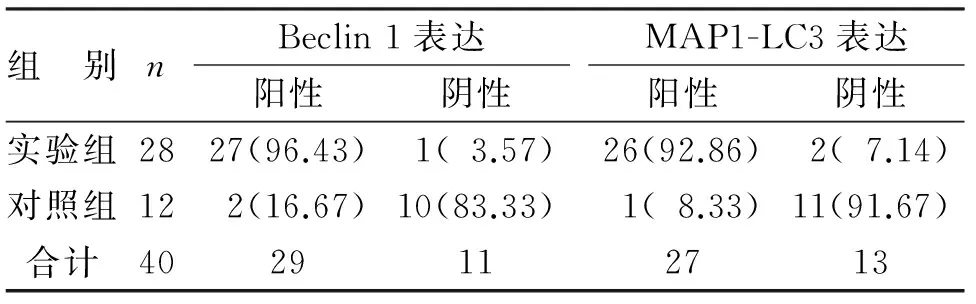
表1 Beclin 1和MAP1-LC3实验组与对照组中的表达(例,%)
3 讨 论
自噬是依赖溶酶体的细胞器或细胞质成分的降解途径,是细胞通过降解自身成分以维持内环境稳定的基本过程[14]。自噬可被多种形式的细胞应激所激活,其中包括:营养物质缺乏、激素、缺氧、活性氧、脱氧核糖核酸(deoxyribonucleic acid,DNA)损伤、蛋白质聚集体、损伤的细胞器或细胞内的病原体等。当细胞遭受以上这些应激时,自噬过程被激活,试图去维持细胞存活[15]。自噬过程一旦启动,部分胞浆和胞质内的细胞器进入自噬泡中,最终进入溶酶体内大量的降解[16]。在代谢应激时,自噬提供腺嘌呤核苷三磷酸(adenosine triphosphate,ATP)或其他的大分子作为能量资源增加细胞存活能力,但是当代谢应激的强度过大或持续时间过长时,细胞可能会发生自噬性程序性细胞死亡[17]。自噬作用就像一把“双刃剑”,在已有的研究中,既有自噬促进细胞存活的报道又有其导致细胞死亡的报道[18-19],这依赖于细胞的种类和应激的水平及持续时间。无论在细胞还是动物实验中,MAP1-LC3Ⅱ结构均是公认的自噬体膜存在的标记物[20]。研究表明,MAP1-LC3Ⅱ在细胞中的含量或MAP1-LC3Ⅱ/MAP1-LC3Ⅰ的比例和自噬泡的数目呈正相关[21]。本实验分别采用免疫组化和Western blot两种方法检测家兔SANFH模型中MAP1-LC3的表达。在免疫组化结果中显示SANFH模型中MAP1-LC3表达的阳性率较对照组增高;Western blot结果同样证明SANFH模型中MAP1-LC3Ⅱ蛋白含量较对照组增高。实验结果显示SANFH模型中自噬的表达增高,表明自噬参与了SANFH的发病。
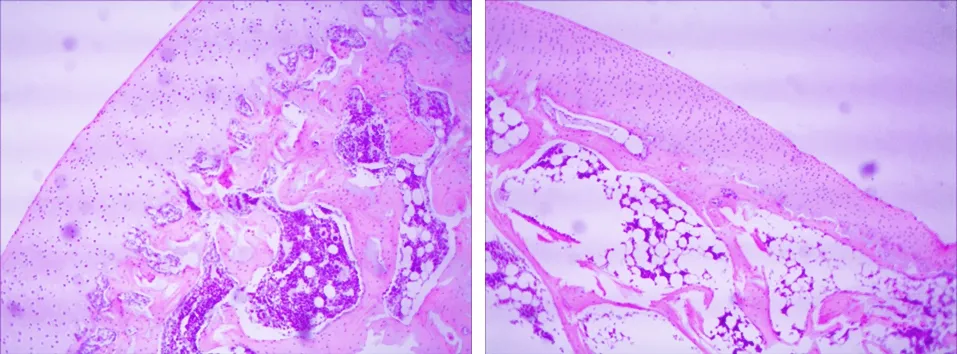
a 对照组(×100) b 实验组(×100)
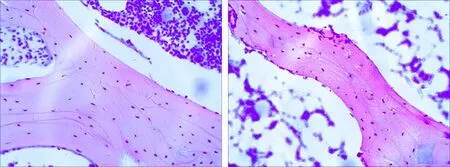
c 对照组(×400) d 实验组(×400)
a 对照组(×400) b 实验组(×400)
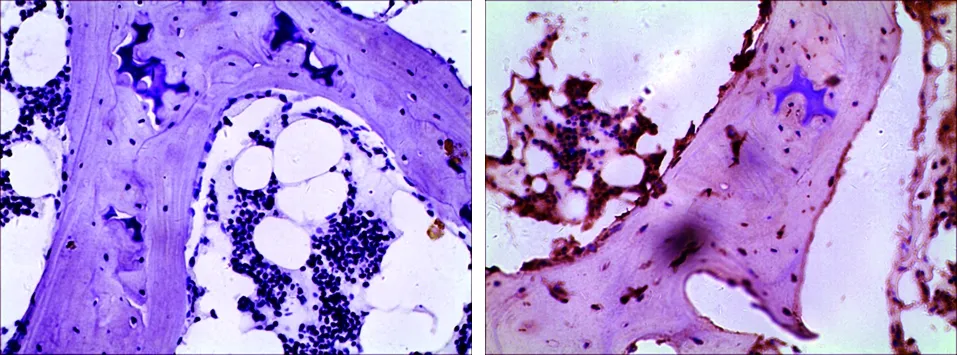
a 对照组(×400) b 实验组(×400)
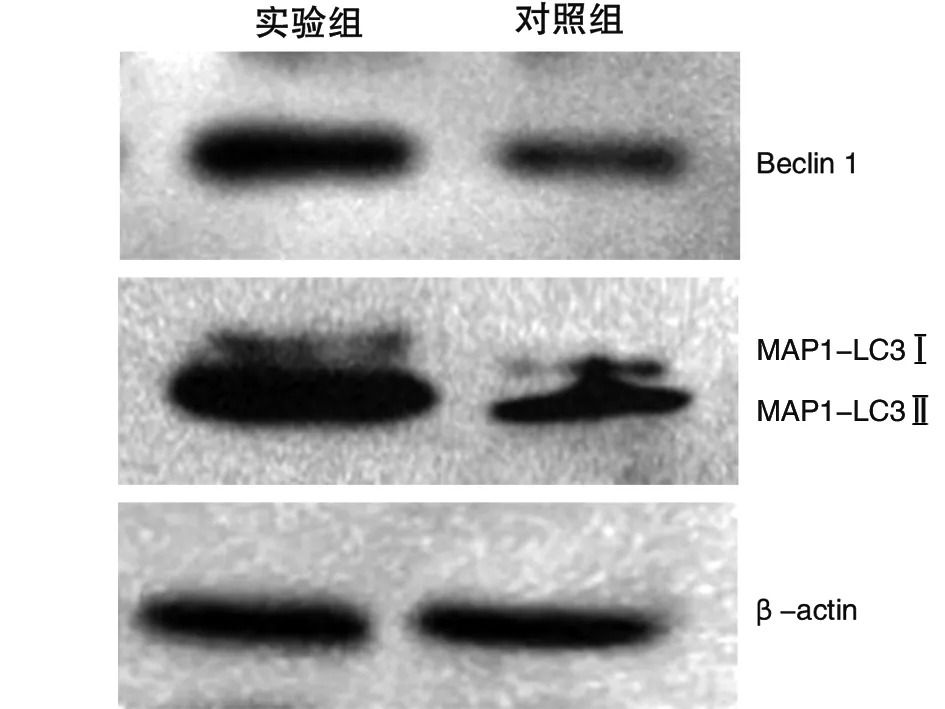
图4 Western blot结果
研究表明,激素可同时诱导骨细胞发生细胞凋亡和自噬[11,22],骨细胞的命运与激素的剂量有关,较低剂量的激素激活自噬,而高剂量的激素则增强凋亡。Jia等[22]用泼尼松龙缓释剂埋置在雄性Swiss-Webster小鼠皮下,按缓释剂类型分为低、中、高剂量组,28 d后观察到低剂量GC组的小鼠与安慰剂组的小鼠相比较,在股骨远端的皮质骨区域中骨细胞自噬明显增加,而在高剂量组的皮质骨中观察到骨细胞凋亡明显增加。Xia等[11]用内源性蛋白降解抑制剂3-甲基腺嘌呤(3-methyl adenine,3-MA)抑制骨细胞的自噬过程,可以观察到骨细胞死亡数量的增加。由此认为,在持续时间短的或缓和的应激条件下,自噬很可能作为一种保护性机制对抗细胞的死亡;在持续时间较长的或者激烈的应激条件下,细胞内可产生大量的自噬体,这些自噬体的堆积可导致细胞发生死亡。但以上实验只是以骨质疏松为模型和体外培养骨细胞来研究探讨自噬过程,国内外尚未见关于自噬在SANFH中表达的相关报道。所以本实验使用肾上腺皮质激素造成家兔早期SANFH模型,通过检测股骨头中自噬标记物MAP1-LC3的表达来观察自噬在SANFH中的表达情况,实验检测到实验组中MAP1-LC3的表达均较对照组增高,表明早期SANFH中存在细胞凋亡和自噬的增强。由此我们推测:当GC剂量较低或疗程较短时,自噬过程被激活,可成功的使受损的骨细胞得以存活,不容易导致SANFH发生;然而当GC使用时间增加和剂量增大时,自噬过程减弱,甚至会发生自噬性程序性细胞死亡,骨细胞存活能力降低,加之细胞凋亡的增加,致使SANFH发生或进一步发展。Almonte-Becerril等[23]在骨关节炎实验模型的研究中证实:在骨关节炎早期软骨细胞自噬活性增高,作为一种适应性反应去避免软骨细胞死亡,而到骨关节炎晚期阶段,细胞自噬和细胞凋亡可共同导致软骨细胞死亡的增加,最终导致疾病的加重,这一结论与我们的推断相一致。
Beclin 1基因是酵母自噬相关基因6在哺乳动物中的同源物。Liang等[24]于1998年在致死性Sinbis病毒性脑炎的大鼠模型中发现一种分子量大小为60 kd的蛋白质,并将编码这种蛋白的基因命名为Beclin 1,同时证实在哺乳动物的细胞中通过上调Beclin 1基因的表达可以刺激自噬的发生。Aita等[25]于1999年发现编码这种蛋白的基因Beclin 1位于人类17q21染色体上,并成功的克隆了Beclin 1基因,发现Beclin 1基因与酵母的自噬基因atg6/vps30有高度的同源性。Beclin 1对自噬蛋白在前自噬体结构的定位上起到关键性作用,这一过程依赖于Beclin 1与磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3-K)的相互作用,他们共同形成Beclin 1-Vps34-Vps15复合物而进一步调节自噬活性[26]。研究表明:B淋巴细胞瘤-2基因(B-cell lymphoma-2,bcl-2)可与Beclin l结合而抑制自噬的活性,因Beclin 1可与Bcl-2家族中抑制凋亡的蛋白相结合,而不能和促进凋亡的蛋白相结合。在研究Beclin 1分子结构时发现,Beclin 1蛋白具有Bcl-2家族中促凋亡蛋白共有的Bcl-2同源结构域3(Bcl-2 homology domain 3,BH3)结构[27],因此认为Beclin l可能同时参与自噬与凋亡的调节。实验同样采用免疫组化和Western blot两种方法对SANFH模型中Beclin 1的表达进行检测,结果显示两种方法测得的Beclin 1的表达均较对照组增高,证明Beclin 1基因参与了SANFH的发病。然而,Beclin 1基因是如何调节细胞凋亡及自噬在SANFH各阶段中的表达,以及细胞凋亡及自噬在SANFH整个病理过程中的相互作用有待更进一步研究。
综上所述,本研究通过在家兔SANFH模型股骨头中检测Beclin 1和MAP1-LC3的表达,结果证实自噬参与了SANFH的发病,Beclin 1通过调节自噬的表达进而调节SANFH的发病进程。本实验未能在激素性股骨头坏死造模过程中的各个时间点检测Beclin 1和MAP1-LC3的表达,未能够在同一时间点比较细胞凋亡与自噬在SANFH发病过程中的表达,从而不能详细了解自噬及Beclin 1在SANFH发病过程中的每个阶段的作用,以及细胞凋亡及自噬在这一疾病中的相互作用。深入探讨Beclin 1参与SANFH发生发展的分子病理机制,尤其是在细胞自噬和凋亡中的作用,有助于明确SANFH生物学行为及发病机理,有望为SANFH的临床治疗提供新的分子靶标。
[1]Drescher W,Schlieper G,Floege J,et al.Steroid-related osteonecrosis——an update[J].Nephrol Dial Transplant,2011,26(9):2728-2731.
[2]Youm YS,Lee SY,Lee SH.Apoptosis in the osteonecrosis of the femoral head[J].Clin Orthop Surg,2010,2(4):250-255.
[3]韦露,罗高斌,李巍,等.微小RNA-206及其靶基因间隙连接蛋白43基因在激素性股骨头坏死中的作用 [J].中华实验外科杂志,2015,32(7):1582-1585.
[4]Jia YB,Jiang DM,Ren YZ,et al.Inhibitory effects of vitamin E on osteocyte apoptosis and DNA oxidative damage in bone marrow hemopoietic cells at early stage of steroid-induced femoral head necrosis[J].Mol Med Rep,2017,15(4):1585-1592.
[5]Bai R,Liu W,Zhao A,et al.Nitric oxide content and apoptosis rate in steroid-induced avascular necrosis of the femoralhead[J].Exp Ther Med,2015,10(2):591-597.
[6]Wu J,Yao L,Wang B,et al.Tao-Hong-Si-Wu Decoction ameliorates steroid-induced avascular necrosis of the femoral head by regulating the HIF-1α pathway and cell apoptosis[J].Biosci Trends,2016,10(5):410-417.
[7]贾岩波,刘万林,任逸众.维生素E干预激素性股骨头坏死早期细胞凋亡的研究[J].中华实验外科杂志,2014,31(2):375-377.
[8]赵振群,刘万林,龚瑜林,等.骨髓造血细胞DNA氧化损伤与骨细胞凋亡在早期激素性股骨头坏死中的表现[J].中国组织工程研究,2015,19(11):1652-1657.
[9]赵振群,张志峰,刘万林,等.激素性股骨头坏死过程中低氧诱导因子1 a与骨细胞凋亡[J].中国组织工程研究,2015,19(51):8201-8207.
[10]Rabinowitz JD,White E.Autophagy and metabolism[J].Science,2010,330(6009):1344-1348.
[11]Xia X,Kar R,Gluhak-Heinrich J,et al.Glucocorticoid -Induced Autophagy in Osteocytes[J].J Bone Miner Res,2010,25(11):2479-2488.
[12]Kitajima M,Shigematsu M,Ogawa K,et al.Effects of glucocorticoid on adip-ocyte size in human bone marrow[J].Med Mol Morphol,2007,40(3):150-156.
[13]Weh KM,Howell AB,Kresty LA.Expression,modulation,and clinical correlates of the autophagy protein Beclin-1 in esophageal adenocarcinoma[J].Mol Carcinog,2016,55(11):1876-1885.
[14]Kroemer G,Mario G,Levine B,et al.Autophagy and the integrated stress response[J].Mol Cell,2010,40(2):280-293.
[15]Martinet W,Agostinis P,Vanhoecke B,et al.Autophagy in disease:a double-edged sword with therapeutic potential[J].Clin Sci (Lond),2009,116(9):697-712.
[16]Mizushima N,Levine B,Cuervo AM,et al.Autophagy fights disease through cellular self-digestion[J].Nature,2008,451(7182):1069-1075.
[17]Kepp O,Galluzzi M,Lipinski J,et al.Cell death assays for drug discovery[J].Nature Reviews Drug Discovery,2011,10(3):221-237.
[18]Gurusamy N,Das DK.Is autophagy a double-edged sword for the heart?[J].Acta Physiol Hung,2009,96(3):267-276.
[19]Tsujimoto Y,Shimizu S.Another way to die:autophagic programmed cell death[J].Cell Death Differentiation,2005,12(2):1528-1534.
[20]TanakaY,Kume S,Kitada M,et al.Autophagy as a therapeutic target in diabetic nephropathy[J].Exp Diabetes Res,2012(2012):628978.
[21]Kabeya Y,Mizushima N,Ueno T,et al.LC3,a mammalian homologue of yeast Apg8p,is localized in autophagosome mernbranes after processing[J].EMBO J,2000,19(21):5720-5728.
[22]Jia J,Yao W,Guan M,et al.Glucocorticoid dose determines osteocyte cell fate[J].FASEB J,2011,25(10):3366-3376.
[23]Almonte-Becerril M,Navarro-Garcia F,Gonzalez-Robles A,et al.Cell death of chondrocytes is a combination between apoptosis and autophagy during the pathogenesis of osteoarthritis within an experimental model[J].Apoptosis,2010,15(5):631-638.
[24]Liang XH,Jackson S,Seaman M,et al.Induction of autophagy and inhibition of tumorigenesis by Beclin 1[J].Nature,1999,402(6762):672-676.
[25]Aita VM,Liang XH,Murty VV,et al.Cloning and genomic organization of Beclin 1,a candidate tumo suppressor gene on chromosome 17q21[J].Genomics,1999,59(1):59-65.
[26]He C,Levine B.The Beclin 1 interactome[J].Curr Opin Cell Biol,2010,22(2):140-149.
[27]Feng W,Huang S,Wu H,et al.Molecular basis of Bcl-xL’s target recognition versatility revealed by the structure of Bcl-xL in complex with the BH3 domain of Beclin-1[J].J Moi Biol,2007,372(1):223-235.
AnExperimentalStudyontheExpressionofBeclin1andMAP1-LC3inAvascularNecrosisoftheFemoralHeadInducedbyGlucocorticoids
Wang Wenxuan1,Zhao Zhenqun2,Liu Wanlin2,et al
(1.Department of Hand and Foot Surgery,Second Affiliated Hospital of Inner Mongolia Medical University,Hohhot 010030,China;2.Department of Pediatric Orthopedics,Second Affiliated Hospital of Inner Mongolia Medical University,Hohhot 010030,China)
ObjectiveTo investigate the expression of autophagy-related gene Beclin 1 and microtubule-associated protein 1 light chain 3(MAP1-LC3)in avascular necrosis of the femoral head model induced by glucocorticoids,and explore the role of autophagy in avascular necrosis of the femoral head model induced by glucocorticoids.MethodsForty mature Japanese rabbits were randomly divided into experimental group(n=28)and control group(n= 12).The experimental group was given an intramscular injection of 7.5 mg/kg of methylprednisolone twice per week for 8 weeks in all;the control group was given equal isotonic Na chloride.Rabbits of each group were killed at the 8th week respectively,and the hibateral heads of femur were taken out.The left heads of femur were made into general sections,dyed by HE.The expression of Beclin-1 and MAP1-LC3 were detected by immunohistochemical method.The right heads of femur were put into liquid nitrogen quickly,protein were extracted from bone tissue,right head of femur was detected the protein expression of Beclin 1 and MAP1-LC3 by Western blot.ResultsHematoxylin and eosin stain showed the successfuluccessful production of steroid induced avascular necrosis of the femoral head in rabbits.The expression of Beclin l and MAPI-LC3 in the experimental group were 96.43%and 92.86% respectively,and the expression of Beclinl and MAPI-LC3 in the control group were 16.67%and 8.33% respectively.And the difference was significant (P<0.05).Compared to the control group,the protein expression of Beclinl and MAPI-LC3 increased remarkably in the experimental group,the difference was significant (P<0.05).ConclusionAdrenal cortex hormones cause the rabbits early avascular necrosis of the femoral head,Beclin 1 and MAP1-LC3 expression increased.This study suggests that autophagy may play an important role in the development of femoral head model induced by glucocorticoids.
gucocorticoids;osteonecrosis;autophagy;Beclin 1;microtubule-associated protein 1 light chain 3
1008-5572(2017)09-0811-05
国家自然科学基金(81360273);*本文通讯作者:刘万林
R681.8
:A
2017-02-22
王文选,赵振群,刘万林,等.Beclin 1和MAP1-LC3在家兔激素性股骨头缺血坏死中表达的实验研究[J].实用骨科杂志,2017,23(9):811-815.
