左旋西替利嗪口腔速崩片的制备工艺优化及HPCE含量分析
2017-09-27周爱珍
杨 丹,周爱珍
左旋西替利嗪口腔速崩片的制备工艺优化及HPCE含量分析
杨 丹1,周爱珍2*
目的对左旋西替利嗪口腔速崩片的工艺处方进行优化,并建立其HPCE含量分析方法。方法①考察粉末直接压片法、内加崩解剂法、内外加崩解剂法3种制备工艺条件下各片剂的润湿时间及崩解时间,筛选最佳制备工艺;②采用正交试验对崩解剂、掩味剂、矫味剂和填充剂用量进行筛选,优化工艺条件;③采用HPCE法对口腔速崩片中的左旋西替利嗪进行含量分析,考察手性选择剂类型及浓度、缓冲液 pH、分离电压等因素对分离的影响。结果①左旋西替利嗪口腔速崩片的最佳制备工艺为粉末直接压片法,最佳处方:左旋西替利嗪用量2.06%,β-CD用量8.24%,MCC+L-HPC最佳配比为4∶1的混合物用量为40%,PVPP用量10%,甘露醇用量28.7%,阿斯巴甜用量5%,柠檬酸用量6%;②左旋西替利嗪溶液在1~50 μg/mL范围内,峰面积Y与浓度X呈良好线性关系,精密度RSD为0.69%,稳定性RSD为0.69%,回收率RSD为0.53%。结论利用该工艺制备的成品具有较好的外观,崩解迅速,口感佳,且生产成本和技术要求不高,适合工业化大生产。
左旋西替利嗪;口腔速崩片;制备;含量分析
0 引言
口腔速崩片(Rapidly disintegrating oral tablets,RDT)作为一种新型口服速释固体制剂,在美国、日本和中国等先后有部分产品上市,成为药剂领域中的研究热点。该剂型的特点在于只需借助口腔唾液即可完成服药过程,适合婴幼儿、残疾人及在无水服药情况下的人群,不仅服用方便,还可以提高生物利用度,增强疗效。口腔速崩片的辅料多采用高效崩解剂,大多为水不溶性,有砂砾感,但口崩片制备工艺相对简单,工业化生产难度较小,只要解决其口感问题就会有广阔的应用前景[1-2]。
西替利嗪临床上主要用于抗过敏的治疗,其本身是一种外消旋体,有镇静、嗜睡、肠胃紊乱及心律失常等不良反应。左旋西替利嗪是西替利嗪的活性光学异构体,用药量少,毒副作用较西替利嗪小,其抗组胺活性相当于西替利嗪,是理想的H1受体拮抗剂。
本实验考察了左旋西替利嗪口腔速崩片的制备工艺,以及各种辅料对片剂的吸水性能和崩解时间的影响,使用正交试验进行处方筛选和优化,确定左旋西替利嗪口腔速崩片的最佳处方,采用高效毛细管电泳法(HPCE)分离盐酸西替利嗪对映体,确定HPCE的最佳分离条件,并对自制的左旋西替利嗪口腔速崩片进行含量测定。
1 仪器与试药
78X-6A片剂四用测定仪(上海右一仪器有限公司);TDP-1.5单冲压片机(上海烨昌食品机械有限公司);BSM-220.4型电子分析天平(上海卓精电子科技有限公司);Beckman P/ACE MDQ型高效毛细管电泳仪,P/ACE固定波长紫外检测器,熔融石英毛细管柱(总长65 cm,内径50 μm,美国Beckman公司)。
左旋西替利嗪(批号:150607,武汉河源化工有限公司);CMC-Na (羧甲基纤维素钠,德国JRS);CMS-Na (羧甲基淀粉钠,德国BASF);L-HPC (低取代羟丙基纤维素,日本信越);PVPP (交联聚乙烯吡咯烷酮,德国JRS);MCC (微晶纤维素,德国BASF);β-环糊精(β-CD,广东省郁南县环糊精厂);丙烯酸树脂Eudragit E100 (德国Rohm公司);明胶(沈阳市新西试剂厂);阿斯巴甜(美国NutraSweet);乳糖(上海诺泰化工);柠檬酸(吴江市旭龙化工有限公司);甘露醇(金盛辉化工);左旋西替利嗪(含量99.91%,批号:150911,北京新瑞开元科技发展有限公司);甲基-β-环糊精(M-β-CD,天津市倍思乐色谱技术开发中心);羟丙基-β-环糊精(HP-β-CD,天津市倍思乐色谱技术开发中心);三羟甲基氨基甲烷(Tris,上海山浦化工有限公司)。
2 方法
2.1 制备工艺考察 按照基本处方主药及辅料比例[4],即左旋西替利嗪2.06%,β-CD 8.24%,MCC 32%,L-HPC 8%,PVPP 10%,甘露醇29.7%,柠檬酸6%,阿斯巴甜4%。拟定粉末直接压片法、内加崩解剂法、内外加崩解剂法3种工艺制备左旋西替利嗪口腔速崩片。
工艺1(粉末直接压片法):辅料过筛,等量递增法将左旋西替利嗪与崩解剂、填充剂、矫味剂混合均匀,Φ=6 mm冲进行压片,片重70 mg,硬度控制在2 kgf。
工艺2(内外加崩解剂法):辅料过筛,主药和掩味剂、矫味剂、一半崩解剂混合均匀后,5%PVP乙醇溶液为黏合剂制软材,过40目筛制粒,55 ℃干燥30 min,过80目筛整粒,干燥整粒后再与另一半崩解剂混匀,Φ=6 mm冲进行压片,片重70 mg,硬度控制在2 kgf。
工艺3(内加崩解剂法):辅料过筛,主药和所有掩味剂、矫味剂、崩解剂、填充剂按处方量混合均匀后,5%PVP乙醇溶液为黏合剂制软材,过40目筛制粒,55 ℃干燥30 min,过80目筛整粒,Φ=6 mm冲进行压片,片重70 mg,硬度控制在2 kgf。
按上述3种不同口腔速崩片制备工艺分别压片,测定各片剂的润湿时间及崩解时间,按照文献方法[3],考察不同制备工艺对片剂崩解时间及吸水率的影响。
2.2 崩解剂的筛选 L-HPC、PVPP、CMS-Na、CMC-Na、MCC 5种崩解剂分别按片重8%的用量加入处方中,考察5种崩解剂对口腔速崩片吸水率及崩解时间的影响,同时考察不同崩解剂之间的用量和配比。
2.3 掩味剂的筛选 左旋西替利嗪味苦,因此必须选择适当的掩味剂来掩盖药物苦味,以改善口腔速崩片的口感。本课题选用了β-环糊精、丙烯酸树脂Eudragit E100和明胶作为掩味剂,考察对左旋西替利嗪的掩味效果、片剂润湿时间和崩解时间的影响。
掩味剂1:按重量比(1∶4)称取左旋西替利嗪和β-CD,将二者混合于研钵中,强力研磨20~30 min,即得左旋西替利嗪β-CD包合物。再加入其他辅料,直接压片。
掩味剂2:按重量比(1∶2)分别称取左旋西替利嗪和丙烯酸树脂Eudragit E100,将Eudragit E100溶解于无水乙醇中,缓缓加入左旋西替利嗪搅拌使其分散均匀,室温干燥,研细,并过100目筛。再加入其他辅料,直接压片。
掩味剂3:按重量比(1∶5)分别称取左旋西替利嗪和明胶,分别溶于少量无水乙醇中,缓慢将左旋西替利嗪溶液加入明胶溶液中,搅拌均匀,挥干乙醇,得共沉淀物,研细,并过100目筛。再加入其他辅料,直接压片。
2.4 矫味剂的筛选 固定其他辅料配比和用量,考察阿斯巴甜(3%、5%、7%)和柠檬酸(4%、6%、8%)用量。相同压力下压片,将制得的片剂放入6名健康志愿者口腔中,通过微甜、甜、偏甜和微酸、酸、偏酸等味觉指标来评价药物口感,并测定各片剂的润湿时间及崩解时间。
2.5 填充剂的筛选 固定其他辅料配比和用量,分别以相同处方量的甘露醇和乳糖为填充剂,测定相同压力下各片剂的润湿时间及崩解时间。
2.6 正交设计优化处方 根据文献报道及预试验结果[4-8],利用L9(34)正交设计对辅料用量进行优化,以左旋西替利嗪口腔速崩片的体外崩解时间为主要考察指标,确定各辅料的最佳用量。见表1。
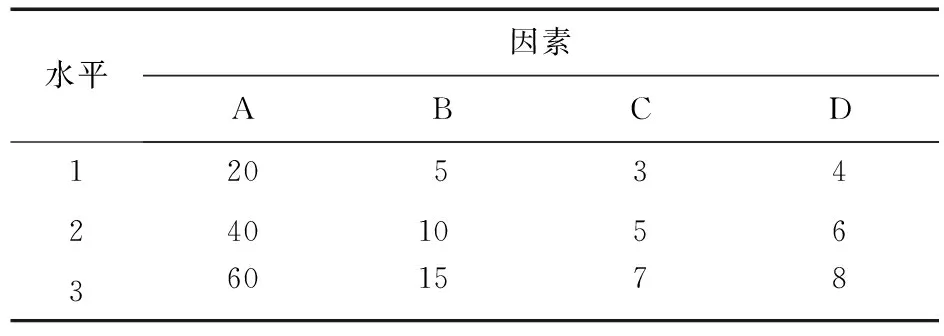
表1 处方用量正交设计表
注:A.MCC∶L-HPC (4∶1),B.PVPP,C.阿斯巴甜用量,D.柠檬酸
2.7 HPCE法测定口腔速崩片中左旋西替利嗪的含量
2.7.1 HPCE电泳条件 50 mmol M-β-CD与50 mmol HP-β-CD二元环糊精体系的50 mmol Tris-H3PO4,pH值2.5,分离电压22 kV,温度25 ℃。石英毛细管使用前,依次用0.1 mol/L HCl、0.1 mol/L NaOH和水各冲洗5 min,2次运行之间用0.1 mol/L NaOH、水和缓冲液各冲洗2 min,采用气压进样(0.5 psi×10 s),检测波长235 nm。
2.7.2 对照品溶液的制备 精密称取减压干燥至恒重的左旋西替利嗪10 mg,置100 mL容量瓶中,加水稀释至刻度,摇匀,即得100 μg/mL的左旋西替利嗪对照品溶液。
2.7.3 供试品溶液的制备 取自制的左旋西替利嗪口腔速崩片,用10 mL水充分溶解,经0.45 μm微孔滤膜过滤,取上清液1 mL,再稀释5倍。
3 结果
3.1 制备工艺考察 按上述3种不同口腔速崩片制备工艺分别压片,测定相同硬度下各片剂的润湿时间及崩解时间,由图1可见,用粉末直接压片法制得左旋西替利嗪口腔速崩片的润湿时间和崩解时间最短,其余2种分别将部分或全部崩解剂与其他辅料混合后进行湿法制粒,虽可压性较好,但崩解时间均较长。因此,选用工艺1。
3.2 崩解剂的筛选
3.2.1 崩解剂的组成 崩解剂的种类不同,崩解机制也各异。在具体的片剂处方中,需综合考虑崩解剂的崩解效果。将5种崩解剂分别按片重8%的用量加入处方中,考察各片剂的润湿时间及吸水过程,并测定崩解时间,考察不同种类崩解剂对片剂吸水性能及崩解性能的影响,结果见图2、图3、表2。
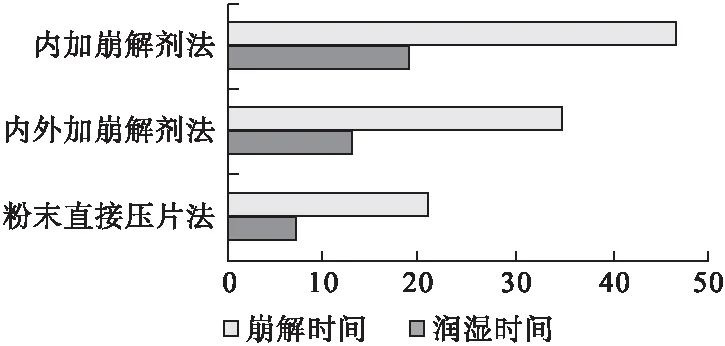
图1 不同制备工艺下的润湿时间和崩解时间
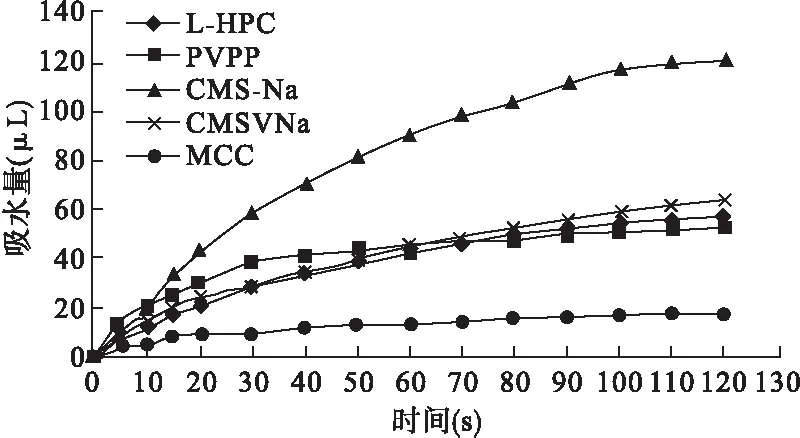
图2 不同崩解剂对吸水率的影响
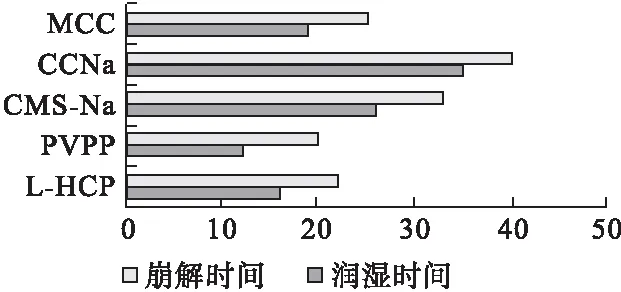
图3 不同崩解剂对润湿时间和崩解时间的影响
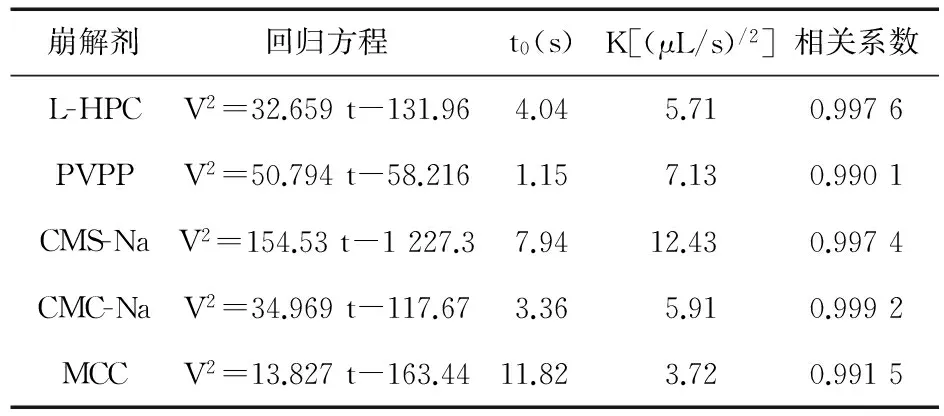
崩解剂回归方程t0(s)K[(μL/s)/2]相关系数L-HPCV2=32.659t-131.964.045.710.9976PVPPV2=50.794t-58.2161.157.130.9901CMS-NaV2=154.53t-1227.37.9412.430.9974CMC-NaV2=34.969t-117.673.365.910.9992MCCV2=13.827t-163.4411.823.720.9915
以上实验结果表明,采用PVPP的崩解片t0最小,吸水速率也较大,在30 s时的吸水量可达总吸水量的90%,能够很快达到吸水平衡。同等条件下,采用L-HPC的崩解片与CMC-Na片在30 s时吸水量为总量的50%~60%;CMS-Na 30 s时吸水量低于50%;MCC的吸水量虽然最小,溶胀性能弱,但具有较大的药物容纳量,另有毛细管作用,所以崩解效果好,一般不单独使用,和L-HPC合用效果较好。L-HPC有很强的吸水性和溶胀性,二者联用可提高片剂孔隙率,增强毛细管作用,使片剂可以在少量水中快速崩解。此外,PVPP片剂的润湿时间最短,崩解时间也最短。
综上,考虑选用MCC、L-HPC和PVPP 3种崩解剂联合应用,三者优势互补,片剂崩解效果更佳。
3.2.2 MCC和L-HPC的配比考察 固定PVPP用量8%,MCC和L-HPC混合物用量20%,考察MCC和L-HPC不同重量比(4∶1、5∶1、6∶1、7∶1、8∶1、9∶1)条件下各片剂的润湿时间及崩解时间,结果表明,当MCC和L-HPC比例为4∶1时,崩解时间最短(22 s),见图4。
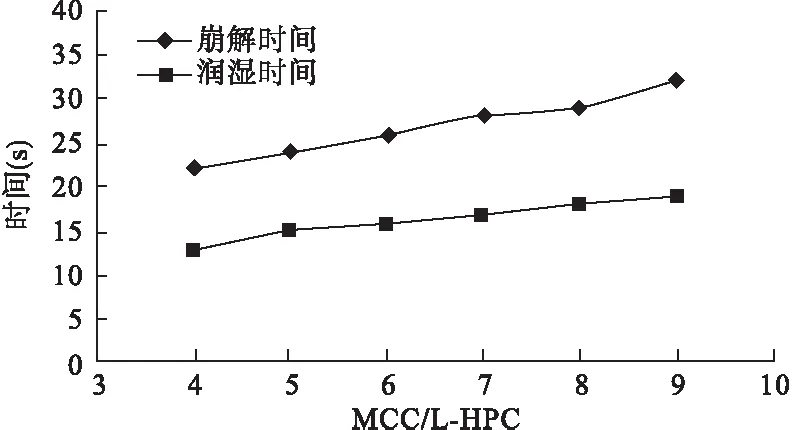
图4 不同重量配比的MCC和L-HPC混合物的润湿时间及崩解时间
3.2.3 MCC∶L-HPC(4∶1)的用量考察 固定PVPP用量为8%时,考察MCC∶L-HPC(4∶1)不同用量(10%、20%、40%、50%、60%)条件下各片剂的润湿时间及崩解时间。结果表明,随用量的增加,片剂的表面润湿时间和崩解时间都逐渐缩短;用量>40%后,反而呈逐渐延长的趋势。综合考虑片剂的可压性、崩解时间和口感,认为MCC和L-HPC用量为40%较合适,见图5。
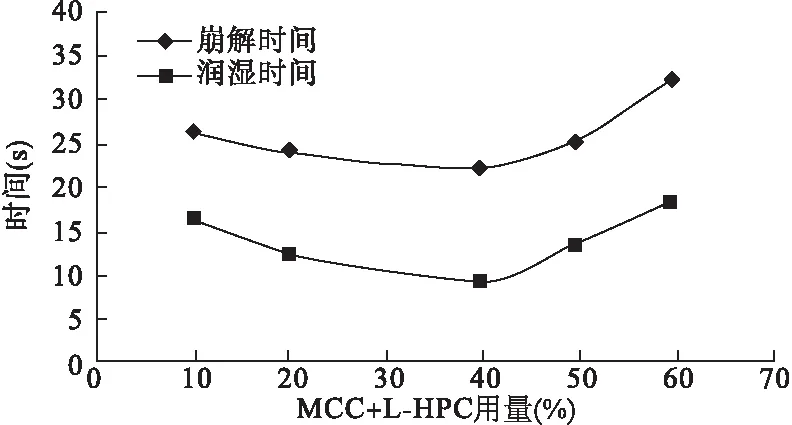
图5 不同用量的MCC/L-HPC混合物的润湿时间及崩解时间
3.2.4 PVPP的用量考察 固定MCC∶L-HP(4∶1)的混合物用量40%,考察PVPP不同用量(5%、8%、10%、12%、15%)条件下各片剂的润湿时间及崩解时间。结果表明,PVPP用量为10%时,表面润湿时间和崩解时间最短。见图6。
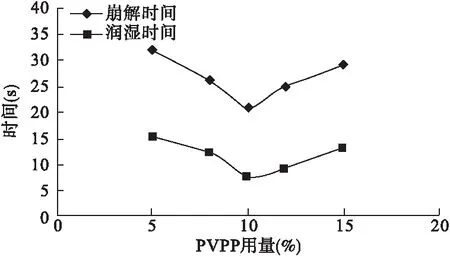
图6 不同用量PVPP的润湿时间及崩解时间
3.3 掩味剂的筛选 分别取β-环糊精、丙烯酸树脂Eudragit E100和明胶作为掩味剂制得的口崩片,放入6名健康志愿者口腔中,通过极苦、苦、微苦、不苦等味觉指标和对口腔黏膜有无刺激性来评价药物口感,并观察外观和测定各片剂的润湿时间及崩解时间,结果见表3、图7。

表3 不同掩味剂对片剂外观、口感及刺激性的对比
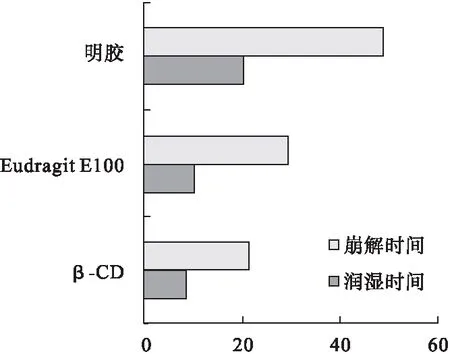
图7 不同掩味剂对片剂润湿时间和崩解时间的影响
由表3可见,选用β-CD、丙烯酸树脂Eudragit E100和明胶3种掩味剂均能较好地掩盖左旋西替利嗪的苦味,并且对口腔黏膜无刺激性。但是用明胶制得的口腔速崩片外观颜色不均匀,有较多的明胶小颗粒黄色斑点。由图7可见,用β-CD制得的口腔速崩片的润湿时间和崩解时间均低于用丙烯酸树脂Eudragit E100和明胶制得的口腔速崩片,可能与丙烯酸树脂的渗透性差和明胶具有一定的胶黏性及韧性有关。
3.4 矫味剂的用量筛选 考察不同阿斯巴甜用量(3%、5%、7%)和柠檬酸用量(4%、6%、8%)条件下各片剂的润湿时间及崩解时间,并将制得的片剂放入6名健康志愿者口腔中,通过微甜、甜、偏甜和微酸、酸、偏酸等味觉指标来评价药物口感。结果表明,阿斯巴甜和柠檬酸用量对片剂的润湿时间及崩解时间影响不大(见图8),当阿斯巴甜用量为5%时甜度较好,柠檬酸用量为6%时酸度较好(见表4)。
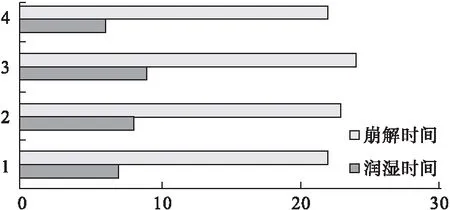
图8 不同用量阿斯巴甜和柠檬酸的润湿时间及崩解时间
注:1.阿斯巴甜2%,2.阿斯巴甜4%,3.阿斯巴甜8%,4.柠檬酸3%,5.柠檬酸6%,6.柠檬酸9%

3.5 填充剂的选择 固定MCC和L-HPC最佳配比4∶1的混合物用量40%,PVPP用量10%,分别以相同处方量的甘露醇和乳糖为填充剂,测定相同压力下各片剂的润湿时间及崩解时间,结果见图9。
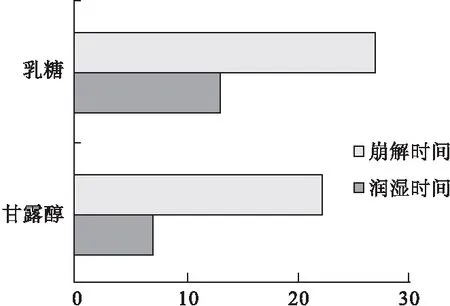
图9 不同填充剂对片剂润湿时间和崩解时间的影响
实验结果显示,以甘露醇作为填充剂制备的口腔速崩片较以乳糖作为填充剂制备的口腔速崩片润湿时间和崩解时间更短,且其片面光洁度更好。甘露醇作为填充剂,溶解时吸热,使口腔有清凉、舒适感。
3.6 正交实验结果及分析 选择正交表L9(34)进行实验,以左旋西替利嗪口腔速崩片的体外崩解时间为主要考察指标,口感作为辅助考察指标,筛选最佳处方。正交实验设计结果见表5、表6。
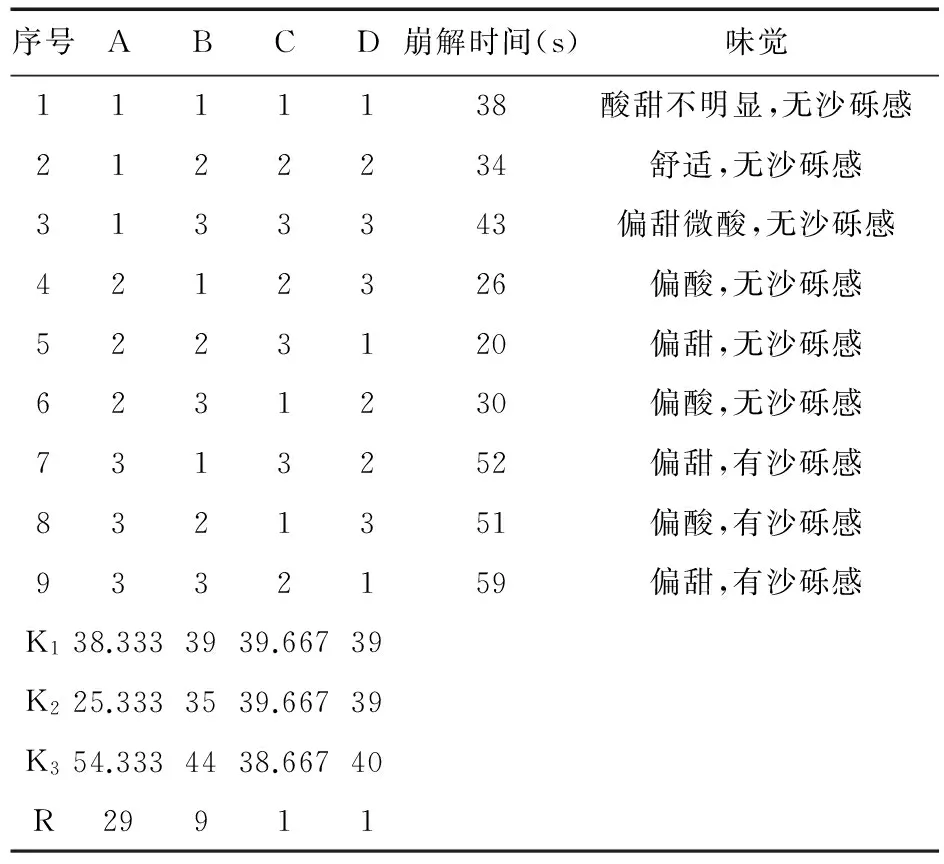
表5 正交实验设计结果
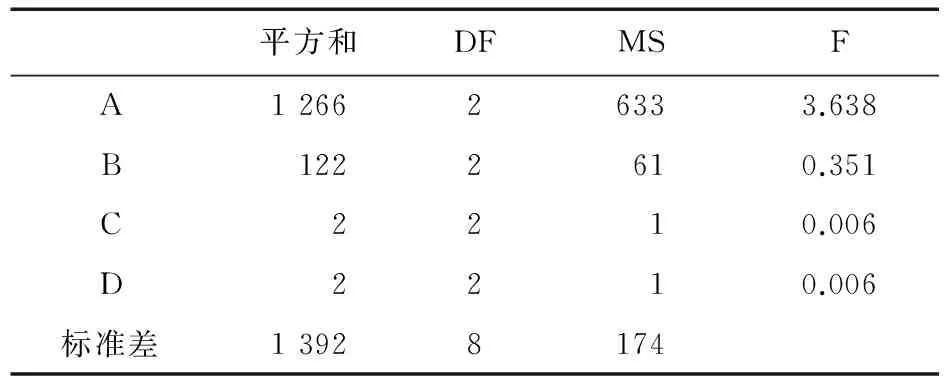
表6 正交实验方差分析
注:F0.05(2,8)=4.46,F0.01(2,8)=8.65,F0.1(2,8)=3.11
根据极差结果(R值)分析可知,A因素对片剂崩解时间的影响较大,B因素次之,而C因素、D因素影响不大,故选最佳崩解条件为A2B2。而崩解时间方差分析结果表明,A、B因素的P>0.05,说明A、B因素对片剂崩解时间的影响无显著性差异。对口感影响较大的因素是A、C、D,故最佳口感条件为A2C2D2。综合考虑,最佳处方为A2B2C2D2,即MCC∶L-HPC最佳配比为4∶1,用量为40%,PVPP用量10%,阿斯巴甜用量5%,柠檬酸用量6%。
综上所述,左旋西替利嗪口腔速崩片的最佳制备工艺为粉末直接压片法。最佳处方:左旋西替利嗪用量2.06%,β-CD用量8.24%,MCC+L-HPC最佳配比为4∶1的混合物用量40%,PVPP用量10%,甘露醇用量28.7%,阿斯巴甜用量5%,柠檬酸用量6%。
3.7 HPCE法测定左旋西替利嗪的含量
3.7.1 线性范围 精密量取左旋西替利嗪对照品溶液适量,加水稀释成浓度为1、5、12、25、37、50 μg/mL的溶液,按最佳分离条件测定左旋西替利嗪的峰面积。结果表明,左旋西替利嗪溶液在1~50 μg/mL范围内,峰面积Y与浓度X呈良好线性关系,回归方程为Y=11 996 X+7 022.6,R2=0.999 5。
3.7.2 精密度试验 精密量取左旋西替利嗪对照品溶液,加水稀释配制成20 μg/mL浓度的标准溶液,分别连续测定5次,RSD=0.69%,表明方法精密度良好。
3.7.3 稳定性试验 精密量取左旋西替利嗪对照品溶液,加水稀释配制成20 μg/mL浓度的标准溶液,分别于0、4、8、16、24、48 h测定样品含量,RSD=1.13%,表明方法稳定性良好。
3.7.4 回收率试验 将左旋西替利嗪制成低、中、高(10、20、40 μg/mL) 3个浓度的标准溶液,分别测定5次,由标准曲线回归方程计算其测定值,测定值与真实值的比值为回收率,回收率测定结果见表7。
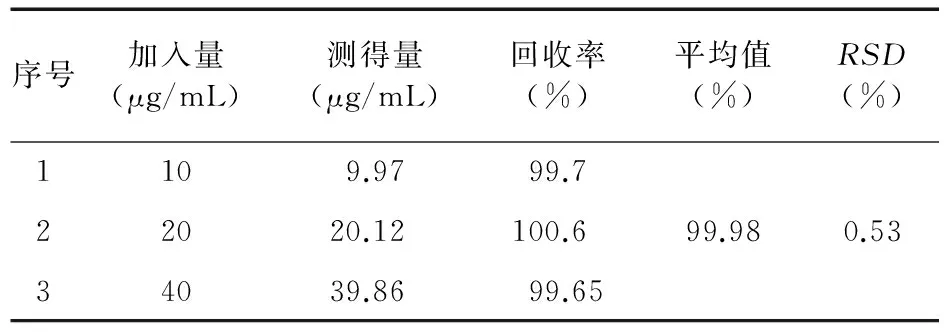
表7 回收率实验结果
3.7.5 左旋西替利嗪口腔速崩片的含量测定 将供试品溶液按最佳分离条件测定左旋西替利嗪的峰面积,根据回归方程计算自制口腔速崩片中左旋西替利嗪的含量,结果见表8。

表8 药物含量测定结果
4 讨论
4.1 口腔速崩片制备工艺 固体速释制剂的制备工艺主要有固态溶液技术、喷雾干燥技术、冷冻干燥技术、湿法制粒压片法、直接压片法等工艺,其中,常用的是直接压片法和湿法制粒压片法,其工艺简单,不需特殊的生产设备。采用粉末直接压片法成本低,适合工业化大生产,同时可以避免加热过程破坏左旋西替利嗪的稳定性而使药物失效。
4.2 口腔速崩片崩解剂的选择 口腔速崩片的崩解机制主要有3种:毛细管作用、膨胀作用及排斥作用。前期实验结果表明,PVPP吸水膨胀率不如其他3种,最大吸水量偏小,但因其内部具有较高交联度的纤维结构,毛细管作用比较明显,吸水易膨胀,崩解迅速。相反,CMS-Na和CMC-Na虽然吸水膨胀率大,但形成的凝胶会阻碍水分快速渗透,t0较长,崩解慢。因口腔速崩片中亲水性辅料会与崩解剂争夺水分,因此,速崩片的崩解主要依靠毛细管作用。本实验结果表明,PVPP润湿时间短,崩解速度快,符合上述原理[9]。
MCC有一定的毛细管作用,并且能在加压过程中成塑性变形,崩解效果好,可压性好,但溶胀性能很弱,可作为直接压片的填充剂、黏合剂、崩解剂或润滑剂使用。实际应用中,MCC往往和L-HPC联合使用,L-HPC较强的吸水性和溶胀性可提高口腔速崩片孔隙率,增强毛细管作用,使口腔速崩片可以在少量水中快速崩解。综合以上因素,本实验选用MCC、L-HPC和PVPP 3种崩解剂联合应用,三者优势互补,使片剂崩解效果更佳。此外,实验结果表明,不管采用何种崩解剂,其润湿时间与崩解时间趋势一致,推测口腔速崩片的润湿时间是影响口崩片崩解的重要因素之一[10]。
4.3 口腔速崩片崩解剂的用量 有报道,PVPP吸水速率会随其用量的增加而增快,当含量达6%时,内部总孔隙率最大,产生的压力也最大,崩解速度最快。但PVPP含量超过10%时,形成的凝胶状物质会阻碍水分子渗透,吸水速率反而减小。本实验中关于PPVP用量的结果与上述研究一致。此外,将含有15%PVPP的口腔速崩片置于水中后,片剂表面会形成凝胶层,晃动后,凝胶层漂移,余下部分未见明显膨胀、崩解。因此,PVPP 用量为10%时,能获得最佳的崩解效果[11]。
MCC主要起增强片剂硬度和促进崩解的作用。随MCC用量的增加,片剂的表面润湿时间和崩解时间都逐渐缩短,但MCC和L-HPC用量>40%后,呈逐渐延长的趋势。这是因为MCC在加压过程中塑性变形,加之很强的毛细管作用,水分极易渗入片内,但MCC是水不溶性的,会阻碍水分的继续渗透,当MCC和L-HPC用量>40%后,这种疏水性的影响更为明显。而且,由于其粒径较大,又不溶于水,用量过多在口腔中会产生砂砾感。综合考虑片剂的可压性、崩解时间和口感,认为MCC和L-HPC用量为40%较合适[12]。
4.4 HPCE含量测定条件的考察[13-14]
4.4.1 不同手性选择剂对分离的影响 分别以20 mmol M-β-CD、10 mmol HP-β-CD、20 mmol M-β-CD与20 mmol HP-β-CD的二元环糊精体系为手性选择剂,在操作电压18 kV、温度25 ℃、pH 2.5的条件下,考察不同手性选择剂对盐酸西替利嗪的分离情况。见图10。
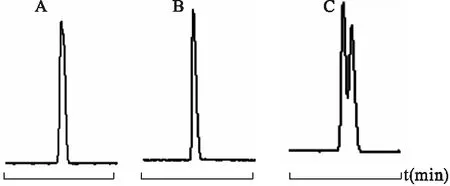
图10 不同手性选择剂对手性分离的影响
注:A.20 mmol M-β-CD,b.20 mmol HP-β-CD,c.20 mmol M-β-CD+20 mmol HP-β-CD
从图10可见,采用单一的M-β-CD或 HP-β-CD作为手性选择剂不能将盐酸西替利嗪对映体分离,而采用M-β-CD与HP-β-CD组成的二元环糊精体系作为手性选择剂,能使盐酸西替利嗪对映体得到初步的分离,其最佳分离条件有待进一步考察。在很多情况下,二元环糊精体系具有明显的“协同效用”,表现出比一元环糊精体系更好的分离效果。
4.4.2 缓冲液pH值对分离的影响 以20 mmol M-β-CD与20 mmol HP-β-CD的二元环糊精体系为手性选择剂,在操作电压18 kV、温度25 ℃条件下考察不同pH值对盐酸西替利嗪的分离情况。见图11。
左旋西替利嗪为碱性化合物,在缓冲液pH<7.0时因质子化而带正电,其电泳方向与电渗流同向;M-β-CD和HP-β-CD是电中性物质,随电渗流一起迁移。因此pH值越小,越有利于对映异构体的分离;同时,电渗流随pH值的升高迅速增大,使手性药物与手性选择剂在毛细管内的迁移时间缩短,反而不利于对映异构体的分离。从图11可以明显看出,盐酸西替利嗪对映体在pH值为2.5~3.5范围内得到较好分离,最佳分离pH值为2.5。
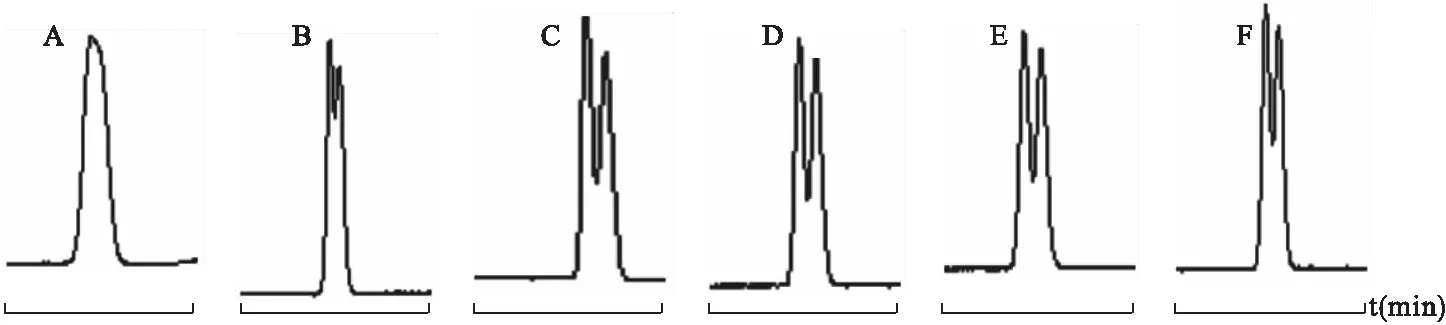
图11 缓冲液pH值对手性分离的影响
4.4.3 二元环糊精浓度对分离的影响 两种手性选择剂浓度比例的变化对分离有很大的影响,当n(M-β-CD)∶n(HP-β-CD)=1∶1时,才能得到最大的分离度。分别以20 mmol M-β-CD与20 mmol HP-β-CD、30 mmol M-β-CD与30 mmol HP-β-CD、40 mmol M-β-CD与40 mmol HP-β-CD、50 mmol M-β-CD与50 mmol HP-β-CD的二元环糊精体系为手性选择剂,在操作电压18 kV、温度25 ℃、pH 2.5的条件下考察不同浓度的二元环糊精体系对盐酸丁胺醇的分离情况。见图12。
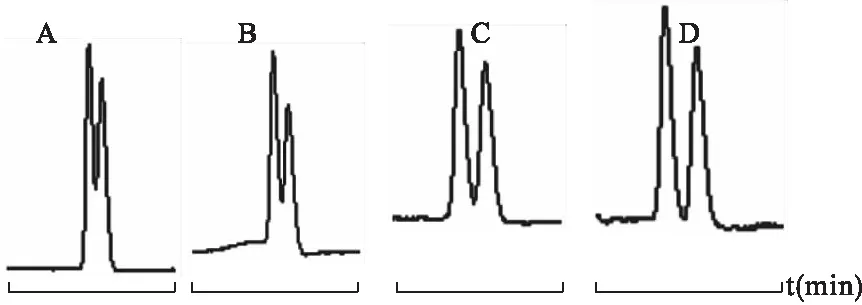
图12 不同浓度二元环糊精系统对手性分离的影响
注:A.20 mmol M-β-CD+20 mmol HP-β-CD,B.30 mmol M-β-CD+30 mmol HP-β-CD,C.40 mmol M-β-CD+40 mmol HP-β-CD,D.50 mmol M-β-CD+50 mmol HP-β-CD
由图12可见,二元环糊精体系的浓度对盐酸西替利嗪对映体的分离影响最大。随着二元环糊精浓度的增大,盐酸西替利嗪的分离度增大,当M-β-CD与HP-β-CD浓度分别为50 mmol时,分离效果最佳。
4.4.4 电压对分离的影响 以50 mmol M-β-CD与50 mmol HP-β-CD二元环糊精体系为手性选择剂,在操作温度25 ℃、pH 2.5的条件下,考察不同分离电压对盐酸西替利嗪的分离情况。见图13。
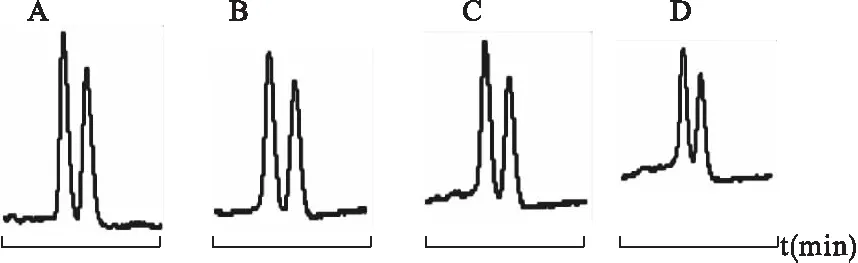
图13 不同电压对手性分离的影响
从图13可见,分离电压对盐酸西替利嗪对映体的分离影响不大。当电压分别为18、20、22 kV时,均能使盐酸西替利嗪对映体完全分离,而且电压越大,出峰时间越快,峰形越尖锐,25 kV时分离效果略差。在沙丁胺醇对映体得到完全分离的情况下,考虑到分离效果及出峰时间,选择22 kV作为最佳分离电压。
[1] 姚敏娜,张伟,马宁,等.复方酪萨维口腔速崩片的制备及质量控制[J].中国医院药学杂志,2013,33(11):849-852.
[2] 刘迪,贺建昌,龚媛媛,等.苯海明口腔崩解片的制备[J].解放军药学学报,2009,25(2):139-142.
[3] 姚方耀,刘欢,刘衡,等.口腔崩解片体外崩解评价方法探讨[J].中国药学杂志,2007,42(4):276-279.
[4] 张伟民,吴强,李瑞芳,等.红景天口腔崩解片的制备及质量控制[J].中国医院药学杂志,2012,32(8):603-606.
[5] 邹萍,齐同珍,刘辉,等.天麻素口腔崩解片的制备和质量控制[J].中国药业,2013,22(23):39-41.
[6] 景荣琴,景怡,胡天慧.葛根素提取物口腔崩解片的制备及质量评价[J].中华中医药杂志,2012,27(3):750.
[7] 周毅生,孟江,咸银库,等.丹参多酚酸口腔崩解片制剂处方的研究[C].运城:全国中药创新与研究论坛,2009.
[8] 刘洪玉,张慧,龚伟,等.阿戈美拉汀口腔崩解片的制备与质量评价[J].国际药学研究杂志,2012,39(5):433-436.
[9] Rai PR,Tiwary AK,Rana V.Superior disintegrating properties of calcium cross-linked Cassia fistula gum derivatives for fast dissolving tablets[J].Carbohydrate Polymers,2012,87(2):1098-1104.
[10]Katsuno E,Tahara K,Takeuchi Y,et al.Orally disintegrating tablets prepared by a co-processed mixture of micronized crospovidone and mannitol using a ball mill to improve compactibility and tablet stability[J].Powder Technol,2013,241:60-66.
[11]Gryczke A,Schminke S,Maniruzzaman M,et al.Development and evaluation of orally disintegrating tablets (ODTs) containing ibuprofen granules prepared by hot melt extrusion[J].Colloids Surf B Biointerfaces,2011,86(2):275-284.
[12]Sano S,Iwao Y,Noguchi S,et al.Design and evaluation of microwave-treated orally disintegrating tablets containing polymeric disintegrant and mannitol[J].Int J Pharm,2013,448(1):132-141.
[13]李玉兰,李军,刘敏,等.小花鬼针草的毛细管电泳特征图谱研究[J].药物分析杂志,2009,29(2):179-183.
[14]仝战旗,高建义,陈丙跃.高效毛细管电泳法测定复方苦参结肠溶胶囊中氧化苦参碱[J].中草药,2010,41(5):725-727.
StudyonoptimizedpreparationofrapidlydisintegratingoraltabletsoflevocetirizineandcontentanalysisbyHPCE
YANG Dan1,ZHOU Ai-zhen2*
(1.Luqiao Hospital of Taizhou Medical Center,Taizhou 318050,China;2.Zhejiang pharmaceutical College,Ningbo 315000,China)
ObjectiveTo optimize the prescription and preparation process of rapidly disintegrating oral tablets of levoceririzine,and to establish the method of content analysis by HPCE.Methods①The best preparation process of the tablet was screened by observing the wetting time and disintegration time through the following three methods:direct powder compression,adding disintegrants inside,and adding inside and outside.②The amount of the disintegrants,taste masking agent,taste correcting agents and fillers was screened by orthogonal experiment to optimize the process conditions.③The effect of chiral selector type and concentration,buffer,pH,separation voltage and other factors on the separation was investigated by using HPCE method to analyze the content of levocetirizine in orally disintegrating tablets.Results①The optimized preparation of rapidly disintegrating oral tablets of levocetirizine was direct powder compression method,and the best prescription was:levocetirizine (2.06%),β-CD(8.24%),mixtures of MCC+L-HPC (4∶1)(40%),PVPP (10%),mannifol (28.7%),aspartame (5%),and citric acid (6%).②The linear relationship between peak area (Y) and concentration (X) in the range of 1~50 μg/mL was good.TheRSDs of precision test,stability test and recovery test were 0.69%,0.69% and 0.53%,respectively.ConclusionThis process for preparing a product has good appearance,rapid disintegration and good taste,with low production costs and technical requirements,which is suitable for industrial mass production.
Levocetirizine;Rapidly disintegrating oral tablets;Preparation;Content analysis
2016-10-29
1.台州恩泽医疗中心(集团)路桥医院,浙江 台州 318050;2.浙江医药高等专科学校,浙江 宁波 315000
*通信作者
10.14053/j.cnki.ppcr.201709023
