DBA/1J小鼠胶原诱导关节炎模型的建立与鉴定
2017-09-27徐慧雯郝文婷陈德生张雅文陆云娟李向阳秦苏萍
徐慧雯,郝文婷,陈德生,张雅文,陆云娟,李向阳,秦苏萍,潘 伟*
(1.江苏省免疫与代谢重点实验室,江苏 徐州 221004;2.徐州医科大学病原生物学与免疫学教研室,江苏 徐州 221004; 3.徐州医科大学临床医学系,江苏 徐州 221004)
研究报告
DBA/1J小鼠胶原诱导关节炎模型的建立与鉴定
徐慧雯1, 2, 3#,郝文婷1, 2#,陈德生1, 2, 3,张雅文1, 2, 3,陆云娟1, 2, 3,李向阳1, 2,秦苏萍1, 2,潘 伟1, 2*
(1.江苏省免疫与代谢重点实验室,江苏 徐州 221004;2.徐州医科大学病原生物学与免疫学教研室,江苏 徐州 221004; 3.徐州医科大学临床医学系,江苏 徐州 221004)
目的建立DBA/1J小鼠胶原诱导性关节炎(collagen-induced arthritis,CIA)模型,从形态学、病理学及免疫学等多方面对该模型进行鉴定。方法将牛Ⅱ型胶原(type Ⅱ collagen,CⅡ)与佐剂混合并充分乳化,于DBA/1J小鼠尾根部皮下注射进行初次免疫,21 d后同样的方法进行再次免疫。观察小鼠体重变化、关节肿胀程度等形态学指标,进行踝关节病理检查,并用CBA法检测血清中细胞因子的水平。结果造模组小鼠体重于首免后35 d开始下降并持续低于对照组。于28 d,造模组小鼠出现足爪红肿,35 d足爪肿胀厚度显著高于对照组(P< 0.05),至62 d发病率高达90%。病理学检测显示,造模组小鼠关节腔变窄,滑膜组织增生,炎症细胞浸润,软骨结构不同程度破坏。相比于对照组,造模组小鼠血清中炎性因子IL-6、IFN-γ、MCP-1显著升高(P< 0.05),而抗炎因子IL-10轻微下降(P> 0.05)。结论DBA/1J小鼠尾根部皮下注射牛Ⅱ型胶原可成功诱导CIA模型。
DBA/1J小鼠;牛Ⅱ型胶原;胶原诱导性关节炎模型;炎症因子
类风湿性关节炎(rheumatoid arthritis,RA)是一种以关节滑膜炎症、关节进行性破坏为主要病理特征的慢性自身免疫性疾病。其全球发病率约0.24%,且近年来患病人群趋于年轻化[1]。RA病程持续且反复发作,最终导致关节畸形,引起功能障碍,其致畸率高达90%以上。迄今为止,RA的病因尚未明确,但已明确其发病机制与Th1/Th2轴、Th17/Treg轴失衡以及促炎因子过量释放、抑炎因子释放减少有关。为深入探讨RA病因、病理、免疫学及临床等方面的机制,寻找更有效的RA治疗方案,国内外学者建立了一些比较成熟的动物病理模型[2],如胶原诱导的关节炎(collagen-induced arthritis,CIA)和佐剂性关节炎(adjuvant-induced arthritis,AA)。相比于AA,Trentham[3]于1977年首次建立的CIA模型在临床症状、病理学变化和免疫学指标等方面与RA更为相似。大鼠、小鼠或灵长类动物均曾用于CIA模型的制作研究,其中,DBA/1(H-2q)小鼠品系诱导CIA发病率高(约90%),其滑膜炎等病理变化类似人RA[4]。本文采用牛Ⅱ型胶原(type Ⅱ collagen,CⅡ)免疫DBA/1J小鼠诱导出关节炎模型,并对其进行了鉴定,可为研究RA病理机制及评价RA治疗药物效果提供实验基础。
1 材料和方法
1.1实验动物
40只雌性SPF级DBA/1J小鼠,7~8周龄,体重15~18 g,购自北京维通利华实验动物技术有限公司【SCXK(苏)2015-0009】。
1.2试剂与仪器
C Ⅱ(Chondrex公司,货号:2002-2);弗氏完全佐剂(含卡介苗,CFA,Sigma公司);弗氏不完全佐剂(不含卡介苗,IFA,Sigma公司);Mouse Inflammation Kit(BD公司,货号:552364,美国);离心机(Eppendorf公司,德国);FACSCanto Ⅱ流式细胞仪(BD公司,美国);FCAP 3.0软件(BD公司,美国)。1.3CIA模型制备
参照文献[5]制备CIA模型。40只雌性DBA/1J小鼠随机分为对照组和造模组。将CⅡ与CFA等体积混合乳化制成CⅡ胶原乳剂。无菌条件下以每只0.1 mg的剂量在小鼠尾根部皮下注射,首免当日记为1 d。在21 d,将CⅡ与IFA等体积混合乳化,再次注射于小鼠尾根部皮下,剂量同前。对照组在1 d及21 d分别注射等体积完全及不完全佐剂。所有小鼠均正常饲养于SPF环境【SYXK(苏)2016-0028】。按实验动物使用的3R原则给予人道主义关怀。1.4CIA模型鉴定
1.4.1 形态学观察
监测小鼠体重、关节炎发生率、足爪肿胀程度等。
1.4.2 病理学变化
首免62 d后处死小鼠,取后足踝关节置于10%福尔马林中固定,经EDTA脱钙后制备石蜡切片,再进行HE及番红O-固绿染色,置于光学显微镜下观察。
1.4.3 免疫学改变
于首免62 d后剖杀小鼠,收集血清,采用CBA法测定血清中IL-6、IL-17、IL-10、IFN-γ、TNF-α、MCP-1的含量,具体操作详见说明书。将标记好的样本用FACS CantoⅡ流式细胞仪进行检测,利用FCAP 3.0软件进行细胞因子浓度的换算,测定结果以pg/mL为单位。
1.5统计学分析
2 结果
2.1CIA小鼠体重变化
造模组小鼠体重在首次免疫21 d后开始高于对照组,而在35 d时,体重开始下降,并持续到实验结束,体重变化相比于对照组差异无显著性(P> 0.05)。(如图1所示)。
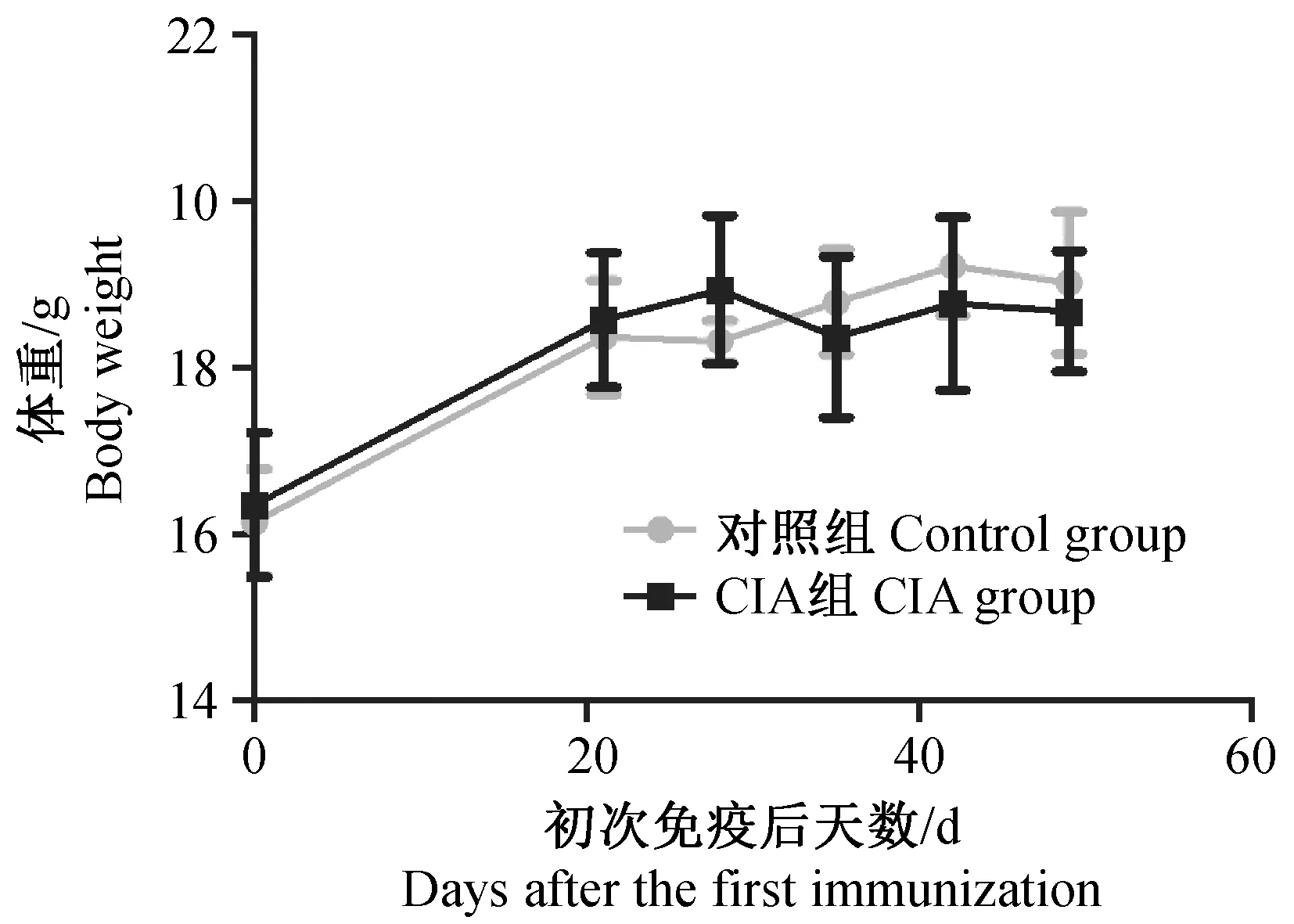
图1 CIA小鼠体重变化Fig.1 Body weight changes of the CIA mice
2.2CIA发生率

图2 小鼠CIA发生率Fig.2 Incidence rates of CIA in the mice
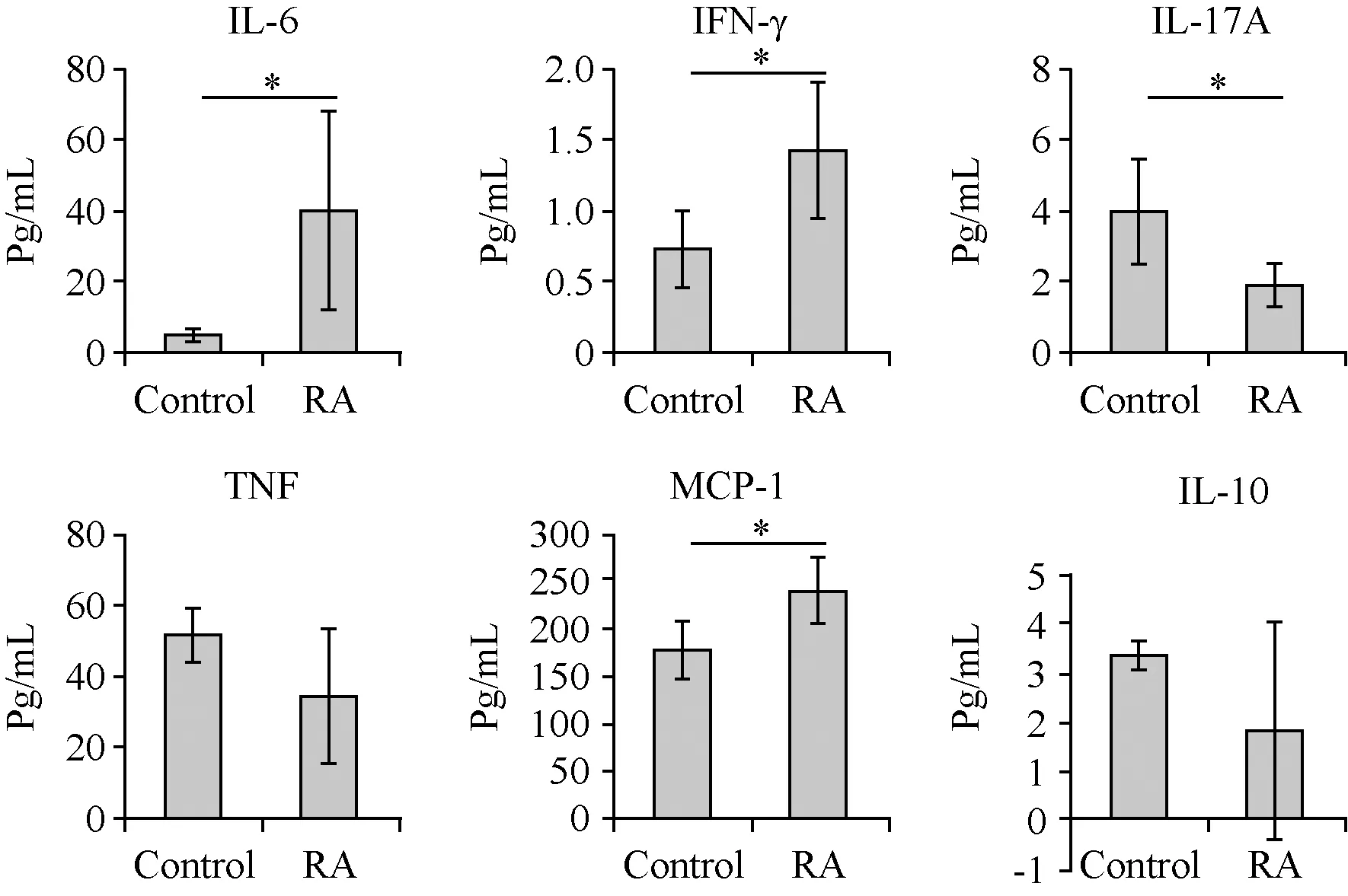
造模组小鼠于首次免疫后28 d,开始发病,35 d后发病率骤升;至62 d达到最高峰,发病率为90.0%(18/20)(如图2所示)。而正常组均未发病。2.3CIA小鼠足掌肿胀程度
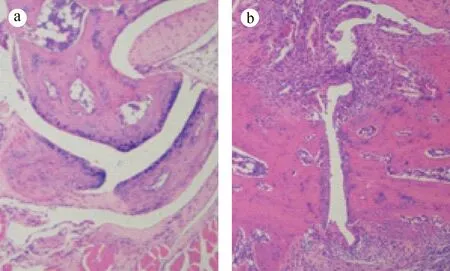
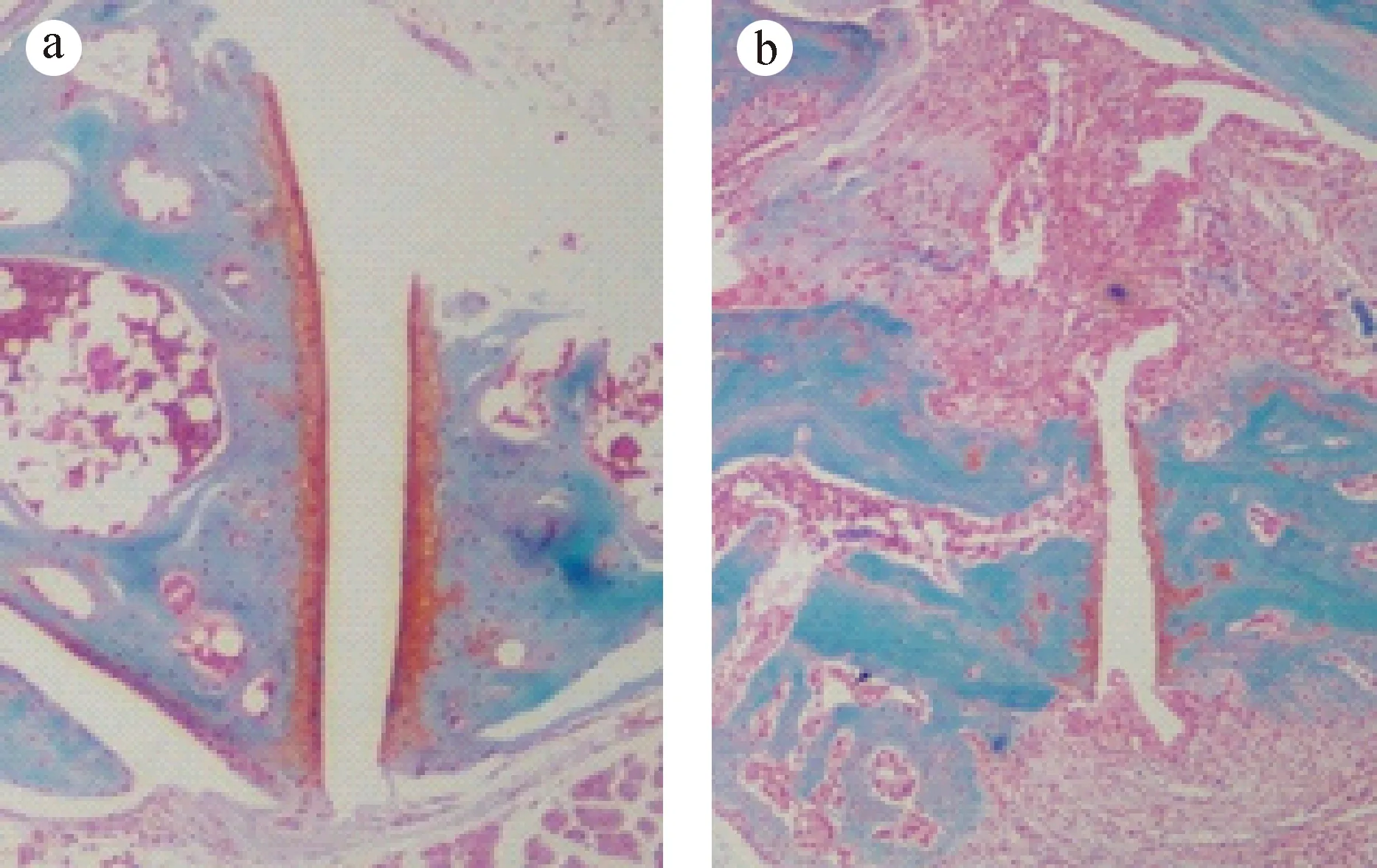
首次免疫后35 d,模型组小鼠足爪厚度开始增加,显著高于对照组(0.01 2.4CIA小鼠踝关节病理变化 注:与对照组相比,*P < 0.05,**P < 0.01。图3 CIA小鼠足爪肿胀厚度动态变化Note. Compared with the control group,*P < 0.05,**P < 0.01.Fig.3 Dynamic changes of swollen paws of the mice 2.4.1 HE染色结果 对照组小鼠踝关节的关节面完整,软骨呈粉红淡染,关节间隙正常,滑膜组织结构光滑,未见滑膜增生及炎性细胞浸润现象(图4a);而造模组小鼠滑膜组织严重增生,炎症细胞大量浸润,关节间隙严重缩窄,关节软骨破坏严重(图4b)。 注:a: 正常组;b: 造模组。图4 小鼠踝关节HE染色(×40)Note. a: Normal group; b: CIA group.Fig.4 Histology of ankle joints of the mice. HE staining 注:a: 正常组;b: 造模组。图5 小鼠踝关节番红O-快绿染色(×40)Note. a: Normal group; b: CIA group.Fig.5 Histology of ankle joints of the mice. Safranin O-fast green staining 注:与对照组相比,*P < 0.05。图6 CIA小鼠血清炎症因子水平Note. Compared with the control group,*P< 0.05.Fig.6 Serum levels of inflammatory cytokines of the CIA mice 2.4.2 番红O-快绿染色结果 正常组小鼠踝关节软骨组织光滑、完整(图5a);造模组可见软骨层缺损较严重,软骨细胞大量坏死,仅有散在番红O着色,软骨下潮线缺损,基质紊乱,细胞分布杂乱(图5b)。 2.5CIA小鼠血清炎症因子水平 如图6所示,造模组小鼠血清中促炎因子IL-6、IFN-γ、MCP-1水平显著高于对照组(P< 0.05),而抑炎因子IL-10低于对照组(P> 0.05),表明模型组小鼠炎症反应明显。此外,与对照组相比,模型组小鼠血清中IL-17A、TNF水平下降(如图6)。 本实验以雌性DBA/1J小鼠为对象,通过尾根部皮下注射C Ⅱ胶原乳剂,诱导CIA模型。首免28 d后,小鼠后足红肿,之后延伸到前足,并伴有体重下降现象。至实验末期,CIA发病率可达90%;造模小鼠血清IL-6、IFN-γ、MCP-1等促炎因子升高而抑炎因子IL-10降低,表明本实验成功诱导小鼠CIA模型。 有文献报道,DBA/1品系雄性小鼠比雌性对CIA更易感,其原因与雄性小鼠的应激因素和行为因素有关,雄鼠间的互相攻击可提高对CIA的易感性且对严重自发性肌腱附着点病变的发展有促进作用[6]。实际上,RA女性发病率明显高于男性[7],男女发病比约为1∶2~1∶3。故本研究特选用雌性小鼠进行造模,发病率高达90%,略低于文献中雄性小鼠发病率,但更符合人类RA发病性别特征,可为RA致病机制研究及RA药物效果评价提供较好的实验模型。 Th1/Th2细胞平衡紊乱及Th17细胞活化被公认为RA发病的重要机制之一[8]。CD4+T细胞被自身抗原或细胞因子刺激活化后,可分化为不同的功能亚群,例如Th1通过分泌IFN-γ、IL-6、TNF-α等效应因子介导细胞免疫,其功能异常将导致自身免疫病、慢性炎症等病理损伤[9],而Th2通过分泌IL-4、IL-10等效应因子发挥抗炎作用[10]。本实验发现模型小鼠血清中Th1相关的促炎因子IL-6、IFN-γ和MCP-1显著增加(P< 0.05),而Th2相关的抑炎因子IL-10降低,表明在CIA发病阶段Th1反应占主导地位,提示CIA小鼠发病与Th1/Th2失平衡有关。而出乎意料的是造模组IL-17A及TNF水平并未明显升高[11],这可能与剖杀小鼠时间略晚有关(首免62 d),此时小鼠关节炎症已从急性期进入消退期,相关炎症因子的表达水平受免疫调节而有所下降。 综上,本研究利用牛CⅡ免疫雌性DBA/1J小鼠,诱导出CIA模型,为进一步研究RA的致病机制和药物评价提供了实验基础。 [1] Cross M, Smith E, Hoy D, et al. The global burden of rheumatoid arthritis: estimates from the global burden of disease 2010 study [J]. Ann Rheum Dis, 2014, 73(7): 1323-1330. [2] Hegen M, Keith JC Jr, Collins M, et al. Utility of animal models for identification of potential therapeutics for rheumatoid arthritis [J]. Ann Rheum Dis, 2008, 67(11): 1505-1515. [3] Trentham DE, Townes AS, Kang AH. Autoimmunity to type Ⅱ collagen: an experimental model of arthritis [J]. J Exp Med, 1977, 146(3): 857-868. [4] Lories RJ, Matthys P, de Vlam K, et al.Ankylosing enthesitis, dactylitis, and onychoperiostitis in male DBA/1 mice: a model of psoriatic arthritis [J]. Ann Rheum Dis, 2004, 63(5): 595-598. [5] Simelyte E, Criado G, Essex D,et al. CD200-Fc, a novel antiarthritic biologic agent that targets proinflammatory cytokine expression in the joints of mice with collagen-induced arthritis [J]. Arthritis Rheum, 2008, 58(4): 1038-1043. [6] Jasson L, Holmdahl R. Estrogen-mediated immunosuppression in autoimmune diseases [J]. Inflamm Res, 1998, 47(7): 290- 301. [7] Hallert E, Thyberg I, Hass U, et al.Comparison between women and men with recent onset rheumatoid arthritis of disease activity and functional ability over two years (the TIRA project) [J]. Ann Rheum Dis, 2003, 62(7): 667-670. [8] Koshy PJ, Henderson N, Logan C, et al.Interleukin 17 induces cartilage collagen breakdown: novel synergistic effects in combination with proinflammatory cytokines [J]. Ann Rheum Dis, 2002, 61(8): 704-713. [9] Romagnani S. Human Th1 and Th2 subsets: doubt no more [J]. Immunol Today, 1991, 12(8): 256-257. [10] Yudoh K, Matsuno H, Nakazawa F, et al. Reduce expression of regulatory CD4+ T cell subset is related to Th1/Th2 balance and disease severity in rheumatoid arthritis [J]. Arthritis Rheum, 2000, 43(3): 617-627. [11] 肖智勇, 张令令, 张小锐, 等. 小鼠胶原诱导性关节炎模型的建立及其免疫学变化研究 [J]. 中国比较医学杂志, 2011, 21(10): 136-140. EstablishmentandcharacterizationofaDBA/1Jmousemodelofcollagen-inducedarthritis XU Hui-wen1, 2, 3#, HAO Wen-ting1, 2#, CHEN De-sheng1, 2, 3, ZHANG Ya-wen1, 2, 3,LU Yun-juan1, 2, 3, LI Xiang-yang1, 2, QIN Su-ping1, 2, PAN Wei1, 2* (1.Jiangsu Key Laboratory of Immunology and Metabolism, Xuzhou 221004, China; 2.Department of Pathogenic Biology and Immunology,Xuzhou Medical University, Xuzhou 221004; 3.Faculty of Clinical Medicine, Xuzhou Medical University, Xuzhou 221004) ObjectiveTo establish a DBA/1J mouse model of collagen-induced arthritis (CIA) and to characterize the pathological and immunological changes of the model.MethodsBovine type Ⅱ collagen (CⅡ) was emulsified in complete Freund’s adjuvant (CFA), subcutaneously injected at the root of tail of DBA/1J mice for primary immunization, and the injection was repeated 21 days later for secondary immunization. The changes of body weight, degree of joint swelling and other morphological indicators of arthritis were observed and pathological changes in the ankle joints were analyzed. The serum levels of inflammatory cytokines were detected by cytometric bead assay (CBA).ResultsThe body weight of the CIA mice began to decrease 35 days after primary immunization and was continuously lower than that in the control group. 28 days after the primary immunization, their paws began to tern red and swollen, and after 35 days, the thickness of swollen paws of the CIA mice was significantly greater than that in the control group (P< 0.05). The incidence rate of CIA reached 90% on the 62nd day. Pathological examination showed a narrowed articular space, hyperplasia of synovial tissue, inflammatory cell infiltration and varying degrees of cartilaginous damage. Compared with the control group, the serum levels of inflammatory cytokines IL-6, IFN-γ and MCP-1 were significantly increased in the CIA mice (P< 0.05), while the anti-inflammatory cytokine IL-10 was slightly decreased (P> 0.05).ConclusionsA collagen-induced arthritis model can be successfully established by subcutaneous injection of bovine collagen type Ⅱ emulsified in complete Freund’s adjuvant at the root of tail of DBA/1J mice, and provides a useful experimental tool for further studies of pathogenesis of and drug development for rheumatoid arthritis. DBA/1J mice; Bovine type Ⅱ collagen; Collagen-induced arthritis; Inflammatory cytokines R-33 A 1671-7856(2017) 09-0007-04 10.3969.j.issn.1671-7856. 2017.09.002 2017-01-15 国家自然科学基金(编号:81501762);大学生创新创业训练计划项目基金(编号:201510313017);江苏省博士后科研资助计划(编号:1501061A);江苏高校品牌专业建设工程一期项目(编号:PPZY2015B161)。 徐慧雯(1995-),女,本科生,E-mail: xuhuiwen0210@163.com; 郝文婷(1992-),女,免疫学专业硕士,E-mail: 1126678568@qq.com。#共同第一作者 潘伟(1984-),男,博士,讲师,主要从事自身免疫性疾病的分子免疫学研究。E-mail: panwei525@126.com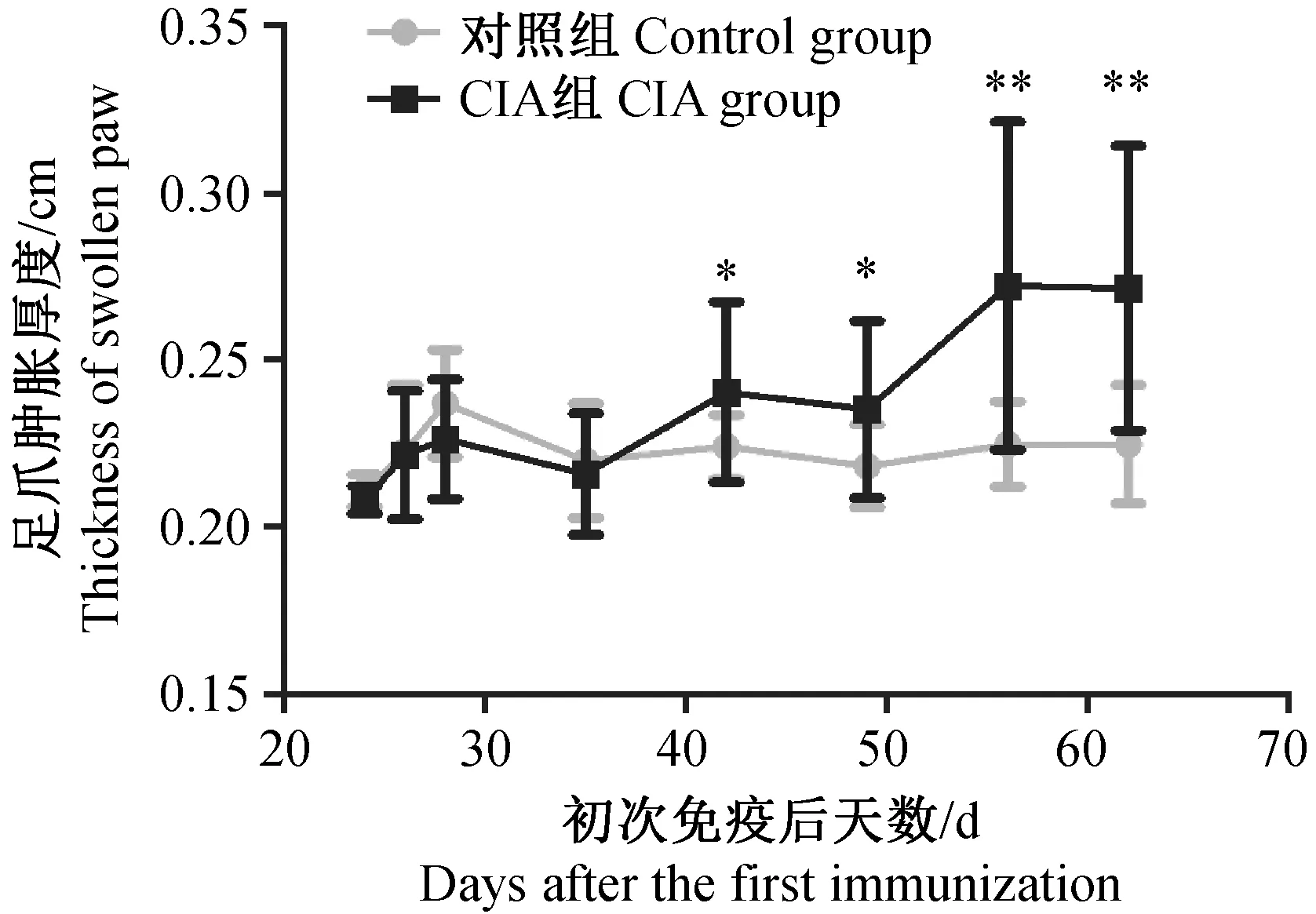
3 讨论
