转基因小鼠常见传染病血清学液相芯片技术多重检测方法的建立
2017-09-27朱科燕褚燕青齐月寒蔡月琴
陈 诚,朱科燕,褚燕青,齐月寒,蔡月琴
(浙江中医药大学动物实验研究中心,杭州 310053)
转基因小鼠常见传染病血清学液相芯片技术多重检测方法的建立
陈 诚,朱科燕,褚燕青,齐月寒,蔡月琴*
(浙江中医药大学动物实验研究中心,杭州 310053)
目的制备小鼠MHV、LCM、ECT和HANT液相芯片,建立转基因小鼠传染病抗体的xMAP多重检测方法。方法将荧光微球分别与小鼠MHV、LCM、ECT和HANT蛋白进行偶联,并且对最佳蛋白偶联量、检测抗体最佳工作浓度和Streptavidin-PE最佳工作浓度进行优化,制备小鼠MHV、LCM、ECT和HANT液相芯片,对56个转基因小鼠血清样品、阴性血清、阳性血清和质控血清进行xMAP多重检测。并应用传统的ELISA方法对xMAP检测结果进行验证。结果1)小鼠MHV、LCM、ECT和HANT蛋白的最佳偶联量分别为20 μg、20 μg、40 μg和20 μg,检测抗体最佳浓度分别为2 μg/mL、2 μg/mL、2 μg/mL和4 μg/mL;Streptavidin-PE抗体最佳浓度均为2 μg/mL;(2)xMAP检测结果显示,14号、23号、55号和56号转基因小鼠血清MHV MFI值和index值均高于质控血清,其余小鼠血清的MFI值和index值均低于质控血清,表明14号、23号、55号和56号转基因小鼠MHV抗体阳性,其余小鼠MHV、LCM、ECT和HANT抗体阴性;(3)ELISA检测结果显示,14号、23号、55号和56号转基因小鼠MHVA450值和index值均高于质控血清,其余小鼠血清的A450值和index值均低于质控血清,表明14号、23号、55号和56号转基因小鼠MHV抗体阳性,其余小鼠MHV、LCM、ECT和HANT抗体阴性,该ELISA检测结果与xMAP检测结果相一致。结论建立的xMAP多重检测技术可应用于转基因小鼠的传染病检测。
转基因小鼠;传染病;xMAP技术;液相芯片
xMAP技术(flexible multi-analyte profiling),又称液相芯片技术,该技术的核心是将微球用荧光染色进行编码,然后将每种编码微球共价交联上针对特定检测物的抗原、抗体或核酸探针等捕获分子,把针对不同检测物的编码微球混合,再加入微量待检样本,在悬液中靶分子与微球表面交联的捕获分子发生特异性结合,最后通过仪器的激光分别识别微球的编码和检测微球上报告分子的荧光强度[1, 2]。
转基因动物已成为当今生命科学中一个发展最快、最热门的领域,用转基因动物的方法构建人类疾病模型可为研究提供理想的动物模型,但是目前转基因小鼠的微生物质量不容乐观,这将严重危害人类健康和科研实验[3, 4]。根据对实验小鼠的致病性和对实验人员的危害来看,必须对小鼠肝炎病毒(mouse hepatitis virus,MHV)、淋巴细胞性脉络丛脑膜炎病毒(lymphocytic choriomeningitis virus,LCM)、鼠痘病毒(ectromilia virus,ECT)、汉坦病毒(Hantaan virus,HANT)进行监测,排除此类病原体[5-8]。本研究拟通过制备MHV、LCM、ECT和HANT蛋白芯片,建立快速、高通量的血清学多重xMAP技术,并用ELISA方法验证,为最终建立转基因小鼠的传染病监测体系奠定基础。
1 材料和方法
1.1实验动物
56只转基因小鼠,其中1~22号于2016年3月从国内某动物研究所引进,23~56号于2015年分批从国外实验室引进,均饲养于浙江中医药大学实验研究中心屏障级转基因动物隔离饲养室 [SYXK (浙) 2013-0184],温度(22±2)℃,相对湿度40%~60%。1.2实验试剂
体外重组的MHV、LCM、ECT和HANT蛋白以及biotin标记的MHV、LCM、ECT和HANT抗体均购自武汉华美公司;荧光标记的链霉亲和素(Streptavidin-PE)购自Invitrogen公司;活化剂EDC、Sulfo-NHS购自Thermo公司;96孔PVDF滤膜板购自Millipore公司;荧光微球、鞘液、Bio-Plex校正试剂盒均购自Bio-Rad公司;小鼠MHV、LCM、ECT和HANT阴性血清、阳性血清和质控血清以及ELISA试剂盒均购自Smart公司。
1.3实验方法
1.3.1 样品制备
分别从新引进的转基因小鼠尾巴取适量血,置于1.5 mL离心管中,4℃,3000 r/min,离心10 min,分离血清,-20℃冻存。
1.3.2 小鼠MHV、LCM、ECT和HANT液相芯片的制备
一种编码的荧光微球对应偶联一种蛋白,30号、36号、47号和56号4种荧光微球,分别与体外重组亲和纯化的MHV、LCM、ECT和HANT蛋白进行偶联,每种蛋白设置4个梯度(分别为10、20、40和80 μg)。荧光微球经S-NHS、EDC活化液室温避光活化30 min,分别与10、20、40和80 μg的MHV蛋白偶联,在垂直旋转仪上室温避光偶联2 h,已偶联蛋白的微球加1% BSA封闭1 h,该微球即为制备的小鼠MHV单重液相芯片,于4℃避光保存,用于后期效率验证。
按照以上制备方案,将36号荧光微球与LCM蛋白偶联,47号荧光微球与ECT蛋白偶联,56号荧光微球与HANT蛋白偶联制备液相芯片。
1.3.3 小鼠MHV、LCM、ECT和HANT液相芯片制备的验证及蛋白最佳偶联量的确定
将制备的小鼠MHV、LCM、ECT和HANT液相芯片与PE抗体直接反应,阴性孔加入未偶联蛋白的微球作为阴性对照,在Bio-Plex 200液相悬浮芯片系统上检测荧光值。MHV、LCM、ECT和HANT液相芯片的荧光值超过2000荧光强度(median fluorescence intensity,MFI),阴性对照孔低于100 MFI,即可认为偶联成功。每组芯片中,选取与最高蛋白浓度差异无显著性的蛋白量作为最佳偶联量。
1.3.4 检测抗体和Streptavidin-PE最佳工作浓度的确定
用1% PBSB溶液分别将biotin标记的MHV、LCM、ECT和HANT抗体稀释成4个浓度组,分别为0.5 μg/mL、1 μg/mL、2 μg/mL、4 μg/mL,Streptavidin-PE稀释成3个浓度组,分别为1 μg/mL、2 μg/mL、4 μg/mL,每组3个复孔,采用棋盘滴定法确定最佳检测抗体浓度和Streptavidin-PE工作浓度。
1.3.5 小鼠血清MHV、LCM、ECT和HANT抗体的xMAP检测
用制备的MHV、LCM、ECT和HANT液相芯片,对56个转基因小鼠血清样品、阴性血清、阳性血清和质控血清进行xMAP检测。取PVDF滤膜板,同一反应孔分别加入100 μL(1×104个)MHV、LCM、ECT和HANT液相芯片微球,用PBST溶液洗涤两次,25 μL小鼠血清,室温避光慢摇(450 r/min)60 min,洗涤3次,加入混合的biotin标记的MHV、LCM、ECT和HANT检测抗体,100 μL/孔,室温避光慢摇(450 r/min)60 min,洗涤3次,每孔加入100 μL Streptavidin-PE,室温避光慢摇(450 r/min)30 min,洗涤3次,在液相悬浮芯片系统上机检测荧光值,得到每个样品的MFI值,小鼠血清样品的index=血清样品的MFI值/质控血清的MFI值。
1.3.6 小鼠血清MHV、LCM、ECT和HANT抗体的ELISA验证
分别用MHV、LCM、ECT和HANT进口ELISA检测试剂盒对同一批56个转基因小鼠血清样品、阴性血清、阳性血清和质控血清进行检测。分别取50 μL阴性血清、阳性血清、稀释后的小鼠血清样品和质控血清加入到包被MHV抗体的酶标板孔中,按照MHV试剂盒说明书操作,最后在多功能酶标仪上检测A450。按照以上操作方法,用LCM、ECT和HANT ELISA检测试剂盒对同一批56个转基因小鼠血清样品、阴性血清、阳性血清和质控血清进行检测。
1.4统计学方法和结果判定
2 结果
2.1小鼠MHV、LCM、ECT和HANT液相芯片制备的验证和最佳偶联量的确定
MHV、LCM、ECT和HANT阴性孔的荧光值分别为16.2 MFI、10.5 MFI、12.0 MFI和9.8 MFI,均低于100 MFI。表1显示,在MHV、LCM、ECT和HANT中,4组偶联量的荧光值均大于2000 MFI,表明MHV、LCM、ECT和HANT液相芯片制备成功。
表1可以看出,在MHV、LCM和HANT芯片中,20 μg组、40 μg组、80 μg捕获抗体组的MFI值均显著高于10 μg组(P< 0.01),40 μg组、80 μg组与20 μg组比较差异无显著性(P> 0.05);在ECT芯片中,40 μg组、80 μg捕获抗体组的MFI值均显著高于10 μg组和20 μg组(P< 0.05,P< 0.01),40 μg组与80 μg组差异无显著性(P> 0.05)。根据以上优化试验,MHV、LCM、ECT和HANT蛋白的最佳偶联量分别为20、20、40和20 μg捕获抗体。
2.2小鼠MHV、LCM、ECT和HANT检测抗体最佳工作浓度的确定
Biotin标记的MHV、LCM、ECT和HANT检测抗体稀释为0.5 μg/mL、1 μg/mL、2 μg/mL、4 μg/mL 4组,表2结果显示,在MHV、LCM和ECT中,4 μg/mL组、2 μg/mL组的MFI值均显著高于0.5 μg/mL、1 μg/mL组(P< 0.01),4 μg/mL组与2 μg/mL组差异无显著性(P> 0.05);在HANT中,4 μg/mL组的MFI值最高,显著高于0.5 μg/mL、1 μg/mL、2 μg/mL组(P< 0.05,P< 0.01)。据此,MHV、LCM、ECT和HANT检测抗体最佳工作浓度分别为2 μg/mL、2 μg/mL、2 μg/mL和4 μg/mL。
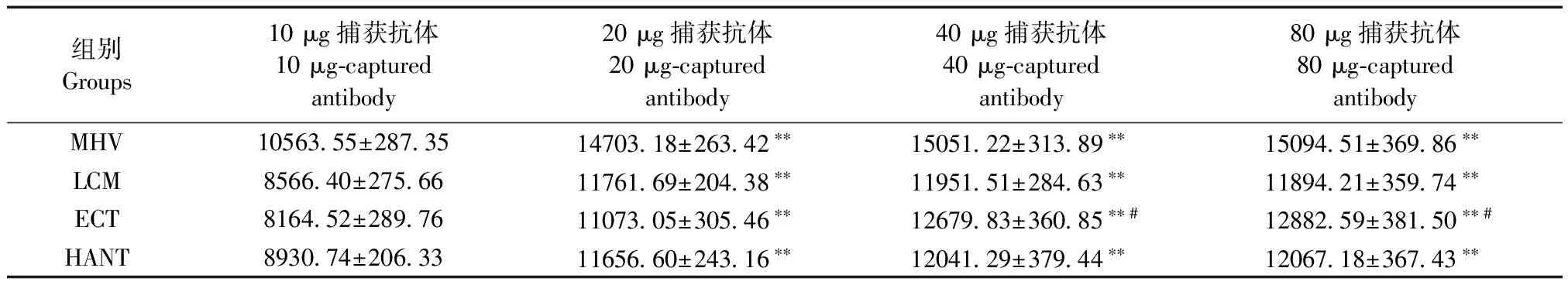
表1 MHV、LCM、ECT和HANT不同蛋白偶联量的荧光值(MFI)
注:与10 μg蛋白偶联量组相比,*P< 0.05,**P< 0.01;与20 μg蛋白偶联量组相比,#P< 0.05,##P< 0.01。
Note. Compared with the group of 10 μg-captured antibody,*P< 0.05,**P< 0.01; Compared with the group of 20 μg-captured antibody,#P< 0.05,##P< 0.01.
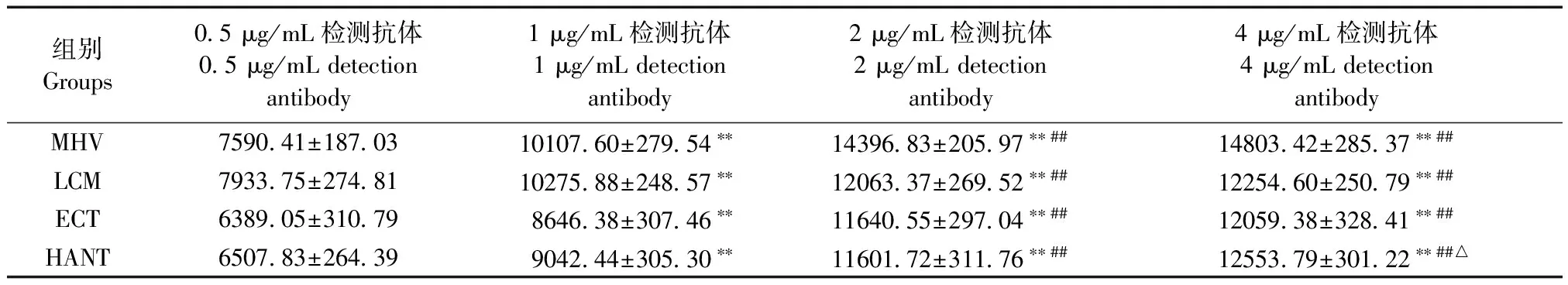
表2 MHV、LCM、ECT和HANT不同检测抗体浓度的荧光值(MFI)
注:与0.5 μg/mL检测抗体组相比,**P< 0.01;与1 μg/mL检测抗体组相比,##P< 0.01;与2 μg/mL检测抗体组相比,△P< 0.05。
Note. Compared with the group of 0.5 μg/mL detection antibody,**P< 0.01; Compared with the group of 1 μg/mL detection antibody,##P< 0.01; Compared with the group of 2 μg/mL detection antibody,△P< 0.05.
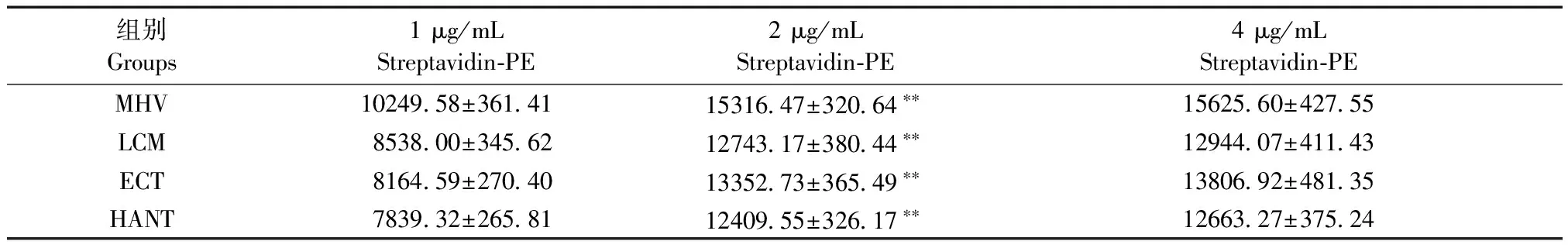
表3 MHV、LCM、ECT和HANT不同Streptavidin-PE抗体浓度的荧光值(MFI)
注:与1 μg/mL Streptavidin-PE组相比,**P< 0.01;与2 μg/mL Streptavidin-PE组相比,##P< 0.01。
Note. Compared with 1 μg/mL Streptavidin-PE,**P< 0.01; Compared with 2 μg/mL Streptavidin-PE,##P< 0.01.
2.3Streptavidin-PE最佳工作浓度的确定
Streptavidin-PE浓度有1 μg/mL、2 μg/mL、4 μg/mL 3组,由表3可见,在MHV、LCM、ECT和HANT中,2 μg/mL、4 μg/mL组的MFI值均显著高于1 μg/mL组(P< 0.01),4 μg/mL组与2 μg/mL组相比差异无显著性(P> 0.05)。表明,MHV、LCM、ECT和HANT的最佳Streptavidin-PE抗体浓度均为2 μg/mL。
2.4小鼠血清MHV、LCM、ECT和HANT抗体的xMAP检测结果
14号、23号、55号和56号转基因小鼠血清的MHV MFI值分别为18813.88、16924.57、20780.34和13659.18,index值分别为2.6823、2.4130、2.9627和1.9474,均高于质控血清的MFI值(7014.04)和index值(1.0000),表明14号、23号、55号和56号转基因小鼠MHV抗体阳性;1~13号、15~22号、24~54号转基因小鼠血清的MHV MFI值和index值均低于质控血清的MFI值和index值,表明这些转基因小鼠MHV抗体阴性。1~56号转基因小鼠血清的LCM、ECT和HANT的MFI值和index值均低于质控血清的MFI值和index值,表明这些转基因小鼠LCM、ECT和HANT抗体阴性。
2.5小鼠血清MHV、LCM、ECT和HANT抗体的ELISA方法验证
分别用进口MHV、LCM、ECT和HANT ELISA试剂盒对同一批56个转基因小鼠血清样品、阴性血清、阳性血清和质控血清进行检测,得到每个样品的A450值,小鼠血清样品的index=血清样品的A450值/质控血清的A450值。14号、23号、55号和56号转基因小鼠血清的MHVA450值分别为3.3127、3.0113、3.6234和2.4365,index值分别为2.5437、2.3122、2.7822和1.8709,均高于质控血清的A450值(1.3023)和index值(1.0000),表明14号、23号、55号和56号转基因小鼠MHV抗体阳性;1~13号、15~22号、24~54号转基因小鼠血清的MHVA450值和index值均低于质控血清的A450值和index值,表明这些转基因小鼠MHV抗体阴性。1~56号转基因小鼠血清的LCM、ECT和HANT的MFI值和index值均低于质控血清的A450值和index值,表明这些转基因小鼠LCM、ECT和HANT抗体阴性。
由此表明,转基因小鼠血清的MHV、LCM、ECT和HANT抗体ELISA结果与xMAP检测结果相一致。
3 讨论
在医学研究中,利用转基因动物建立各种人类疾病的动物模型,为深入研究疾病的发病机理以及基因治疗创造了前所未有的条件[9, 10]。目前,国内使用的转基因实验动物主要以小鼠为主,大部分转基因小鼠通过代购或者自行携带方式从国外输入,由于受饲养环境控制条件不同等限制,转基因小鼠的微生物质量存在着严重的问题。由于多数感染病毒的转基因小鼠早期缺乏特异的临床表现,必须依赖实验室进行诊断,常用的血清学检测方法主要有酶联免疫吸附试验(ELISA)[11, 12]。ELISA这种传统检测方法的主要缺点在于每个反应仅能对标本的一种传染病指标进行检测,且操作耗时较长、成本较高、血清样本使用量较大,不适用于转基因小鼠多种传染病的多重检测和快速诊断。
xMAP技术即多功能多指标同步分析技术,提供了一个高通量的多重分子检测技术平台[13]。xMAP技术与传统的ELISA检测方式有很大的区别,该技术可以在一种反应体系中放入许多不同编码的荧光微球,多种微球可以标记上多种不同的蛋白,每种荧光微球对应一种传染病待测指标,因此xMAP技术同时可对一份血清样品进行多种分析指标的检测,标本利用率大大提高,从而实现样品量少的转基因动物血清的高通量分析[14, 15]。本研究应用了30号、36号、47号和56号4种微球,分别与MHV、LCM、ECT和HANT蛋白进行共价偶联,并且对小鼠MHV、LCM、ECT和HANT悬浮芯片制备中的最佳蛋白偶联量进行了优化,发现小鼠MHV、LCM、ECT和HANT蛋白的最佳偶联量分别为20 μg、20 μg、40 μg和20 μg,表明每种蛋白的最佳偶联量存在差异,因此每个蛋白必须确定其最佳偶联量。此外本研究对小鼠MHV、LCM、ECT和HANT检测抗体最佳工作浓度和Streptavidin-PE最佳工作浓度进行优化,选取与最高MFI值组无显著性差异的抗体浓度作为检测抗体和Streptavidin-PE的最佳工作浓度。
根据上述优化的条件,制备小鼠MHV、LCM、ECT和HANT液相芯片,对56个转基因小鼠血清样品、阴性血清、阳性血清和质控血清进行xMAP检测,发现阴性血清MHV、LCM、ECT和HANT中的index值均低于1.0,阳性血清的index值均高于1.0,表明该xMAP检测结果可信。从结果中看出,只有14号、23号、55号和56号转基因小鼠血清MHV的index值均高于1.0,表明14号、23号、55号和56号转基因小鼠MHV抗体阳性。此外分别用进口小鼠MHV、LCM、ECT和HANT的ELISA检测试剂盒对同一批56个转基因小鼠血清样品、阴性血清、阳性血清和质控血清进行一一检测,发现只有14号、23号、55号和56号转基因小鼠MHV抗体阳性,其余为阴性,该ELISA检测结果与xMAP检测结果相一致。
这些结果表明本研究建立的xMAP多重检测技术可应用于转基因小鼠的传染病检测,可对一份少量的血清样品进行多种传染病指标的检测,克服了ELISA每个反应仅能检测一种传染病指标的缺点,从而实现转基因小鼠传染病抗体的高通量分析,为建立转基因小鼠的传染病监测体系奠定基础。
[1] Simonova MA, Valyakina TI, Petrova EE, et al. Development of xMAP assay for detection of six protein toxins [J]. Anal Chem, 2012, 84(15): 6326-6330.
[2] Thierry S, Derzelle S. Multiplexed genotyping ofBacillusanthracisby Luminex xMAP suspension array [J]. Methods Mol Biol, 2015, 1247: 401-412.
[3] Li W, Shuai L, Wan H, et al. Androgenetic haploid embryonic stem cells produce live transgenic mice [J]. Nature, 2012, 490(7420): 407-411.
[4] Li LP, Lampert JC, Chen X, et al. Transgenic mice with a diverse human T cell antigen receptor repertoire [J]. Nat Med, 2010, 16(9): 1029-1034.
[5] Van Cuong N, Carrique-Mas J, Vo Be H, et al. Rodents and risk in the Mekong Delta of Vietnam: seroprevalence of selected zoonotic viruses in rodents and humans [J]. Vector Borne Zoonotic Dis, 2015, 15(1): 65-72.
[6] Parker S, Crump R, Foster S, et al. Co-administration of the broad-spectrum antiviral, brincidofovir (CMX001), with small-pox vaccine does not compromise vaccine protection in mice challenged with ectromelia virus [J]. Antiviral Res, 2014, 111: 42-52.
[7] Islam MM, Toohey B, Purcell DF, et al. Suppression subtractive hybridization method for the identification of a new strain of murine hepatitis virus from xenografted SCID mice [J]. Arch Virol, 2015, 160(12): 2945-2955.
[8] Ma C, Wang Z, Li S, et al. Analysis of an outbreak of hemorrhagic fever with renal syndrome in college students in Xi’an, China [J]. Viruses, 2014, 6(2): 507-515.
[9] Todd JA. Intolerable secretion and diabetes in tolerant transgenic mice, revisited [J]. Nat Genet, 2016, 48(5): 476-477.
[10] 叶廷巧, 马双陶, 李丹, 等. 钙蛋白酶抑制蛋白转基因小鼠的构建和鉴定 [J]. 中国实验动物学报, 2014, 22(4): 47-51.
[11] Plastino M, Fava A, Pirritano D, et al. Effects of insulinic therapy on cognitive impairment in patients with Alzheimer disease and diabetes mellitus type-2 [J]. J Neurol Sci, 2010, 288 (1-2): 112-116.
[12] Sims-Robinson C, Kim B, Rosko A, et al. How does diabetes accelerate Alzheimer disease pathology? [J]. Nat Rev Neurol, 2010, 6(10): 551-559.
[13] Bongoni AK, Lanz J, Rieben R, et al. Development of a bead-based multiplex assay for the simultaneous detection of porcine inflammation markers using xMAP technology [J]. Cytometry A, 2013, 83(7): 636-647.
[14] Wang LS, Leung YY, Chang SK, et al. Comparison of xMAP and ELISA assays for detecting cerebrospinal fluid biomarkers of Alzheimer’s disease [J]. J Alzheimers Dis, 2012, 31(2): 439-445.
[15] Codorean E, Nichita C, Albulescu L, et al. Correlation of XMAP and ELISA cytokine profiles; development and validation for immunotoxicological studiesinvitro[J]. Roum Arch Microbiol Immunol, 2010, 69(1): 13-19.
Establishmentofaflexiblemulti-analyteprofilingassaytodetectcommoninfectiousdiseaseantibodiesintheserumoftransgenicmice
CHEN Cheng, ZHU Ke-yan, CHU Yan-qing, Qi Yue-han, CAI Yue-qin*
(Animal Experiment Research Center, Zhejiang Chinese Medical University, Hangzhou 310053, China)
ObjectiveTo establish a multiplex xMAP assay for detection of infectious disease antibodies in the serum of transgenic mice by liquid chips of mouse MHV, LCM, ECT and HANT proteins.MethodsThe fluorescent microspheres were conjugated with mouse MHV, LCM, ECT and HANT proteins, and the amount of protein-conjugates and the working concentrations of antibodies and Streptavidin-PE were optimized, respectively. The liquid chips of mouse MHV, LCM, ECT and HANT were prepared and used to detect the antibodies in the serum samples from 56 transgenic mice, together with the negative, positive and control serum, by the multiplex xMAP assay. The results of xMAP assay were verified by traditional ELISA.Results(1) The optimal conjugated amount of mouse MHV, LCM, ECT and HANT protein was 20 μg, 20 μg, 40 μg and 20 μg, respectively. The optimal concentration of their detection antibodies was 2 μg/mL, 2 μg/mL, 2 μg/mL and 4 μg/mL, and the optimal concentration of Streptavidin-PE for all of them was 2 μg/mL. (2) The results of xMAP assay showed that the MFI and index values of the serum samples from the No. 14, No. 23, No. 55 and No. 56 transgenic mice detected with the liquid chip of MHV were higher than those of the control serum, while other MFI and index values were lower than those of the control serum, indicating that the antibodies of MHV were positive in the No. 14, No. 23, No. 55 and No. 56 transgenic mice and negative in the other mice, and the antibodies of LCM, ECT and HANT were negative in all of the mice. (3) The results of ELISA showed that theA450 and index values of MHV in the No.14, No.23, No.55 and No.56 transgenic mice were higher than those of the control serum, while otherA450 and index values were lower than those of the control serum, indicating that the antibodies of MHV were positive in the No.14, No.23, No.55 and No.56 transgenic mice and negative in the other mice, and the antibodies of LCM, ECT and HANT were negative in all of the mice. These ELISA results were consistent with the results of the xMAP assay.ConclusionsThe multiplex xMAP assay established in this study can be used in the detection of infectious disease antibodies in transgenic mice.
Transgenic mice; Infectious diseases; Flexible multi-analyte profiling, xMAP; Liquid chip
R-33
A
1671-7856(2017) 09-0030-06
10.3969.j.issn.1671-7856. 2017.09.006
2017-01-04
