新型聚合物多孔涂层毛细管开管柱的制备及电色谱研究
2017-09-26莫荣珍徐树娟季一兵
莫荣珍,徐树娟,金 灿,王 伟,季一兵
(中国药科大学 理学院,江苏 南京 210009)
新型聚合物多孔涂层毛细管开管柱的制备及电色谱研究
莫荣珍,徐树娟,金 灿,王 伟*,季一兵*
(中国药科大学 理学院,江苏 南京 210009)
以甲基丙烯酸缩水甘油酯(GMA)和乙二醇二甲基丙烯酸酯(EDMA)为前驱体制备了新型聚合物多孔涂层毛细管开管(PLOT)柱固定相。通过优化聚合反应时间、致孔剂比例及交联剂比例获得了色谱性能良好的PLOT柱,扫描电镜结果显示毛细管柱内的多孔涂层厚度适中且均匀。在毛细管电色谱模式下,PLOT柱以反相色谱分离机理有效分离了中性、酸性和碱性小分子。人血清白蛋白(HSA)共价结合的蛋白亲和PLOT柱对5对手性对映体实现了较好的分离,且其分离度远高于HSA修饰的单层聚合物毛细管开管柱。PLOT柱分离烷基苯的日内、日间和柱间的相对标准偏差分别小于1.7%、4.8%和7.8%。
多孔涂层毛细管开管柱;毛细管电色谱;人血清白蛋白;手性分离
手性分离是现代药学研究的热点,常用的手性分离方法有手性衍生化法、手性添加法和手性固定相法等。手性固定相法因手性选择剂用量少、不需衍生化样品等优点而备受关注。人血清白蛋白(HSA)作为一种常用的蛋白类手性固定相,因具有手性识别位点多、范围广的优点[1],常被用于手性药物分离[2-4]或蛋白-药物相互作用[5-7]的研究。目前研究中HSA多作为整体柱手性固定相,但分离柱效较低[8-9]。而毛细管开管柱几乎没有涡流扩散现象,可有效提高分离柱效,且具备分离速度快、柱渗透性好、制备过程简单、不易产生气泡和断流现象等优点[10]。然而相对比表面积小和柱容量低限制了开管柱在手性分离领域中的应用。
多孔涂层毛细管开管(PLOT)柱是在毛细管柱内涂覆或键合上一定厚度的多孔涂层固定相。与其他类型开管柱相比,多孔涂层固定相能更有效地增加开管柱的相对比表面积和柱容量。目前PLOT柱多用于气相色谱(GC)[11-13]、液相色谱(LC)[14-16]和固相萃取[17-18]等分离领域,在毛细管电色谱(CEC)中的应用研究较少。而CEC兼备毛细管电泳(CE)高效性和高效液相色谱(HPLC)高选择性的双重优点,与PLOT柱联用可以提高样品分析速度、分离柱效和灵敏度,减少样品用量和分析成本。
常用于制备PLOT柱多孔涂层的材料有金属骨架[19]、硅胶颗粒[20]等非聚合物和聚合物[21-23]两大类。研究表明,聚合物材料比非聚合物材料具备更稳定的物理、化学性质,表面的官能团更易改性,能满足更多的分离分析需求。聚合物多孔涂层是通过热或光引发的原位聚合反应制得,光引发法反应速度快难控制、且需昂贵的特氟龙毛细管柱和特殊的反应设备。热引发法反应速度慢、操作简单易行,更适合于PLOT柱的制备[24]。目前文献中关于热引发制备PLOT柱的步骤过于繁琐或耗时[23,25-27],因此探索一种制备简单且周期短的PLOT柱制备工艺具有重要的研究意义。
本文以甲基丙烯酸缩水甘油酯(GMA)和乙二醇二甲基丙烯酸酯(EDMA)为前驱体在热引发下制备了新型的聚合物多孔涂层毛细管开管柱,该方法经济环保,简单易行,有效缩短了PLOT柱的制备周期。与单层聚合物毛细管开管柱相比,新型PLOT柱在CEC模式下对中性、碱性和酸性小分子的分离效果明显提高,这表明聚合物多孔涂层的引入有效增加了毛细管开管柱的柱容量。本文首次将HSA以戊二醛法共价结合到PLOT柱中,实现了5对手性对映体的有效分离,为开管柱在手性药物分离的应用提供了参考,具有较好的发展前景。
1 实验部分
1.1 仪器与试剂
HP3DCE 7100 毛细管电泳仪(美国Agilent公司),S-3400NⅡ扫描电子显微镜(日本Hitachi公司);Agilent 1200高效液相色谱仪(美国Agilent公司);ODGC-14B气相色谱柱温箱(日本Shimadzu公司);pHs-25型pH计(上海精密科学仪器有限公司);电子分析天平(美国Sartorius公司);SWQ-IA智能数字恒温水浴锅(南京桑力电子设备厂)。
石英毛细管柱(50 μm I.D.×365 μm O.D.,河北永年锐沣色谱器件有限公司);GMA、EDMA、γ-甲基丙烯酸氧丙基三甲氧基硅烷(γ-MAPS)、正丙醇、1,4-丁二醇、戊二醛、氰基硼氢化钠(NaCNBH3)、乙苯、丙苯、丁苯(上海阿拉丁试剂有限公司);偶氮二异丁腈(AIBN,上海第四试剂厂);人血清白蛋白(HSA,美国Sigma公司);硫脲、苯甲酸类、苯胺类、手性药物消旋体(南京化学试剂厂)。其余试剂均为分析纯,实验用水为纯净水。所有试剂使用前经0.22 μm有机微孔滤膜过滤。
1.2 蛋白亲和PLOT柱的制备
1.2.1毛细管柱预处理毛细管柱依次用1 mol/L的NaOH溶液和0.1 mol/L的HCl溶液冲洗,水冲至中性,氮气挥干。注入50%(体积分数) 的γ-MAPS甲醇溶液,柱密封后50 ℃水浴反应12 h,甲醇冲洗,氮气挥干,备用。
1.2.2 PLOT柱的制备精密称取3.5 mg AIBN,加入一定体积GMA、EDMA、1,4-丁二醇和正丙醇溶液,其中(GMA+EDMA)/(正丙醇+1,4-丁二醇)为35%(质量比),摇匀后通氮除氧,注入预处理好的毛细管柱内,柱密封后60 ℃水浴反应一段时间,甲醇冲掉多余反应液后冲水,备用。该柱为PLOT柱。
1.2.3蛋白亲和PLOT柱的制备将15%的氨水溶液注入PLOT柱内,柱密封后40 ℃水浴反应5 h,水冲至中性,得氨基柱(NH2-PLOT柱)。用100 mmol/L磷酸盐溶液(pH 8.0) 配制的10%戊二醛反应液避光动态注入氨基柱5 h,水冲至中性,得戊二醛柱(GA-PLOT柱)。室温下用100 mmol/L磷酸盐溶液(pH 4.5) 配制2 g/L的HSA反应溶液(含NaCNBH31 g/L)动态灌注戊二醛柱10 h,用100 mmol/L磷酸盐溶液(pH 4.5)冲柱2 h,运行缓冲液平衡1 h,得蛋白亲和PLOT柱(HSA-PLOT柱)。
1.2.4蛋白修饰的单层聚合物毛细管开管柱的制备根据参考文献[28]制备GMA触须式聚合物毛细管开管柱(GMA柱),以“1.2.3”方法制备HSA修饰的触须式聚合物毛细管开管柱(HSA-GMA柱)。
1.3 电色谱条件
毛细管柱使用前用运行缓冲液平衡30 min至基线平稳;小分子的检测波长为210 nm,手性对映体的检测波长为214 nm;运行电压为10~30 kV,柱温为20~30 ℃;柱长为41.5 cm,有效柱长为30 cm。
2 结果与讨论
2.1 聚合反应条件的优化

表1 不同聚合反应时间对PLOT柱渗透性和电渗流的影响Table 1 Influence of polymerization time on the permeability and EOF of PLOT column
experimental conditions:ratio of monomers(GMA-EDMA):2∶1;ratio of porogens(n-propano-1,4-butanediol):6∶1;running buffer:10 mmol/L phosphate buffer(pH 7.0);applied voltage:20 kV;injection:2 kV×2 s;EOF marker,thiourea
2.1.1聚合反应时间的优化聚合反应时间在一定程度上会影响聚合物多孔涂层的厚度。为获得涂层厚度适中的PLOT柱,本实验以扫描电镜(SEM)、电渗流(EOF)和柱渗透性(以渗透率K值表示)结果为依据,考察了不同聚合反应时间对PLOT柱涂层形貌结构和色谱性能的影响。结合图1和表1实验结果发现:随着聚合反应时间从30 min 延长至50 min,毛细管柱内涂层厚度不断增加(图1),电渗流和渗透性降低(表1)。若反应时间过短,形成的多孔涂层太薄,不能有效增加柱容量;若反应时间太长,形成的涂层过厚,亦不能保持良好的柱渗透性和电渗流。综合考虑涂层均匀度、柱渗透性和电渗流,选择聚合反应时间为40 min。
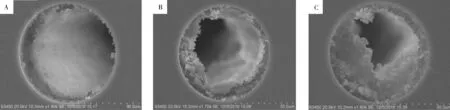
图1 不同反应时间制备的多孔涂层扫描电镜图Fig.1 SEM images of polymer porous layer after different polymerization times A.30 min,B.40 min,C.50 min;the other experimental conditions were the same as those in Table 1

表2 交联剂比例和致孔剂比例对PLOT柱渗透性和电渗流的影响Table 2 Influence of ratio of cross-linker (GMA-EDMA)and porogens(n-propanol-1,4-butanediol) on the permeability and EOF of PLOT column
*the EOF cannot be measured by bubbles or plugging of capillary column
2.1.2交联剂比例的优化聚合物反应液中单体交联剂比例对多孔涂层形貌结构和机械性能的影响较大[29]。本实验中保持单体交联剂与致孔剂的比例不变,考察了不同交联剂比例(质量比)对PLOT柱性能的影响。结果如表2所示:当GMA-EDMA为3∶1时制备的PLOT柱渗透性和电渗流较差;当GMA-EDMA为3∶2时制备的PLOT柱多孔涂层较疏松,未能牢固结合到毛细管柱内壁上,导致电渗流不稳定;而GMA-EDMA为2∶1时制备的PLOT柱有较好的柱渗透性和稳定的电渗流。这可能是由于交联剂EDMA含量的增加使多孔涂层的孔径变小,导致PLOT柱渗透性和电渗流变小。综合考虑柱渗透性和电渗流,选择GMA-EDMA(2∶1)制备PLOT柱。
2.1.3致孔剂比例的优化本文使用正丙醇和1,4-丁二醇组成的二元致孔剂系统,正丙醇含量增加会使聚合反应相分离提早发生,使得多孔涂层孔径变大,导致PLOT柱渗透性和电渗流增大[29]。由表2可知,正丙醇含量较低(1∶1、3∶1)时制备的PLOT柱渗透性和电渗流较小;而正丙醇含量过高(9∶1)时,形成的多孔涂层稀疏且不能牢固地结合到毛细管柱内壁上,导致了不稳定的电渗流。当正丙醇比例适中(6∶1)时所制备的PLOT柱渗透性较好,电渗流较稳定,更适于PLOT柱的制备。
2.2 PLOT柱的电色谱性能研究
2.2.1 PLOT柱分离中性小分子中性小分子在运行缓冲液中不带电,可用于表征毛细管柱性能。本实验以烷基苯作为中性小分子的代表研究了PLOT柱的分离机理和分离性能。
为改善烷基苯的分离,在运行缓冲液中添加乙腈作为有机添加剂,考察了不同乙腈浓度对烷基苯分离的影响。结果发现:随着乙腈浓度的增加,烷基苯的保留时间和分离度减小,柱效不断增加。在乙腈浓度为35%时,烷基苯实现基线分离的同时可获得较高的柱效,继续增大乙腈浓度,烷基苯不能实现基线分离。表明乙腈的加入增加了烷基苯的洗脱能力,而烷基苯的洗脱顺序为苯、乙苯、丙苯、丁苯,这与其疏水性大小一致。说明烷基苯在PLOT柱内的保留机制为反相色谱保留机制。
实验还考察了运行电压对4种烷基苯分离的影响,结果显示:随着运行电压的增加,烷基苯的柱效和分离度呈先增加后减小的趋势。这可能是随着运行电压的升高,烷基苯分子的纵向扩散降低,分离柱效增加,分离度随之增加。而运行电压过大会导致焦耳热效应,使色谱峰展宽,烷基苯柱效降低,分离度下降。综合柱效和分离度,实验选择运行电压为25 kV。
柱温影响运行缓冲液粘度,从而影响烷基苯的保留和分离。实验考察了不同柱温对烷基苯分离的影响,结果显示,烷基苯的柱效和分离度随着柱温的升高呈先增加后减小的趋势。当柱温较低时,烷基苯的分离度和柱效较低。这可能是由于柱温较低,流动相粘度较大,柱内电渗流较小,色谱峰出现展宽和拖尾现象。当柱温为25 ℃时烷基苯的柱效和分离度最优。随着柱温进一步升高,PLOT柱内的焦耳热效应增加,色谱峰展宽,分离度降低。综合考虑分离度和柱效,选择柱温为25 ℃。
2.2.2 PLOT柱分离荷电小分子为拓宽PLOT柱的分离范围,实验考察了PLOT柱对酸性小分子苯甲酸类和碱性分子苯胺类的分离情况。如图2所示,与单层聚合物毛细管开管柱相比,PLOT柱对苯甲酸类和苯胺类小分子均获得了更好的分离效果。这说明聚合物多孔涂层固定相的引入可以有效增加毛细管开管柱的比表面积和柱容量,同时也可以提供更多的疏水作用基团,增大了苯甲酸类和苯胺类的分离度。
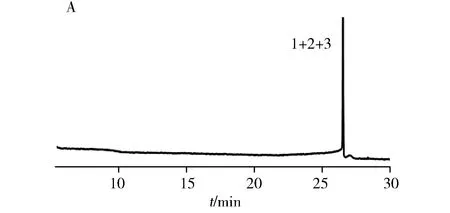
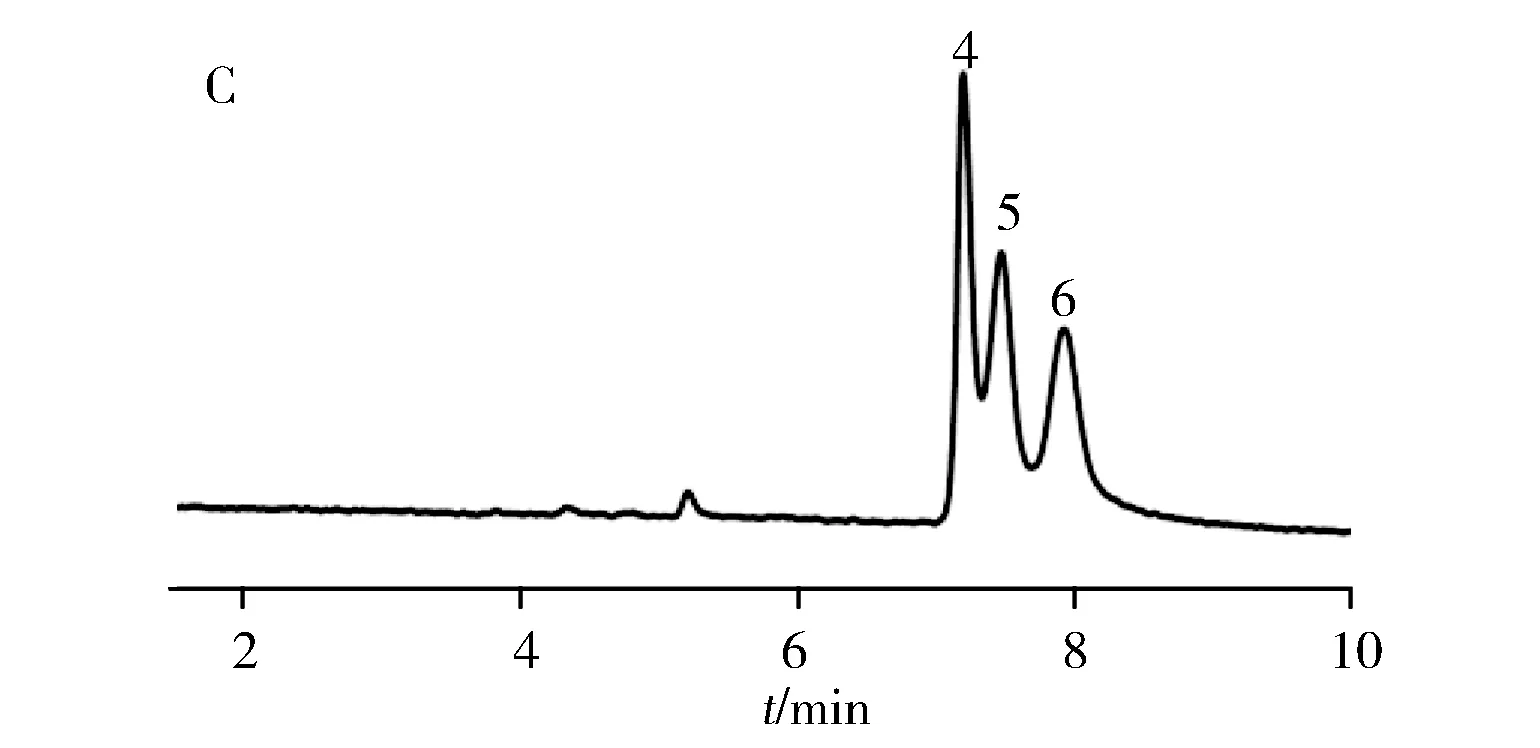
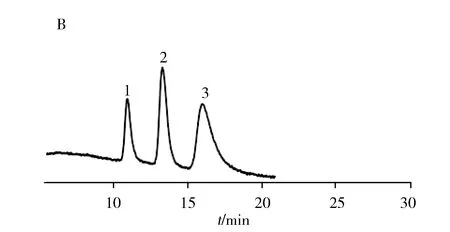

图2 苯甲酸类和苯胺类在GMA柱(A,C)和PLOT柱(B,D)的分离色谱图Fig.2 Separation chromatograms of benzoic acids and anilines on GMA column(A,C) and PLOT column(B,D)experimental conditions for A and B:running buffer:10 mmol/L phosphate buffer(pH 7.0),applied voltage:-25 kV,injection:1 kV×1 s;experimental conditions for C and D:running buffer:20% acetonitrile-10 mmol/L phosphate buffer(pH 6.5),applied voltage:15 kV,injection:10 kV×3 s,applied external pressure:2 bar for D;peak identification:1.3-fluorobenzoic acid;2.m-toluic acid;3.3,4-dichlorobenzoic acid;4.o-phenylenediamine;5.4-chloro-1,2-phenylenediamine;6.p-chloroaniline
2.2.3 PLOT柱的重复性与稳定性以电渗流作为标准考察了PLOT柱涂层的稳定性,连续进样电渗流标记物10针,每针间冲柱10 min,以电渗流计算进样精密度的相对标准偏差(RSD)为3.8%,表明PLOT柱的多孔涂层机械性能良好,进样稳定性较好。为考察PLOT柱的分离重现性,以烷基苯类小分子的分离度(Rs)和选择性因子(α)的RSD作为PLOT柱重复性和稳定性的评价标准。结果如表3所示:烷基苯Rs和α的日内RSD值分别小于1.7%和 0.5%,日间RSD值分别小于4.8% 和2.7%;柱间RSD值分别小于7.8%和3.9%。这表明PLOT柱的重复性和稳定性良好。

表3 PLOT柱中烷基苯分离度和选择性因子的相对标准偏差Table 3 RSDs of resolution and selectivity factor for alkylbenzenes separation on PLOT columns RSD/%
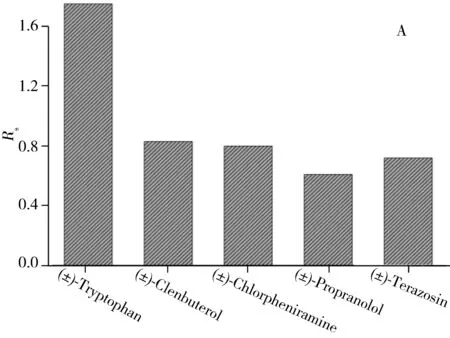
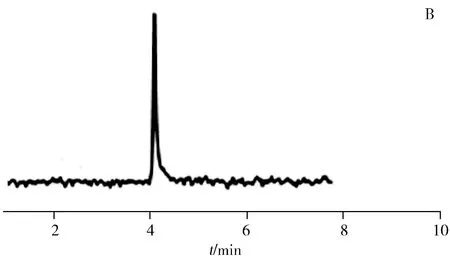
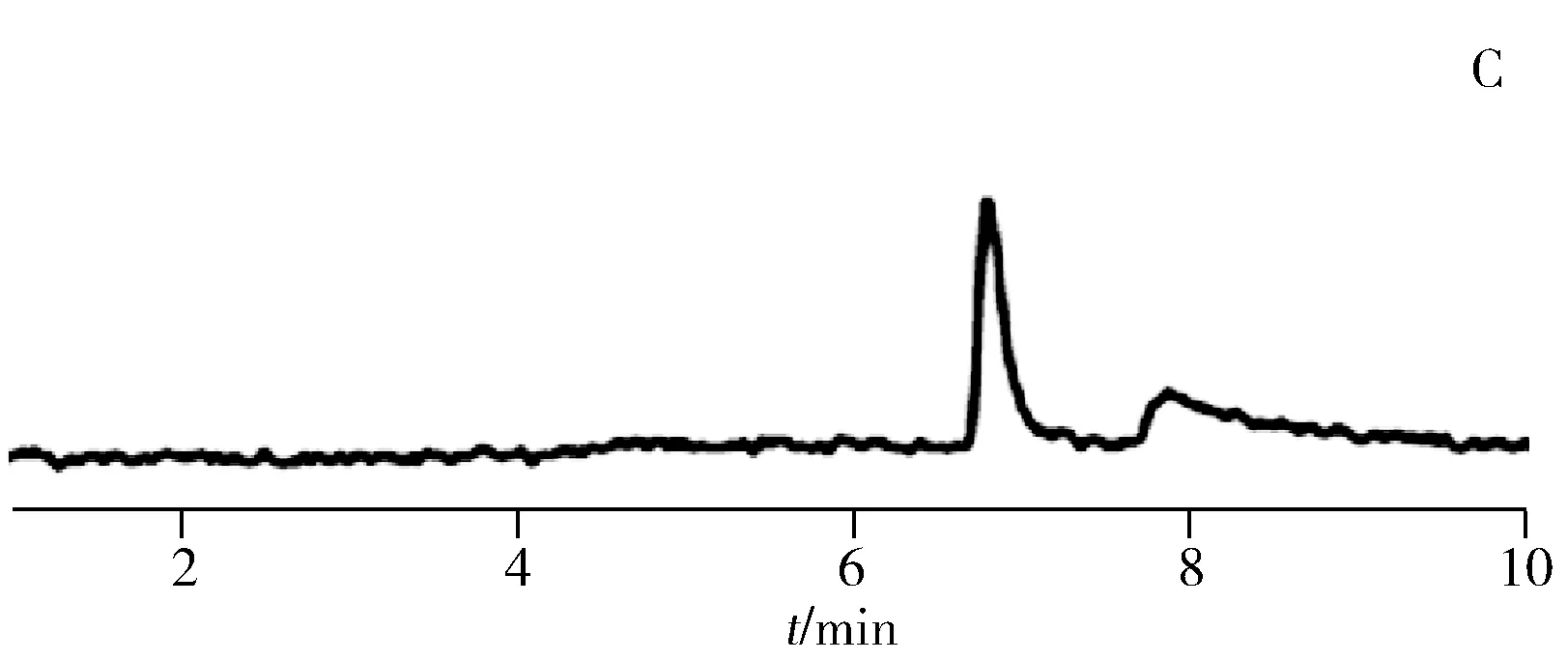
图3 HSA蛋白亲和PLOT柱分离5对手性对映体(A)及色氨酸对映体在HSA-GMA柱(B)与HSA蛋白亲和PLOT柱(C)上的分离色谱图Fig.3 Resolutions of five pairs of enantiomers on HSA-PLOT column(A) and the separation ability of(±)-tryptophan on HSA-GMA(B) and HSA-PLOT(C)running buffer:10 mmol/L phosphate buffer(pH 8.4);applied voltage:15 kV;injection:2 kV×2 s
2.3 蛋白亲和PLOT柱的电色谱性能研究
2.3.1蛋白亲和PLOT柱的电渗流表征电渗流(EOF)大小在一定程度上可以表征毛细柱内壁官能团的键合情况。实验考察了蛋白柱制备过程中每步反应后的电渗流。结果显示:PLOT柱内EOF较小(1.161×10-4cm2·V-1·s-1),经氨水开环后,氨基质子化带部分正电荷而使EOF降至0.859 4×10-4cm2·V-1·s-1;随着戊二醛反应的进行,覆盖了柱内氨基,电渗流增大;HSA修饰后电渗流明显增加至2.300×10-4cm2·V-1·s-1,说明HSA成功键合到PLOT柱上。
2.3.2蛋白亲和PLOT柱分离手性对映体为了研究蛋白亲和PLOT柱的手性分离能力,实验分离了色氨酸、克伦特罗、扑尔敏、普萘洛尔、特拉唑嗪5对手性对映体,结果如图3A所示。所有对映体在HSA-GMA中没有分离迹象(如图3B)。而在HSA蛋白亲和PLOT柱上5对手性对映体均获得了较好分离,其中色氨酸对映体的分离度为1.72(如图3C)。这表明聚合物多孔涂层的引入有效增加了HSA的键合量和开管柱的手性分离能力。蛋白亲和PLOT柱分离色氨酸对映体的柱效分别为37 323和3 680,明显高于Hage等[8-9]和Hong等[30]制备的蛋白亲和整体柱。综上所述,PLOT柱独特的涂层厚度有效改善了整体柱纵向扩散和开管柱蛋白键合量小的缺点,在手性分离中具有较好的发展前景。
3 结 论
本文制备了一种蛋白修饰的新型PLOT柱固定相,聚合物多孔涂层的引入有效增加了毛细管开管柱的柱容量和蛋白配基键载量。无论是PLOT柱对中性、酸性、碱性小分子的分离效果,还是蛋白亲和PLOT柱对5对手性对映体的分离效果均优于单层聚合物毛细管开管柱。此外,蛋白亲和PLOT柱的柱效与整体柱相比得到了明显提高,这为开管柱在手性分离研究方面的应用提供了宝贵经验。
[1] Zhang X X,Hong F,Chang W B,Ci Y X,Ye Y H.Anal.Chim.Acta,1999,392:175-181.
[2] Yao C H,Qi L,Qiao J,Zhang H Z,Wang F Y,Chen Y,Yang G L.Talanta,2010,82:1332-1337.
[3] Mallik R,Hage D S.J.Pharm.Biomed.Anal.,2008,46:820-830.
[4] Hong T T,Chen X P,Xu Y J,Cui X Q,Bai R H,Jin C,Li R J,Ji Y B.J.Chromatogr.A,2016,1456:249-256.
[5] Qian K,Chen X,Chen Q.J.Instrum.Anal.(钱凯,陈旭,陈沁.分析测试学报),2015,34(9):1061-1065.
[6] Wang Y J,Zhang Y Q,Li Y X,Li Y F,Zhang H R.J.Instrum.Anal.(王迎进,张艳青,李亚雄,李艳芳,张海容.分析测试学报),2013,32(2):239-243.
[7] Liu C H,Li Y Q,Jia B X,Qi Y X,Li K.J.Instrum.Anal.(刘彩红,李玉琴,贾宝秀,齐永秀,李珂.分析测试学报),2011,30(5):532-536.
[8] Pfaunmiller E L,Hartmann M,Dupper C M,Soman S,Hage D S.J.Chromatogr.A,2012,1269:198-207.
[9] Mallik R,Tao J,Hage D S.Anal.Chem.,2004,76:7013-7022.
[10] Stege P W,Lapierre A V,Martinez L D,Messina G A,Sombra L L.Talanta,2011,86:278-283.
[11] Nichols J E,Harries M E,Lovestead T M,Bruno T J.J.Chromatogr.A,2014,1334:126-138.
[12] Patrushev Y V,Sidelnikov V N.J.Chromatogr.A,2014,1351:103-109.
[13] Nesterenko E P,Burke M,de Bosset C,Pessutto P,Malafosse C,Collins D A.RSCAdv.,2015,5:7890-7896.
[14] Wang D,Hincapie M,Rejtar T,Karger B L.Anal.Chem.,2011,83:2029-2037.
[15] Forster S,Kolmar H,Altmaier S.J.Chromatogr.A,2013,1283:110-115.
[16] Forster S,Kolmar H,Altmaier S.J.Chromatogr.A,2013,1315:127-134.
[17] Mugo S M,Huybregts L,Mazurok J.Anal.Methods,2014,6:1291-1295.
[18] Ortiz-Villanueva E,Benavente F,Gimenez E,Yilmaz F,Sanz-Nebot V.Anal.Chim.Acta,2014,846:51-59.
[19] Pan C,Wang W,Zhang H,Xu L,Chen X.J.Chromatogr.A,2015,1388:207-216.
[20] Qu Q S,Liu Y Y,Shi W J,Yan C,Tang X Q.J.Chromatogr.A,2015,1399:25-31.
[21] Collins D A,Nesterenko E P,Brabazon D,Paull B.Anal.Chem.,2012,84:3465-3472.
[22] Al-Hussin A,Boysen R I,Saito K,Hearn M T.J.Chromatogr.A,2014,1358:199-207.
[23] Collins D A,Brabazon D,Nesterenko E P,Paull B.Chromatographia,2013,76:581-589.
[24] Collins D A,Nesterenko E P,Paull B.Analyst,2014,139:1292-1302.
[25] Luo Q Z,Yue G H,Valaskovic G A,Gu Y,Wu S L,Karger B L.Anal.Chem.,2007,79:6174-6181.
[26] Luo Q Z,Rejtar T,Wu S L,Karger B L.J.Chromatogr.A,2009,1216:1223-1231.
[27] Thakur D,Rejtar T,Wang D,Bones J,Cha S,Clodfelder-Miller B,Richardson E,Binns S,Dahiya S,Sgroi D,Karger B L.J.Chromatogr.A,2011,1218:8168-8174.
[28] Gao X,Mo R Z,Ji Y B.J.Chromatogr.A,2015,1400:19-26.
[29] Danquah M K,Forde G M.J.Chem.Eng.,2008,140:593-599.
[30] Hong T T,Zheng Y,Hu W W,Ji Y B.Anal.Biochem.,2014,464:43-50.
Preparation of a Novel Polymer Porous Layer Open Tubular Capillary Column and Its Electrochromatographic Study
MO Rong-zhen,XU Shu-juan,JIN Can,WANG Wei*,JI Yi-bing*
(College of Science,China Pharmaceutical University,Nanjing 210009,China)
A novel polymer porous layer stationary phase containing the copolymer of glycidyl methacrylate and ethylene glycol dimethacrylate(GMA-EDMA) was fabricated, and applied as a porous layer open tubular capillary(PLOT) column.To obtain a suitable capillary for electrochromatography,various conditions including the polymerization time,the ratio ofn-propanol/1,4-butanediol and GMA/EDMA in the polymerization mixture were optimized.Scanning electron microscopy demonstrated a nearly uniform polymer porous layer on the inner wall of the open tubular capillary column.In the capillary electrochromatographic mode,the PLOT column provided the reasonable separation of neutral,acidic and basic small molecules based on a reversed phase mechanism.After immobilizing the chiral selector human serum albumin(HSA),the HSA-PLOT column performed a better chiral recognition for five pairs of enantiomers compared with the single-layer polymer coated open tubular capillary column modified with HSA.The intra-day,inter-day and column-to-column relative standard deviations for alkylbenzenes separated on the PLOT column were less than 1.7%,4.8% and 7.8%,respectively.
porous layer open tubular capillary column;capillary electrochromatography;human serum albumin(HSA);chiral separation
O657.8;TQ460.72
:A
:1004-4957(2017)09-1081-06
2017-02-24;
:2017-04-23
*
:王 伟,博士,研究方向:药物分析及手性药物分析,Tel:025-86185150,E-mail:qdhcpu@126.com 季一兵,博士,教授,研究方向:药物分析新材料与新技术,Tel:025-86185150,E-mail:jiyibing@msn.com
10.3969/j.issn.1004-4957.2017.09.004
