基于MALDI-TOF MS的串联富集策略在磷酸化蛋白组学中的应用
2017-09-26张传静任红鑫张玲帆杜一平
张传静,吴 婷,任红鑫,张玲帆,杜一平
(华东理工大学 化学与分子工程学院,上海 200237)
研究报告
基于MALDI-TOF MS的串联富集策略在磷酸化蛋白组学中的应用
张传静,吴 婷*,任红鑫,张玲帆,杜一平
(华东理工大学 化学与分子工程学院,上海 200237)
提出一种除盐-富集串联用于磷酸肽富集研究的思路。选用C18柱和铈(Ⅳ)修饰的壳聚糖材料进行脱盐实验,以制备的基于聚合物基体螯合Fe3+的亲和色谱材料为富集材料。将直接富集和串联策略应用到标准品和血清中,研究结果表明,该富集材料具有高选择性和高灵敏度(1.6 fmol),铈(Ⅳ)修饰的壳聚糖材料前提下的串联策略能明显降低样品的复杂性。相比直接富集方法,能够提高磷酸化肽的覆盖率。
脱盐;固定金属离子亲和色谱;基质辅助激光解吸/电离飞行时间质谱;磷酸肽;串联富集
蛋白质的磷酸化是一个可逆过程,是极其重要的蛋白质翻译后修饰的方式之一,调控着很多的生理过程,诸如基因表达、细胞的增殖与分裂、新陈代谢以及信号的转导[1-3]。因此,关于磷酸化蛋白质组学的研究备受关注。
生物质谱技术具备反映生物信息的能力,现已被广泛用于蛋白质的磷酸化分析。然而,在磷酸化蛋白质的酶解产物中,磷酸化肽段的含量低,与此同时离子化效率也低。在进行质谱检测时,磷酸化肽段的信号会被高丰度的非磷酸化肽段的信号干扰和抑制[4],甚至无法进行检测。所以,在检测之前,需从样品中将磷酸化肽选择性地分离富集出来。目前,固定金属离子亲和色谱法(IMAC)的操作过程最简单方便,是磷酸化肽段分离富集中使用最为频繁的重要技术之一,其基本原理是利用金属离子与磷酸肽中的磷酸基团之间形成强的螯合作用力,从而实现磷酸肽的分离与富集。IMAC材料主要由色谱基质、连接臂和金属离子组成。传统的固定Fe3+、Ga3+和Al3+的IMAC材料[5-7]以亚氨基二乙酸和次氮基三乙酸为连接臂,连接臂和金属离子间的亲和作用力较弱,在使用过程中易丢失金属离子,限制了材料的富集效率。近年来,固定Zr4+和Ti4+的IMAC材料[8-10]基于磷酸肽的磷酸根与金属离子间牢固的亲和作用力实现磷酸肽富集;固定Ce4+的IMAC材料[11]金属离子固载量丰富且可重复使用性好,实验室现有的铈(Ⅳ)修饰的壳聚糖材料(Ce-MCM)不仅具备上述优点,还具有宽泛的使用范围,在pH 3.0~11.0下均可使用,在一般的有机介质中也很稳定,能够耐受离心和超声处理。
一般直接采用IMAC方法来实现磷酸化肽的富集。但由于一些盐分和污染物的存在,造成加合峰过多形成峰包,给质谱分析带来不便。为解决实际问题,相关的研究致力于串联策略[12]。二维色谱的完美结合,诸如强阴离子交换-金属氧化物亲和色谱法(SAX-MOAC)[13]、强阳离子交换-固定金属离子亲和色谱法(SCX-IMAC)[14]、固定金属离子亲和色谱-亲和作用色谱(IMAC-HILIC)[15]、固定金属离子亲和色谱- C18(IMAC-C18)[16]柱和固定金属离子亲和色谱(IMAC-IMAC)[17]已成为趋势并在磷酸化肽的识别上表现出各自的特性。
为改善质谱检测结果[18],通常需对肽和蛋白样品进行除盐。本文提出一种除盐-富集串联策略用于研究磷酸化肽的分离富集,分别选用商品化的C18柱和Ce-MCM进行除盐实验,以制备的一种基于聚合物基体螯合Fe3+的IMAC材料为富集材料。综合比较了两者的除盐能力以及串联之后富集磷酸化肽的效果。
1 实验部分
1.1 仪器与试剂
真空扫描电子显微镜(SEM,型号:HITACHI-S3400N),傅立叶变换红外光谱仪(FT-IR,型号:6700),基质辅助激光解吸/电离飞行时间质谱仪(AB SCIEX 4800 plus MALDI-TOF/TOF MS)。美国Millipore公司Milli-Q(Millipore,Bedford,MA)水处理系统。
甲基丙烯酸缩水甘油酯(GMA)、2,2′-二甲氧基-2-苯基苯乙酮(DMPA)、三氟乙酸(TFA,99%)购自阿拉丁试剂有限公司。乙氧化三羟甲基丙烷三丙烯酸酯(SR454)、α-酪蛋白(α-Casein)、β-酪蛋白(β-Casein)、牛血清白蛋白(BSA)、2,5-二羟基苯甲酸(2,5-DHB)、二硫苏糖醇(DTT,99%)、碘代乙酰胺(IAA,99%)、亚氨基二乙酸(IDA)和乙腈(ACN,高效液相色谱级别)购自西格玛奥德里奇(上海)贸易有限公司。无水碳酸钠、六水合氯化铁、氯化钠、浓氨水和碳酸氢铵购自国药控股有限公司。人血清为100例健康人血清混合样品,样品存储于-80 ℃冰箱待用。实验用水由Milli-Q水处理系统处理。
1.2 GMA-co-SR454/Iron(Ⅲ)-IDA材料的制备
GMA-co-SR454/Iron(Ⅲ)-IDA的合成流程如图1所示。
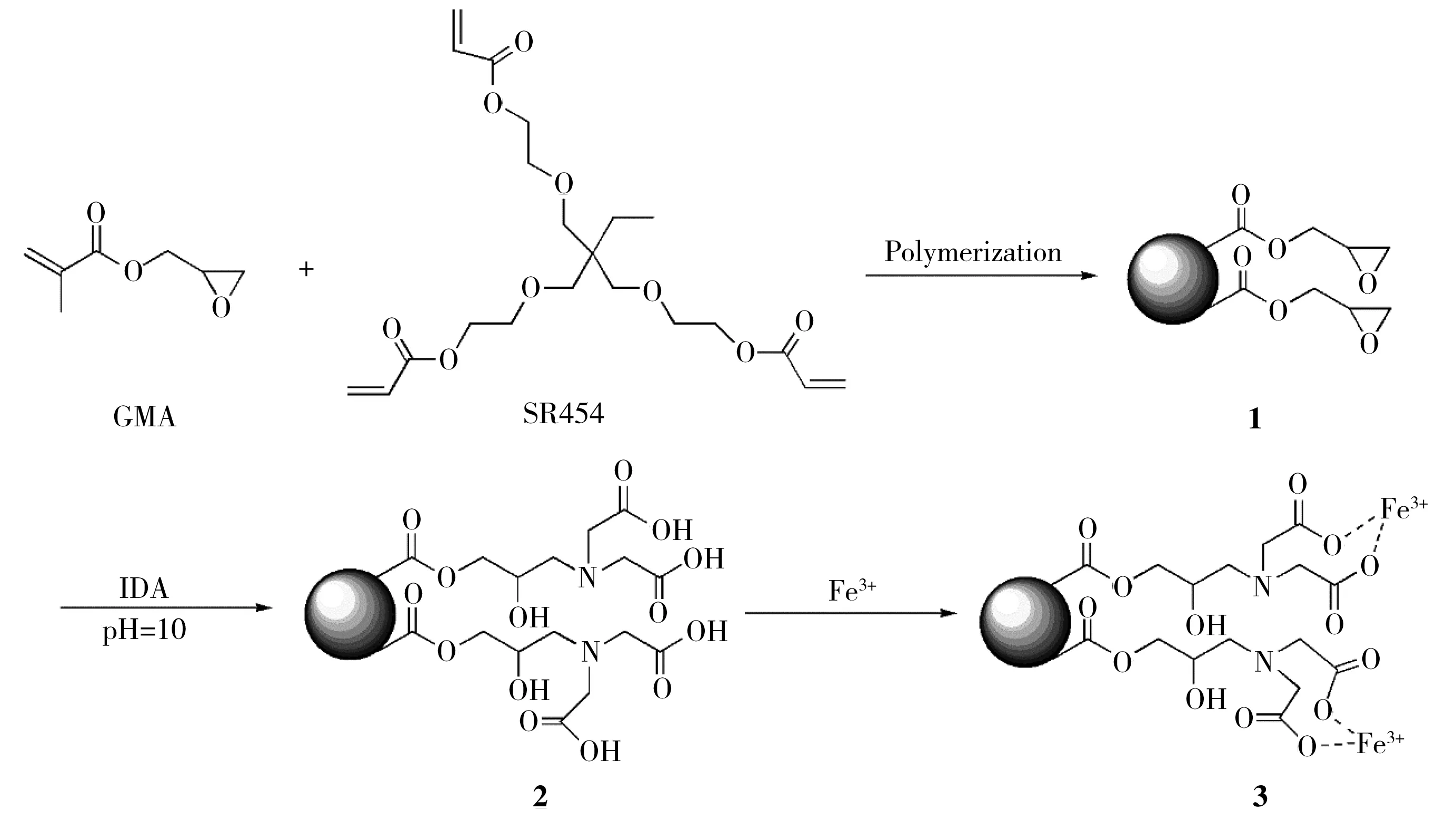
图1 GMA-co-SR454/Iron(Ⅲ)-IDA材料的制备示意图Fig.1 Synthesis of GMA-co-SR454/Iron(Ⅲ)-IDA material
粉末状GMA-co-SR454材料的合成:称取甲基丙烯酸缩水甘油酯1.9 g,乙氧化三羟甲基丙烷三丙烯酸酯2.9 g,2,2′-二甲氧基-2-苯基苯乙酮(DMPA)0.12 g,置于10 mL离心管中。移取环己醇6.234 mL和甲醇1.517 mL于上述离心管中,使用涡旋振荡器加速固体完全溶解。转移上述溶液于8 cm的玻璃培养皿中,用波长为365 nm的便携式紫外灯照射10 min,促使自由基聚合反应发生。聚合反应完成后,关闭紫外灯,分别用甲醇和超纯水洗去致孔剂和未反应完的单体,得到整体柱材料。将所合成的整体柱材料通过研磨、筛分后,获得一定大小的粉末状GMA-co-SR454材料。
GMA-co-SR454-IDA材料的合成:根据已有报道[19],对GMA-co-SR454材料进行羧基改性。将1.5 g上述合成的粉末状GMA-co-SR454材料置于100 mL圆底烧瓶中,加入0.50 g 20 mL IDA 的碳酸钠溶液(pH 10.0),再加入0.25 g氯化钠,置于75 ℃水浴中,搅拌反应6 h。之后离心,弃去上清液,将材料用超纯水洗至中性。
GMA-co-SR454/Iron(Ⅲ)-IDA材料的合成:根据方法[8],对GMA-co-SR454-IDA材料固定金属离子。取适量的上述材料于100 mL圆底烧瓶中,随后加入40 mL 50 mmol/L的三氯化铁溶液,常温下搅拌反应3 h。减压抽滤,用超纯水洗至中性,自然环境下晾干,即得粉末状的GMA-co-SR454/Iron(Ⅲ)-IDA材料。
1.3 标准蛋白质的酶解及人血清样品制备
1)部分街道名称标注不清。如创新街和创业街,两条街的地理位置接近,老百姓极易混淆。个别街道名称后来经过更名,而更名后的街道名称反而给老百姓带来记忆上的混乱。如北宫街的其中一段在2014年更名为通亭街,新、老北宫街没有实现实际的对接,给老百姓出行带来一定困扰。
称取1.00 mg 标准磷酸化蛋白质(α-/β-酪蛋白),溶解于500 μL 25 mmol/L碳酸氢铵溶液(pH 8.2),按照酶与蛋白质量比1∶50的比例加入胰蛋白酶,于37 ℃酶解18 h。
称取2.00 mg牛血清白蛋白,溶于1 mL含8 mol/L尿素和50 mmol/L碳酸氢铵(pH 8.3)的溶液中,加入20 μL 1 mol/L二硫苏糖醇,于60 ℃孵育1 h。随后加入7.20 mg碘代乙酰胺,置于室温和暗室的环境下烷基化反应45 min,用50 mmol/L碳酸氢铵(pH 8.3)溶液稀释10倍。按照酶与蛋白质量比1∶50加入胰蛋白酶,37 ℃酶解18 h。酶解结束后,分装冻干,存储于-20 ℃冰箱备用。
对于人血清,收集血液样品5 mL于室温下凝结1 h,离心,保留上清液并分装,存储于-20 ℃冰箱备用。
1.4 样品脱盐处理
C18柱除盐步骤比较成熟,可参考已有文献[20]。而Ce-MCM脱盐的流程如下:首先用60% ACN/1.0% TFA体系将样品稀释至所需浓度,加入0.10 mg Ce-MCM,室温下振荡10 min。离心,移去上清液,用50% ACN/0.1% TFA体系清洗残留物3次,将残留在材料表面的盐分、干扰物或结合不牢固的肽段清洗下来。最后,使用5%(体积分数)NH3·H2O作为洗脱液,将结合在材料上的肽段洗脱下来,待用。
1.5 GMA-co-SR454/Iron(Ⅲ)-IDA材料分离富集磷酸肽
将样品溶液用上样液(80% ACN/0.1% TFA或1.0% TFA)稀释至所需浓度,加入0.50 mg GMA-co-SR454/Iron(Ⅲ)-IDA材料,室温下振荡30 min。于8 000 r/min下离心5 min,弃去上清液。依次用上样液和80% ACN溶液进行清洗,前者洗2次,后者洗1次。加入10 μL 15% NH3·H2O洗脱2次,收集洗脱液,待用。
取0.5 μL洗脱液点覆于不锈钢靶板的圆点处,室温自然挥干,再将0.5 μL DHB基质溶液点覆在样品表面,室温下自然挥干;将制备好的样品送入MALDI-TOF MS进行分析。
2 结果与讨论
2.1 GMA-co-SR454/Iron(Ⅲ)-IDA材料的合成与表征
图1为GMA-co-SR454/Iron(Ⅲ)-IDA的合成过程。首先,GMA单体在交联剂和紫外光的共同作用下,发生聚合反应,制备出GMA-co-SR454整体柱材料。其次,整体柱材料上的环氧基与IDA发生亲电取代反应而开环,生成GMA-co-SR454-IDA材料。最后,通过Fe3+与杂原子氧之间的螯合作用,而成功将Fe3+固载在材料上。
采用傅立叶红外光谱(FT-IR)分析GMA与SR454的聚合情况以及亚氨基二乙酸与该聚合物的反应情况(图2)。如图2a所示,908 cm-1处的峰对应于GMA中环氧基的对称伸缩振动,说明聚合反应生成了GMA-co-SR454。图2b中3 425 cm-1处的吸收峰对应于缔合的O—H的伸缩振动,1 129 cm-1处的峰对应于C—OH的伸缩振动,608 cm-1处的峰对应于缔合状态的醇类中O—H的面外变形振动,说明亚氨基二乙酸接到GMA-co-SR454聚合物上,从而使环氧基发生开环。
扫描电镜图(图3)显示,GMA-co-SR454/Iron(Ⅲ)-IDA呈堆积的球形结构,直径约为100 nm。
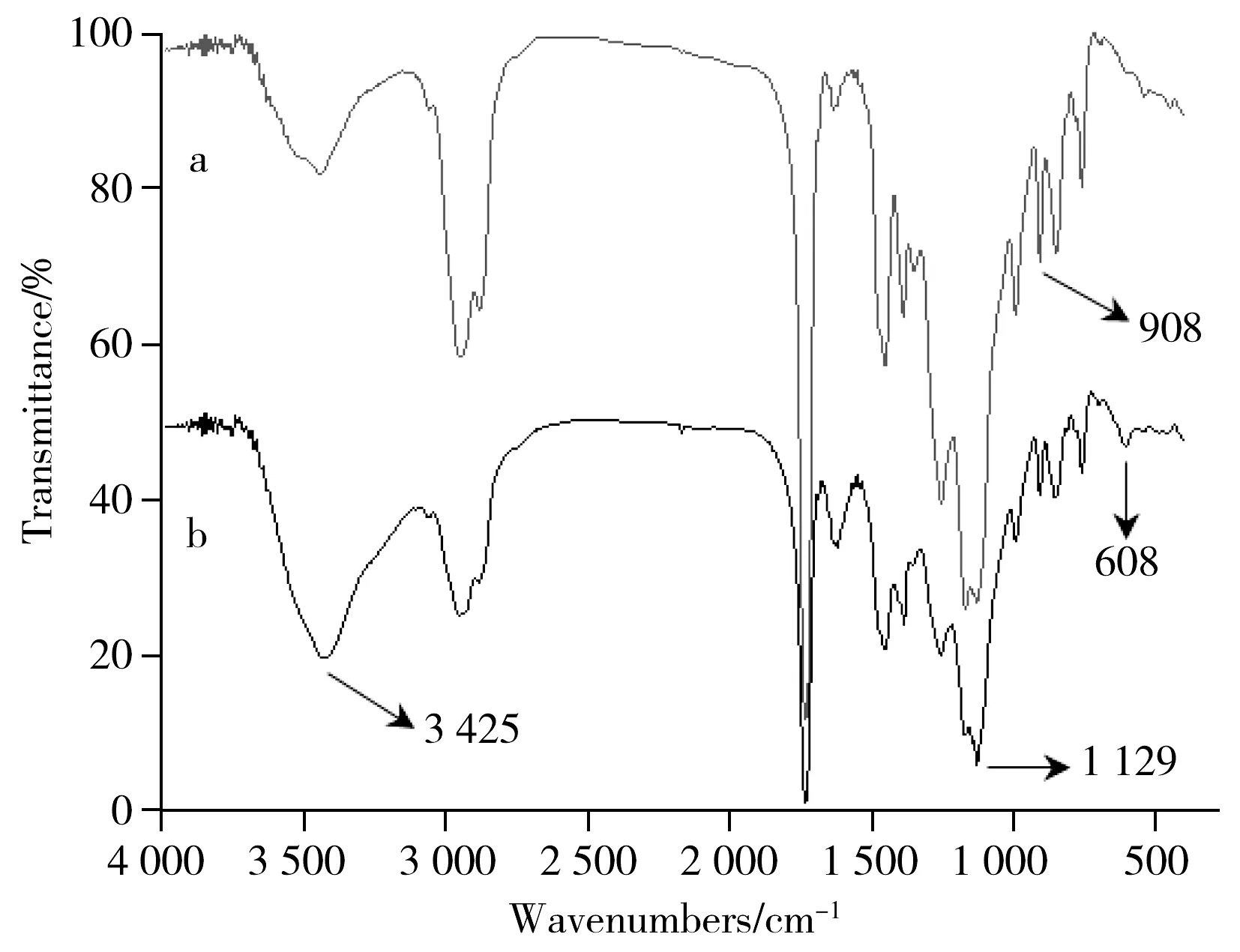
图2 GMA-co-SR454(a)与GMA-co-SR454-IDA(b)的傅立叶变换红外光谱图Fig.2 FT-IR spectra of GMA-co-SR454(a) and GMA-co-SR454-IDA(b)

图3 GMA-co-SR454/Iron(Ⅲ)-IDA材料的扫描电镜图Fig.3 SEM image of GMA-co-SR454/Iron(Ⅲ)-IDA material
2.2 GMA-co-SR454/Iron(Ⅲ)-IDA材料用于标准磷酸化蛋白质酶解液中磷酸化肽的富集
为考察GMA-co-SR454/Iron(Ⅲ)-IDA材料对磷酸化肽段的富集性能,首先使用磷酸化的β-酪蛋白标准品(通常含有α-酪蛋白)的酶解液进行评价。如图4A所示,直接分析时,仅能检测到2条弱信号强度和低信噪比的目标肽段,这是由于磷酸化肽的丰度低、离子化效率低,以及高丰度的非磷酸化肽对磷酸化肽有强烈的信号抑制作用。然而,经GMA-co-SR454/Iron(Ⅲ)-IDA材料富集后(图4B),非磷酸化肽段的质谱峰几乎消失,检测到4条高信号强度和高信噪比β-酪蛋白酶解液中的磷酸化肽段以及4条低信号强度的α-酪蛋白中的磷酸化肽段。其中有一系列特征性的片段,如丢失磷酸基团的肽段,信号强度比较可观。另外,评估了该材料对α-酪蛋白酶解液中磷酸化肽段的富集能力,成功捕捉到21条目标肽段。以上富集到的目标肽段的详细信息见表1。
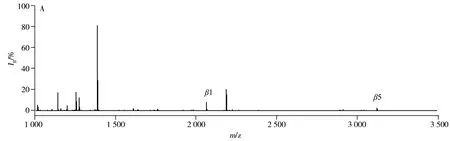
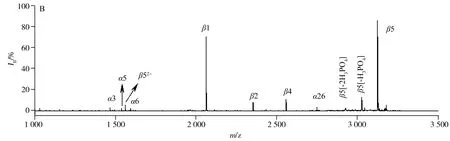
图4 直接分析β-酪蛋白酶解液(A)以及经GMA-co-SR454/Iron(Ⅲ)-IDA材料富集后(B)的质谱图Fig.4 MALDI-TOF MS of tryptic digest of β-casein direct analysis(A) and after enrichment with GMA-co-SR454/Iron(Ⅲ)-IDA(B)the phosphopeptides and their dephosphorylated fragments of the metastable losses of phosphoric acid were marked with β and -nH3PO4,respectively
为进一步评价GMA-co-SR454/Iron(Ⅲ)-IDA材料的富集选择性,将该材料用于β-酪蛋白酶解液与牛血清白蛋白酶解液的混合体系。当两者的摩尔比为1∶10时,在未富集之前有2条信号强度很低的磷酸化肽段,非磷酸化肽段的峰占主导位置。而经该材料富集后,在洗脱液中检测到4条β-酪蛋白酶解液中的磷酸化肽段。即使将两者的摩尔比降至1∶500,该材料仍能高效地富集到3条目标肽段。
2.3 GMA-co-SR454/Iron(Ⅲ)-IDA材料对β-酪蛋白酶解液中磷酸化肽的富集灵敏度
将GMA-co-SR454/Iron(Ⅲ)-IDA材料分别用于富集不同稀释浓度的β-酪蛋白酶解液。结果显示,MALDI-TOF MS可以检测出4 fmolβ-酪蛋白酶解液中的4条磷酸化肽;当β-酪蛋白酶解液的浓度降低至1.6 fmol时,质谱图上有β1和β5峰,β5峰的强度随蛋白酶解液浓度的降低发生规律性地变化。由于在β-酪蛋白酶解液的浓度降于1.6 fmol的情况下,质谱仪未检测到任何峰。因此,当选用β5峰来定义检出限时,GMA-co-SR454/Iron(Ⅲ)-IDA材料对磷酸化肽的检出限为1.6 fmol。优于文献[18-19]中其他IMAC材料的检出限(如chitosan-GMA-IDA-Fe3+为5 fmol,NPs poly(AGE/DVB)-Fe3+wafer为2 fmol)。

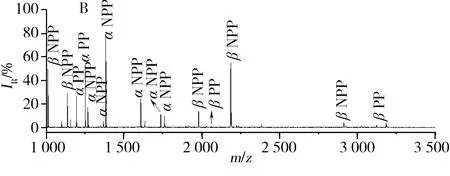
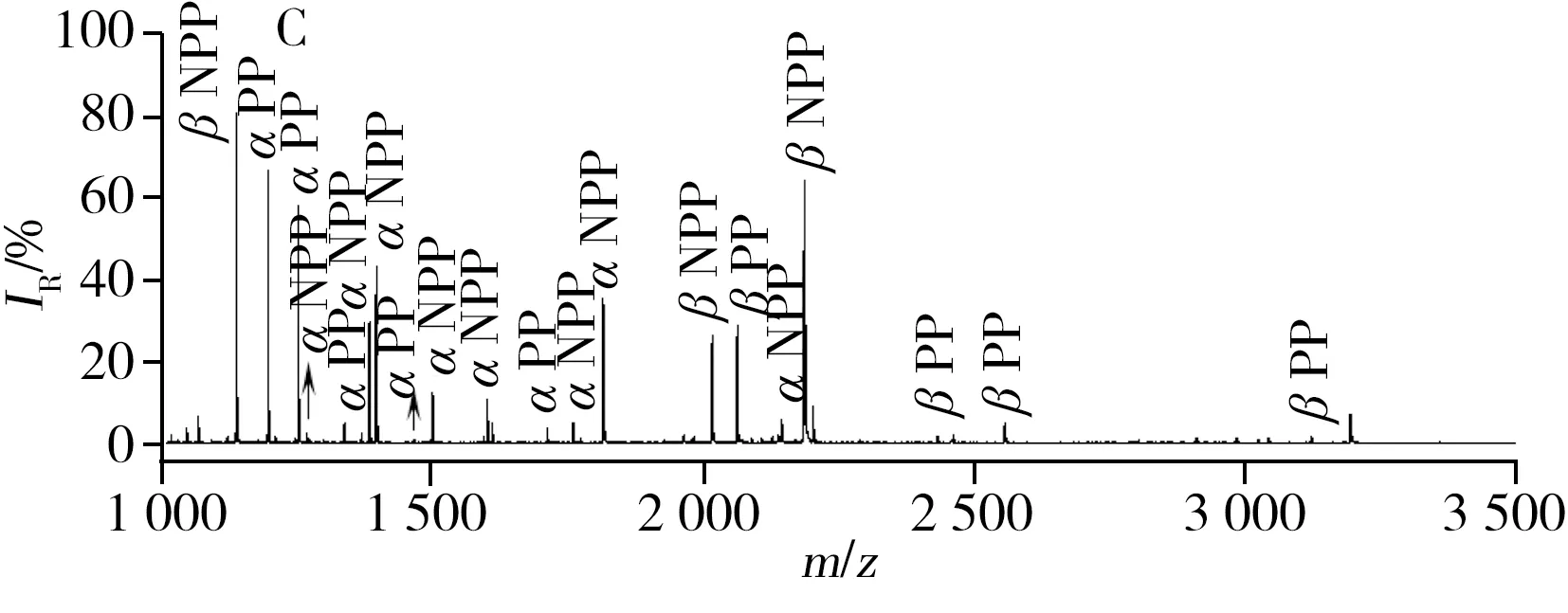
图5 直接分析β-酪蛋白酶解液(A),经C18吸附材料除盐后(B),以及经Ce-MCM除盐后(C)的质谱图Fig.5 MALDI-TOF MS of tryptic digest of β-caseinA.no desalting;B.desalted by C18;C.desalted by Ce-MCM;NPP:non-phosphopeptide(非磷酸肽);PP:phosphopeptide(磷酸肽)
2.4直接IMAC富集与串联策略分离富集比较
为考察除盐效果,首先检测了脱盐后的酶解液。如图5A所示,直接分析β-酪蛋白的酶解液时,由于碳酸氢铵的干扰,仅能检测到10条肽段。而经过除盐后,得到的质谱图有明显改善,肽段的数目及信号强度有所增加(图5B、C)。通过比较发现,经Ce-MCM除盐后,质谱仪能检测出20条肽段数,其中磷酸化肽段有9条;而经C18柱处理后的质谱结果是15条肽段中有4条磷酸化肽段。这是由于Ce-MCM是一种IMAC材料,在使用的ACN/TFA体系下,对特定的肽段没有选择性,能保留更多的肽段,在碱性条件下,保留的肽段能被有效地洗脱下来;而C18吸附材料易使一些亲水性的肽段丢失或者在盐浓度高的情况下,作用效率低。由此可知,Ce-MCM的除盐效果更为理想。
另外,将串联策略分离富集的质谱图与直接富集的质谱图进行比较,发现C18柱和Ce-MCM的脱盐对富集产生不同影响。如图6所示,前者(图A)使磷酸化肽的数目及信号强度减弱。后者(图B)却恰恰相反,单磷酸化肽段(β1,β4)的峰明显增强,1条新的单磷酸化肽段(β3)被富集到,而在多磷酸化肽段中,β5肽段减弱,β2肽段几乎不见。
为进一步说明问题,将串联策略应用到α-酪蛋白酶解液中。如图7所示,相比直接IMAC富集,Ce-MCM/IMAC(图7A)能捕捉到更多的目标肽段(24条),并且有不同的目标肽段。而C18/IMAC(图7B)表现效果不佳。通过比较图7A与图7B发现,图7A中,单磷酸化肽段的峰如α3、α4、α6、α7、α10、α11从无到有,而且峰α8的信号强度显著增强。但在一些多磷酸肽段的峰中,峰α21、α23、α25、α27、α29减弱,峰α18、α24、α26、α30消失不见。这些现象归因于脱盐材料各自不同的特性,Ce-MCM是一种金属螯合亲和色谱材料,在60% ACN/1.0% TFA上样液体系下,非磷酸化肽和磷酸化肽在材料上产生共吸附,保留的肽段经5% NH3·H2O洗脱液洗脱后,其质谱响应信号明显改善,此外,Ce-MCM上的铈(Ⅳ)金属离子对磷酸酯键的水解作用[21],使一些多磷酸肽的含量降低,甚至使含量不高的多磷酸肽达不到质谱检测时需求的浓度。而C18吸附材料是反相色谱材料,易造成一些亲水性的肽段如磷酸肽的丢失[22]。综上可知,Ce-MCM/IMAC串联策略中的Ce-MCM的亲和色谱性质有利于磷酸化肽数目的增加。以上富集到的目标肽段的详细信息见表1。


图6 β-酪蛋白酶解液经C18/IMAC富集后(A),经Ce-MCM/IMAC富集后(B)的质谱图Fig.6 MALDI-TOF MS of tryptic digest of β-casein after enrichment by C18/IMAC(A) and Ce-MCM/IMAC(B)-nHPO3 :the metastable losses of metaphosphoric acid(-nHPO3为脱亚磷酸基团肽段)

图7 α-酪蛋白酶解液经Ce-MCM/IMAC富集后(A),以及经C18/IMAC富集后(B)的质谱图Fig.7 MALDI-TOF MS of tryptic digest of α-casein after enrichment by Ce-MCM/IMAC(A) and C18/IMAC(B) *multi-phosphopeptides(多磷酸肽)
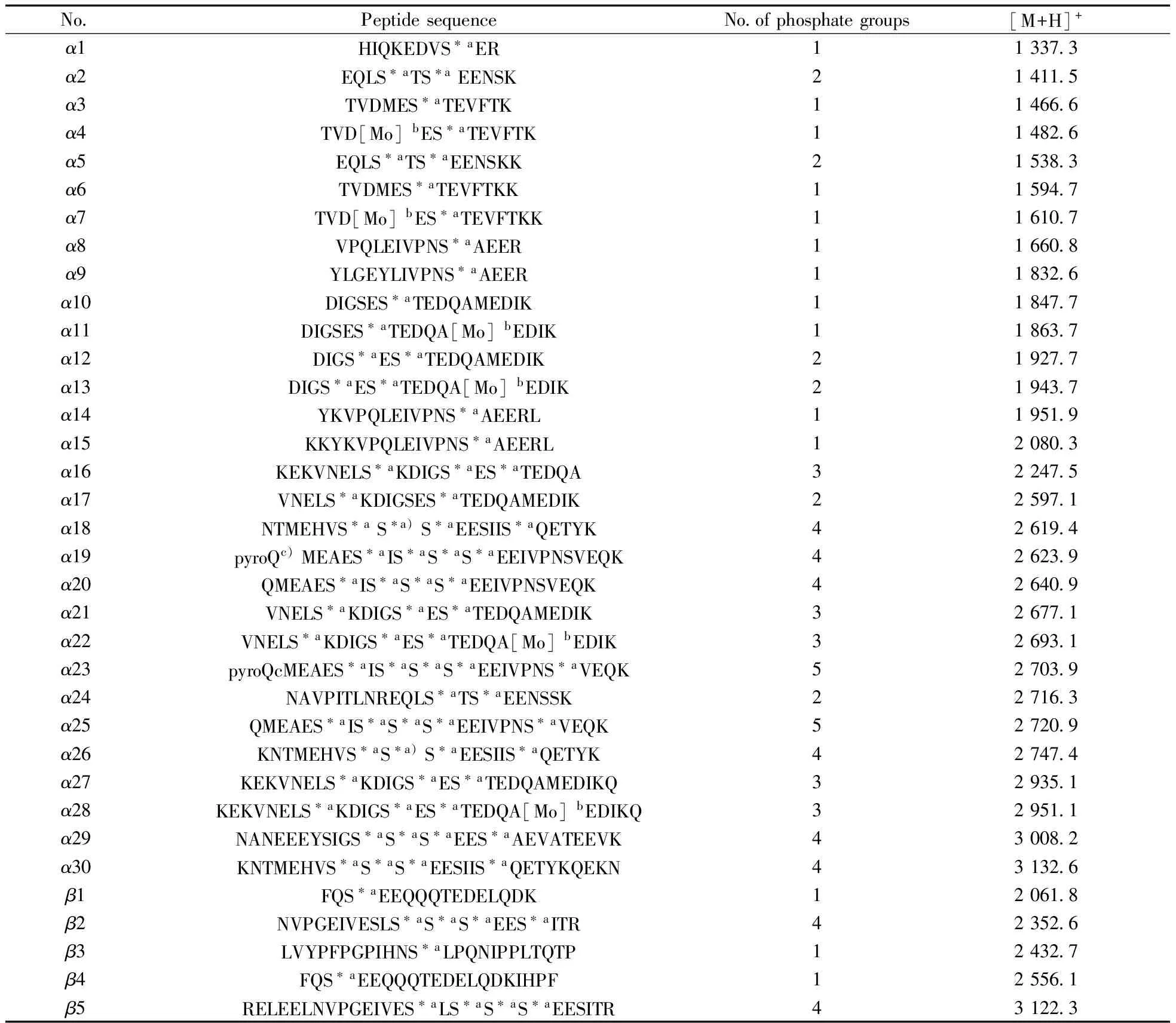
表1 直接IMAC方法和串联策略从α-/β-酪蛋白酶解液中富集到的磷酸化肽段的磷酸化位点及序列Table 1 Phosphorylation sites and the sequence of identified peptides in tryptic digest of α-/β-casein enriched by direct IMAC and tandem desalting/IMAC
a:phosphorylated residue,b:oxidation on methionine,c:pyroglutamylation on the N-terminal
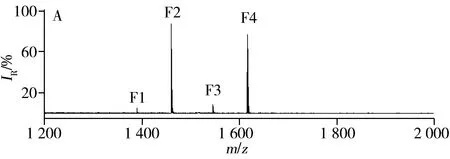
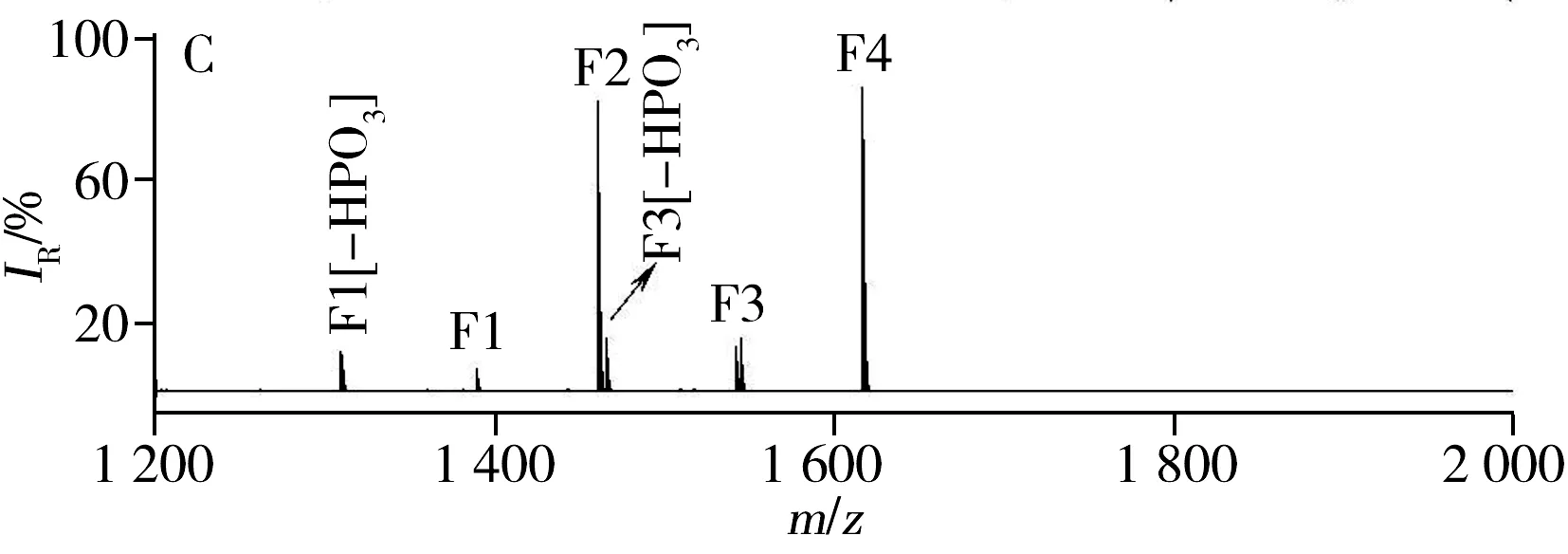
图8 正常人的血清经IMAC材料富集后(A),经C18/IMAC富集后(B)以及经Ce-MCM/IMAC富集后(C)的质谱图Fig.8 MALDI-TOF MS of the diluted human serum sample after enrichment with direct IMAC(A),with C18/IMAC(B) and with Ce-MCM/IMAC(C)F:phosphopeptides;-nHPO3 :dephosphorylated fragments of the metastable losses of metaphosphoric acid
以健康人血清为实际样品,Ce-MCM/IMAC(图8C)能捕捉到与直接IMAC方法(图8A)等同的4条目标肽段(1 389.5,1 460.5,1 545.6,1 616.6),此外还检测到多余的峰,即去亚磷酸基团的峰,这是铈(Ⅳ)离子催化磷酸酯键发生水解作用的结果。但在C18/IMAC(图8B)的情况下,仅能富集到3条目标肽段,并且肽段F2和F3的峰强相对变弱。
3 结 论
制备了基于聚合物的GMA-co-SR454/Iron(Ⅲ)-IDA富集材料,并提出除盐-富集串联策略。通过考察标准品和实际样品,发现该材料能选择性地富集到β-酪蛋白酶解液中的4条目标肽段和血清中的4条目标肽段,检出限达1.6 fmol。另外,Ce-MCM/IMAC串联的结果优于C18/IMAC和直接IMAC富集,能显著降低样品的复杂性和增加磷酸化肽的富集数目,方法重现性好。因此,该串联富集策略可为增加磷酸化肽的覆盖率提供一种新思路。
[1] Pawson T,Scott J D.TrendsBiochem.Sci.,2005,30(6):286-290.
[2] Reinders J,Sickmann A.Proteomics,2005,5(16):4052-4061.
[3] Dephoure N,Zhou C,Villen J,BeausoleilS A,Bakalarski C E,Elledge S J,Gygi S P.PNAS,2008,105(31):10762-10767.
[4] Zhou H L,Watts J D,Aebersold R.Nat.Biotechnol.,2001,19(4):375-378.
[5] Pan C S,Ye M L,Liu Y G,Feng S,Jiang X G,Han G H,Zhu J J,Zou H F.J.ProteomeRes.,2006,5(11):3114-3124.
[6] Zhang L Y,Liang Z,Zhang L H,Zhang Y K,Shao S J.Anal.Chim.Acta,2015,900:46-55.
[7] Biswas S,Sarkar A,Misra R.Biotechnol.Biotec.Eq.,2017,31(3):639-646.
[8] Zheng L Y,Dong H P,Hu L J.Ind.Eng.Chem.Res.,2013,52(23):7729-7736.
[9] Yu Z Y,Han G H,Sun S T,Jiang X N,Chen R,Wang F J,Wu R A,Ye M L,Zou H F.Anal.Chim.Acta,2009,636(1):34-41.
[10] Wu T,Shi J N,Zhang C J,Zhang L F,Du Y P.J.Chromatogr.B,2016,1008:234-239.
[11] Wang Z G,Cheng G,Liu Y L,Zhang J L,Sun D H,Ni J Z.J.ColloidInterf.Sci.,2014,417(3):217-226.
[12] Herring L E,Grant K G,Blackburn K,Haugh J M,Goshe M B.J.Chromatogr.B,2015,988:166-174.
[13] Nühse T S,Stensballe A,Jensen O N,Peck S C.Mol.Cell.Proteomics,2003,2(11):1234-1243.
[14] Villen J,Beausoleil S A,Gerber S A,Gygi S P.PNAS,2007,104(5):1488-1493.
[15] McNulty D E,Annan R S.Mol.Cell.Proteomics,2008,7(5):971-980.
[16] Chockalingam M,Darwish N,Le Saux G,Gooding J J.Langmuir,2011,27(6):2545-2552.
[17] Ye J,Zhang X,Young C,Zhao X,Hao Q,Cheng L,Jensen O N.J.ProteomeRes.,2010,9(7):3561-3573.
[18] Najamulhaq M,Saeed A,Jabeen F,Maya F,Ashiq M N,Sharif A.ACSAppl.Mater.Inter.,2014,6(5):3536-3545.
[19] Zou X,Liu D,Zhong L J,Yang B,Lou Y X,Hu B H,Yin Y X.Anal.Bioanal.Chem.,2011,401(4):1251-1261.
[20] Jehmlich N,Golatowski C,Murr A,Salazar G,Dhople V M,Hammer E,Völker U.Clin.Chim.Acta,2014,434:16-20.
[21] Wu J H,Xiao K,Zhao Y,Zhang W P,Guo L,Feng Y Q.J.Sep.Sci.,2010,33(15):2361-2368.
[22] Hussain D,Najamulhaq M,Jabeen F,Ashiq M N,Athar M,Rainer M,Huck C W,Bonn G K.Anal.Chim.Acta,2013,775(7):75-84.
Application of Tandem Enrichment Strategy by MALDI-TOF MS in Phosphorylated Proteomics
ZHANG Chuan-jing,WU Ting*,REN Hong-xin,ZHANG Ling-fan,DU Yi-ping
(School of Chemistry and Molecular Engineering,East China University of Science and Technology,Shanghai 200237,China)
A scheme was presented for the tandem purification of phosphopeptide using desalting prior to immobilized metal ion affinity chromatography(IMAC).Both C18tip and the cerium(Ⅳ)-modified chitosan material(Ce-MCM) were used in the desalting experiments.GMA-co-SR454/Iron(Ⅲ)-IDA was synthesized,and used as an excellent phosphopetides enrichment material.They were applied to selectively capture the phosphopeptides in standards and human serum.Results demonstrated that C18/IMAC and Ce-MCM/IMAC have different performances because of their hydrophobic or hydrophilic properties.Ce-MCM/IMAC tandem strategy notably decreased the complexity of peptides,and yielded a far greater coverage for phosphopeptides than single IMAC.
desalting; IMAC; matrix-assisted laser desorption-ionization time of flight mass spectrometry(MALDI-TOF MS); phosphopeptides; tandem enrichment
O657.7;O657.63
:A
:1004-4957(2017)09-1061-08
2017-03-19;
:2017-05-20
国家质检总局科技计划项目(2015IK201)
*
:吴 婷,博士,高级工程师,研究方向:蛋白质组学,Tel:021-64252107,E-mail:wu_ting@ecust.edu.cn
10.3969/j.issn.1004-4957.2017.09.001
