响应面优化超高压提取鸡血血红蛋白的工艺
2017-09-26唐道邦程镜蓉张友胜张业辉刘学铭
张 炫, 唐道邦, 程镜蓉, 张友胜, 张业辉, 刘学铭*
(1.广东省农业科学院 蚕业与农产品加工研究所/农业部功能食品重点实验室/广东省农产品加工重点实验室,广东 广州510610;2.江西农业大学 生物科学与工程学院,江西 南昌330045)
响应面优化超高压提取鸡血血红蛋白的工艺
张 炫1,2, 唐道邦1, 程镜蓉1, 张友胜1, 张业辉1, 刘学铭*1
(1.广东省农业科学院 蚕业与农产品加工研究所/农业部功能食品重点实验室/广东省农产品加工重点实验室,广东 广州510610;2.江西农业大学 生物科学与工程学院,江西 南昌330045)
在单因素的基础上,以Hb得率为响应值,应用响应面法优化Hb的提取条件;通过高速均质机处理Hb溶液评价超高压对Hb特性中乳化性和起泡性的作用。结果表明:料液质量体积比、提取时间及超高压对Hb得率的影响是极显著的;其最佳工艺参数:料液质量体积比为1 g∶250 mL、提取时间为5.4 min、超高压135 MPa。在上述条件下,Hb得率为6.697 g/dL,与模型值基本一致。经超高压处理,Hb的乳化性有明显的提高,乳化稳定性则下降,而起泡性和泡沫稳定性有显著的增强。
超高压;料液比;响应面;乳化性;起泡性
鸡血含大量的蛋白质和丰富的氨基酸以及微量元素、维生素、酶类和其他一些生物活性物质[1]。鸡血营养丰富,蛋白质含量高,尤其是Hb。它是一种大分子物质,其相对分子质量约68 000,具有四级结构,由4个亚基组成,每个亚基是具有三级结构的多肽链,并含有一个血红素和一个氧结合部位[2]。近年来Hb开发利用一直是关注的热点问题,其广泛应用于食品工业、医疗保健、饲料工业等领域。目前许多研究者利用生物酶水解Hb并从中分离出具有ACE抑制肽[3]、抗氧化肽[4]、抗菌肽[5]等具有生物活性的小肽分子,因此大规模提取Hb并将Hb资源高值化利用具有现实的经济效益。
目前,动物血中Hb的提取方法主要包括有机溶剂提取法、两相萃取法、超滤法、乙酸锌沉淀提取法、超声波辅助超纯水提取法等,这些方法普遍存在提取速度慢,投入高,安全性低,不利于大规模生产。路秀玲等[6]探索了将膨胀床吸附层析提取动物血中的Hb,该方法设备要求高、过程复杂。如周玲[7]以及赫玉兰[8]等利用超声波提取Hb,虽然提取率高、投入低,但是作用时间长。迄今为止没有看到利用超高压辅助超纯水提取Hb的报道。
超高压(UHP)亦称高静水压(High Hydrostatic Pressure,HHP),利用液体(油或者水)作为压力传导介质对样品进行加压(100~1 000 MPa)处理,引起食品中某些大分子物质的离子键、氢键、疏水作用等非共价键的破坏或形成,使酶钝化、蛋白质改性、淀粉糊化,并杀死食品中的病毒、细菌、霉菌等微生物,从而达到食品保藏加工的目的[9]。赵谋明等[10]利用均质机在60 MPa压力下破碎红细胞,使Hb溶出冷冻备用。作者利用超高压作用于吸水的红细胞使其加速涨破快速释放出Hb这一技术,通过响应面(Response Surface Methodology,简称RSM)优化其提取工艺,为大规模工业化提取Hb提供理论依据。
1 材料与方法
1.1 试验材料和主要试剂
新鲜鸡血,购自燕岭农贸市场。
1.2 试验方法

1.2.1 工艺路线 工艺路线如下所示。
1.2.2 技术要点
1)抗凝 向新鲜鸡血中添加5 g/L的柠檬酸三钠,取血时摇晃混匀即可;
2)离心 将含抗凝剂的鸡血在4℃、12 000 r/ min离心20 min,弃上清液得血浆和红细胞沉淀;
3)洗涤 用生理盐水洗涤沉淀,去除沉淀中的小分子蛋白质以及游离氨基酸等可溶性物质,反复洗涤3次;
4)超高压处理 按照下述单因素试验的要求加适量的超纯水,分别在低速均质机中混匀1 min,装入铝箔袋封口,静置5 min,分别用不同的超高压处理;
5)二次离心 将处理样品在4℃、8 000 r/min离心20 min,弃沉淀得上清液;
6)取样 吸取处理样品的上清液1 mL,按等浓度梯度稀释100倍,备用;
7)冷冻干燥 将处理样品的上清液冷冻,置真空冷冻干燥机中干燥称重,记录数据。
1.2.3 单因子试验
1)料液质量体积比的确定 取添加了抗凝剂的新鲜鸡血100 mL离心,获得血浆沉淀,生理盐水洗涤,得血浆沉淀质量与超纯水体积比称之为料液质量体积比。在超高压100 MPa、25℃、pH值为7条件下,分别对不同的料液质量体积比处理5 min,考察不同的料液质量体积比对快速提取Hb的影响。
2)提取时间的确定 在超高压100 MPa、温度为25℃、pH值为7的条件下,对料液质量体积比为1 g∶200 mL的样品分别处理5、10、15、20 min,考察不同的提取时间对快速提取Hb的影响。
3)超高压压力的确定 在25℃、pH值为7条件下,对料液质量体积比为1 g∶200 mL的样品分别采用100、150、200、250、300、400 MPa超高压处理5 min,考察不同超高压压力对Hb得率的影响。
4)pH的确定 在超高压100 MPa、温度为25℃的条件下,对料液质量体积比为1 g∶200 mL的样品分别处理5 min中,考察pH(4、5、6、7、8、9)对快速提取Hb的影响。
5)最适温度的确定 在超高压100 MPa、对料液质量体积比为1 g∶200 mL的样品分别处理5 min中,pH值为7,考察不同的温度(5、10、15、20、25、30、35℃)对快速提取Hb的影响。
1.2.4 响应面的设计 根据上述单因素的结果,得出影响Hb得率的最主要的条件,采用BOXBehnken试验设计和响应面分析料液比、提取时间、超高压对提取Hb的影响。
1.3 分析测定
1.3.1 Hb的测定 对上述经过不同条件处理的样品进行离心的上清液,将上清液稀释100倍,使溶液中的Hb质量浓度在3.6~200 mg/L范围内,取稀释液0.15 mL与显色剂混匀,37℃保温20 min,510nm测吸光值;用Hb标准稀释也将Hb标准液稀释成不同的浓度:20、40、60、80、100、120、160、200 mg/ L,用紫外分光光度计测定OD值,绘制标准曲线如下图1所示。
1.3.2 Hb乳化性及其稳定性的测定 在测试管中分别加入15 mL 0.1 g/dL Hb溶液(pH 7.2~7.5)和5mL玉米油,乳液经高速均质机(20 000 r/min)处理1 min后,从测试管底部取出50 μL乳液,用0.1 g/ dL的SDS稀释100倍后,于500 nm比色。乳化性指数(EAI,m2/g)和乳化稳定性指数(ESI,min)的计算公式如下[11]:

图1 微量游离血红蛋白(FHb)标准曲线Fig.1 Standard curve of trace free hemoglobin(FHb)


式中,DF为稀释因子,DF=100;ρ为蛋白质量浓度,g/mL;Ø为光程,Ø=0.01 m;θ为油相所占分数,θ= 0.25;A0、A10分别为0 min和10 min是的吸光度。
1.3.3 Hb起泡性及其稳定性的测定 将2 g Hb溶于300 mL水中,置于500 mL量筒(口径6 cm,高为20 cm),使用高速乳化均质机以一定的转速均质40s,连续3次共计2 min,记录均质后液面高度记为V0,静置30 min后记录液面高度,记为V30min[12]。
起泡能力(Foaming capacity)的计算公式如下:

泡沫稳定性(Foaming stability)的计算式如下:

2 结果与讨论
2.1 不同料液质量体积比对提取Hb的影响
如下图2所示,在25℃经过100 MPa处理5min后,料液质量体积比为1 g∶200 mL时,此时获得的Hb达到最大值,此后料液质量体积比值越小,Hb的得率增加不明显,反而其上清液干重有增加的趋势。这说明当料液质量体积比为1 g∶200 mL时,此时血浆中的红细胞恰好能跟超纯水全面接触,使红细胞在100 MPa的作用下迅速吸水涨破,释放Hb。此后因为100 mL鸡血中红细胞数量的限制,随着超纯水的增加,对Hb的得率没有影响。有文献表明,蛋白质的四级结构对压力最为敏感,50~300 MPa的压力能导致大多数寡聚蛋白质解聚[13]。而上清液物质干质量的增加可能是因为在超高压的作用下,一些蛋白质解聚或疏水基团暴露出来,增加其溶解性[14]。
2.2 不同提取时间对提取Hb的影响
如下图3所示,经过100 MPa处理料液质量体积比为1 g∶200 mL的样品时,处理5 min时Hb得率已达到最大值;随着提取时间的延长,Hb的得率并没有增加,而上清液物质干重有增加趋势。这说明在此条件下,样品处理5 min时,红细胞已经完全破碎,Hb被释放出来,其得率并不会随着时间的延长而增加。超高压处理会使大分子蛋白子解聚成亚基单元,使暴露极性基团增多,疏水作用增强,从而提高其溶解性[15]。黄群[16]等人利用超高压处理S-卵白蛋白,发现其结构有明显的变化,S-卵白蛋白的溶解性等功能特性也随压力增加而明显改善。然而干物质量的增加可能是因为100 MPa长时间的作用下,改变某些物质的结构使其溶解,导致干质量增加。

图2 不同料液质量体积比对快速提取Hb的影响Fig.2 Affects of different solid-liquid ratio on rapid extraction Hb

图3 不同提取时间对快速提取Hb的影响Fig.3 Effects of different extraction time on rapid extraction Hb
2.3 不同超高压压力处理对Hb得率的影响
如下图4所示,在不同的超高压处理料液质量体积比1 g∶200 mL的样品5 min,超高压压力为150 MPa时Hb得率最高,随后随着超高压的增加,Hb的得率迅速降低,但是上清液物质的质量浓度一直在增加。这说明在100~150 Mpa压力对Hb的分子结构影响不大,当超过150 MPa时,过高的压力会使Hb分子的四级结构解聚成4个亚基,亚基的结构也发生变化,三级结构中血红素卟啉环中的Fe2+的两个配位键被破坏,致使Hb得率随着压力的升高而减少。然而由于血浆含有各种纤维蛋白、球蛋白和白蛋白等蛋白质,压力升高的同时会破坏它们的非共价键、离子键以及氢键等,引起蛋白质解聚、暴露疏水基和分子结构伸张,增加它们的溶解性,因而使得上清液的质量浓度随着压力的增加而显著升高[17]。

图4 不同压力处理对Hb得率的影响Fig.4 Effects of different Ultra-high pressure on the yield of Hb
2.4 不同pH对Hb得率的影响
如下图5所示,在其他条件不变的情况下,通过改变料液比的pH值,Hb的得率无明显变化,上清液物质的干重也无明显的变化趋势。研究表明,低的pH值使红细胞膜通透性增加,利于吸水,高的pH可使红细胞体积减小,而pH在7.4左右时红细胞更接近于球形。pH值的不同会使红细胞的形态、大小及膜的特性发生变化[18]。出现这种原因的可能是pH作用的时间较短,来不及改变细胞的形态红细胞就已经吸水涨破。因此,不选用pH值作为后续响应面考察的因素。
2.5 不同温度处理对Hb得率的影响
下图6所示,在其他条件不变的情况下,Hb得率和上清液的干重随着温度的升高逐渐增加,直至30℃时,其得率增加趋于平缓。这是因为热胀冷缩的原理,红细胞随着温度的升高更容易吸水涨破。虽然30℃Hb得率稍微比25℃多,但是超高压在处理的过程中随着保压时间的延长会伴随着温度的升高,且血液在30℃时更容易滋生细菌,导致腐败发臭。因此选用25℃比较合理,没有必要对其进行优化。
2.6 响应面优化试验

图5 不同pH处理对Hb得率的影响Fig.5 Effects of different pH on the yield of Hb
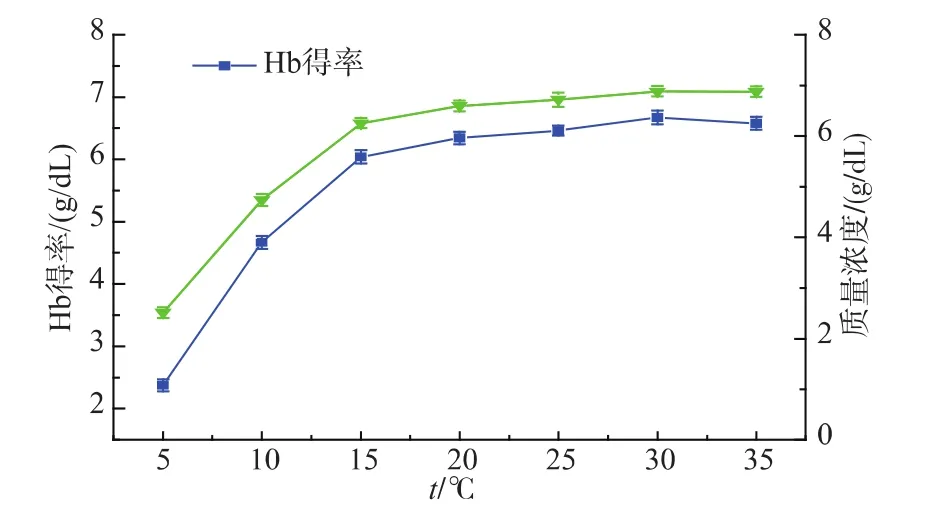
图6 不同处理温度对Hb得率的影响Fig.6 Effects of different tempreture on the yield of Hb

表1 因素水平编码表Table 1 Coding table of factors and levels

表2 BOX-Behnken试验设计与结果Table 2 BOX-Behnken design matrix and extraction results of programme
2.6.1 BOX-Behnken试验结果 根据上述单因素实验结果,确定3个重要影响因素,分别记为变量X1、X2、X3,响应面试验因子及水平见表1,设立了17个处理组,响应面试验设计方案表1及其结果表2。
2.6.2 模型的建立与显著性检验 利用 Design Expert8.0软件对BOX-Behnken试验结果进行多元回归拟合分析,获得自变量与Hb得率的回归方程:Y=6.70+0.38A+0.34B-0.23C-0.31AB-0.065AC-0.36BC-0.34A2-0.76B2-0.57C2,由表3可知,模型的P值<0.000 1,且失拟项P=0.102 4>0.05不显著,说明此模型回归显著;复相关系数R2=0.986 8,表明此模型的拟合程度较高,模型的校正系数R2Adj=0.9699,说明不利因素对本实验结果的影响极小,实验误差小,可以用此模型分析和预测超高压辅助提取Hb的工艺结果[19]。对该模型进行显著性分析,结果如表3所示,由P值可知影响超高压提取Hb的主次因素A>B>C,即料液比>提取时间>超高压。模型中的一次项A、B、C以及交互项AB和BC对Hb得率的影响都是极其显著的(P<0.01),交互项AC对Hb得率的影响是不显著的。
2.6.3 模型验证试验 在获得回归非线性模型和响应面之后,对此模型方程求一阶偏导并使其等于0,可以得到曲面的最大值。求解次方程组得到最大Hb得率的最佳最佳工艺条件为:A=1 g∶250 mL,B= 5.38 min,C=135.34 MPa,Hb得率的预测值为6.863g/dL。应用响应面法得到最优值后,在料液质量体积比为1 g∶250 mL、提取时间为5.4 min、超高压135 MPa试验条件下进行验证试验,试验3次,测定Hb得率的平均值为6.697 g/dL,实验值与模型值相差0.166 g/dL,说明该模型能较好地预测实际Hb提取情况。
2.7 超高压处理后Hb的有关特性分析
2.7.1 超高压处理后对Hb乳化活性及其稳定性的影响 未经超高压处理的对照组,其乳化活性比处理过的乳化活性低;而其稳定性正好相反。这是因为经超高压处理后Hb暴露出更多的疏水基团,其亲水亲油发生改变导致乳化活性增强;但是随着时间的延长,疏水基团发生凝聚导致其乳化稳定性反而下降。
2.7.2 超高压处理后对Hb起泡性及其稳定性的影响 经超高压处理的Hb的起泡性及其稳定性比对照组有明显的提高。这可能的原因是超高压力提高压缩Hb分子,破坏其非共价键,蛋白质解聚,分子结构伸展,液体变得更加粘稠,亚基之间的相互凝聚形成较小的气泡,发泡能力增强,亚基之间的相互作用有利于泡沫的稳定性。

表3 DH响应面结果的方差分析Table 3 ANOVA of RSM for DH
3 结语
通过单因素试验从料液质量体积比、提取时间、超高压、pH值和温度5个因素中选出影响Hb得率最主要的因素及最佳水平,利用BOX-Behnken试验设计,应用响应面法优化超高压提取Hb的工艺参数。且经超高压处理后Hb的乳化性有明显的提高,起泡能力和泡沫稳定性有显著的增强。与传统的丙酮等[20]有机试剂提取相比较,利用超高压提取Hb无试剂污染、提取时间短、Hb得率较高等特点,为进一步工业化提取提供数据的支持。
[1]MARQUEZ E,BRACHO M,ARCHILE A,et al.Proteins,isoleucine,lysine and methionine content of bovine,porcine and poultry blood and their fractions[J].Food chemistry,2005,93(3):503-505.
[2]王镜岩,朱圣庚,徐长法.生物化学[M].北京:高等教育出版社,2002.
[3]YU Y,HU J,BAI X,et al.Preparation and function of oligopeptide-enriched hydrolysate from globin by pepsin[J].Process Biochemistry,2006,41(7):1589-1593.
[4]CHANG C Y,WU K C,CHIANG S H.Antioxidant properties and protein compositions of porcine hemoglobin hydrolysates[J]. Food Chemistry,2007,100(4):1537-1543.
[5]NEDJAR A N,DUBOIS D V,MILOUDI K,et al.Isolation and characterization of four antibacterial peptides from bovine hemoglobin[J].Peptides,2006,27(9):2082-2089.
[6]LU Xiulin,ZHAO Dongxun,JIN Yetao,et al.Eficient separation and purification of bovine hemoglobin using expanded bed adsorption[J].Journal of Chemical I ndustry and Eng ineering(China),2003(9):1257-1263.(in Chinese)
[7]ZHOU Ling,KAN Jianquan,WAN Xuerong.Study on ultrasonic extraction of hemoglobin from pig red blood cells[J].Food Science,2009,30(4):92-95.(in Chinese)
[8]HAO Yulan,LU Shilin,WU Yanan,et al.Optimization of ultrasonic extraction of bovine hemoglobin by response surface methodology[J].Science and Technology of Food Industry,2015,10:259-263+268.(in Chinese)
[9]WAN Chunfang,MAO Ming,YU Yong,et al.Research status of micro-organisms’mutagenic mechanism and influencing factors by the ultra-high pressure[J].Journao of Chinese Institute of Food Science and Technology,2013(7):164-169.(in Chinese)
[10]ZHAO Mouming,GUO Shangguan,CUI Chun,et al.Emymatic hydrolysis of porcine hemoglobin and debitteriIIg of hydrolysates [J].Journal of Jilin University(Engineering and Technology Edition),2006(6):1034-1040.(in Chinese)
[11]CHAVAN U D,MCKENZIE D B,SHAHIDI F.Functional properties of protein isolates from beach pea(Lathyrus maritimus L.)[J].Food Chemistry,2001,74(2):177-187.
[12]刘瑾.酶法改善大豆分离蛋白起泡性和乳化性的研究[D].无锡:江南大学,2008.
[13]LI Renjie,LIAO Xiaojun,HU Xiaosong,et al.Effects of High Hydrostatic pressure on proteins[J].Chinese Jouranl of High Pressure Physics,2014,28(4):498-506.(in Chinese)
[14]WAGNER J R,SORGENTINI D A,ANON M C.Relation between solubility and surface hydrophobicity as an Indicator of modifications during preparation processes of commercial and laboratory-prepared soy protein isolates[J].Agricultureand food Chemistry,2000,48(8):3159-3165.
[15]DONG Xinghong,ZHAO Mouming,JIANG Yueming.Application of ultra-high pressure technique in protein food industry[J]. Science and Technology of Food Industry,2012(2):451-454.(in Chinese)
[16]HUANG Qun,JIN Yongguo,MA Meihu,et al.Effect of ultra high pressure on conformation and functional properties of S-ovalbumin[J].Transactions of the Chinese Society for Agricultural Machinery,2013,44(3):161-166.(in Chinese)
[17]HE Xuanhui,LIU Hongzhi,WANG Qiang,et al.Effect of ultra-high pressure on gelation property of food protein[J].Food Science,2013,13:334-337.(in Chinese)
[18]YAO Chengcan,HUANG Yaoxiong,LI Xiaokun,et al.Effect of pH on the mechanical properties of red blood cell membrane and intracellular protein structure and function[J].Chinese Science Bulletin,2003,10(10):1050-1053.(in Chinese)
[19]LUO Ping,WAN Shasha,SUN Junjie,et al.Optimization of ultrasonic-assisted extraction of total alkaloids from plumula nelumbinis by response surface methodology[J].Journal of Food Science and Biotechnology,2014(7):743-749.(in Chinese)
[20]HUANG Qiangzeng,WU Bie,LIU Zhaorong.Study on acetone extraction of hemoglobin[J].Strait Pharmacy,1997(3):52.(in Chinese)
中国毒理学会第八次全国毒理学大会
所属学科:病毒与免疫学,医学免疫学
开始日期:2017-10-15 结束日期:2017-10-18
所在城市:山东省 济南市 具体地点:山东大厦会议中心
主办单位:中国毒理学会 承办单位:山东省医学科学院、山东省毒理学会
联系人:孔祥颖 联系电话:010-66932387,010-68187038
E-MAIL:cst@chntox.org 会议网站:http://223.4.55.186:8088/chntoxWeb/cnaCN/index.asp?exhId=9
会议背景介绍:中国毒理学会第八次全国毒理学大会 (CSOT-VIII)暨第七届全国会员代表大会将于2017年10月15-18日在山东省济南市山东大厦会议中心召开。大会由中国毒理学会主办,山东省医学科学院和山东省毒理学会承办。中国毒理学会是中国科学技术协会所属国家一级学会,是国际毒理学联合会(IUTOX)成员和亚洲毒理学会(ASITOX)创始成员。目前已有25个专业委员会,注册会员达1万5千余名。全国毒理学大会是中国毒理学领域最高层次学术盛会,已先后召开了7次,即1993年(第1次,北京)、1997年(第2次,西安)、2001年(第3次,南京)、2005年(第4次,沈阳)、2009年(第5次,贵阳)、2013年(第6次,广州)、2015年(第7次,武汉)。这些会议,对于推动我国毒理学的发展与交流起到了十分重要的作用。2017年第八次全国毒理学大会将又是我国毒理学科技界的一次盛会。大会将邀请国内、外知名专家学者就毒理学领域的最新研究进展、前沿理论与技术发展做大会报告。热诚欢迎我国毒理学和相关领域的专家、学者、科技和教育工作者、管理人员、研究生以及相关企业工程技术人员等踊跃投稿、积极参加会议、展示学术成果。大会期间,将召开中国毒理学会全国代表大会,换届选举第七届中国毒理学会理事会,产生新一届领导机构。此外,大会期间还将举办与毒理学发展相关科技产品、试剂、仪器等科技展览,欢迎生物、医药科技企业、厂家等参展。
Process Optimization of the Ultra-High Pressure Extraction of Hemoglobin from Chicken Blood by Response Surface Methodology
ZHANG Xuan1,2, TANG Daobang1, CHENG Jingrong1,ZHANG Yousheng1, ZHANG Yehui1, LIU Xueming*1
(1.Sericultural and Agri-Food Research Institute,Guangdong Academy of Agricultural Sciences/Key Laboratory of Functional Food of Ministry of Agriculture/Key Laboratory of Agricultural Product Processing of Guangdong Province,Guangzhou 510610,China;2.College of Bio-Engineering,Jiangxi Agricultrural,Nanchang 330045,China)
This study was under taken to exploring the optimal process for ultra-high pressure extraction of chicken blood hemoglobin(Hb)and demonstrating the key process properties.To accomplish this,response surface analysis methodology(RSM)was used for optimizing ultra-high pressure extraction of Hb with Hb rate as the response.In the meanwhile,the role of ultra-high pressure in improving Hb functional properties by high speed homogenization,such as emulsifying properties and foaming capacity,were also revealed.Results showed that the technical parameters,including liquid ratio,extraction time and ultra-high pressure presented significant impact on Hb yield.The optimal extraction conditions were 1 g∶250 mL solid-liquid ratio,135 MPa for 5.4 min. Under these conditions,the yield of Hb was 6.697 g/dL.With ultra-high pressure treated,theemulsifying property of Hb was obviously improved while its emulsion stability decreased;both the foaming capacity and foaming stability presented enhanced trends.
ultra-high pressure,liquid ratio,response surface,emulsion,foaming capacity
S 873
:A
:1673—1689(2017)07—0743—07
2015-08-25
广东省科技计划项目(2014A020208046);广东省促进科技服务业发展计划项目(2013B040400009)。
*通信作者:刘学铭(1967—),男,江西兴国人,工学博士,研究员,主要从事畜禽水产加工研究。E-mail:xuemingliu@21cn.com
张炫,唐道邦,程镜蓉,等.响应面优化超高压提取鸡血血红蛋白的工艺[J].食品与生物技术学报,2017,36(07):743-749.
