β-紫罗兰酮脂质体包封率测定方法研究
2017-09-26王一涵徐迎波周志磊徐菲菲
王一涵, 徐迎波, 宁 敏, 周志磊,梁 蓉,陈 羚, 徐菲菲,钟 芳*
(1.江南大学 食品学院,江苏 无锡214122;2.安徽中烟工业有限责任公司 烟草化学安徽省重点实验室,安徽合肥230088;3.江南大学 食品胶体与生物技术教育部重点实验室,江苏 无锡214122)
β-紫罗兰酮脂质体包封率测定方法研究
王一涵1,2, 徐迎波2, 宁 敏2, 周志磊1,梁 蓉3,陈 羚1, 徐菲菲1,钟 芳*1
(1.江南大学 食品学院,江苏 无锡214122;2.安徽中烟工业有限责任公司 烟草化学安徽省重点实验室,安徽合肥230088;3.江南大学 食品胶体与生物技术教育部重点实验室,江苏 无锡214122)
采用薄膜超声法制备β-紫罗兰酮脂质体,通过反透析法分离脂质体和游离物质,并以高效液相色谱法为分析手段对其包封率进行测定。在选定色谱条件下,辅料不干扰测定,β-紫罗兰酮在5~80 mg/L的质量浓度范围内线性关系良好(R2=0.999 8),日内和日间精密度(RSD)均小于3%;透析平衡时间为12 h,游离物回收率符合要求(99.21%~101.22%),且透析20 h内无渗漏,方法重现性好;使用此法测得β-紫罗兰酮脂质体的平均包封率为(52.76±1.10)%。反透析法简便,准确,经济,适用于β-紫罗兰酮脂质体包封率的测定。
β-紫罗兰酮脂质体;薄膜超声法;包封率;反透析法
β-紫罗兰酮[4-(2,6,6-三甲基-1-环己烯基)-3-丁烯-2-酮,β-ionone]是一种重要的香味化合物,为类胡萝卜素9,10-双键断裂形成的氧化产物。其为浅黄色液体,具有浓郁的紫罗兰香气,接近烟草的木香,且带有果香[1-2],广泛用于香水、烟草等行业中。对香气成分进行包埋是对其进行保护和控制释放的有效手段。在众多包埋方法中,脂质体技术表现出很大的优势。脂质体不仅可以有效地包埋和转运亲水和亲油性物质[3],其还具有靶向性,可以利用温度,pH等条件的变化控制包埋物的释放。作者利用温度的变化(卷烟在抽吸时滤嘴的温度约为40℃)控制脂质体中包埋的风味物质的释放,制备适合添加于滤嘴中的温度敏感型脂质体(40℃),开发出新的卷烟香精微胶囊化技术和加香方法。
包封率 (Entrapment Efficiency,EE%)指被包裹在脂质体囊中的芯材占脂质体混悬液中芯材总量的比例。对于热敏脂质体而言,包封率是评价脂质体制备工艺和质量的重要指标。其测定方法主要分为两种:一种是直接测定,另一种是将游离药物与脂质体分离后测定。常用的分离方法有柱层析法,离心法等[4]。由于柱层析操作繁琐,且葡聚糖G50为水溶性凝胶,较难洗脱脂溶性芯材;而超速离心法对设备转速要求较高,还易使脂质体中的芯材泄漏。先前研究中有人采用气相色谱法测定了环糊精中β-紫罗兰酮的含量[5],但对脂质体中β-紫罗兰酮的包封率研究未见报道。再者,包埋的物质不同,包封率的测定方法不同,现有的包封率测定方法不适合测定紫罗兰酮这种挥发性成分。因此作者采用薄膜超声法制备了脂质体,并建立了测定β-紫罗兰酮脂质体包封率的方法,为β-紫罗兰酮脂质体的质量评价提供了依据。
1 材料
1.1 材料
二棕榈酰磷脂酰胆碱DPPC,氢化大豆卵磷脂HSPC:上海艾韦特医药科技有限公司产品;β-紫罗兰酮:分析纯,上海安谱实验科技股份有限公司产品;乙腈:色谱纯,上海沃凯化成工业有限公司产品;水:超纯水。
1.2 仪器
旋转蒸发器:R-205,上海申顺生物科技有限公司产品;超声波细胞粉碎机:南京菲奇工贸产品;磁力加热搅拌器:C-MAG HS4,德国IKA产品;Waters高效液相色谱仪:美国waters公司产品。
2 方法与结果
2.1 脂质体的制备
称取一定比例的DPPC、HSPC、吐温80和β-紫罗兰酮于250 mL圆底烧瓶中,加入20 mL的无水乙醇,在50℃下水浴至溶,减压旋转蒸发除去乙醇,形成薄膜。再加入一定量的PBS(pH=6.8)缓冲溶液,旋转蒸发水化30 min(50℃),迅速冷却,于探头式超声仪上碎冰浴超声处理4 min。50℃水溶2 h后于4℃静置过夜,冷冻离心(4 500 g)30 min除去钛颗粒,置于冰箱中保存[6-7]。
2.2 β-紫罗兰酮脂质体质量浓度测定
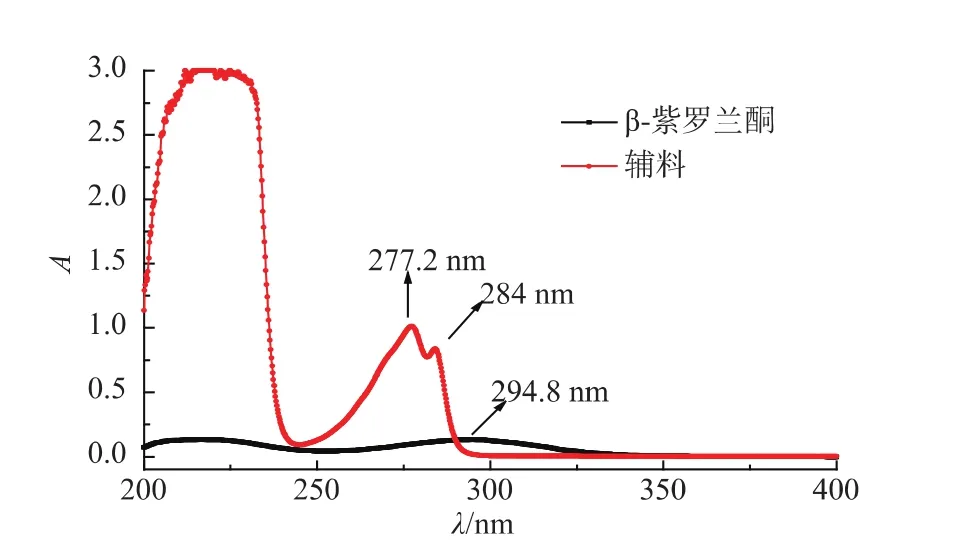
图1 β-紫罗兰酮和辅料的紫外吸收光谱Fig.1 Ultraviolet absorption spectrum of beta-ionone and supplementary materials
2.2.1 检测波长的确定 配制β-紫罗兰酮标准品的乙醇溶液,并按比例配制对应辅料的乙醇溶液,在200~400 nm内进行紫外扫描,见图1。通过紫外吸收图谱可见,辅料在β-紫罗兰酮最大吸收波长294 nm处干扰很大,故在选择测定方法时,选择辅料无干扰的HPLC系统。
2.2.2 HPLC的色谱条件和色谱行为 色谱柱:C18(250 mm×4.6 mm,5 μm,美国waters公司);流动相:V(乙腈)∶V(水)=70∶30等度洗脱;柱温:30℃;流量:1.0 mL/min;检测波长:304 nm;进样体积:20 μL。取β-紫罗兰酮溶液,空白脂质体破乳溶液和β-紫罗兰酮脂质体破乳溶液各20 μL进样分析。由图2可见,杂质峰与β-紫罗兰酮峰分离良好,辅料和试剂对β-紫罗兰酮测定无干扰。
2.2.3 线性范围及标准曲线 用乙醇准确配制质量浓度为100 mg/L的β-紫罗兰酮对照品贮备液,4℃冰箱保存,分别精密吸取β-紫罗兰酮对照品贮备液0.5、1、2、4、6、8 mL,置1~8号10 mL棕色容量瓶中,以乙醇定容至刻度,摇匀,得质量浓度分别为5、10、20、40、60、80 mg/L的紫罗兰酮标准溶液,进液相色谱分析。以质量浓度C对峰面积A进行线性回归,得回归方程:A=83 597C-8 509.3,R2=0.999 8。实验表明,β-紫罗兰酮在5~80 mg/L的质量浓度范围内,峰面积与质量浓度呈良好的线性关系。
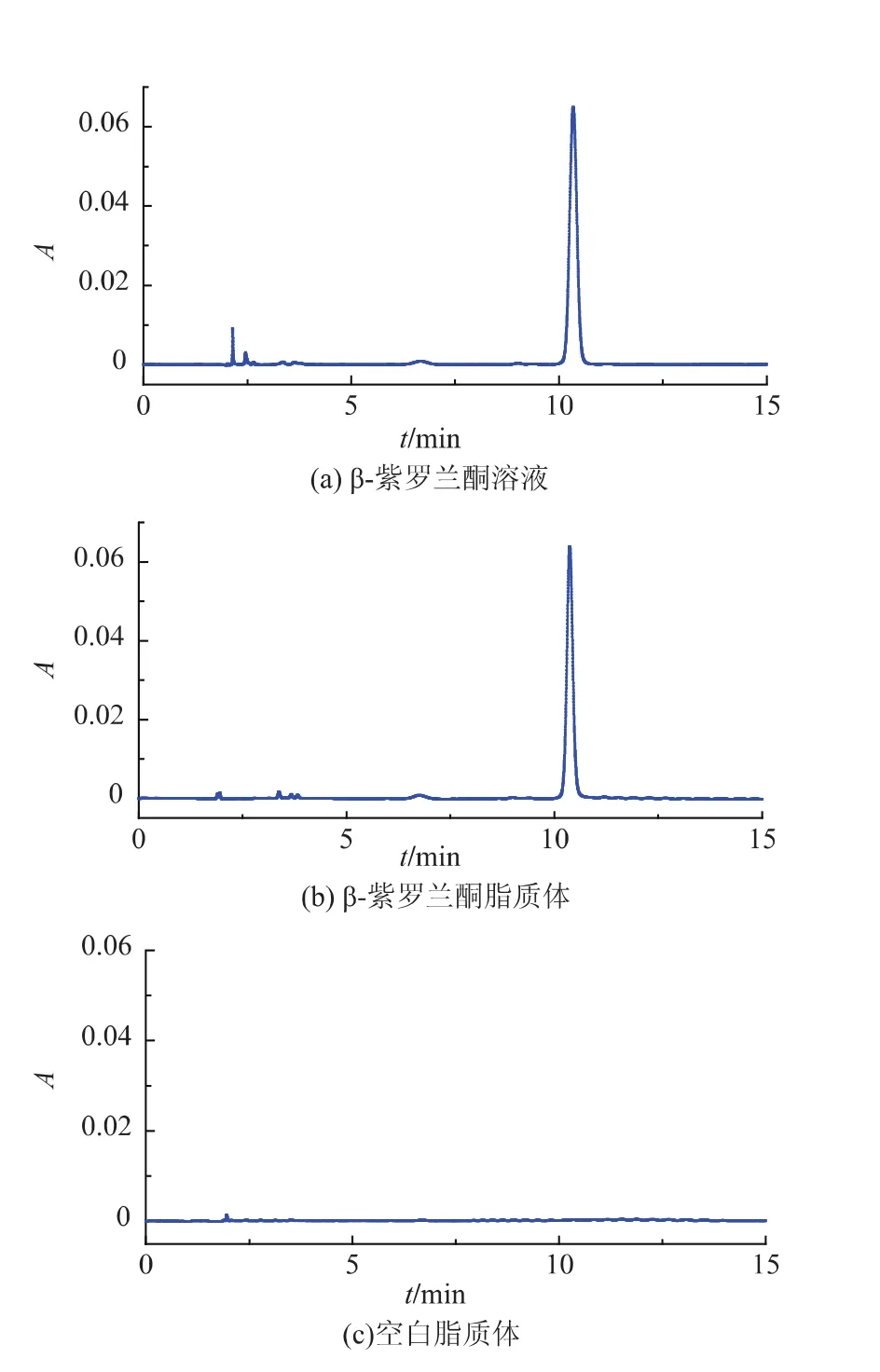
图2 HPLC色谱图Fig.2 Representative HPLC chromatograms used for specificity
2.2.4 进样精密度和回收率实验 取质量浓度为10,20,40,60 mg/L的β-紫罗兰酮对照品贮备液,于1天和1周内重复进样3次,进样体积20 μL,测得日内精密度和日间精密度,结果见表1。
精密度用相对标准偏差表示,结果表明,在此条件下测定,RSD<5%,重现性良好。
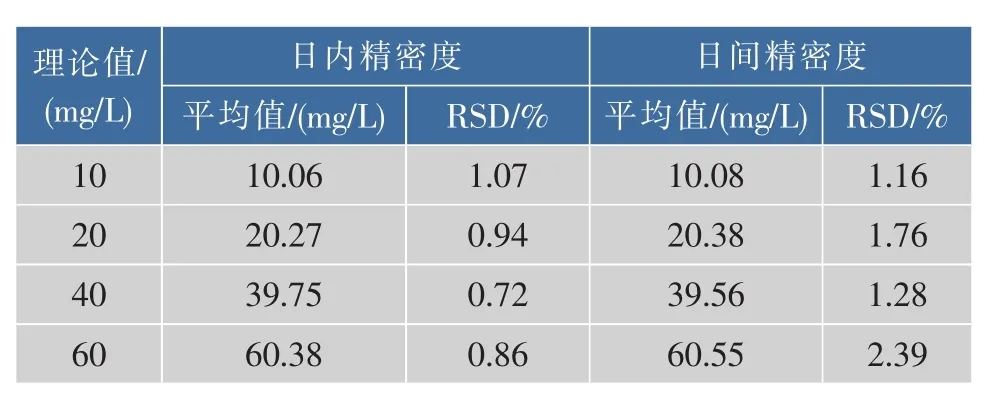
表1 HPLC的进样精密度实验结果Table 1 Intra-precision and Inter-precision of HPLC determination for beta-ionone
精密量取250 μL空白脂质体溶液,分别加入至125,350,625 μL的β-紫罗兰酮贮备液 (1 000 mg/L)中,每个样品各3份,以适量Triton X-100破坏脂质体,用水定容至10 mL,摇匀即得样品溶液,分别进样20 μL,测定峰面积,计算回收率,结果见表2。
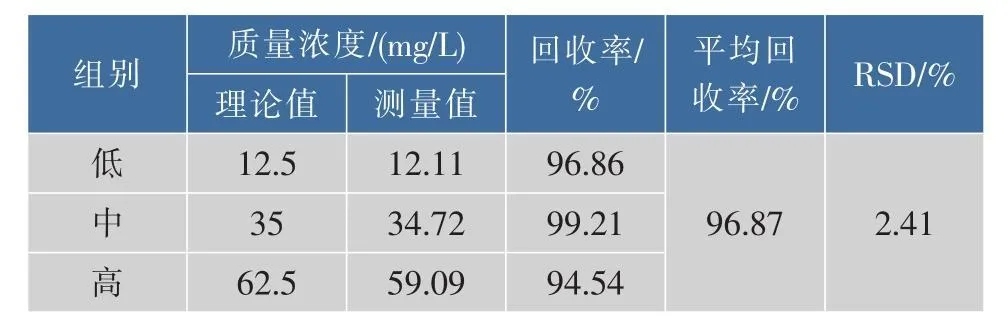
表2 空白脂质体加β-紫罗兰酮加样回收率Table 2 Recovery of beta-ionone with blank liposomes
2.3 脂质体包封率的测定
2.3.1 反透析平衡时间的确定 精密量取脂质体混悬液5 mL置于250 mL烧杯中,用体积分数20%的乙醇水溶液稀释至200 mL。再精密量取乙醇溶液5 mL于已处理的透析袋内,把透析袋浸入上述经稀释的脂质体混悬液中,同时以磁力搅拌器搅拌,透析过程中,分别于0、2、4、6、8、10、12、16、20 h吸取20 μL袋内透析液,并补充等量的释放介质,HPLC进样测定[8]。
实验结果可知,10 h即可达到透析平衡,透析袋内外的游离β-紫罗兰酮浓度相等,并且在20 h内脂质体不发生严重的渗漏现象,在此时间段内β-紫罗兰酮浓度基本保持不变,为保证透析完全而脂质体不渗漏,将透析时间定为12 h。
2.3.2 反透析法游离紫罗兰酮回收率 分别称取一定量的β-紫罗兰酮,用体积分数20%乙醇等渗液溶解,得β-紫罗兰酮过饱和溶液,室温避光条件下平衡24 h后,过0.22 μm微孔滤膜,制成β-紫罗兰酮饱和溶液,即时进样20 μL,得游离β紫罗兰酮质量浓度Ctol。以此饱和溶液作为外相,取5 mL乙醇等渗液作为内相,透析时间与脂质体透析平衡时间(12 h)一致。透析平衡后取内相20 μL进样,得游离β紫罗兰酮透析量Cfree。回收率=(Cfree/Ctol)*100%。
结果表明,回收率在99.21%~101.22%之间。这说明采用反透析法能达到除去脂质体中游离β-紫罗兰酮的目的,该方法可行。
2.3.3 β-紫罗兰酮包埋率的测定 取一定量的脂质体混悬液到10 mL容量瓶中,加入等量的TritonX-100溶液,漩涡振荡使脂质体解体,用超纯水定容后过0.22 μm微孔滤膜,HPLC测定溶液里β-紫罗兰酮的总质量浓度Ctol。
精密量取脂质体混悬液5 mL置于250 mL烧杯中,用乙醇溶液稀释至200 mL。再量取的乙醇溶液5 mL于已处理的透析袋内,把透析袋浸入上述经稀释的脂质体混悬液中,同时以磁力搅拌器搅拌,达到平衡时间(12 h)后,取透析袋内透析液20μL进样,HPLC测定计算游离β紫罗兰酮的质量浓度CFree。
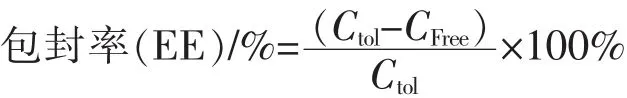
式中,Ctol为脂质体溶液中β-紫罗兰酮的总质量浓度;CFree为脂质体溶液中游离β-紫罗兰酮的质量浓度。
3 结语
1)为保证紫罗兰酮总含量测定的准确性,需将脂质体破乳,使β-紫罗兰酮从载体中完全释放出来。TritonX-100可溶解脂质体使溶液澄清,并且不干扰β-紫罗兰酮含量的测定。因此,作者选择TritonX-100为破乳溶剂。
2)分离脂质体中未被包埋的芯材的方法较多,如葡聚糖凝胶过滤法,超速离心法,超滤离心法,微柱离心法,滤膜法,反透析法等。
作者采用的反透析法则可避免因脂质体与游离芯材动态平衡被打破所导致的渗漏问题,且透析袋价格较低,比较经济[9-11]。
3)因β-紫罗兰酮的水溶性较差,而脂溶性较好,平衡透析法选择透析介质为使用高浓度20%乙醇溶液,能将一个处方量游离的β-紫罗兰酮完全溶解,即对游离β-紫罗兰酮有一定的溶解能力,且又在平衡时间内不造成脂质体的渗漏[12]。
[1]ISABEL Silva,SILVIA M Rocha,MANUEL A Coimbra.Quantification and potential aromacontribution of β-ionone in marine salt[J].Flavourand Fragrance Journal,2010,25:93-97.
[2]CHEN Lijun,ZHANG Xinya,HUANG Hong.Preparation methods of β-ionone with high purity[J].Flavour Fragrance Cosmetics,2005,6(3):29-32.
[3]SIPAI Altaf Bhai M,VANDANA Yadav,MAMATHA Y,et al.Liposomes:an overview[J].Journal of Pharmaceutical and Scientific Innovation,2012,1(1):13-21.
[4]LEI Xiaofen,LIU Yuzhen.Study on the method for determining the entrapment efficiency of coix seed oil liposomes[J].Science and Technology of Food Industry,2013,34(2):61-67.(in Chinese)
[5]苏长涛.紫罗兰酮的合成及其卷烟加香应用研究[D].郑州:河南农业大学,2008.
[6]XIA Shuqin,XU Shiying.Preparation of ferrous sulfate liposomes[J].Journal of Food Science and Biotechnology,2004,23(4):74-77.(in Chinese)
[7]BANGHAM A D,STANDISH M M,WATKINS J C.Diffusion of univalent ions across the lamellae of swollen phospholipids[J]. J Mol Biol,1965,13:238-252.
[8]ZHANG Ying,ZHU Jiabi,WANG Yueling,et al.Studies on the method for determination the entrapment efficiency of nimodipine nanoliposomes[J].Pharmaceutical and Clinical Research,2004,12(3):1-4.(in Chinese)
[9]胡松.白葵芦醇脂质体的制备及评价[D].吉林:延边大学,2010.
[10]ZHANG Yang,ZOU Hao,CHEN Jianming.Determination of entrapment efficiency of teniposide liposomes by Sephadex G-50 gelminicolumn centrifugation-HPLC[J].Chinese Journal of New Drugs,2009,18(16):1572-1576.(in Chinese)
[11]KE Xue,WANG Changjiang,YAN Fei.Filtration by microspore film for determination of the entrapment efficiency of docetaxel liposomes[J].Chinese Journal of Modern Applied Pharmacy,2008,25(4):314-316.(in Chinese)
[12]PAOLA Mura,FRANCESCA Maestrelli,MARIA Luisa González-Rodríguez,et al.Development,characterization and in vivo evaluation of benzocaine-loaded liposomes[J].European Journal of Pharmaceutics and Biopharmaceutics,2007,67:86-95.
Determination of Entrapment Efficiency of Beta-Ionone Liposomes
WANG Yihan1,2, XU Yingbo2, NING Ming2, ZHOU Zhilei1,LIANG Rong3, CHEN Ling1, XU Feifei1, ZHONG Fang*1
(1.School of Food Science and Technology,Jiangnan University,Wuxi 214122,China;2.Key Laboratory of Tobacco Chemistry,China Tobacco Anhui Industrial Co.,LTD,Hefei 230088,China;3.Key Laboratory of Food Colloids and Biotechnology,Ministry of Education,Jiangnan University,Wuxi 214122,China)
A method used for determining the entrapment efficiency of beta-ionone in liposomes was established.The liposome was prepared by thin film evaporation.The free beta-ionone was separated from liposomes by reverse dialysis and quantified with HPLC.The results showed that the calibrated curve was linear(R2=0.999 8)within the range of 5~80 mg/L for beta-ionone.Intra-day and inter-day precision(RSD)were both less than 3%.The equilibrium time for the dialysis was 12 h,and the recoveries showed with good reproducibility (99.21%~101.22%),and the leaking percentage in 20 h was negligible.The average entrapment efficiency of beta-ionone liposome was 52.76±1.10%.The reverse dialysis method was convenient,accurate and economic,suitable for determining the encapsulation efficiency of beta-ionone liposomes.
Beta-ionone liposomes,thin film evaporation,entrapment efficiency,reverse dialysis method
TS 201.7
:A
:1673—1689(2017)07—0688—04
2015-07-06
国家自然科学基金项目(31171686);烟草化学安徽省重点实验室2013年开放课题资助项目(0920140109010)。
*通信作者:钟 芳(1972—),女,河南新乡人,工学博士,教授,博士研究生导师,主要从事食品物性、食品胶体研究。E-mail:fzhong@jiangnan.edu.cn
王一涵,徐迎波,宁敏,等.β-紫罗兰酮脂质体包封率测定方法研究[J].食品与生物技术学报,2017,36(07):688-691.
