纳米金-还原氧化石墨烯修饰葡萄糖氧化酶传感器的制备及其电流法检测饮料中的葡萄糖
2017-09-26郑海松陈雪娇李云飞操小栋叶永康
郑海松,毛 慎,丁 顺,陈雪娇,李云飞,宗 凯,操小栋,叶永康*
(1.安徽出入境检验检疫局 技术中心,安徽 合肥 230022;2.合肥工业大学 食品科学与工程学院,安徽 合肥 230009)
纳米金-还原氧化石墨烯修饰葡萄糖氧化酶传感器的制备及其电流法检测饮料中的葡萄糖
郑海松1,毛 慎2,丁 顺2,陈雪娇1,李云飞1,宗 凯1,操小栋2,叶永康2*
(1.安徽出入境检验检疫局 技术中心,安徽 合肥 230022;2.合肥工业大学 食品科学与工程学院,安徽 合肥 230009)
利用纳米金(AuNPs)与还原氧化石墨烯(rGO)复合纳米材料制备了葡萄糖氧化酶生物传感器并用于饮料中葡萄糖含量的检测。将壳聚糖作为还原剂及稳定剂,通过一步法合成了AuNPs-rGO复合材料,并通过物理吸附固定葡萄糖氧化酶(GOx)来制作GOx生物传感器。该传感器在磷酸盐缓冲溶液(0.1 mol/L,pH 6.0)中,-0.45 V(vs.Ag/AgCl)电位下电流法检测葡萄糖含量,线性检测范围为0.01~0.88 mmol/L,灵敏度为22.54 μA·mmol-1·L·cm-2,检出限为1.01 μmol/L,且表观米氏常数为0.497 mmol/L。该传感器用于多种饮料中葡萄糖含量的直接检测,结果满意。
纳米金;还原氧化石墨烯;葡萄糖氧化酶;电流法;饮料;葡萄糖
葡萄糖氧化酶(GOx)作为识别原件对葡萄糖具有高选择性,可在氧的存在下催化葡萄糖氧化成过氧化氢和葡糖酸内酯[1]。基于GOx的电化学[1-3]和光谱生物传感器[4-6]用于血液和食物中葡萄糖测定的研究已有报道。用于葡萄糖测定的电化学生物传感器由于具有制备和应用简易,成本低,灵敏,选择性高和能够快速检测葡萄糖的优点,已成为研究热点[4,7]。
石墨烯由于具有比表面积大、导电性良好和机械强度高等突出特点,在基础和应用研究中获得了极大的关注[8],如制作可以检测非法食品添加剂苏丹红Ⅰ的传感器[9]。石墨烯类生物传感器具有适合保持生物大分子活性的微环境[1,10],且可以固定AuNPs[11]、PtNPs[12]、SiO2纳米球[13]和TiO2纳米球[14]等形成石墨烯纳米复合材料(如GOx固定在铂纳米粒子功能化氮掺杂石墨烯纳米复合材料上用于葡萄糖的测定[15]),在更宽的线性范围、高灵敏度和低检出限等方面显示出优异的分析性能。
本文利用壳聚糖作为还原剂和稳定剂,进行一步法制备AuNPs-rGO纳米复合材料用以固定GOx,构建电化学GOx生物传感器。对构建过程中的pH值、酶浓度以及时间~电流响应电位进行优化,以提高其灵敏度,并在最优条件下对该传感器的性能进行了研究。使用本方法检测饮料中葡萄糖,相比于酶比色法葡萄糖检测试剂盒,方法操作简单,结果稳定可靠。
1 实验部分
1.1 试剂与仪器
GOx、低分子量壳聚糖和GAGO-20葡萄糖检测试剂盒(美国Sigma-Aldrich公司);氧化石墨(南京吉仓纳米科技有限公司);氯金酸(HAuCl4,上海三爱思试剂有限公司);麦芽糖(上海源聚生物科技有限公司);D-果糖(北京索莱宝科技有限公司);葡萄糖、乳糖、蔗糖、醋酸、Na2HPO4和NaH2PO4(国药集团化学试剂有限公司)。其他化学试剂均为分析纯。各种饮料购自超市。所有溶液配制均使用双蒸馏水。
CHI 660D电化学工作站(上海辰华仪器有限公司);透射电子显微镜(TEM,日本JEOL);UV4802分光光度计(UNICO,尤尼柯上海仪器有限公司)。
1.2 AuNPs-rGO复合纳米材料的合成
按文献[10]报道略作调整,使用壳聚糖作为还原剂和稳定剂一步法制备AuNPs修饰的rGO:超声波24 h处理氧化石墨(1.0 mg/mL)得到棕色氧化石墨烯(GO)悬浮液,离心除去未剥离的氧化石墨,透析上清液除去盐和酸。10 mg/mL HAuCl4溶液和50 μL 0.1 mol/L NaOH加入2.0 mL 1.5 mg/mL氧化石墨烯悬浮液中,85 ℃下剧烈搅拌10 min。然后加入10.0 mL 1.0 mg/mL壳聚糖(1.0%乙酸溶液),120 ℃下搅拌24 h。最后,该AuNPs-rGO溶液冷却并储存在4 ℃备用。作为空白对照,相同条件下分别合成rGO和AuNPs。
1.3 GOx/AuNPs-rGO修饰玻碳电极的制备
将直径为3 mm的玻碳电极(GCE)抛光至镜面并清洗后,以5.0 μL AuNPs-rGO溶液分散至其表面,4 ℃下干燥后得到AuNPs-rGO/GCE;再将5.0 μL 7.0 mg/mL GOx(0.1 mol/L pH 6.0 PBS溶液)滴涂在上述电极表面,制得GOx/AuNPs-rGO/GCE电极。用0.1 mol/L pH 6.0 PBS彻底清洗电极以除去未吸附的GOx,4 ℃下保存。

图1 rGO(A)与rGO-AuNPs(B、C)的透射电子显微镜图以及UV-Vis图(D)Fig.1 TEM images of reduced graphene oxide (A), rGO-AuNPs(HAuCl4∶GO = 1∶3) (B),rGO-AuNPs (HAuCl4∶GO = 2.8∶3) (C) and UV-Vis absorption spectra (D)a:graphene oxide;b:rGO;c:rGO-AuNPs
1.4实际样品的电化学检测及试剂盒参照方法的建立
实际样品检测:样品无需预处理,分别取样10.0 μL,用双蒸水稀释至5.0 mL,组装3支传感器采用电流 ~时间响应方法分析。当电流稳定时,每隔50 s依次注入1.0 μL样品,同一传感器每个样品测3次。葡萄糖试剂盒检测方法根据产品说明书,样品预处理后分别取样10.0 μL,用双蒸水稀释至5.0 mL后测量。
2 结果与讨论
2.1 AuNPs-rGO纳米复合材料的表征

2.2 GOx/AuNPs-rGO/GCE对葡萄糖的电催化反应及分析性能
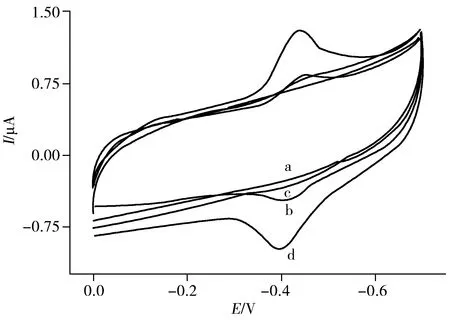
图2 不同材料修饰电极在无氧PBS中的循环伏安图Fig.2 CVs of the different material modified electrodes in N2-saturated PBSa.AuNPs-rGO/GCE;b.GOx/AuNPs/GCE;c.GOx/rGO/GCE;d.GOx/AuNPs-rGO/GCE
采用循环伏安法(CV)研究葡萄糖氧化酶的直接电化学。如图2所示,在无氧条件下(底液为0.2 mol/L PBS,pH 7.0,扫描速率100 mV/s),AuNPs-rGO/GCE(曲线a)在-0.7 ~ 0.0 V电位窗口内无氧化还原峰,而GOx/AuNPs-rGO/GCE(曲线d)有1对对称的氧化还原峰,其标准势电位(E0’)和峰电位差(ΔEp)分别为-0.418 V和46 mV。此外,GOx/AuNPs-rGO/GCE的峰电流明显大于GOx/AuNPs/GCE(曲线b)和GOx/rGO/GCE(曲线c)的峰电流。说明AuNPs-rGO复合物显著加强了酶与电极之间的电子传递能力。无氧条件下,在20~500 mV/s范围内,ΔEp随着扫描速率(v,mV/s)的增大而增大;阳极峰电流(Ipa)和阴极峰电流(Ipc)与扫描速率呈良好的线性关系。这表明GOx与电极表面之间的电子转移是一个表面控制过程。当v为100 mV/s时,其电子转移速率常数(Ks)为2.80 s-1。
图3A为传感器在不同底液中的循环伏安图。在无氧的PBS中,GOx/AuNPs-rGO/GCE有1对明显的氧化还原峰(曲线a),说明GOx具有一个可逆的电化学反应。但在含氧的PBS中,还原峰电流急剧增加而氧化峰电流降低(曲线b),说明氧气参与了反应。然而在含氧的PBS中加入0.1 mmol/L葡萄糖后,因为氧气的消耗,还原峰电流显著下降(曲线c)。
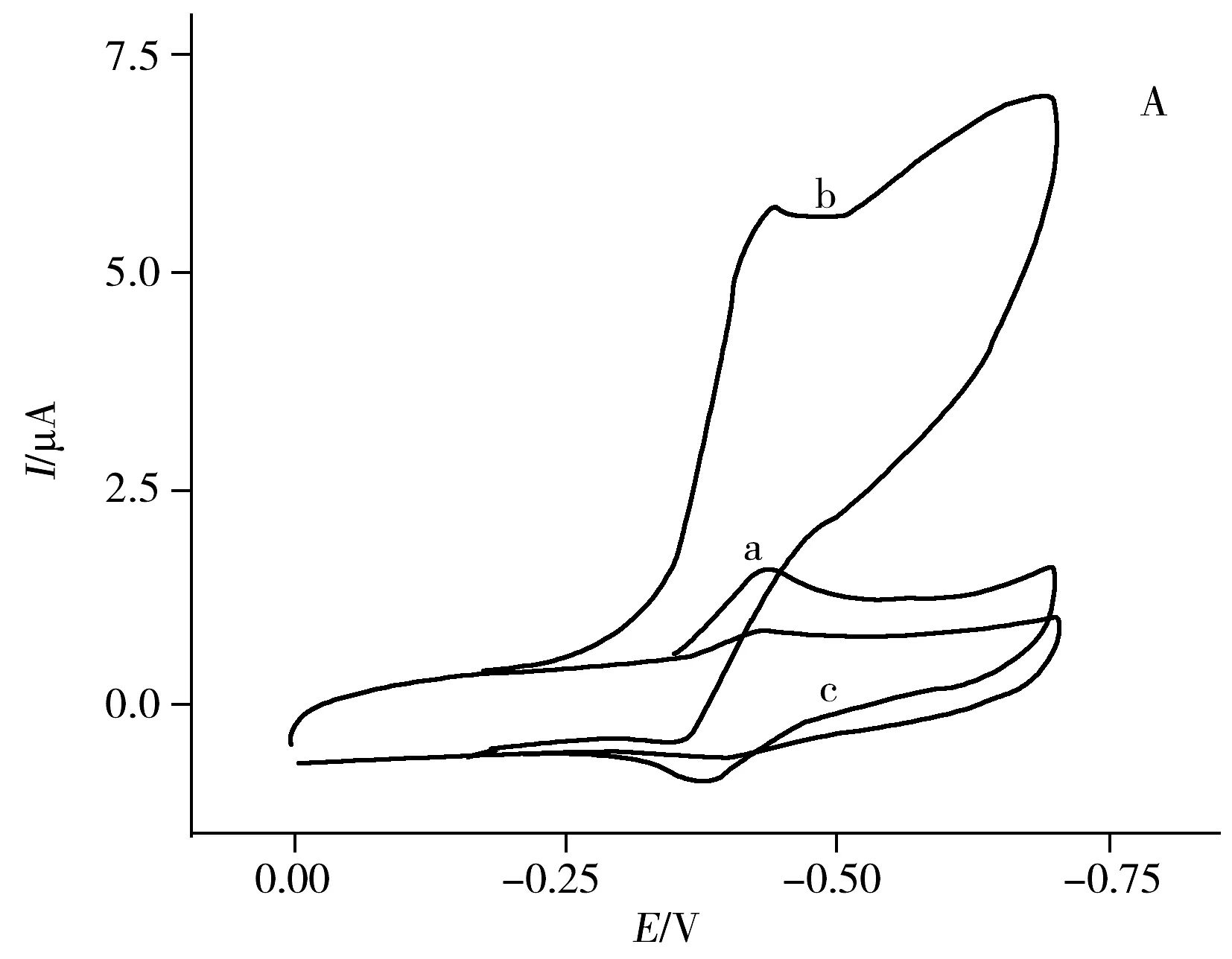
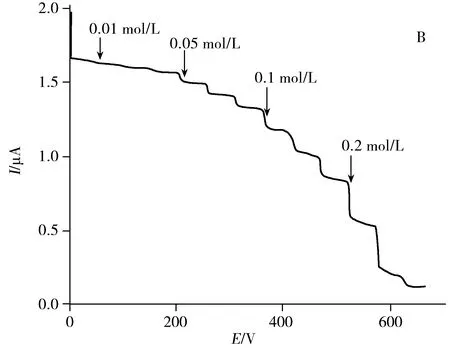
图3 GOx/AuNPs-rGO/GCE在PBS中的循环伏安表征(A)以及对葡萄糖的时间~电流响应曲线(B)Fig.3 Cyclic voltammograms of GOx/AuNPs-rGO/GCE in phosphate buffer(A) and amperometric responses of GOx/AuNPs-rGO/GCE(B) upon successive additions of glucosea:N2-saturated; b:air-saturated; c:air-saturated phosphate buffer in presence of 0.1 mmol/L glucose
优化了电极的检测分析过程:包括AuNPs-rGO(2.8∶3),酶负载量(7 mg/mL GOx),缓冲液的酸碱度(pH 6.0 PBS)和电流测量的工作电位(-0.45 V)等条件。采用I~t方法在最优的实验条件下研究GOx/AuNPs-rGO/GCE传感器对不同浓度葡萄糖的催化响应(图3B),每50 s向5.0 mL体系中依次注入3次1.0 μL的0.01、0.05、0.1、0.2 mol/L葡萄糖溶液,随着体系中葡萄糖浓度的增加,响应电流持续降低。葡萄糖浓度与稳态电流的线性关系显示,当体系的葡萄糖浓度在0.01 ~ 0.88 mmol/L范围内时,葡萄糖的浓度与稳态电流成正比,线性方程I(μA)=1.621-1.593cglucose(mmol/L) (r2= 0.999),检出限低至1.01 μmol/L(S/N=3),传感器的灵敏度高达22.54 μA·mmol-1·L·cm-2。表观米氏常数Kmapp是酶促反应中极为重要的动力学参数,表示酶与底物之间的亲和能力。根据传感器对葡萄糖的线性响应,利用Lineweaver-Burk公式计算得到该传感器的米氏常数为0.497 mmol/L。
表1比较了部分文献用于葡萄糖的电流检测研究的生物传感器的分析性能,相较而言,本体系的Kmapp较小,表明该GOx传感器对葡萄糖具有更高的亲和力与酶活性,并具有更宽的线性范围和更低的检出限。
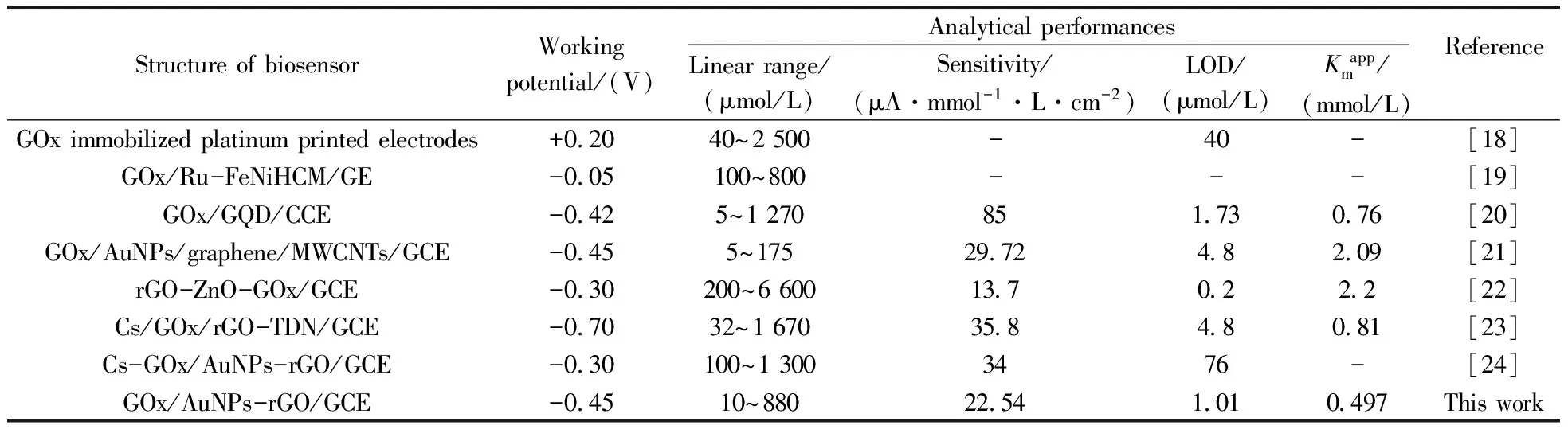
表1 不同葡萄糖生物传感器的分析性能比较Table 1 Comparison of analytical performances of various glucose biosensors
Ru-FeNiHCM:ruthenium(Ⅲ),nickel(Ⅱ) and iron(Ⅱ) hexacyanometallate(HCM);GE:graphite electrode;CCE:carbon ceramic electrode;MWCNTs:multi-walled carbon nanotubes;GQD:graphene quantum dots;Cs:chitosan;TDN:titanium dioxide nanocluster;poly(BSeTT):poly(4,7-bis(thieno[3,2-b]thiophen-2-yl)benzo[c][1,2,5] selenadiazole)
2.3 GOx传感器的选择性、再现性及稳定性
本文所提出的传感器对葡萄糖检测具有良好的选择性。在PBS中依次加入0.05 mmol/L的葡萄糖、蔗糖、乳糖、麦芽糖、果糖和葡萄糖溶液,结果显示,蔗糖、乳糖和果糖对葡萄糖的检测几乎无影响,麦芽糖略有影响(其响应电流仅为葡萄糖的3.4%),这可能是麦芽糖水解产生少量葡萄糖所致,总体而言,该生物传感器的抗干扰性能强。
对传感器稳定性进行了考察。用6根玻碳电极组装传感器,其对0.1 mmol/L葡萄糖的响应电流标准误差为±0.010 8 mmol/L,以100 mV/s扫速进行循环伏安扫描,结果无明显变化。同批GOx传感器(n=3)的相对标准偏差(RSD)为1.46%,电极在4 ℃冰箱中放置1周后再进行测试,电流响应仍为初始电流响应的96.1%,表明在实验期间未发生明显的GOx损失。该GOx传感器具有良好的测量稳定性和寿命。
2.4 实际饮料样品中葡萄糖的检测
制备的GOx传感器用于检测15种饮料中的葡萄糖含量,以商业酶比色法试剂盒检测结果作为对照。在优化条件下,样品无需任何预处理,直接注入检测池记录其安培响应。样品的浓度根据标准曲线计算得出。将生物传感器所得的结果与比色法的结果进行比较(表2)。方法回收率为87%~112%;通过配对样本检验,在0.05水平上,两种方法之间无显著性差异(t统计值为-0.040 89;P为0.967 96,P>|t|)。
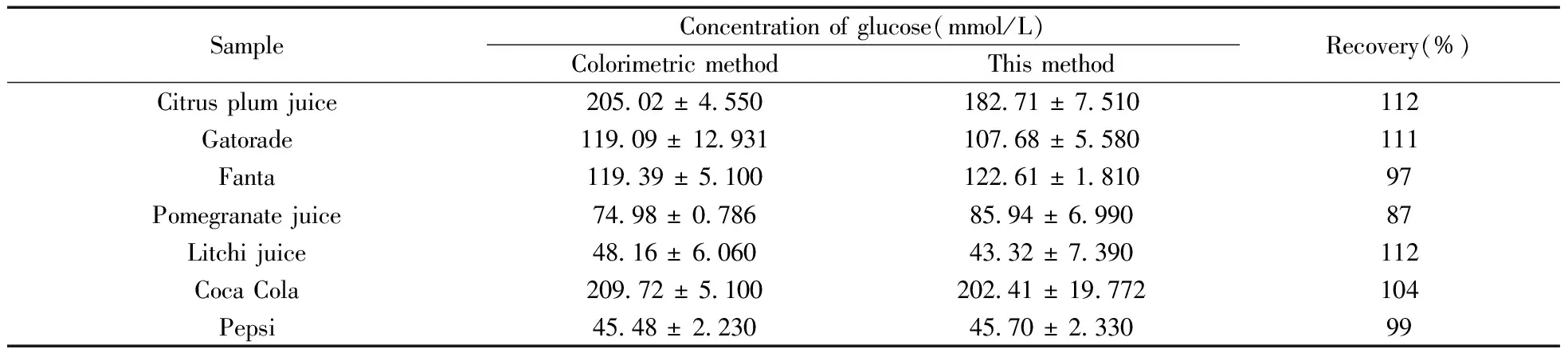
表2 比色法和传感器对各种饮料中葡萄糖含量的检测结果Table 2 Detection results for glucose analysis in beverages obtained from the proposed biosensor and colorimetric method
(续表2)
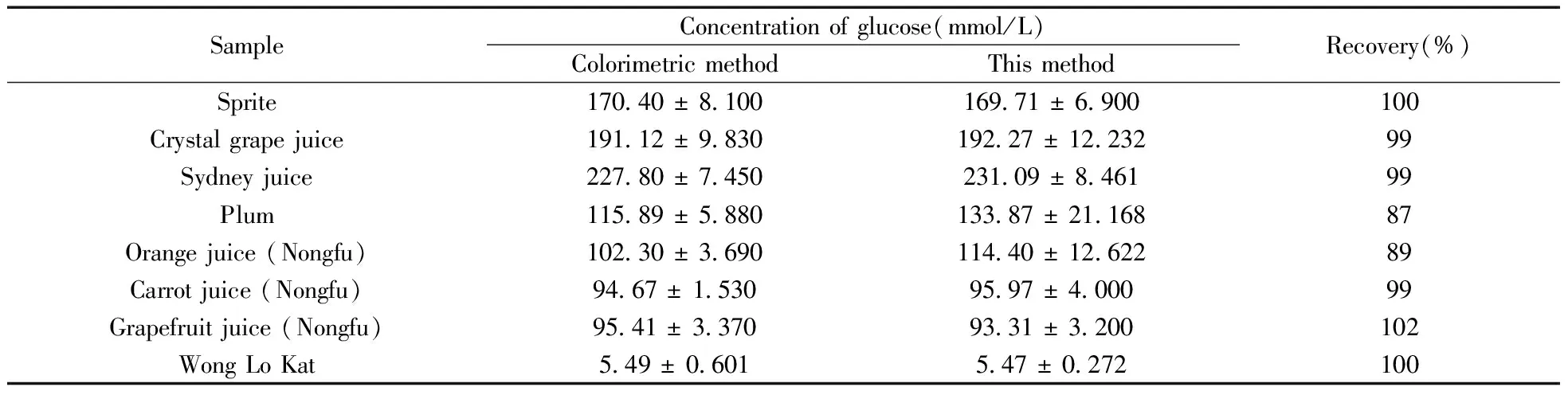
SampleConcentrationofglucose(mmol/L)ColorimetricmethodThismethodRecovery(%)Sprite170 40±8 100169 71±6 900100Crystalgrapejuice191 12±9 830192 27±12 23299Sydneyjuice227 80±7 450231 09±8 46199Plum115 89±5 880133 87±21 16887Orangejuice(Nongfu)102 30±3 690114 40±12 62289Carrotjuice(Nongfu)94 67±1 53095 97±4 00099Grapefruitjuice(Nongfu)95 41±3 37093 31±3 200102WongLoKat5 49±0 6015 47±0 272100
3 结 论
本研究利用一步法还原制备了AuNPs-rGO复合材料用以在GCE表面固定GOx,所制备的GOx传感器对葡萄糖显示出良好的电催化能力。在优化的分析条件下,将GOx/AuNPs-rGO传感器直接用于饮料中葡萄糖含量的测定,与商品化的酶比色法葡萄糖检测试剂盒相对照,两种方法无显著性差异;且用于制备传感器的材料稳定性好,GOx酶活度保持性好,线性范围宽,灵敏度得到了提高。传感器制备方便快捷,无需预处理样品,保存条件简单,寿命较长,具备在食品行业应用的可能性。
[1] Cao X,Ye Y,Li Y,Xu X,Yu J,Liu S.J.Electroanal.Chem.,2013,697:10-14.
[2] Cao X,Sun Y,Ye Y,Li Y,Ge X.Anal.Methods,2014,6:1448-1454.
[3] Yang Z,Xu Y,Li J,Jian Z,Yu S,Zhang Y,Hu X,Dionysiou D D.Microchim.Acta,2015,182:1841-1848.
[4] Cao X,Li Y,Zhang Z,Yu J,Qian J,Liu S.Analyst,2012,137:5785-5791.
[5] Delfino I,Camerlingo C,Portaccio M,Ventura B D,Mita L,Mita D G,Lepore M.FoodChem.,2011,127:735-742.
[6] Sanz V,de Marcos S,Galbán J.Talanta,2009,78:846-851.
[8] Yang Y,Asiri A M,Tang Z,Du D,Lin Y.Mater.Today,2013,16:365-373.
[9] Prabakaran E,Pandian K.FoodChem.,2015,166:198-205.
[10] Ye Y,Ding S,Ye Y,Xu H,Cao X,Liu S,Sun H.Microchim.Acta,2015,182:1783-1789.
[11] Baby T T,Aravind S S J,Arockiadoss T,Rakhi R B,Ramaprabhu S.Sensor.ActuatorB,2010,145:71-77.
[12] Li Y,Gao W,Ci L,Wang C,Ajayan P M.Carbon,2010,48:1124-1130.
[13] Veerapandian M,Kim H Y,Seo Y T,Lee K N,Yun K,Lee M H.Mater.Res.Bull.,2014,49:593-600.
[14] Williams G,Sege B,Kamat P V.ACSNano,2008,2:1487-1491.
[15] Yang Z,Cao Y,Li J,Jian Z,Zhang Y,Hu X.Anal.Chim.Acta,2015,871:35-42.
[16] Li D,Müller M B,Gilje S,Kaner R B,Wallace G G.Nat.Nanotechnol.,2008,3:101-105.
[17] Iliut M,Leordean C,Canpean V,Teodorescu C M,Astilean S J.Mater.Chem.C,2013,1:4094-4104.
[18] Goriushkina T B,Soldatkin A P,Dzyadevych S V.J.Agric.FoodChem.,2009,57:6528-6535.
[20] Razmi H,Mohammad-Rezaei R.Biosens.Bioelectron.,2013,41:498-504.
[21] Yu Y,Chen Z,He S,Zhang B,Li X,Yao M.Biosens.Bioelectron.,2014,52:147-152.
[22] Dey R S,Raj C R.RSCAdvances,2013,3:25858-25864.
[23] Luo Z,Ma X,Yang D,Yu W L,Zhu X,Weng L,Wang L.Carbon,2013,57:470-476.
[24] Bai X,Shiu K K.J.Electroanal.Chem.,2014,720/721:84-91.
Preparation of a Gold Nanoparticles-Reduced Graphene Oxide Modified Glucose Oxidase Biosensor and Its Amperometric Determination of Glucose in Beverages
ZHENG Hai-song1,MAO Shen2,DING Shun2,CHEN Xue-jiao1,LI Yun-fei1,ZONG Kai1,CAO Xiao-dong2,YE Yong-kang2*
(1.Technology Center of Anhui Entry-Exit Inspection and Quarantine Bureau,Hefei 230022,China; 2.School of Food Science and Engineering,Hefei University of Technology,Hefei 230009,China)
An amperometric glucose oxidase(GOx) biosensor based on gold nanoparticles(AuNPs) -reduced graphene oxide(rGO) was fabricated for the detection of glucose in beverages.AuNPs-rGO composite was synthesized by one-pot method with chitosan as reducing and stabilizing agent.It was used as the matrix for GOx immobilization via physical adsorption technique to fabricate the GOx-based biosensor.The biosensor was applied in the amperometric determination of glucose at -0.45 V(vs.Ag/AgCl) in a phosphate buffer (0.1 mol/L,pH 6.0).There was a linear response to glucose in the concentration range of 0.01-0.88 mmol/L,with a sensitivity of 22.54 μA·mmol-1·L·cm-2and a detection limit of 1.01 μmol/L.The apparent Michaelis-Menten constant was rather small(0.497 mmol/L).The constructed biosensor was successfully applied in the detection of glucose in beverages.
gold nanoparticles; reduced graphene oxide; glucose oxidase; amperometric determination; beverage;glucose
O657.1;S951.4
:A
:1004-4957(2017)09-1114-05
2017-04-12;
:2017-05-17
安徽省自然科学基金项目(1508085MC42,1508085MC47);国家自然科学基金青年科学基金项目(31401573);安徽省科技计划项目(1604g0702051)
*
:叶永康,博士,副教授,研究方向:食品分析,Tel:0551-62903171,E-mail:yongkang.ye@hfut.edu.cn
10.3969/j.issn.1004-4957.2017.09.010
