环磷酰胺诱导的小鼠骨髓抑制模型及中药对其防治作用机制研究进展
2017-09-25王成龙赵东峰杨志烈贾友冀常君丽王拥军杨燕萍
王成龙 赵东峰 杨志烈,3 贾友冀,4 常君丽 王拥军 杨燕萍
(1 上海中医药大学附属龙华医院脊柱病研究所,上海,200032; 2 上海中医药大学附属龙华医院科技中心实验室,上海, 200032; 3 滨州医学院中西医结合学院,烟台,264003; 4 上海交通大学医学院附属瑞金医院骨科,上海,200025)
环磷酰胺诱导的小鼠骨髓抑制模型及中药对其防治作用机制研究进展
王成龙1,2赵东峰1杨志烈1,3贾友冀1,4常君丽1王拥军1杨燕萍1
(1 上海中医药大学附属龙华医院脊柱病研究所,上海,200032; 2 上海中医药大学附属龙华医院科技中心实验室,上海, 200032; 3 滨州医学院中西医结合学院,烟台,264003; 4 上海交通大学医学院附属瑞金医院骨科,上海,200025)
化疗后骨髓抑制容易导致患者发生感染或出血,严重影响患者治疗、预后和生命质量,甚至危及生命,给患者及家属带来很大痛苦。中医药防治化疗导致骨髓抑制越来越受到重视。随着骨髓抑制动物模型的建立、应用和成熟,中药防治化疗导致骨髓抑制机制的研究也取得许多进展,显出中药治疗的优势和前景。
环磷酰胺;化疗;骨髓抑制;小鼠模型;机制研究
化疗是肿瘤治疗的重要手段,骨髓抑制是化疗最常见的不良反应,严重影响化疗进行,使临床疗效降低。因此,减轻化疗导致的骨髓抑制,促进骨髓造血功能的恢复,提高外周血白细胞、血小板等成为临床研究热点。环磷酰胺是临床最常用的烷化剂类广谱抗肿瘤药。中医药防治化疗导致骨髓抑制越来越受到重视,为阐明其机制开展了广泛的基础研究。本文综述了环磷酰胺诱导的小鼠骨髓抑制模型及中药防治化疗导致骨髓抑制机制的研究进展。
1环磷酰胺(CTX)诱导的小鼠骨髓抑制模型
细胞周期非特异性抗肿瘤药环磷酰胺是最常用建立骨髓抑制动物模型的药物。CTX通过发生烷化反应抑制DNA复制和转录或导致DNA链断裂等,造成DNA功能和结构的损害,从而杀死肿瘤细胞[1]。CTX在抗肿瘤的同时易阻碍正常造血细胞的分裂和增生,导致骨髓再生功能受损或造血系统损害,骨髓有核细胞数减少,造血重建活性下降等[2],其中白细胞减少最常见,其次是血小板减少,严重时红细胞也会受到影响。
以下是对近年部分文献骨髓抑制模型中环磷酰胺用量、小鼠品种、干预天数以及模型效果的梳理结果见表1。
2中药对环磷酰胺诱导的骨髓抑制防治作用机制
目前的研究涉及组织、细胞、分子水平,从以下几个方面讨论。
2.1 骨髓造血组织形态结构 观察骨髓组织结构的变化,从病理形态学角度探讨中药防护环磷酰胺诱导的骨髓抑制的是机制研究的基本内容。周武斌等[20]运用光镜和电镜观察CTX造模小鼠(以200 mg/kg·次,注射CTX)骨髓组织结构,发现骨髓受损严重,脂肪组织大量增生,几乎充满整个骨髓腔,有核细胞、红细胞及血窦大量减少。同时血窦壁断裂,残存的造血细胞的核膜模糊,线粒体基质深染,嵴扩张,内质网扩张成囊泡状,溶酶体增多。而当归注射液观察组(造模当天注射,连续7 d)中,红系和粒系大量增生,巨核细胞增生。内质网和线粒体较模型组明显增多,形态基本正常,血窦丰富,血窦内皮细胞核正常,有丰富的微绒毛。这说明当归注射液能拮抗环磷酰胺对小鼠骨髓细胞的损伤,促进受损小鼠造血细胞的增生。徐振晔等[21]用C57BL/6J纯系雌性小鼠,体重18~20 g,第1天腹腔注射CTX 100 mg/kg,连续3 d;造模第4天小鼠骨髓细胞明显减少,粒系受损严重,镜下可见少量红系造血岛。髓内血窦壁破裂或呈波浪状弯曲变性,窦内皮细胞胞质呈泡状突起脱落,线粒体肿胀;第6天骨髓内血细胞数量减少,细胞膜不规整,核内异染色质凝集成块状;第8天骨髓内血细胞较前增多,细胞膜不规整,胞质中内质网扩张,线粒体肿胀明显,峭减少,甚则成大泡状。而双黄升白冲剂观察组对症状有缓解作用,使骨髓细胞量增多,细胞膜较完整,线粒体肿胀减轻,染色质凝集较少。
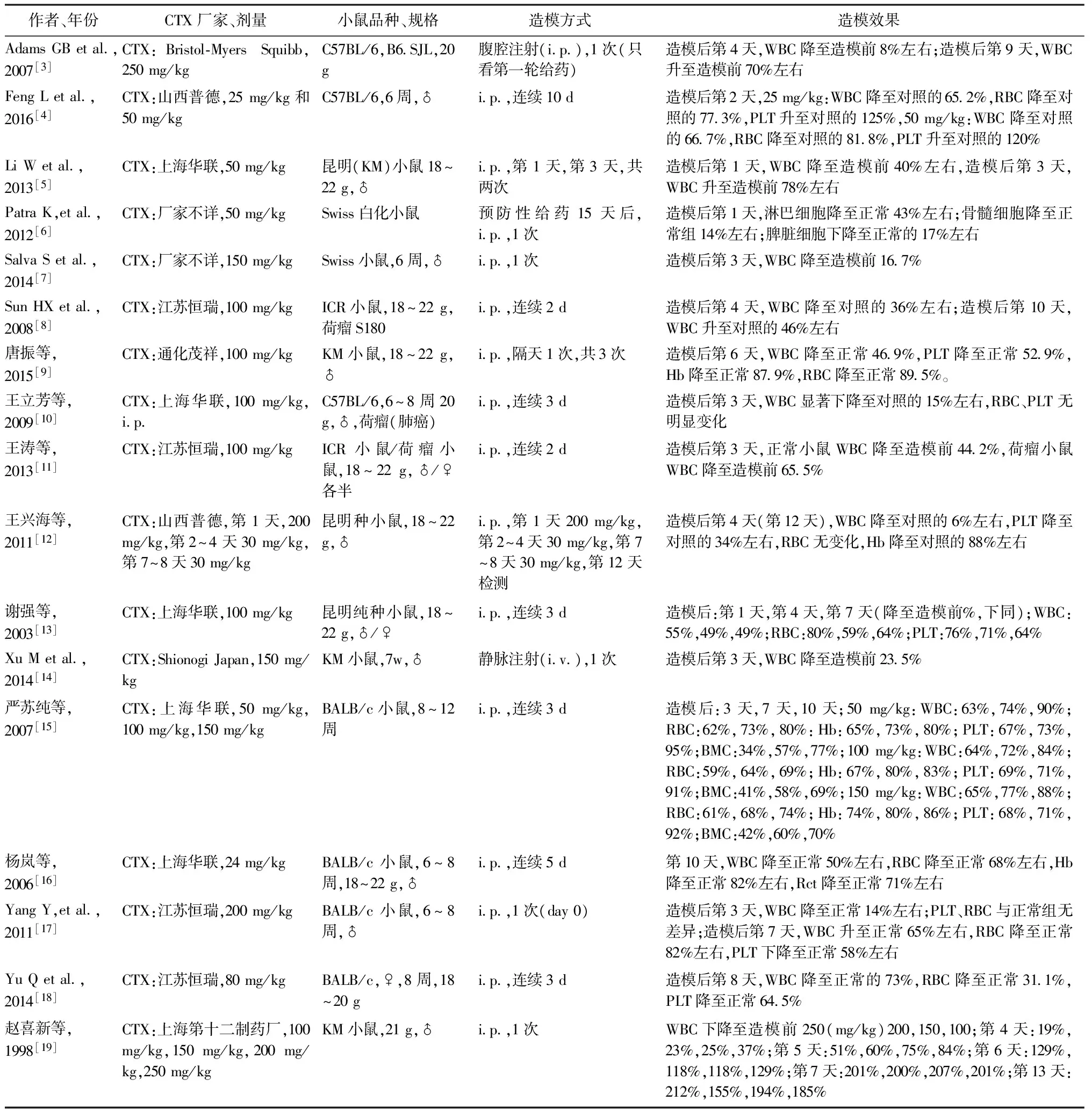
表1 CTX诱导的骨髓抑制模型造模方法及效果
2.2 造血干/祖细胞和间充质干细胞的功能 骨髓造血活动与造血干细胞的存在密切相关。骨髓造血干细胞具有分化为红细胞系、粒细胞巨噬细胞系、巨核细胞系造血祖细胞的能力。以中药灌胃小鼠后,取原代骨髓细胞体外培养,可以显示造血祖细胞集落形成能力的差异,反映造血祖细胞增殖分化能力。Yang Y等[17]用CTX:200 mg/kg·次,腹腔注射6~8周龄Balb/c雄性小鼠后,以达玛烷苷元(DS)高中低剂量连续灌胃7 d。第3天时,模型组WBC降至正常14%左右,而75 mg/kgDS组(中剂量)WBC仅降至31%;PLT、RBC与正常组无差异;第7天时,模型组WBC升至正常65%左右,RBC降至正常82%左右,PLT下降至正常58%左右;而各剂量用药组WBC升至正常的74% ~80%左右,中低剂量的DS保护RBC只降到94%,PLT降到71%。同时以集落形成实验显示造血祖细胞功能差异。模型组7 d时CFU-GM(粒-巨噬细胞集落形成单元)降至正常组36%,CFU-E(红细胞集落形成单元)降至正常组的26%,BFU-E(红细胞爆发形成单元)降至正常组的28%,CFU-Meg(巨核细胞集落形成单元)降至正常组的50%,CFU-GEMM(粒-红-巨噬-巨核细胞集落形成单元)降至正常组的48%,DS中高剂量组使各集落形成单元恢复至正常水平的80% ~110%。显示一定剂量DS可以促进造血祖细胞功能,减少外周血指标降低,加速骨髓抑制小鼠恢复(Yang YY et al.,2011)。Zhu XL等[22]以注射灵芝多糖(GI-PS)治疗环磷酰胺所致的骨髓抑制,发现模型组CFU-GM、BFU-E、CFU-GEMM分别降为正常的60%,18%,43%,而GI-PS观察组分别降为正常的80%,38%,93%,起到明显的保护造血祖细胞增殖分化潜能的作用。Diaz-Montero CM等[23]以200 mg/kg一次腹腔注射CTX造模,3天后冲骨髓取骨髓单核淋巴细胞,流式检测HSC(Lin-Sca-1+c-kit+),发现CTX造模组骨髓单核细胞(BM-MNC)和HSC都显著降低,表征造血祖细胞分化与克隆形成能力的CFU-GM和CAFC(鹅卵石样区形成细胞实验)也显著降低;而注射二硫谷胱甘肽样NOV-002的观察组BM-MNC、HSC、CFU-GM和CAFC都有显著升高。Xu SF等[24]以150 mg/kg每日剂量腹腔注射CTX,连续3天造模,发现模型组骨髓细胞总量、骨髓HSC(Lin-Sca-1+c-kit+)、外周血中HSC和CD3+细胞都有显著下降,骨髓细胞钙离子感应受体(CaSR)表达升高;而注射人参皂苷Rg1的观察组,比较于模型组,骨髓细胞总量、骨髓HSC(Lin-Sca-1+c-kit+)、外周血中HSC和CD3+细胞都有显著回升,骨髓细胞CaSR mRNA表达有显著的下降。Wang S等[25]以CTX:100 mg/kg,ip.,连续3 d造模雄性BALB/C裸鼠,从造模第1天开始灌胃双黄升白颗粒进行治疗,连续10 d。发现双黄升白颗粒促进造模小鼠骨髓CD34+Sca-1+造血干细胞的增殖。这一过程是通过上调mmu-miR-106b*,mmu-miR-144,mmu-miR-669k*,下调mmu-miR-142-3p,mmu-miR-210,mmu-miR-223实现的。间充质干细胞最初在骨髓中发现,具有多向分化潜能(成骨,成软骨,成脂等)、造血支持等特点,是骨髓造血微环境的重要组成部分[26]。在环磷酰胺所致的骨髓抑制模型中也没有骨髓间充质干细胞(MSC)数量和功能变化情况的数据及中药是否通过保护MSC数量和功能而促进骨髓抑制小鼠恢复的报道。
2.3 骨髓造血微环境:基质细胞、细胞因子和信号途径 骨髓造血微环境是HSC赖以生存,进行自我更新,并能产生大量祖细胞的内环境。它包括微血管系统、基质细胞、细胞外基质和多种细胞因子,支持和调节HSC定居、增殖、分化、发育和成熟。基质细胞包括成骨细胞[27],间充质干细胞[28],血窦内皮细胞和血管周基质细胞[29]等。基质细胞通过产生和分泌多种细胞因子如干细胞因子(SCF),粒-巨噬细胞集落刺激因子(GM-CSF),G-CSF,M-CSF,酸性和碱性成纤维细胞生长因子(a-FGF和b-FGF),白细胞介素,胰岛素样生长因子(IGF),β型转化生长因子(TGF-β),基质细胞衍生因子(SDF-1),血管内皮生长因子(VEGF)等对造血干/祖细胞的增殖、分化和发育起重要的调控作用[30]。细胞外基质包括一些生物大分子成分等。一些黏附分子,如血管细胞黏附分子(VCAM-1),整合素(Integrin),神经钙黏素(N-cadherin)等在介导干细胞黏附、锚定在微环境中起重要作用。Zhu XL等[22]在体外培养的脾细胞(1×107)或骨髓基质细胞(1×106)中施加灵芝多糖(GI-PS)(0~200 μg/mL)48 h后,Elisa法检测上清中细胞因子的含量。脾细胞中加各浓度GI-PS后,上清中G-CSF,GM-CSF,IL-1β,IL-6含量都显著上升。骨髓基质细胞加各浓度GI-PS后,G-CSF,GM-CSF,IL-6,SCF都显著上升。在注射CTX所致骨髓抑制小鼠中,检测外周血清细胞因子浓度,模型组G-CSF,IL-1β有反应性上升,GI-PS观察组G-CSF,IL-1β,IL-6,TNF-α,IFN-γ较模型组和正常组都显著上升。Yu Q等[18]以80 mg/kgCTX剂量腹腔注射BALB/c小鼠,连续3 d造模,模型组脾脏CD4+T细胞显著减少,CD4+/CD8+比例也显著下降;而注射灵芝多糖(PSG-1)的观察组随PSG-1剂量增加CD4+T细胞和CD4+/CD8+比例都显著提高。模型组血清中IL-2,IFN-γ,IgA,IgM,IgG,hemolysin(溶血素)都显著降低,血清中IL-10升高;而PSG-1的观察组随PSG-1剂量增加IL-2,IFN-γ,IgA,IgM,IgG,hemolysin都有显著提高,IL-10有显著下降(与模型组比较)。模型组脾脏中自然杀伤细胞(NK)细胞毒性T细胞(CTL)的细胞毒性显著下降;观察组随PSG-1剂量增加NK和CTL的细胞毒性显著恢复(上升)。Xu M等[14]以静脉注射CTX 150 mg/kg·次,造模昆明小鼠,模型组造模后第3天白细胞明显降低;而皮下注射肌肽(CAR,一种鸡肉提取物)的观察组第9天白细胞明显恢复(上升),此外,观察组脾脏IL-3和SCF mRNA表达比模型组明显提高,同时分离的脾脏细胞在刀豆素A刺激下分泌IL-3的量比模型组显著提高。骨髓细胞一些信号通路可能调控着骨髓造血干细胞或其微环境,在中药治疗骨髓抑制中发挥响应作用。有研究者以CTX:100 mg/kg,ip.,连续3 d造模小鼠,发现骨髓细胞EGF、EGFR、K-ras分子表达都有明显降低,而灌胃双黄升白颗粒的观察组上述分子表达明显回升[31]。在肺癌细胞荷瘤C57BL/6小鼠中同样造模,双黄升白颗粒可以显著升高骨髓细胞Notch1、Notch2、Notch3、CSL等Notch信号通路分子表达,和骨髓细胞的Wnt,β-catenin,Frizzled,DSH,GSK3等Wnt/β-catenin通路分子表达,同时降低肿瘤组织中上述分子表达[32];Chen Xin等[33]以CTX:100 mg/kg,ip.,连续3 d造模昆明小鼠,以地榆总皂苷、地榆皂苷I和地榆皂苷II分别进行治疗,发现它们可以通过激活FAK和Erk1/2提高细胞存活率,抑制凋亡;通过下调骨髓造血抑制因子MIP-2,PF4,P-selectin的分泌,保护和恢复造血。目前在环磷酰胺所致的骨髓抑制研究中仅有细胞因子的报告,还没有基质细胞变化情况的文献。另外涉及的分子机制-信号通路方面的研究也不多,已有的机制研究也有待深入。
2.4 细胞周期 细胞周期能否启动,关键在于能否从G0/G1期进入S期,G1期是细胞能否进入分裂阶段的关键点,这一阶段的细胞比例是反应细胞增殖程度的重要指标,其比例越低,说明细胞增殖越活跃,增殖指数(PI)越高。徐振晔观察组用双黄升白颗粒灌胃CTX诱导的骨髓抑制小鼠,发现(与模型组比较)该方使骨髓G0/G1期细胞比例降低,PI升高,促进其增殖,且这一过程与骨髓细胞中细胞周期蛋白依赖激酶4,6(CDK4,CDK6)和细胞周期蛋白D1(CyclinD1)上调相关。同时,该方使小鼠所荷肿瘤G0/G1期细胞比例升高,PI降低,抑制其增殖。且这一过程与肿瘤中CDK4,CDK6和CyclinD1下调相关[10]。Gu等[34]进一步研究发现,CyclinD1-CDK4/6途径上游的正向因子c-Myc,CDC25A,下游的Rb,pRb和E2F在用药小鼠骨髓中都升高,而在小鼠荷瘤组织中都是降低的。这样的双向调节作用体现了中医药防治肿瘤化疗骨髓抑制的优势。程卓等[35]以CTX:90 mg/kg,ip,连续3 d,造模8周龄雄性昆明小鼠,发现模型小鼠脾脏和胸腺指数降低,脾脏和胸腺细胞周期出现G0/G1期阻滞,脾脏和胸腺细胞免疫刺激下增殖能力和免疫功能降低;而石见穿多糖观察组小鼠脾脏和胸腺指数明显升高,G0/G1期阻滞缓解,分裂期细胞比例增高,免疫刺激下增殖能力和免疫功能提高。
2.5 细胞凋亡 细胞凋亡是细胞在基因控制下的程序性死亡,是一种生理性、主动性的死亡过程,在骨髓造血过程中,细胞凋亡对于维持造血细胞的发育、分化、成熟以及造血系统的稳定发挥着非常重要的作用,放化疗直接或间接损伤细胞的DNA,通过Fas/FasL和Bax/Bcl-2两条途径介导细胞凋亡,诱导凋亡不可逆发生[36]。引起造血细胞凋亡增加是骨髓抑制的重要原因之一。Zhu XL等[22]以注射灵芝多糖(GI-PS)治疗环磷酰胺所致的骨髓抑制,以2.5 mg/kg连续注射10 d,其中在第2~4天以100 mg/kg同时注射CTX3次完成造模,在GI-PS末次注射后24 h,以AnnexinⅤ-FITC检测凋亡情况。发现模型组细胞凋亡率显著上升,但GI-PS观察组没有明显降低凋亡率效果。在另一个以黄芪注射液(AMI)治疗CTX所致(以250 mg/kg·次,注射CTX)的骨髓抑制研究中,造模3 d后给药,连续6 d,末次给药48 h后,以免疫组化和原位杂交法检测骨髓基质细胞中抗凋亡Bcl-2蛋白和mRNA表达情况。结果发现,相对于模型组以AMI观察组Bcl-2mRNA表达和蛋白明显增多。蒋立峰等[37]以CTX100 mg/kg连续注射3 d造成骨髓抑制模型,在造模第1天同时给药连续7 d。发现精元康胶囊可以明显降低CTX造模引起的细胞凋亡相关基因Fas,FasL,Caspase-3的上调。黄威峰等[38]以CTX200 mg/kg,隔7 d注射1次,连续4次,对8周龄雄性Balb/c小鼠造模,发现模型小鼠睾丸指数降低,各级生殖细胞数量减少,抗凋亡蛋白BCL2显著减少,BAX,Caspase3显著升高,凋亡阳性细胞显著增多;而五子衍宗方观察组随剂量增加,睾丸指数升高,各级生殖细胞数量增多,BCL2增多,BAX与Caspase3显著降低,BCL2/BAX比值升高,凋亡阳性细胞减少。上述研究表明,减少凋亡可能是中药治疗骨髓抑制、改善造血的途径之一。
2.6 细胞氧化还原作用 Diaz-Montero CM等[23]以200 mg/kg·次,腹腔注射CTX造模,发现模型组HSPC(Lin-c-kit+)中超氧化物歧化酶3和谷胱甘肽过氧化物酶2(SOD3和GPX2)表达显著降低,HSPC和MDSC(CD11b+Ly6G+)中活性氧(ROS)产生显著增加,脾脏细胞还原型谷胱甘肽和氧化型谷胱甘肽比率(GSH/GSSG)显著下降。注射二硫谷胱甘肽样NOV-002的观察组显著提高了HSPC中SOD3和GPX2表达,抑制了HSPC和MDSC中活性氧ROS的产生,升高了脾脏细胞GSH/GSSG比率,起到改善CTX对造血和免疫抑制的作用。Yu Q等[18]以CTX:80 mg/kg剂量腹腔注射BALB/c小鼠连续3 d造模,模型组心、肝、肾脏的匀浆细胞总抗氧化能力(T-AOC),超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)活性都显著降低,丙二醛(MDA)含量显著升高;而注射灵芝多糖(PSG-1)的观察组随PSG-1剂量增加,T-AOC、SOD、CAT、GSH-Px活性都有显著升高,MDA含量都有显著降低。王米[39]以CTX:80 mg/kg剂量腹腔注射BALB/c雄性小鼠连续3 d造模,模型组心、肝、肾脏的匀浆细胞总抗氧化能力(T-AOC),超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)活性都显著降低,丙二醛(MDA)含量显著升高;而灌胃蛹虫草多糖(CMP)的观察组随CMP剂量增加,T-AOC、SOD、CAT、GSH-Px活性都有显著升高,MDA含量都有显著降低。
2.7 DNA损伤 DNA是生物体内最重要的遗传物质,性质稳定。然而,在生命活动过程中,DNA会不断受到各种环境因素的攻击而导致损伤。其损伤可因DNA代谢、化学药物(试剂)诱变、电离辐射和活性氧损伤等原因而产生。DNA损伤直接影响DNA复制、转录和蛋白质合成,进而影响细胞生长、发育、遗传、代谢和繁殖等生命活动,是造成突变、癌变、老化和死亡的重要原因。CTX作为细胞周期非特异性药物,主要通过细胞的DNA损伤发挥作用。CTX可以使分裂中的细胞形成DNA加合物,DNA交联,单链和双链DNA断裂。其对大鼠外周血,骨髓和脾脏淋巴细胞DNA的损伤较大。暴露于CTX的雄性大鼠可以产生精子的DNA损伤,包括DNA双链断裂,单链断裂和染色体畸形。刘静等[40]以CTX:50 mg/kg,隔2 d注射1次,连续10次,对Balb/c小鼠造模,发现小鼠精子浓度、形态正常率、活率显著减少,彗星实验表明出现DNA损伤;而使用五子衍宗丸可显著提高小鼠精子浓度、形态正常率、活率,改善睾丸内生殖细胞的DNA损伤。进一步研究发现,五子衍宗丸这种保护作用与其降低睾丸组织细胞核中DNA损伤蛋白γ-HZAX,Ku70及损伤修复负调节的p-P53,P21表达相关。CTX引起的骨髓细胞DNA损伤还需要深入研究。不同的细胞群体,如粒系和淋巴系、分化的细胞与干/祖细胞的敏感性差别,中药保护的选择性及其机制都需要进一步研究。
3小结与展望
本文在梳理CTX诱导的小鼠骨髓抑制模型建立方法与效果的基础上,从组织形态学,骨髓微环境,骨髓干细胞,细胞周期、凋亡、氧化还原作用,DNA损伤等方面整理了中药防治CTX诱导骨髓抑制机制研究的进展。CTX诱导的小鼠骨髓抑制模型已经比较成熟,广泛应用于化疗导致的骨髓抑制、免疫抑制[36]等机制和中药的防治研究。研究的层次从组织病理水平到干细胞微环境,从细胞周期到细胞凋亡和氧化还原作用,从细胞因子到信号通路,从DNA损伤到MicoRNA调控[25],越来越深入。总体来说,中药防治CTX诱导骨髓抑制机制研究涉及面广,但整体还比较肤浅,有待更加深入,为中药防治化疗后骨髓抑制临床治疗和新药开发提供科学依据。
[1]李欣娜,李魏.骨髓抑制动物模型建立方法综述[J].黑龙江医药,2008,21(2):24-27.
[2]殷霁虹,沈小珩.中药对恶性肿瘤化学治疗引起骨髓抑制的干预作用动物实验研究进展[J].上海中医药大学学报,2010,24(1):78-80.
[3]Adams GB,Martin RP,Alley IR,et al.Therapeutic targeting of a stem cell niche[J].Nat Biotechnol,2007,25(2):238-43.
[4]Feng L,Huang Q,Huang Z,et al.Optimized Animal Model of Cyclophosphamide-induced Bone Marrow Suppression[J].Basic Clin Pharmacol Toxicol,2016,119(5):428-435.
[5]Li W,Zhao Y,Li X.Effect of Zishenshengxue capsule on myelosuppression in mice induced by cyclophosphamide[J].J Tradit Chin Med,2013,33(2):233-237.
[6]Patra K,Bose S,Sarkar S,et al.Amelioration of cyclophosphamide induced myelosuppression and oxidative stress by cinnamic acid[J].Chem Biol Interact,2012,195(3):231-239.
[7]Salva S,Marranzino G,Villena J,et al.Probiotic Lactobacillus strains protect against myelosuppression and immunosuppression in cyclophosphamide-treated mice[J].Int Immunopharmacol,2014,22(1):209-921.
[8]Sun HX,Peng XY.Protective effect of triterpenoid fractions from the rhizomes of Astilbe chinensis on cyclophosphamide-induced toxicity in tumor-bearing mice[J].J Ethnopharmacol,2008,119(2):312-317.
[9]唐振,李世杰,王颖飞,等.化疗减毒汤对环磷酰胺致骨髓抑制小鼠的保护机制研究[J].中国全科医学,2015,18(27):3360-3365.
[10]王立芳,徐振晔,金长娟,等.双黄升白颗粒对Lewis肺癌荷瘤鼠细胞周期双重调控的研究[J].上海中医药杂志,2009,43(2):56-59.
[11]王涛,刘薇,庄辉传,等.复方甘草酸苷注射液对小鼠放、化疗模型减毒作用实验研究[J].中国现代应用药学,2013,30(9):943-948.
[12]王兴海,曹瑞,张波,等.维血宁对环磷酰胺致骨髓抑制模型小鼠的WBC、RBC、PLT和Hb的影响[J].西北药学杂志,2011,26(5):354-356.
[13]谢强,黄丽萍,柳勤.生血丸对环磷酰胺所致小鼠骨髓抑制的影响[J].中国病理生理杂志,2003,19(8):1117-1118.
[14]Xu M,He RR,Zhai YJ,et al.Effects of carnosine on cyclophosphamide-induced hematopoietic suppression in mice[J].Am J Chin Med,2014,42(1):131-142.
[15]严苏纯,祝彼得,陈志伟.几种骨髓抑制性贫血小鼠模型的比较研究[J].成都中医药大学学报,2007,30(1):31-34.
[16]杨岚,祝彼得,彭成.血虚证动物模型的标准化研究初探[J].四川动物,2006,25(1):160-164.
[17]Yang Y,Xu S,Xu Q,et al.Protective effect of dammarane sapogenins against chemotherapy-induced myelosuppression in mice[J].Exp Biol Med(Maywood),2011,236(6):729-735.
[18]Yu Q,Nie SP,Wang JQ,et al.Chemoprotective effects of Ganoderma atrum polysaccharide in cyclophosphamide-induced mice[J].Int J Biol Macromol,2014,64:395-401.
[19]赵喜新,阎杜海,王和平,等.环磷酰胺引致的小鼠白细胞减少模型及动力学分析[J].上海实验动物科学,1998,18(1):12-14.
[20]周武斌,徐之良.当归注射液对环磷酰胺损伤小鼠骨髓细胞组织形态及超微结构的保护作用[J].咸宁学院学报:医学版,2007,21(1):13-15.
[21]徐振晔,朱晏伟,周卫东,等.双黄升白冲剂对化疗引起骨髓抑制的临床研究及小鼠骨髓超微结构的观察[J].中国中西医结合杂志,2001,21(5):328-331.
[22]Zhu XL,Liu JH,Li WD,et al.Promotion of myelopoiesis in myelosuppressed mice by Ganoderma lucidum polysaccharides[J].Front Pharmacol,2012,3(Article 20):1-7.
[23]Diaz-Montero CM,Wang Y,Shao L,et al.The glutathione disulfide mimetic NOV-002 inhibits cyclophosphamide-induced hematopoietic and immune suppression by reducing oxidative stress[J].Free Radic Biol Med,2012,52(9):1560-1568.
[24]Xu SF,Yu LM,Fan ZH,et al.Improvement of ginsenoside Rg1 on hematopoietic function in cyclophosphamide-induced myelosuppression mice[J].Eur J Pharmacol,2012,695(1-3):7-12.
[25]Wang S,Xu ZY,Wang LF.Shuanghuang Shengbai granule cures myelosuppression and suppresses lung cancer progression:mechanism and therapeutic targets from the aspect of microRNAs[J].Oncotarget,2017,Jul 10.doi:10.18632/oncotarget.19129.
[26]Méndez-Ferrer S,Michurina TV,Ferraro F,et al.Mesenchymal and haematopoietic stem cells form a unique bone marrow niche[J].Nature,2010,466(7308):829-834.
[27]费成明,常春康.成骨细胞在造血微环境中的作用及与部分血液系统疾病关系的研究进展[J].中国实验血液学杂志,2014,22(4):1133-1136.
[28]章婧嫽,竺晓凡.骨髓间充质干细胞缺陷与获得性再生障碍性贫血[J].中国当代儿科杂志,2015,19(1):100-106.
[29]Kiel MJ,Yilmaz OH,Iwashita T,et al.SLAM family receptors distinguish hematopoietic stem and progenitor cells and reveal endothelial niches for stem cells[J].Cell,2005,121(7):1109-1121.
[30]陈海琳,张福鹏,周永明.骨髓造血微环境及中药调控作用研究进展[J].中成药,2010,32(7):1183-1188.
[31]王鹤潼,王立芳,徐振晔,等.双黄升白颗粒对小鼠化疗骨髓抑制期骨髓EGFR信号通路的调控作用[J].上海中医药杂志,2014,48(10):93-98.
[32]王立芳,徐振晔,司海龙,等.双黄升白颗粒对化疗所致骨髓抑制Lewis肺癌荷瘤鼠Notch信号通路的双重调控作用[J].上海中医药大学学报,2015,29(6):45-49.
[33]Chen X,Li B,Gao Y,et al.Saponins from Sanguisorba officinalis Improve Hematopoiesis by Promoting Survival through FAK and Erk1/2 Activation and Modulating Cytokine Production in Bone Marrow[J].Front Pharmacol,2017,8:130.
[34]Gu X,Xu ZY,Zhu LY,et al.Dual control of Shuanghuang Shengbai granule on upstream and downstream signal modulators of CyclinD-CDK4/6 signaling pathway of cell cycle in Lewis-bearing mice with cyclophosphamide-induced myelosuppression[J].Onco Targets Ther,2013,6:199-209.
[35]程卓,赵文豪,吕叙鹏,等.石见穿多糖对环磷酰胺诱导小鼠免疫低下的调节作用[J].中药材,2016,39(1):183-187.
[36]钟金凤,方热军.环磷酰胺免疫抑制机制及在动物模型上的应用[J].中国免疫学杂志,2016,32(10):1541-1546.
[37]蒋立峰,桑锋,蒋士卿,等.精元康胶囊对骨髓抑制小鼠骨髓细胞凋亡相关基因表达水平的影响[J].中国实验方剂学杂志,2011,17(12):119-122.
[38]黄威峰,张长城,刘静,等.五子衍宗方对环磷酰胺致成年雄性小鼠睾丸生殖细胞凋亡的保护作用[J].中药材,2016,39(5):1143-1147.
[39]王米,王宵旸,张丽芳,等.蛹虫草多糖对注射环磷酰胺小鼠抗氧化功能的影响[J].中国畜牧兽医,2016,43(12):3251-3256.
[40]刘静,张长城,宋来新,等.五子衍宗方对环磷酰胺致成年雄性小鼠睾丸生殖细胞DNA损伤及P53通路的影响[J].中药材,2017,40(1):183-187.
(2016-10-19收稿 责任编辑:王明)
MouseModelofCyclophosphamide-InducedMyelosuppressionandResearchProgressonMechanismofActionofChineseMeteriaMedicainitstreatmentandprevention
Wang Chenglong1,2,Zhao Dongfeng1,Yang Zhilie1,3,Jia Youji1,4,Chang Junli1,Wang Yongjun1,Yang Yanping1
(1Spineinstitute,LonghuaHospital,ShanghaiUniversityofTraditionalChineseMedicine,Shanghai200032,China; 2CentralLaboratoryforResearch,LonghuaHospital,ShanghaiUniversityofTraditionalChineseMedicine,Shanghai200032,China; 3IntegratedChineseandWesternMedicineCollege,BinzhouMedicalCollege,Yantai264003,China;4DepartmentofOrthopedics,RuijinHospital,ShanghaiJiao-TongUniversityMedicalSchool,Shanghai200025,China)
Patients with chemotherapy-induced myelosuppression is prone to infection or bleeding,which has a serious impact on their treatment,prognosis and quality of life and even endangers life and leads patients and their family to suffering.In recent years,traditional Chinese medicine in preventing and treating chemotherapy-induced myelosuppression have gradually garnered increasing attention.As the animal model of myelosuppression is being established,applied and mature,research on mechanism of Chinese meteria medica in preventing and treating chemotherapy-induced myelosuppression has made great achievements,showing the advantages and prospect of Chinese meteria medica in the treatment of this disease.
Cyclophosphamide; Chemotherapy; Myelosuppression; Mouse model; Study of Mechanism
国家自然科学基金项目(81202708,81373667,81674006) 作者简介:王成龙(1981.01—)男,博士,助理研究员,研究方向:中药调控骨髓干细胞的研究,E-mail:clwang1981@126.com 通信作者:杨燕萍(1972.07—)女,博士,研究员,研究方向:骨肿瘤发病机制及中医药防治,E-mail:yanpingyangks@163.com
R285.5
:Adoi:10.3969/j.issn.1673-7202.2017.09.064
