新加良附方抑制人胃癌细胞增殖的分子机制
2017-09-25石凤芹朱陵群田劭丹
李 亚 石凤芹 朱陵群 田劭丹 董 青 侯 丽
(1 北京中医药大学东直门医院血液肿瘤科,北京,100700; 2 北京中医药大学东直门医院中医内科学教育部 重点实验室和北京市重点实验室,北京,100700)
新加良附方抑制人胃癌细胞增殖的分子机制
李 亚1石凤芹1朱陵群2田劭丹1董 青1侯 丽1
(1 北京中医药大学东直门医院血液肿瘤科,北京,100700; 2 北京中医药大学东直门医院中医内科学教育部 重点实验室和北京市重点实验室,北京,100700)
目的:探讨新加良附方及其主要成分薯蓣皂苷药物血清对人胃癌细胞BGC-823的增殖抑制作用及可能的作用机制。方法:制备新加良附方及薯蓣皂苷药物血清,并作用于胃癌细胞株BGC-823,使用MTS方法检测细胞增殖抑制率;采取实时PCR方法观察新加良附方及薯蓣皂苷药物血清对人胃癌细胞BGC-823中caspase-3及p53表达的影响;采取实时PCR方法检测胃癌细胞中miR-34a表达水平。结果:新加良附方药物血清及薯蓣皂苷药物血清对胃癌细胞BGC-823有明显的增殖抑制作用,并且其作用与时间正相关。新加良附方对胃癌细胞的增殖抑制作用在48 h、72 h高于其主要成分薯蓣皂苷;人胃癌BGC-823细胞中caspase-3的表达明显低于其在正常胃黏膜上皮细胞GES-1中的水平,p53基因表达水平高于正常GES-1细胞中的p53表达水平。新加良附方药物血清及薯蓣皂苷药物血清作用于BGC-823细胞后其caspase-3表达水平均明显上升,且随着时间增加其表达量升高;p53基因表达水平下降,并且与时间负相关。新加良附方与其主要成分薯蓣皂苷相比较,两者对caspase-3、p53的调控作用无明显差异;胃癌细胞中miR-34a表达水平高于正常胃黏膜上皮细胞GES-1。结论:新加良附方及其主要成分薯蓣皂苷可以显著抑制胃癌BGC-823细胞的生长,新加良附方对胃癌细胞的抑制作用高于其主要成分薯蓣皂苷。新加良附方及薯蓣皂苷抑制胃癌细胞增殖作用可能与增加凋亡相关蛋白caspase-3表达,抑制突变型p53表达相关。miR-34a可能发挥癌基因的作用,应明确其作用并进行下一步研究。
新加良附方;胃癌;caspase-3;p53;miR-34a
我国是一个胃癌大国,多数患者就诊时已属中晚期,丧失手术根治可能。化疗是中晚期胃癌主要的治疗措施,但疗效不容乐观,且伴有显著的治疗相关毒性。中医药在胃癌治疗中扮演着重要角色,可以改善患者生命质量、控制临床症状、提高缓解率、减低治疗相关并发症、延长生存时间等,让患者从治疗中受益,具有多角度多靶点的综合疗效优势。课题组前期对167例进展期胃癌研究分析显示脾胃虚寒、气滞血瘀型是本病最基本的证型,因此陈信义教授结合研究发现及长期临床实践经验提出胃癌发病的关键病机是为“脾阳不振、聚湿生痰”,进而导致寒痰凝滞胃脘、阻滞气机,气机不畅,气滞血瘀,终至形成积聚癥瘕,并确立胃癌的基本治疗法则“温中散寒、行气活血”,在经典名方良附丸基础上加穿山龙组成“新加良附方”(高良姜:香附:穿山龙为1∶1∶2)用于治疗胃癌[1-2]。
前期研究发现新加良附方的抑瘤作用可能与其调节caspase-3、Bcl-2、Akt、Survivin、Fas/FasL等表达有关[3-9],但是关于caspase-3上游基因在胃癌细胞中的表达情况及与新加良附方、主要成分薯蓣皂苷的关系并未涉及,作用机制和靶点尚未明确。因此为进一步明确新加良附方抗胃癌的效应机制,我们将从凋亡入手进一步研究其对caspase-3、p53及与miR-34a相关的通路的影响,探讨可能的机制,为临床治疗胃癌提供依据。
1材料与方法
1.1 材料
1.1.1 动物与细胞 6周龄SD雄性大鼠10只,体重(300±20)g,购自中国医学科学院肿瘤医院实验动物中心。实验前动物于国家药物安全评价中心SPF级别实验室适应1周,饲养条件为(22±3)℃,光暗周期12 h/12 h,自由摄食饮水。人胃癌细胞株BGC-823及人胃黏膜上皮细胞株GES-1细胞购自中国医学科学院肿瘤医院肿瘤细胞库。
1.1.2 药物 新加良附方由北京中医药大学东直门医院制剂室提供,实验用药采用同一批号药物,薯蓣皂苷购于成都普菲德生物技术有限公司(20 mg/支,批号:151106)。
1.1.3 试剂与仪器 RPMI-1640、DMEM培养基购自HyClone公司,胎牛血清购自天津康源公司,胰蛋白酶、Trizol购自美国Sigma公司,MTS购自Promega公司,氯仿、异丙醇、无水乙醇购自北京化工厂,DEPC水购自GenStar公司,miR-34a茎环引物及p53、caspase-3、β-actin、miR-34a、U6的实时PCR引物购自北京擎科新业公司,Oligo DT、AMV Buffer、5×AMV Buffer、dNTP、RNA inhibitor、SYBR Premix Ex Taq购自大连宝生物工程公司。
1.2 方法
1.2.1 分组 将10只6周龄SD雄性大鼠随机分为新加良附方组(新加良附方颗粒剂)、薯蓣皂苷组,每组5只。
1.2.2 给药方法 参考前期实验结果,新加良附方组大鼠以新加良附方每天5 g/(kg鼠重)灌胃,薯蓣皂苷组以薯蓣皂苷每天0.45 g/9 kg鼠重)灌胃,1次/d,连续5 d。
1.2.3 检测指标与方法 1)药物血清的制备:10只6周龄SD雄性大鼠于末次给药次日无菌条件下腹主动脉取血,3 000 r/min离心15 min、4 ℃离心分离血清,56 ℃灭活30 min,用0.22 μm针头滤器灭菌后分装,置于-20 ℃冰箱保存,备用。2)MTS实验:细胞常规培养于含10%血清的RPMI-1640培养基,37 ℃、5%CO2、饱和湿度条件下培养箱常规传代培养。取对数生长期的BGC-823细胞,以含10%血清的RPMI-1640培养基调节细胞浓度至2×105细胞/mL,接种于96孔细胞培养板,100 μL/孔,设置调零组、对照组、新加良附方组和薯蓣皂苷组,每组设3个复孔,培养过夜后换为无血清培养基,按实验药物分组向每孔加入受试血清10 μL,药物作用于细胞24 h、48 h、72 h后,每孔加MTS溶液20 μL,置于37 ℃、5%CO2、饱和湿度条件下培养箱培养1~4 h后,用全自动酶标仪在波长490 nm处读取吸光度(A值。按公式计算细胞抑制率:细胞抑制率(IR)=[1-(实验组A490 nm值-空白组A490 nm值)/(对照组A490 nm值-空白组A490 nm值)]×100%。3)实时PCR检测方法:检测新加良附方及薯蓣皂苷药物血清对caspase-3及p53表达的影响:首先检测未经药物作用的细胞中caspase-3及p53表达水平。收集对数生长的BGC-823及GES-1细胞5×105个,提取总RNA,反转为cDNA,在包含上下游引物、cDNA、SYBR Premix Ex Taq等的反应体系中,以β-actin为内参,每组设3个复孔,进行实时PCR扩增。caspase-3引物序列如下:F:TTCAGAGGGGATGTTGTAGA,R:AATAACCAGGTGCTGTGGAGTA;p53引物序列如下:F:CTCTGACTGTACCACCATCCAC,R:CAAACATGCACCTCAAAGCT;β-actin引物序列如下:F:GACATCCGCAAAGACCTG,R:AACGCTTCACGAATTTGCGT。进一步检测药物作用后胃癌细胞中caspase-3及p53表达变化。实验药物分为3组:对照组、新加良附方药物血清组和薯蓣皂苷药物血清组。取对数生长期的BGC-823细胞,以含10%血清的RPMI-1640培养基调节细胞浓度至5×105细胞/2 mL,接种于6孔细胞培养板,2 mL/孔。置于37 ℃、5%CO2、饱和湿度条件下培养箱培养过夜后弃掉旧培养基,将无血清的RPMI-1640培养基1 800 μL加入细胞中,按实验药物分组向每孔加入受试血清200 μL,分别收集药物作用24 h、48 h前后细胞,检测caspase-3及p53在胃癌细胞中的表达水平,方法同前。进一步我们检测胃癌细胞中miR-34a表达水平:收集对数生长的BGC-823及GES-1细胞5×105个,提取总RNA,反转为cDNA,在包含上下游引物、cDNA、SYBR Premix Ex Taq等的反应体系中,以U6为内参,每组设3个复孔,进行实时PCR扩增。miR-34a引物序列如下:F:GCGTGGCAGTGTCTTAGCT,R:TGGGTTCATTTCTGGGTCTT;U6引物序列如下:F:CTCGCTTCGGCAGCACA,R:AACGCTTCACGAATTTGCGT。实时PCR产物的定量校正和判定分析:采用比较Ct值方法来定量caspase-3、p53及miR-34a表达水平,用β-actin/U6作为内参,将每个样本的Ct值与内参照的Ct值相减,即△Ct=检测基因△Ct值-内参基因△Ct值,计算其相对表达量2-△△CT值。
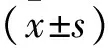
2结果
2.1 新加良附方及薯蓣皂苷药物血清对胃癌细胞的增殖抑制作用 通过MTS方法检测新加良附方及其主要成分薯蓣皂苷对BGC-823细胞的增殖抑制影响,结果显示新加良附方及薯蓣皂苷药物血清对细胞增殖抑制率在24 h(23.67±0.79)%、(21.12±2.88)%;48 h(45.50±1.43)%、(35.79±5.13)%;72 h(65.91±2.35)%、(44.28±3.41)%;明显高于对照组,差异有统计学意义(P<0.05);新加良附方对胃癌细胞的增殖抑制率在24 h、48 h、72 h各时间点比较,差异有统计学意义(P<0.05),新加良附方对胃癌细胞增殖抑制率随时间的增加而升高;薯蓣皂苷对胃癌细胞的增殖抑制率在3个时间点比较,差异有统计学意义(P<0.05),薯蓣皂苷对胃癌细胞的增殖抑制率与时间正相关。新加良附方药物血清对细胞增殖抑制率在48 h、72 h高于薯蓣皂苷药物血清,差异有统计学意义(P<0.05)。见图1。
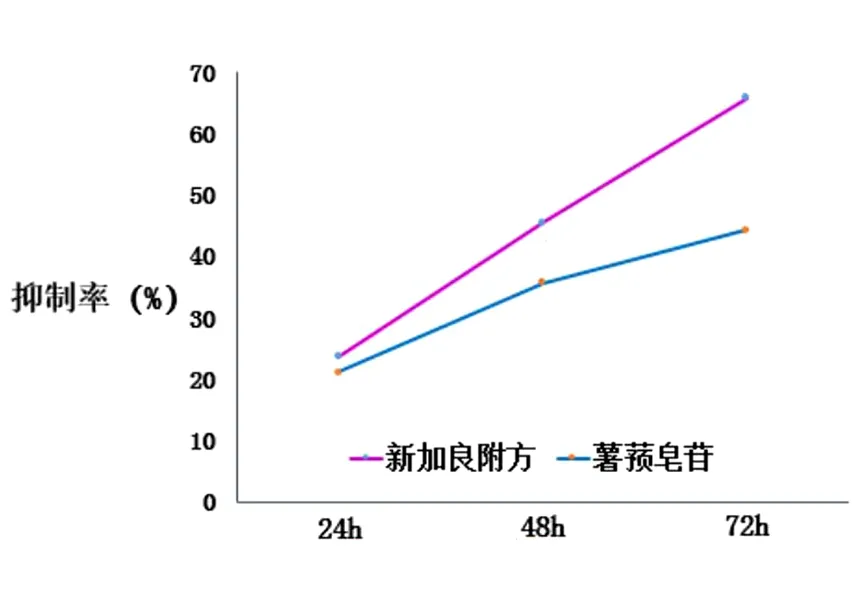
图1 药物对胃癌细胞增殖抑制率
注:P<0.05表示差异有统计学意义
2.2 胃癌细胞中caspase-3及p53表达水平 实时PCR结果显示胃癌细胞BGC-823中caspase-3相对表达量约为人胃黏膜上皮细胞GES-1细胞的(0.289 5±0.054 7)倍,显著低于其在GES-1细胞中的表达水平,差异有统计学意义(P<0.05);p53在胃癌细胞BGC-823中相对表达量为GES-1细胞的(1.176 9±0.040 0)倍,高于其在人胃黏膜上皮细胞GES-1中的表达水平,差异有统计学意义(P<0.05)。
2.3 药物作用后胃癌细胞caspase-3表达水平变化 新加良附方药物血清作用于BGC-823细胞24 h、48 h后caspase-3相对表达量约为对照组(3.886 3±0.759 9)倍、(15.002 7±0.816 6)倍,24 h与48 h比较,差异均有统计学意义(P<0.05),提示新加良附方可上调caspase-3的表达,与时间正相关;薯蓣皂苷药物血清作用于BGC-823细胞24 h、48 h后 caspase-3相对表达量为对照组(3.455 3±0.555 4)倍、(11.968 5±1.900 8)倍,24 h与48 h比较,差异均有统计学意义(P<0.05)。提示薯蓣皂苷可上调caspase-3表达水平,与时间正相关;2组比较,差异无统计学意义(P>0.05)。但新加良附方对caspase-3表达水平的调控显示出优于其主要成分薯蓣皂苷的趋势。见图2。
2.4 药物作用后胃癌细胞p53表达水平变化 新加良附方药物血清作用于BGC-823细胞24 h、48 h后p53相对表达量为对照组(0.580 7±0.112 3)倍、(0.271 2±0.077 5)倍,24 h与48 h比较,差异均有统计学意义(P<0.05)。提示新加良附方可下调p53表达水平,作用与时间负相关。薯蓣皂苷药物血清作用于BGC-823细胞24 h、48 h后p53相对表达量为对照组(0.600 3±0.181 3)倍、(0.299 9±0.007 1)倍,24 h与48 h比较,差异均有统计学意义(P<0.05),提示薯蓣皂苷可下调p53表达水平,作用与时间负相关。2组之间比较,差异无统计学意义(P>0.05)。但新加良附方对p53表达调控显示出优于其主要成分薯蓣皂苷的趋势。见图3。
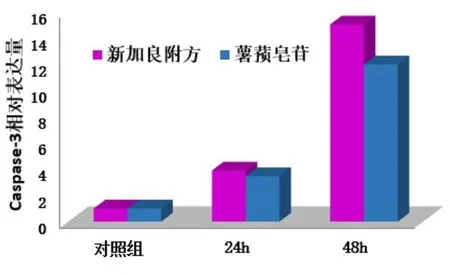
图2 药物作用后caspase-3表达水平

图3 药物作用后p53表达水平
2.5 胃癌细胞中miR-34a表达水平 实时PCR方法检测胃癌细胞系BGC-823和正常胃黏膜上皮细胞GES-1中miR-34a的表达情况,BGC-823细胞中miR-34a相对表达量约为GES-1细胞中miR-34a表达水平的(30.71±7.934 4)倍,较GES-1细胞miR-34a表达显著增高,差异有统计学意义(P<0.05)。见图4。
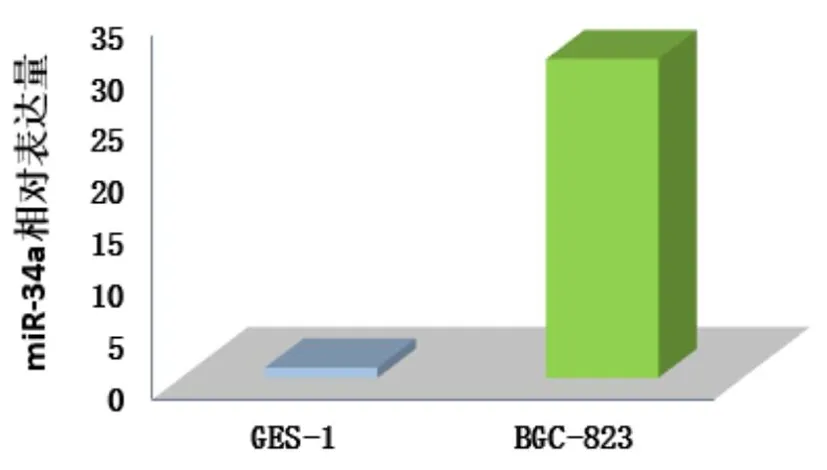
图4 miR-34a表达水平
3讨论
新加良附方药物血清可显著抑制细胞增殖,作用呈时间依赖性,这与课题组前期基础研究结果一致。方中主要成分薯蓣皂苷是穿山龙的提取物,亦可明显抑制细胞增殖,但是其对细胞的增殖抑制率在48 h、72 h均低于新加良附方药物血清。这提示我们新加良附方中除了薯蓣皂苷外尚有其他有效成分可以起到抗肿瘤的作用,如有学者报道高良姜及香附的提取物可以抑制肿瘤细胞的生长。新加良附方作为中药复方,成分复杂,在今后的研究中我们可以进一步明确新加良附方中其他有效成分。
半胱天冬酶(caspase)又称凋亡蛋白酶,是细胞凋亡执行者,是一组对底物天冬氨酸部位有特异水解作用的蛋白酶,其中心富含半胱氨酸,可以分为启动型和效应型,其中后者主要包括caspase-3、6和7。caspase-3是caspase家族最重要的凋亡执行者之一,被认为是整个凋亡级联反应的一个关键调节点[10],受p53及其靶基因的调控,可诱发并加速凋亡的进行[11]。本实验显示caspase-3表达水平在胃癌细胞中较正常人胃黏膜上皮细胞中低,提示caspase-3表达的降低与胃癌的发生发展密切相关,新加良附方及主要成分薯蓣皂苷药物血清作用于胃癌细胞后其caspase-3水平均升高,提示两者可提高caspase-3蛋白表达水平,参与调控细胞的凋亡过程。p53基因有野生型和突变型2种,野生型p53是肿瘤抑制基因,它与细胞的生长阻滞和凋亡有关。在许多肿瘤细胞中,有p53的缺失和突变则凋亡过程减弱。突变的p53基因失去正常生物学活性,不能诱导受损细胞的凋亡,这些细胞就成为癌细胞的前身,通过其靶基因发挥作用,从而影响细胞的细胞周期及凋亡过程,促进肿瘤的发生发展[12]。本实验显示胃癌细胞BGC-823中突变p53表达水平较正常细胞GES-1水平增高。新加良附方药物血清和薯蓣皂苷药物血清作用于胃癌细胞后其p53表达水平降低,提示两者抑癌作用可能与抑制突变型p53表达水平有关。但是对于caspase-3及p53表达水平的调控,新加良附方与薯蓣皂苷相比较并无明显差异,这提示我们新加良附方对胃癌细胞的增殖抑制作用除了参与凋亡的调控,可能仍与细胞周期及衰老等其他途径相关,这也显示了中药抗肿瘤的多靶点多途径作用,因此今后我们将从细胞周期等多方面进行研究。
微小RNA(miRNA)是一类长度约22个核苷酸的非编码单链小分子RNA,在转录后水平沉默基因的表达,为近年的研究热点,研究发现miR-34a受p53直接调控,是p53重要的靶基因,其可以通过调控caspase-3、Bcl-2等凋亡相关蛋白表达来调控细胞的凋亡过程[13-16],能够直接抑制SIRT1从而调控p53的转录活性,因此miR-34a在p53基因的调控通路中发挥着重要作用[17]。miR-34a作为抑癌基因,在不同肿瘤中呈低表达[18],而本实验发现胃癌细胞BGC-823中miR-34a表达较GES-1细胞中表达水平升高,这与部分报道不符。有学者研究发现miR-34a作为抑癌基因在肿瘤发生发展中起着重要的调控作用,但另有一些学者关于miR-34a起到癌基因还是抑癌基因的作用存在不同意见,如研究发现在非小细胞肺癌患者肿瘤组织中miR-34a的表达明显高于正常组织[19],Osawa等[20]分析手术后30例胃癌患者肿瘤组织miRNA表达,发现miR-34a表达水平高于正常组,有学者发现在肝癌组织中miR-34a高表达[21],并提示可能与机体增殖与凋亡不平衡有关,这些研究均提示miR-34a可能发挥癌基因作用,故miR-34a作用及其机制有待进一步研究。结合文献报道,分析所得结果,考虑除了miR-34a可能发挥癌基因作用外,还可能存在以下原因:实验所需的miR-34a茎环引物及PCR引物存在非特异性可能,因此应继续查阅文献寻找可靠的引物序列进行实验;Cao等[22]、陈艳辉[23]及Yang等[24]发现在不同胃癌细胞系中其miR-34a表达亦不同,分析其结果可能与细胞株分化程度、有无淋巴结转移及能否分泌粘液素相关,因此我们将检测多种细胞系中miR-34a表达以明确不同细胞系中其差异性表达情况。同时检测高表达miR-34a细胞对细胞增殖及凋亡的影响以明确其作用。明确miR-34a作用后,我们将继续检测新加良附方及薯蓣皂苷对胃癌细胞miR-34a表达水平及甲基化的影响,明确新加良附方及薯蓣皂苷如何从表观遗传学方面调控肿瘤发生发展并启动细胞增殖、细胞凋亡、血管生成等过程,进行体外、体内实验观察其作用机理,为临床治疗胃癌提供依据。
[1]刘庆,李忠,田劭丹,等.167例进展期胃癌中医证型研究分析[J].北京中医药大学学报,2014,37(4):273-276.
[2]王婧.新加良附颗粒治疗晚期胃癌临床研究[D].北京:北京中医药大学,2010.
[3]庄严,董青,陈信义,等.新加良附颗粒含药血清体外诱导人胃癌细胞凋亡研究[J].中国实验方剂学杂志,2007,13(8):32-35.
[4]田劭丹,董青,侯丽,等.新加良附方对移植性人胃癌细胞Survivin与Caspase-3蛋白表达影响[J].现代生物医学进展,2009,9(21):4021-4023,4065,封2.
[5]田劭丹,董青,侯丽,等.新加良附方对移植性人胃癌细胞Bax/Bcl-2表达影响[J].中国医药指南,2010,8(9):57-59.
[6]董青,田劭丹,侯丽,等.新加良附方对移植性人胃癌细胞Fas/FasL表达影响[J].中国医学创新,2010,7(5):28-30.
[7]倪磊,田劭丹,马成杰,等.新加良附方影响人胃癌裸小鼠移植瘤新生血管形成的研究[J].山西中医.2010,26(4):50-52.
[8]许晶,侯丽,武苗,等.新加良附方联合5-Fu对裸鼠胃癌移植瘤Bax/Bcl-2表达的影响[J].世界中西医结合杂志,2013,8(7):675-678.
[9]宋延平,许晶,赵林涛,等.新加良附方联合5-Fu对裸鼠胃癌移植瘤Survivin/Caspase-3表达的影响[J].中国科技论文在线精品论文.2013,6(23):2259-2264.
[10]Lee Y,Ahn C,Han J,et al.The nuclear RNase III Drosha initiates microRNA processing[J].Nature.2003,425(6956):415-419.
[11]Chen H,Yang X,Feng Z,et al.Prognostic value of Caspase-3 expression in cancers of digestive tract:a meta-analysis and systematic review[J].Int J Clin Exp Med.2015,8(7):10225-10234.
[12]Tarasov V,Jung P,Verdoodt B,et al.Differential regulation of microRNAs by p53 revealed by massively parallel sequencing:miR-34a is a p53 target that induces apoptosis and G1-arrest[J].Cell Cycle,2007,6(13):1586-1593.
[13]Bommer GT,Gerin I,Feng Y,et al.p53-mediated activation of miRNA34 candidate tumor-suppressor genes[J].Curr Biol,2007,17(15):1298-1307.
[14]Corney DC,Flesken-Nikitin A,Godwin AK,et al.MicroRNA-34b and MicroRNA-34c are targets of p53 and cooperate in control of cell proliferation and adhesion-independent growth[J].Cancer Res,2007,67(18):8433-8438.
[15]Navarro F,Lieberman J.miR-34 and p53:New Insights into a Complex Functional Relationship[J].PLoS One.2015,10(7):e0132767.
[16]He L,He X,Lowe SW,et al.microRNAs join the p53 network——another piece in the tumour-suppression puzzle[J].Nat Rev Cancer.2007,7(11):819-822.
[17]Yamakuchi M,Lowenstein CJ.MiR-34,SIRT1 and p53:the feedback loop[J].Cell Cycle.2009,8(5):712-715.
[18]Lodygin D,Tarasov V,Epanchintsev A,et al.Inactivation of miR-34a by aberrant CpG methylation in multiple types of cancer[J].Cell Cycle,2008,7(16):2591-2600.
[19]Franchina T,Amodeo V,Bronte G,et al.Circulating miR-22,miR-24 and miR-34a as novel predictive biomarkers to pemetrexed-based chemotherapy in advanced non-small cell lung cancer[J].J Cell Physiol,2014,229(1):97-99.
[20]Osawa S,Shimada Y,Sekine S,et al.MicroRNA profiling of gastric cancer patients from formalin-fixed paraffin-embedded samples[J].Oncol Lett.2011,2(4):613-619.
[21]Pineau P,Volinia S,McJunkin K,et al.miR-221 overexpression contributes to liver tumorigenesis[J].Proc Natl Acad Sci U S A.2010,107(1):264-269.
[22]Cao W,Fan R,Wang L,et al.Expression and regulatory function of miRNA-34a in targeting survivin in gastric cancer cells[J].Tumour Biol.2013,34(2):963-971.
[23]陈艳辉.miR-34a抑制人胃癌细胞生长与侵袭的实验研究[D].衡阳:南华大学,2013.
[24]Yang B,Huang J,Liu H.miR-335 directly,while miR-34a indirectly modulate survivin expression and regulate growth,apoptosis,and invasion of gastric cancer cells[J].Tumour Biol,2016,37(2):1771-1779.
(2016-12-15收稿 责任编辑:杨觉雄)
MolecularMechanismsofXinjialiangFufanginInhibitingHumanGastricCancerCellProliferation
Li Ya1,Shi Fengqin1,Zhu Lingqun2,Tian Shaodan1,Dong Qing1,Hou Li1
(1DepartmentofOncologyandHematology,DongzhimenHospitalaffiliatedtoBeijingUniversityofChineseMedicine,Beijing100700,China; 2KeyLaboratoryofChineseinternalmedicine,Ministryofeducation,Dongzhimenhospital,BeijingUniversityofChineseMedicine,BeijingKeyLaboratoryofinternalmedicine,Beijing100700,China)
Objective:To explore the inhibitory effect of Xinjialiang Fufang serum and Dioscin serum on the proliferation of human gastric cancer cells BGC-823 and the possible mechanism of their action.Methods:To prepare Xinjialiang FuFang serum and Dioscin serum and act on the human gastric cancer cells BGC-823 and detect the cell proliferation inhibitory rate using MTS assay.To observe the effect of Xinjialiang Fufang serum and Dioscin serum on the expression of caspase-3 and p53 in human gastric cancer cells BGC-823 using RT-PCR method.To detect the expression level of miR-34a in gastric cancer cell using RT-PCR method.Results:Xinjialiang Fufang serum and Dioscin serum have significant cell proliferation inhibitory effect against the human gastric cancer cells BGC-823 and its effect is directly proportional to time.The proliferation inhibitory effect of XinJiaLiangFuFang serum is better than Dioscin serum at 48 h and 72 h.The expression level of caspase-3 in human gastric cancer cells BGC-823 is lower than the normal gastric mucosa epithelial cells GES-1,while its p53 expression level is higher than the normal GES-1 cell.After the XinJiaLiangFuFang serum and Dioscin serum have acted on the BGC-823 cell,its caspase-3 gene expression level significantly increased and the expression level has increased with time,while the p53 gene expression level decreased and is inversely proportional to time.The regulation of caspase-3 and p53 gene between XinJiaLiangFuFang serum and Dioscin serum has no statistical difference.The expression level of miR-34a in gastric cancer cell is higher than the normal gastric mucosa epithelial cells GES-1.Conclusion:Xinjialiang Fufang and Dioscin can significantly inhibit the proliferation of human gastric cancer cells BGC-823 and their effect may be related to the increase of caspase-3 expression and the inhibition of mutated p53 expression.MiR-34a might play a role of oncogene and it is necessary to study further for the next research.
Caspase-3; MiR-34a; P53; Dioscin; Gastric cancer; Xinjialiang Fufang
R289.5;R735.2
:Adoi:10.3969/j.issn.1673-7202.2017.09.036
北京中医药大学面上项目(中青年教师类)(2015-JYB-JSMS063);国家自然科学基金面上项目(81573959)
李亚(1990.08—),女,在读博士,住院医师,研究方向:中西医结合防治恶性肿瘤,E-mial:18731971919@163.com;石凤芹(1982.08—),女,博士,主治医师,研究方向:中西医结合防治恶性肿瘤及血液病,E-mial:shifengqinbj@sina.com
侯丽(1969.12—),女,博士,主任医师,教授,科室主任,研究方向:中西医结合防治恶性肿瘤,E-mial:houli1203@126.com
