饲料中适宜含量铁对建鲤鱼糜冻藏品质变化及组织蛋白酶B/L的影响
2017-09-22李冉钟海霞李树红杨娟胡强柯勤勤白稚子林灵李美良
李冉,钟海霞,李树红,杨娟,胡强,柯勤勤,白稚子,林灵,李美良
(四川农业大学 食品学院,四川 雅安,625014)
饲料中适宜含量铁对建鲤鱼糜冻藏品质变化及组织蛋白酶B/L的影响
李冉,钟海霞,李树红*,杨娟,胡强,柯勤勤,白稚子,林灵,李美良
(四川农业大学 食品学院,四川 雅安,625014)
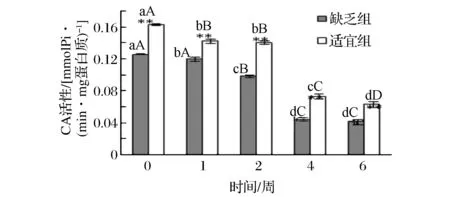
对经过不同铁含量的饲料(缺乏组53.9 mg/kg,适宜组146.1 mg/kg)饲喂90 d后的建鲤,取鱼肉加工为鱼糜,于-20 ℃条件下进行冻藏实验,取样点为0、1、2、4、6周,测定鱼糜冻藏品质指标的变化,包括Ca2+-ATPase活性、总巯基、二硫键、表面疏水性、TBA值;鱼糜冻藏期间组织蛋白酶B、组织蛋白酶L活性采用荧光合成肽底物法进行测定。结果表明,适宜含量铁能极显著提高鱼糜肌动球蛋白初始Ca2+-ATPase活性、总巯基含量(p<0.01),降低二硫键含量(0.01 铁;建鲤;鱼糜;冻藏品质;组织蛋白酶B/L 建鲤(CyprlnuscarpiovarJian)是由中国水产科学研究院淡水渔业研究中心人工育成的水产良种[1],具有生长快、体型优、遗传性状稳定、肉质肉味好、适应性和抗病力强等特点,适合全国各地多种方式养殖,目前已成为我国鲤鱼养殖的主导品种。建鲤精深加工前景十分看好,是一种理想的水产食品加工原材料。 冷冻鱼糜的加工是提高水产品经济附加值的有效途径之一,且对于保持鱼糜制品原料新鲜度、营养价值也是一种有效的方法。2015年,我国鱼糜产量达到了1.45×106t,鱼糜及其制品行业产值规模已经超过了200亿元[2],具有较好的发展前景。肌动球蛋白是形成鱼糜凝胶网状结构的重要蛋白,然而在鱼糜冻藏过程中,其易发生变性而导致物理、化学特性发生改变[3],由此导致鱼糜制品的凝胶性能、弹性品质的劣变[4]。此外,脂质氧化次级产物也可引发肌动球蛋白氧化变性[4-5]。目前,国内外关于鱼肉或鱼糜中蛋白质在冷冻过程中的变性及防止方法研究较为深入,对冻藏期间物理或生化特性变化的研究也比较充分,但其目的主要集中在冻藏温度条件的选择或鱼种冻藏稳定性的比较方面[6-8],而从调节饲料中营养素含量与提高冻藏品质的关系这个角度进行的研究,尚十分缺乏。 铁作为生命体必须的一种微量元素,不仅是血红蛋白和肌红蛋白的重要组成成分,还参与了机体许多重要的生理[9-11]、病理[12]过程。饲料中适宜的铁含量,对于维持鱼类正常生理代谢同样必不可少。已有研究表明,饲料中添加适宜含量的铁,可以促进罗非鱼[13]、斑点叉尾鮰[14]、真鲷[15]等鱼类的生长发育,提高经济效益。团队前期研究工作中,已经确定建鲤养殖过程中的最适宜铁需要量为147.4 mg/kg饲料(以血清铁为标示)[16]。但饲料中铁的含量对建鲤鱼肉品质或鱼糜品质的影响尚未见报道。鱼糜加工制品的品质在很大程度上取决于原料鱼糜的品质,探讨经不同含量铁处理后的建鲤鱼肉加工为鱼糜后在冻藏期间的品质变化情况,对于实际生产具有一定指导意义。 研究表明,内源性组织蛋白酶B(Cathepsin B,CAT B)及组织蛋白酶L(Cathepsin L,CAT L)是引起鱼糜凝胶软化的关键性蛋白酶,能够引起肌动球蛋白重链的水解[17],导致鱼糜制品质构品质劣变。CAT B/L在漂洗后的鱼糜[17]及鱼糜的冻藏期间[18]仍残留显著的活性,这对后续的鱼糜制品加工过程十分不利。因此,如何从鱼糜原料角度降低CAT B/L的活性残留是实际生产中亟待解决的问题之一。 本文拟以适宜铁含量(146.1 mg/kg)饲料饲喂后的建鲤为研究对象,同时与铁缺乏含量(53.9 mg/kg)下饲喂的建鲤进行鱼糜冻藏品质变化、CAT B/L活性变化的比较。结果从产品品质角度,更全面地评价该铁含量(147.4 mg/kg)对建鲤的适宜性,具有补充意义。以期为实际生产中,合理调整饲料中铁的添加量,获得品质更好的水产食品加工原料,提供科学依据。 1.1材料与试剂 1.1.1 动物性实验材料 建鲤及采样:以铁含量为146.1 mg/kg(适宜组)及53.9 mg/kg(缺乏组)的半纯合饲料饲喂90 d的建鲤(初始体重分别为(11.34±0.94)g及(11.37±0.91)g,采样时体重分别为(148.10±24.69)g及(222.32±34.52)g),由四川农业大学动物营养所水生动物饲料与营养实验室饲养并提供。其饲料配方组成、饲料铁含量测定及饲养过程参见凌娟[16]的方法。饲养时每个处理组3个重复,每个重复50尾,即每个处理组150尾。饲养结束后,每组随机采样30尾鱼。用3%的乌来糖麻醉后处死,去除内脏,10 ℃以下自来水清洗,用于后续鱼糜样品制备。 1.1.2 鱼糜样品的制备 建鲤鱼糜的制备参考陈秀华等[19]的方法,在4 ℃条件下进行。采肉:去皮、去除红肉,取背部的白肉,充分绞碎至3~6 mm3;漂洗:将鱼肉糜与5倍体积的4 ℃去离子水混合,缓慢搅拌10 min,使水溶性蛋白等成分充分溶出,静置8~10 min使鱼肉充分沉淀,倾去漂洗液,再用冷却水先后漂洗两次,最后一次用0.15%食盐水漂洗;离心脱水:7 000 r/min,4 ℃离心15 min。 1.1.3 主要试剂 乌来糖、马来酸、尿素、三氯乙酸(TCA),成都科龙化工试剂有限公司;ATP·Na2、8-苯胺基-1-奈磺(ANS)、Z-Arg-Arg-AMC、Z-Phe-Arg-AMC,美国Sigma公司;硫代巴比妥酸(TBA),上海Amresco公司;硫酸P-甲胺酚(Elon试剂),上海创赛科技有限公司;5,5’-二硫代-双-2-硝基苯甲酸(DTNB),上海源叶生物科技有限公司。 1.2仪器与设备 Sorvall ST 16 ST16R高速冷冻离心机、Varioskan Flash荧光酶标仪,美国Thermo Fisher公司;BT124S万分之一电子天平,德国Sartorius公司;V-1100可见分光光度计,上海美谱达仪器有限公司;DY89-II电动玻璃匀浆机,宁波新芝生物科技有限公司;Scientz-IID超声波细胞粉碎机,苏州江东精密仪器有限公司。 1.3实验方法 1.3.1 鱼糜冻藏点设计及取样 设计冻藏取样点为0、1、2、4、6周。将已经制备好的适宜组和缺乏组鱼糜样品均分成5份,用聚乙烯食品包装袋分装后,液氮速冻,然后于-20℃进行冻藏实验。根据设计的取样时间取样,于4 ℃下自然解冻,进行冻藏品质指标变化、CAT B/L活性变化的测定。 1.3.2 建鲤鱼糜冻藏期间的冻藏品质指标测定 根据BENJAKUL等[20]的方法,测定冻藏期间2个处理组鱼糜肌动球蛋白的稳定性指标,主要包括Ca2+-ATPase活性(Ca2+-ATPase activity,CA)、总巯基含量(total sulfhydryl content,TSH content)、二硫键含量(disulfide bonds content,DB content)、蛋白表面疏水性(protein surface hydrophobicity,PSH),以及冻藏期间鱼糜脂肪氧化指标硫代巴比妥酸值(thiobarbituric acid,TBA),用于判断鱼糜的冻藏品质。所有指标均重复测定3次。 1.3.2.1 鱼糜肌动球蛋白的提取 参考BENJAKUL等[21]的方法提取鱼糜中的肌动球蛋白。 1.3.2.2 肌动球蛋白CA活性测定 参考BENJAKUL等[20]的方法,有所改动。将提取的肌动球蛋白用0.6 mol/mL KCl(pH=7.0)稀释至4 mg/mL,按如下10 mL反应体系进行酶反应:1 mL稀释酶液,0.6 mL缓冲液(含0.5 mol/mL Tris-马来酸,pH=7.0),7.9 mL 10 mmol/mL CaCl2,加入0.5 mL的20 mmol/mL ATP启动反应,25 ℃反应5 min后加15% TCA 5 mL终止反应。空白先加入TCA,再加ATP。 各混合液于3 500 g离心5 min。取1 mL上清液加入1 mL硫酸钼酸,0.5 mL Elon试剂,2.5 mL水,搅拌后在室温下发色45 min,640 nm测吸光度。一个CA活力单位定义为25 ℃下每毫克蛋白质在1 min内水解底物并产生的无机磷的微摩尔数(μmol Pi/(min·mg)。 1.3.2.3 肌动球蛋白PSH测定 参考BENJAKUL等[20]的方法进行PSH测定。将制备的肌动球蛋白用10 mmol/L 磷酸缓冲液(含0.6 mol/mL NaCl,pH=6.0)稀释成0.025%,0.05%,0.1%,0.15%,0.2%,0.25%(w/v)的浓度。取各浓度下的肌动球蛋白稀释液1 mL,于20 ℃静置10 min,然后加入5 μL的8 mmol/mL ANS(溶于0.1 mol/mL磷酸缓冲液,pH=7.0)。用荧光分光光度计测定ANS-蛋白共聚物的相对荧光强度,激发波长374 nm,发射波长485 nm。PSH 指数为测得的荧光强度对蛋白质量浓度绘制线性回归曲线的最初曲线斜率值。 1.3.2.4 肌动球蛋白TSH含量测定 参考BENJAKUL等[20]的方法进行TSH含量测定。向1 mL的0.4%的肌动球蛋白中,加入9 mL 0.2 mol/mL Tris-HCl缓冲液(含8 mol/mL尿素,2% SDS,10 mmol/mL EDTA,pH=6.8)。取4 mL该混合液,加入0.4 mL 0.1%的DTNB溶液(含0.2 mol/mL的Tris-HCl缓冲液,pH=8.0溶解),40 ℃水浴25 min。于412 nm下测定吸光值,空白用1 mL的0.6 mol/mL KCl (pH=7.0)替代1 mL的0.4%的肌动球蛋白样品。 TSH含量按以下公式计算: (1) 总SH含量/(μmol·g-1protein)=总SH摩尔浓度/ρ (2) 式中:A412,412 nm波长处的吸光度;n稀释倍数;ε,摩尔吸光系数13 600 L/(mol·cm);ρ,蛋白质质量浓度。 1.3.2.5 肌动球蛋白DB含量测定 根据THANNHAUSER等[22]的方法,制备NTSB溶液,使用时稀释100倍。根据BENJAKUL等[20]的方法,将肌动球蛋白稀释为1 mg/mL,取0.5 mL加入新鲜NTSB溶液3 mL,在25 ℃下暗反应25 min后,测定A412吸光值,空白用水代替肌动球蛋白。 DB含量按以下公式计算: (3) 二硫键含量/(μmol·g-1protein)=0.5 mL×二硫键摩尔浓度/0.5 mL×ρ (4) 式中:A412,412 nm波长处的吸光度;n,稀释倍数;ε,摩尔吸光系数13 900 L/(mol·cm);ρ,蛋白质质量浓度。 1.3.2.6 建鲤鱼糜脂肪氧化TBA值测定 参考陈慧斌等[23]的方法,采用硫代巴比妥酸法测定鱼糜中脂肪氧化产生丙二醛量。 计算公式为: (5) 式中:A,532 nm波长处与600 nm波长吸光值的差值;W,肉样质量。 1.3.3 建鲤鱼糜冻藏期间的CAT B/L活性变化测定 2个处理组鱼糜CAT B/L的粗提液制备参考LI等[24]和BARRETT等[25]的方法。CAT B/L活性的测定基本参照BARRETT等[25]的方法,分别以荧光合成肽Z-Arg-Arg-AMC和Z-Phe-Arg-AMC为底物,采用酶标仪于激发波长380 nm,发射波长460 nm下测定粗提液中CAT B/L的活性。 1个酶活单位定义为在反应条件下,能够在1 min内水解底物并释放出1 nmol AMC产物的酶活性量(1 nmol AMC/min)。 1.4数据处理及统计分析 采用SPSS 22.0数学软件进行统计分析,计算各指标的平均值和标准差,采用One-Way ANOVA法进行差异显著性分析。p>0.05表示差异不显著,0.01 2.1饲料中适宜含量铁对建鲤鱼糜冻藏品质的影响 2.1.1 冻藏期间鱼糜肌动球蛋白CA活性变化 由如图1可知,冻藏期间CA活性整体呈下降趋势,且在冻藏开始时适宜组CA活性极显著(p<0.01)高于缺乏组。适宜组各冻藏点CA活性均极显著(p<0.01)高于缺乏组,且与冻藏初期相比,6周时适宜组和缺乏组CA活性分别下降了60%、67%,说明饲料中适宜含量的营养素铁能减缓CA活性下降。 肌动球蛋白重链头部具有CA活性区域,包含2个活性巯基,在蛋白氧化时巯基氧化交联成二硫键,导致活性区域构象改变[26]。因此,在整个贮藏过程中,CA活性下降反映了肌动球蛋白的结构破坏及蛋白氧化程度增加。SCOTTAL[27]和JIANG等[28]研究阿拉斯加狭鳕(Theragrachalcogramma)鱼糜和鲭鱼(Pneumatophorusjaponicus)鱼糜、鰤鱼(Seriolaquinqueradiata)鱼糜在冻藏中CA活性均呈下降趋势。刘艺杰等[29]研究发现鳙鱼鱼糜在-20 ℃冻藏20周后CA活性下降至新鲜样品的64.1%。本研究的结果与此相似,但适宜含量营养素铁提高了建鲤鱼糜的初始CA活性,且在一定程度上减缓了其下降速度,这可能与铁在动物机体抗氧化方面的显著作用有关。前期研究结果表明,饲料中添加适宜含量的铁,可增强建鲤抗氧化酶系统及非酶抗氧化系统的防御能力[16],而原料肉被加工成鱼糜后,铁可能在一定程度上对于CA活性区域的氧化起到了一定的保护作用。ZHANG等[30]研究也发现饲料中营养素铁能极显著降低草鱼肌肉中的蛋白羰基(PC)含量,增强机体和组织中主要的抗氧化能力。 图1 两个处理组建鲤鱼糜冻藏期间CA活性变化Fig.1 Changes in Ca2+-ATPase activity of Jian carp surimi in each group during frozen storage注:缺乏组和适宜组间进行方差分析,*表示差异显著(0.01 2.1.2 冻藏期间鱼糜TSH含量和DB含量变化 巯基是蛋白质中最具反应活性的功能性基团,其在冷藏、冻藏或冷冻解冻过程中易发生氧化或二硫键交换而引起含量下降,因此通过测定TSH在整个冻藏过程中含量的变化可以反映出蛋白质的变性程度[31]。此外,鱼糜蛋白 TSH 含量与鱼糜凝胶强度呈显著正相关[4],因此TSH 的含量可作为评定鱼糜贮藏品质的重要指标之一。研究还发现,TSH含量下降会导致DB含量呈现上升的趋势[32],两者存在一定相关性。 营养素铁对建鲤鱼糜冻藏期间TSH含量影响如图2所示,随着冻藏时间的增加,鱼糜蛋白的巯基氧化程度不断上升,TSH含量逐渐下降,但适宜组含量均极显著(p<0.01)高于缺乏组。与冻藏初期相比,6周时适宜组和缺乏组TSH含量分别下降了23%、47%。由此可以推断,适宜含量营养素铁对于建鲤鱼糜冻藏过程中的蛋白巯基氧化损失具有保护作用,这与铁的抗氧化性对冻藏过程中鱼糜蛋白CA活性的作用效果基本一致。综合两者结果,可以得出适宜含量铁对维持冻藏期间鱼糜蛋白的稳定性具有正面效果。 图2 两个处理组建鲤鱼糜冻藏期间TSH含量变化Fig.2 Changes in total sulfhydryl content of Jian carp surimi in each group during frozen storage 相应地,对应TSH含量的降低,2个处理组鱼糜冻藏期间DB含量总体呈现上升趋势(图3),除0周、2周外(0.01 图3 两个处理组建鲤鱼糜冻藏期间DB含量的变化Fig.3 Changes in disulfide bond content of Jian carp surimi in each group during frozen storage 2.1.3 冻藏期间鱼糜蛋白PSH变化 由于冻藏期间鱼糜蛋白发生变性,可引起蛋白质PSH增加的连锁效应,这是由于蛋白质变性使蛋白质分子内部的疏水性基团暴露,导致表面疏水性增加[4]。而疏水基团的相互作用是维持蛋白质结构稳定性的重要作用力,疏水作用对蛋白质稳定性、构象和蛋白质功能特性具有重要意义[33]。 建鲤鱼糜冻藏过程中适宜组及缺乏组PSH 变化如图 4 所示,BENJAKUL等[20-21]研究发现,在-18 ℃冻藏过程中,鱼肉蛋白的PSH均随着冻藏时间的延长而显著增加。本研究中,得到相似的PSH增加趋势,即相对于冻藏初始点,6周时适宜组、缺乏组的PSH分别上升了254%、124%,但0周、2周、6周时,适宜组PSH均极显著(p<0.01)低于缺乏组。鱼糜蛋白冻藏期间PSH的上升,会导致鱼糜制品保水性下降,从而导致弹性和凝胶强度下降[24]。饲料中添加适宜含量铁有效降低了鱼糜的初始PSH,并在一定程度上减缓了蛋白质PSH的增加,说明其对改善建鲤鱼糜的冻藏品质具有促进作用。 图4 两个处理组建鲤鱼糜冻藏期间PSH的变化Fig.4 Changes in protein surface hydrophobicity of Jian carp surimi in each group during frozen storage 2.1.4 冻藏期间鱼糜TBA值变化 如图5所示,冻藏0周、1周时,适宜组TBA值稍高于缺乏组。而冻藏2、4、6周时,适宜组TBA值均极显著(p<0.01)低于缺乏组,缺乏组TBA值呈现极显著(p<0.01)上升。冻藏6周后,缺乏组和适宜组TBA值分别上升264%、143%。TBA值是测定脂肪氧化的主要指标之一,在冻藏过程中会逐渐增大,陈慧斌等[23]、包建强等[34]分别报道了牡蛎、金枪鱼在冻藏期间TBA值呈上升趋势。而脂肪氧化次级产物可引发肌原纤维蛋白或肌动球蛋白的氧化,进而导致结构和功能改变[35],同时ARMENTEROS等[36]研究发现,脂质氧化和蛋白氧化之间呈正相关,二者适时的相互作用。因此,脂质氧化亦可能影响鱼糜蛋白的稳定性,进而会加速贮藏过程中鱼糜品质的下降。因此推测,由于适宜组建鲤鱼糜TBA值较低,因此其鱼糜蛋白的氧化速度会相应减弱,更有利鱼糜加工制品的品质。 图5 两个处理组建鲤鱼糜冻藏期间TBA值的变化Fig.5 Changes in TBA value of Jian carp surimi in each group during frozen storage 本研究表明,饲料中适宜含量营养素铁在降低冻藏过程中鱼糜脂肪氧化程度方面具有一定作用,冻藏后期,由于铁的抗氧化作用,使得适宜组鱼糜TBA值与缺乏组差异越来越大。该结果与凌娟[16]的前期研究结果一致,即:铁能够极显著地降低幼建鲤肌肉组织中丙二醛(MDA)含量,其能通过减少幼建鲤脂质过氧化毒性产物丙二醛的含量来提高细胞的抗氧化能力。 2.2饲料中适宜含量铁对建鲤鱼糜冻藏期间CATB/L活性变化的影响 饲料中适宜含量铁对建鲤鱼糜在冻藏期间,CAT B与CAT L活性的影响分别见图6-A、图6-B。由图可知,在冻藏0周即冻藏开始之前,CAT B/L活性在漂洗后的鱼糜中仍存在残留,且适宜组CAT B和CAT L初始活性均极显著地低于缺乏组(p<0.01)。随着冻藏时间的延长,组织蛋白酶发生不同程度的降解,表现为适宜组和缺乏组CAT B/L活性均总体呈现下降趋势。通过各冻藏点活性的差异显著性比较,可较为直观地看出,CAT L的下降趋势更为剧烈,而CAT B的下降趋势更为平缓。冻藏6周后,适宜组与缺乏组CAT B的活性分别下降了62%、78%,且最终的活性差异不显著(p>0.05);而适宜组与缺乏组CAT L的活性则分别下降了61%、45%,最终的活性差异极显著(p<0.01)。以上结果表明,饲料中添加适宜含量铁能有效降低鱼糜的初始CAT B/L活性,且能够促进鱼糜冻藏期间CAT L活性的迅速下降,而对CAT B活性下降的促进作用不明显。 图6 两个处理组建鲤鱼糜冻藏期间CAT B/L活性的变化Fig.6 Changes in CAT B/L activities of Jian carp surimi in each group during frozen storage CAT B/L活性、表达量可影响鱼类胚胎发育[37]、免疫功能[38],进而影响到鱼类生长及肉质形成。在食品方面,鱼肉质地柔软,且鱼死后的自溶速度明显快于畜禽动物。而鱼类肌肉中组织蛋白酶是参与死后自溶,破坏肌肉结构完整性的主要蛋白酶类[39]。不同于畜禽肉类,鱼肉及其制品保持原有的硬度质构特性是十分重要,在加工过程中的“嫩化”对于生产者和消费者都是不需要的。对鲤鱼鱼糜的研究表明,鱼糜中添加CAT L后鱼糜凝胶强度显著下降了24.33%[40]。鲭鱼鱼糜于-40 ℃冻藏8周后,CAT B和CAT L仍然均残留80%左右的活性[18]。因此,降低或抑制鱼糜中组织蛋白酶的残留活性,有利于鱼糜制品贮藏稳定性及质构品质的保持。本研究中,建鲤鱼糜在漂洗后仍然存在不同程度地CAT B/L活性残留,在冻藏过程中,饲料中添加适宜含量的铁又对CAT B/L的活性降低具有一定促进、调节作用,这对于建鲤鱼糜冻藏品质具有正面效果,但该调节机制尚需进一步研究。 综上所述,组织蛋白酶活性与鱼糜制品品质及鱼死后肉质软化密切相关,会影响鱼类死后及贮藏过程中的鱼肉及鱼糜品质。而通过营养素调控,调节鱼肌肉组织中组织蛋白酶的活性,对从饲养源头控制鱼肉及加工制品品质,具有重要的研究意义。 相对于缺乏组(53.9 mg/kg),饲料中添加适宜含量的营养素铁(146.1 mg/kg),可在建鲤鱼糜冻藏期间,保持与鱼糜冻藏品质、质构品质紧密相关的肌动球蛋白稳定性,并能有效降低冻藏期间脂肪氧化产物的生成,以上作用对于减缓冻藏期间鱼糜的蛋白质变性,提升冻藏稳定性具有正面效果。此外,适宜含量的营养素铁可极显著降低建鲤鱼糜的初始CAT B/L活性,并且可促进CAT L在冻藏过程的中的活性降低,有利于防止CAT B/L的高活性残留造成的鱼糜质构品质劣变。 [1] 张建森,孙小异.建鲤综合育种技术的公开和分析[J].中国水产,2006(9):69-72. [2] 中国渔业统计年鉴[M].北京: 中国农业出版社,2016. [3] 周爱梅,曾庆孝,刘欣,等.冷冻鱼糜蛋白在冻藏中的物理化学变化及其影响因素[J].食品科学,2003,24(3):153-157. [4] ERASTO M.冷冻储藏与氧化对鲢鱼肌原纤维蛋白功能性质的影响[D].无锡: 江南大学,2010. [5] LI S J,KING A J.Structural changes of rabbit myosin subfragment 1 altered by malonaldehyde,a byproduct of lipid oxidation[J].Journal of Agricultural & Food Chemistry,1999,47(8):3 124-3 129. [6] AZUMA Y,KONNO K.Freeze denaturation of carp myofibrils compared with thermal denaturation[J].Fisheries Science,1998,64(2):287-290. [7] KATO S,KOSEKI H,KONNO K.Oligomerization of carp myosin which retains its atpase activity[J].Fisheries Science,1996,62(6):985-989. [8] YOSHIKAWA K,INOUE N,KAWAI Y,et al.Changes of the solubility and ATPase activity of carp myofibrils during frozen storage at different temperatures[J].Fisheries Science,1995,61(5):804-812. [9] COAD J,STEWART R,PEDLEY K.Iron: Physiology of iron[J].Encyclopedia of Food & Health,2016:461-467. [10] DHUR A,GALAN P,HERCBERG S.Iron status,immune capacity and resistance to infections[J].Comparative Biochemistry & Physiology Part A Physiology,1989,94(1):11-19. [11] ROBBINS E,PEDERSON T.Iron: its intracellular localization and possible role in cell division[J].Proceedings of the National Academy of Sciences of the United States of America,1970,66(4):1 244-1 251. [12] COATES T D.Physiology and pathophysiology of iron in hemoglobin-associated diseases[J].Free Radical Biology & Medicine,2014,72:23-40. [13] SHIAU S Y,SU L W.Ferric citrate is half as effective as ferrous sulfate in meeting the iron requirement of juvenile tilapia,Oreochromis niloticus x O.aureus.[J].Journal of Nutrition,2003,133(2):483-488. [14] III D M G,WILSON R P.Characterization of iron deficiency and the dietary iron requirement of fingerling channel catfish[J].Aquaculture,1986,52(3):191-198. [15] SAKAMOTO S,YONE Y.Requirement of red sea bream for dietary iron II[J].Nihon-Suisan-Gakkai-Shi,1978,44(3):223-225. [16] LING Juan,FENG Lin,LIU Yang,et al.Effect of dietary iron levels on growth,body composition and intestinal enzyme activities of juvenile Jian carp (Cyprinuscarpiovar.Jian)[J].Aquaculture Nutrition,2010,16(6):616-624. [17] LIU Huan,YIN Li-jun,ZHANG Nan,et al.Isolation of cathepsin B from the muscle of silver carp (Hypophthalmichthysmolitrix) and comparison of cathepsins B and L actions on surimi gel softening[J].Food Chemistry,2008,110(2):310-318. [18] JIANG S T,LEE B L,TSAO C Y,et al.Mackerel cathepsins B and L effects on thermal degradation of surimi[J].Journal of Food Science,1997,62(2):310-315. [19] 陈秀华,李松,李冉,等.漂洗水中不同质量分数VB1对鲢鱼鱼糜冷藏品质的影响[J].食品科学,2014,35(18):236-240. [20] BENJAKUL S,VISESSANGUAN W,THONGKAEW C,et al.Comparative study on physicochemical changes of muscle proteins from some tropical fish during frozen storage[J].Food Research International,2003,36(8):787-795. [21] BENJAKUL S,SEYMOUR T A,MORRISSEY M T,et al.Physicochemical changes in pacific whiting muscle proteins during iced storage[J].Journal of Food Science,1997,62(4):729-733. [22] THANNHAUSER T W,KONISHI Y,SCHERAGA H A.Analysis for disulfide bonds in peptides and proteins[J].Methods in Enzymology,1987,143(1):115-119. [23] 陈慧斌,王梅英,王则金,等.牡蛎冻藏期间脂肪氧化影响因素研究[J].西南大学学报(自然科学版),2008,30(8):96-101. [24] LI Shu-hong,ZHOU Xiao-qiu,ZHANG Nan,et al.Purification and characterisation of cathepsin L2 from dorsal muscle of silver carp (Hypophthalmichthysmolitrix)[J].Food Chemistry,2008,111(4):879-886. [25] BARRETT A J,KIRSCHKE H.Cathepsin B,cathepsin H,and cathepsin L[J].Methods in Enzymology,1981,80 Pt C(Pt C):535-561. [26] WELLS J A,WERBER M M,LEGG J I,et al.Inactivation of myosin subfragment one by cobalt(II)/cobalt(III) phenanthroline complexes.I.Incorporation of Co(III) by in situ oxidation of Co(II)[J].Biochemistry,1979,18(22):4 800-4 805. [27] SCOTT D N,PORTER R W,KUDO G,et al.Effect of freezing and frozen storage of alaska pollock on the chemical and gel-forming properties of surimi[J].Journal of Food Science,1988,53(2):353-358. [28] JIANG S T,MING-Lang H O,LEE T C.Optimization of the freezing conditions on mackerel and amberfish for manufacturing minced fish[J].Journal of Food Science,1985,50(3):727-732. [29] 刘艺杰,薛长湖,李兆杰.鳙鱼鱼糜在冻藏过程中理化性质变化的研究[J].食品工业科技,2006,27(6):70-72. [30] ZHANG Li,FENG Lin,JIANG Wei-dan,et al.The impaired flesh quality by iron deficiency and excess is associated with increasing oxidative damage and decreasing antioxidant capacity in the muscle of young grass carp (Ctenopharyngodonidellus)[J].2016(1):191-201. [31] 秦辉.中华绒螯蟹冻藏品质的研究[D].无锡: 江南大学,2008. [32] BADII F,HOWELL N K.Changes in the texture and structure of cod and haddock fillets during frozen storage[J].Food Hydrocolloids,2002,16(4):313-319. [33] SUN Wei-zheng,ZHOU Fei-bai,SUN Da-wen,et al.Effect of oxidation on the emulsifying properties of myofibrillar proteins[J].Food and Bioprocess Technology,2013,6(7):1 703-1 712. [34] 包建强,路昊,岳晓华,等.冻藏期间金枪鱼的TVB-N、脂肪氧化、pH值的变化[C].上海市制冷学会二○○五年学术年会论文集,2005:246-248. [35] 章银良,安巧云,杨慧.脂肪氧化对蛋白质结构的影响[J].食品科学,2012,33(1):25-30. [36] ARMENTEROS M,HEINONEN M,OLLILAINEN V,et al.Analysis of protein carbonyls in meat products by using the DNPH-method,fluorescence spectroscopy and liquid chromatography-electrospray ionisation-mass spectrometry (LC-ESI-MS)[J].Meat Science,2009,83(1):104-112. [37] ARANISHI F.Differential expression of ovarian cathepsins B,D and L during oocyte growth in scad[J].Journal of Reproduction & Development,2000,46(46):287-291. [38] WATTS C.The endosome-lysosome pathway and information generation in the immune system[J].Biochimica Et Biophysica Acta,2012,1 824(1):14-21. [39] GODIKSEN H,MORZEL M,HYLDIG G,et al.Contribution of cathepsins B,L and D to muscle protein profiles correlated with texture in rainbow trout (Oncorhynchusmykiss)[J].Food Chemistry,2009,113(4):889-896. [40] AN H,PETERS M Y,SEYMOUR T A,et al.Isolation and activation of cathepsin L-inhibitor complex from Pacific whiting (Merlucciusproductus)[J].Journal of Agricultural & Food Chemistry,1995,43(2):327-330. EffectofironsupplementonthechangesofJiancarp(cyprlnuscarpiovarJian)surimiqualityduringfrozenstorageandcathepsinB/L LI Ran,ZHONG Hai-xia,LI Shu-hong*,YANG Juan,HU Qiang,KE Qin-qin,BAI Zhi-zi,LIN Ling,LI Mei-liang (College of Food Science,Sichuan Agricultural University,Ya’an 625014,China) Jian carp (cyprlnuscarpiovarJian) fed for 90 days were compared with different iron content (146.1 mg/kg and 53.9 mg/kg) in their diet.Fish meats were collected and processed into surimi.After frozen storage at -20 ℃,the sample was collected at 0,1st,2nd,4th,6thweek respectively.Indexes including Ca2+-ATPase activity (CA),total sulfhydryl (TSH) content,disulfide bonds (DB) content,protein surface hydrophobicity (PSH),and thiobarbituric acid (TBA) value were detected.Meanwhile,the activities of Cathepsin B/L of Jian carp surimi were detected by fluorescent synthesis of peptide substrate method.The results indicated that the initial CA and TSH content in suitable group was improved extremely significantly (p<0.01),while the initial DB content (0.01 iron; Jian carp; surimi; quality during frozen storage; cathepsin B/L 10.13995/j.cnki.11-1802/ts.013793 硕士研究生(李树红副教授为通讯作者,E-mail:lish@sicau.edu.cn)。 四川省教育厅自然科学重点基金项目(10ZA052);四川省科技支撑计划项目(2014NZ0003) 2017-01-10,改回日期:2017-02-061 材料与方法
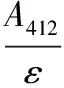
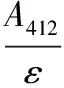
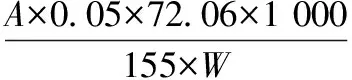
2 结果与分析
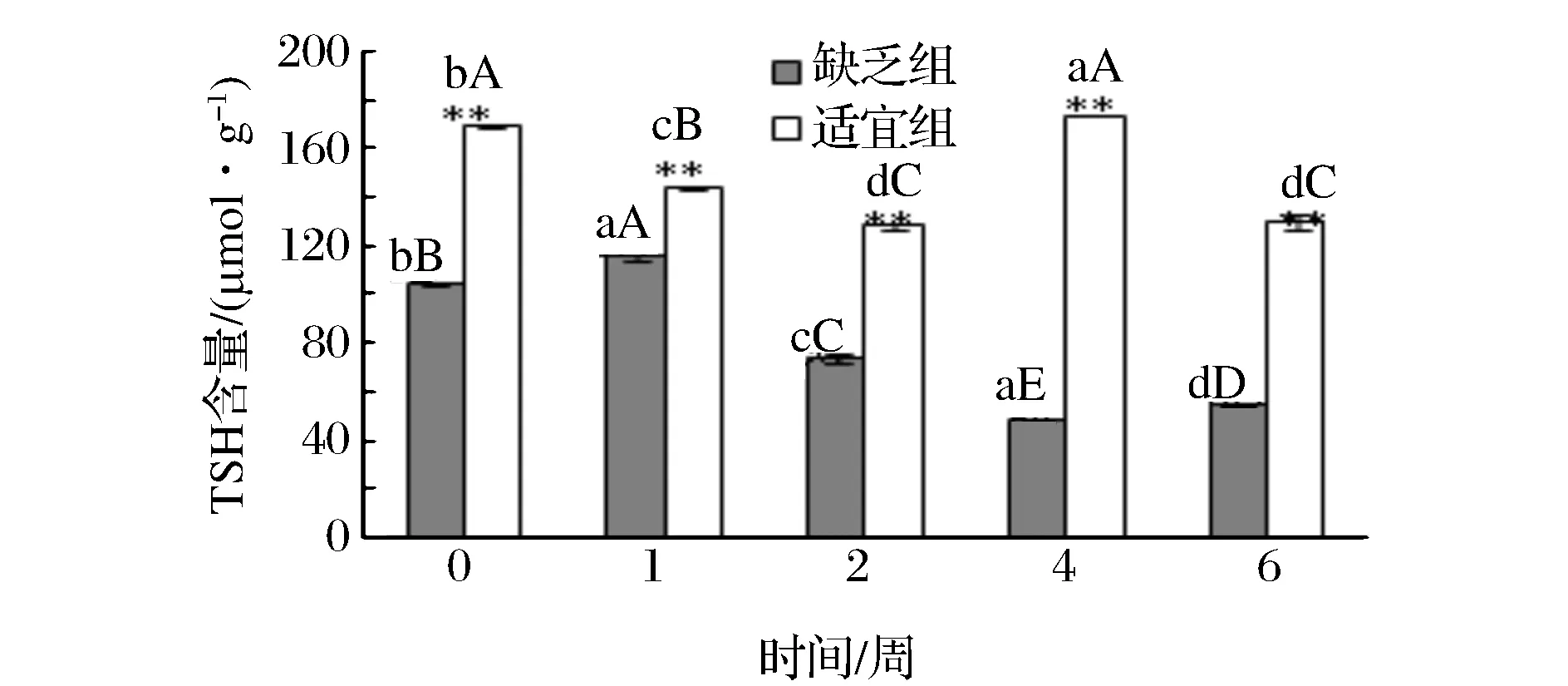

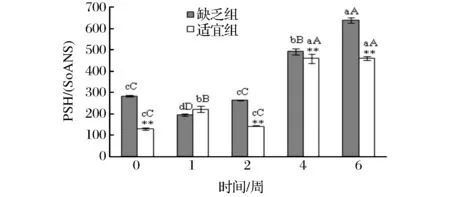
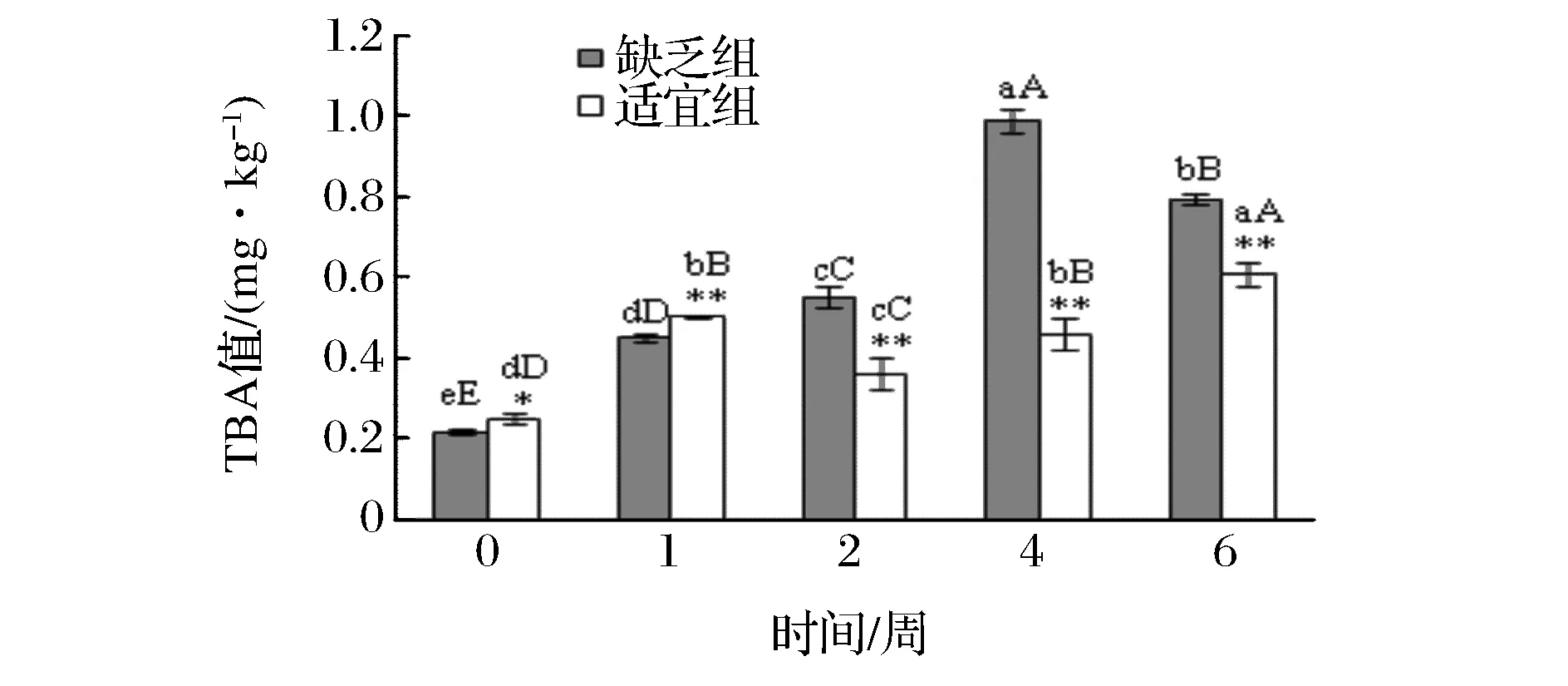
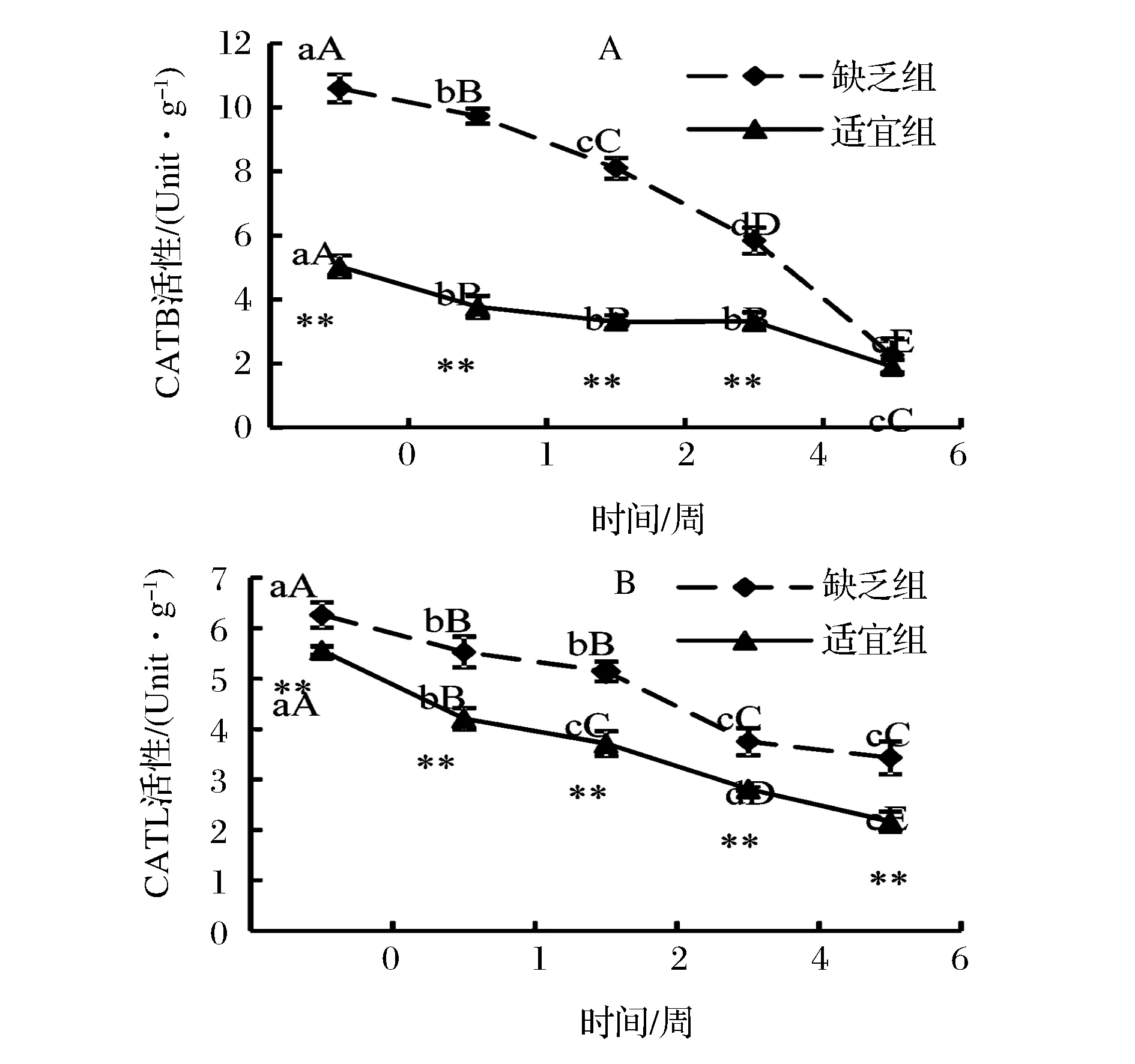
3 结论
