基于酶水解法酿酒高粱的结合态风味研究
2017-09-22吕佳慧范文来徐岩
吕佳慧,范文来,徐岩
(教育部工业生物技术重点实验室,江南大学 生物工程学院,酿造微生物与应用酶学研究室,江苏 无锡,214122)
基于酶水解法酿酒高粱的结合态风味研究
吕佳慧,范文来*,徐岩
(教育部工业生物技术重点实验室,江南大学 生物工程学院,酿造微生物与应用酶学研究室,江苏 无锡,214122)
为探索白酒主要酿造原料高粱对酒品质的影响,采用固相萃取吸附前体物质和β-葡萄糖苷酶水解释放风味成分,应用HS-SPME结合GC-MS技术定性、定量高粱的结合态风味物质。在2种高粱中共检测到38种结合态风味物质(其中3种为临时性鉴定),包括6种醇类、6种醛类、9种酮类、3种芳香族、3种萜类、6种酯类、1种硫化物、1种呋喃类和3种酸类化合物。23种化合物首次在高粱的结合态风味中检测到。研究表明酶水解是一种释放风味物质较为有效的方式。
高粱;β-葡萄糖苷酶;结合态风味;酶解产物
结合态风味(bound aromas)是本身无风味的风味前驱物在酸或酶的作用下释放出来的挥发性风味。来源于原料的风味物质主要以结合态的、不挥发性的风味前驱物的形式存在和积累的[1]。在白酒生产过程中,原料中的风味前驱物会分解、释放出游离态风味物质,成为酒体的风味成分。白酒酿造原料丰富多样,主要是谷类和薯类,如高粱、玉米、甘薯等,而高粱是我国白酒生产使用最广泛的原料[2]。酱香型、清香型及浓香型白酒大部分均使用高粱作为单一的原料,即使在多粮型的浓香型白酒生产中,高粱的使用量也占原料之首。
目前我国对白酒酿造原料的结合态风味的研究较少。曾有报道基于酸水解法研究高粱、小麦、大麦等6种谷物原料的结合态风味[3],检测到35种结合态香气物质,包括醇类、酯类、醛酮类、酸类等7类化合物;日本人研究发现在甘薯中存在结合态形式的里哪醇(linalol)、香叶醇(geraniol)、橙花醇(nerol)和松油醇(α-terpinol),且单萜醇对甘薯烧酒的风味有一定的感官贡献[4]。虽曾有对高粱基于酸水解法的结合态风味相关报道,但未见有对酶水解途径的研究。
本研究以酿酒高粱为研究对象,采用固相萃取吸附前体物质,β-葡萄糖苷酶水解释放结合态风味物质,结合HS-SPME-GC-MS技术研究高粱酶水解途径的结合态风味的组成,以期了解高粱结合态风味对白酒品质的影响。
1 材料和方法
1.1材料和仪器
原料:贵州红缨子糯高粱(由贵州某酒厂提供);山东菏泽杂交粳高粱(由山东某酒厂提供)。
NaCl、Na2HPO4、柠檬酸、无水CaCl2:分析纯,上海国药集团;乙醇、甲醇、2-辛醇、表1中定性定量用到的标准品:色谱纯,Sigma-Aldrich公司;来源于杏仁的β-葡萄糖苷酶(冻干粉末,酶活力为6 U/mg):Sigma-Aldrich公司;Milli-Q超纯水(实验用水均为煮沸并冷却至室温的超纯水)。
仪器:气相色谱-质谱联用仪 GC 6890N-MSD 5975,美国Agilent 公司;自动进样器(MPS2),德国Gerstel公司;50/30 μm DVB/CAR/PDMS萃取头,美国Supelco公司;FFAP 毛细管柱(60 m×0.25 mm×0.25 μm),美国Supelco公司;LC-C18固相萃取柱(2 g,10 mL),上海安谱实验科技股份有限公司;Supelco固相萃取装置(VisiprepDLSPE),美国Supelco公司。
1.2实验方法
1.2.1 高粱结合态风味前体提取和分离
2 g高粱样品用30 mL乙醇提取,37 ℃摇床过夜,转速200 r/min,过滤;30 mL甲醇相同的条件再次提取[5]。合并提取液,35 ℃减压蒸干,残留相用30 mL Milli-Q超纯水复溶,12 000 r/min离心30 min,取上清液。
C18反相极性柱按如下步骤纯化[6]:10 mL色谱级甲醇活化柱子;10 mL超纯水平衡柱子;30 mL高粱提取液上样;90 mL超纯水清洗去除游离态的糖和酸;5 mL色谱级甲醇洗脱并收集洗脱液;缓慢氮吹至干,-20 ℃保存待用。使用前,复溶到20 mL pH 5的磷酸氢二钠-柠檬酸缓冲溶液中。
1.2.2 高粱结合态风味前体酶解
取10 mL前体物质溶液加入0.04 g β-葡萄糖苷酶,溶液的酶活为24 U/mL,25 ℃反应过夜[3],反应完后加入1%固体氯化钙灭酶并离心。
1.2.3 酶解产物的定性定量分析
1.2.3.1 HS-SPME条件
取8 mL离心后的酶解液置于顶空瓶中,加入3 g NaCl和5 μL质量浓度为81.90 mg/L的内标2-辛醇溶液,旋紧瓶盖,HS-SPME-GC-MS分析。DVB/CAR/PDMS三相萃取头,45 ℃预热2.5 min,吸附45 min后直接进样,GC解析5 min[7]。
1.2.3.2 色谱条件
载气He,流速2 mL/min,不分流进样;色谱柱:DB-FFAP(60 m×0.25 mm×0.25 μm),进样口温度250 ℃;柱温升温程序:初始温度50 ℃,2 min后以4 ℃/min的速率升温至230 ℃,保持15 min[7]。
1.2.3.3 质谱条件
EI电离源,电子能量70 eV,离子源温度为230 ℃,全扫描模式,扫描范围为30.00~500.00 amu。
1.2.3.4 定性
化合物通过与NIST 05.L库的标准图谱及标准品的保留指数(RI)比对定性;没有标准品的化合物,参考文献RI定性,为临时鉴定的化合物。
1.2.3.5 定量
将待测化合物溶液稀释成一系列浓度的标准溶液,对样品采用相同的处理方法进行HS-SPME-GC-MS分析。用选择离子法(SIM)计算目标化合物的峰面积,以化合物与内标物的峰面积比为横坐标,质量浓度之比为纵坐标建立标准曲线。3-十三酮、2-十四酮、对甲硫基苯酚为临时鉴定、半定量,化合物的质量浓度是内标的质量浓度、化合物与内标物的峰面积比的乘积。
2 结果与讨论
2.1高粱结合态风味物质定性分析
本研究在粳、糯高粱酶水解液中共鉴定出38种化合物(见图1和表1),包括6种醇类、6种醛类、9种酮类、3种芳香族、3种萜类、6种酯类、1种硫化物、1种呋喃类和3种酸类化合物。其中,23种化合物首次在高粱的结合态风味中检测到。庚酸乙酯仅在糯高粱的酶解液中检测到,苯甲醇仅在粳高粱中检测到。
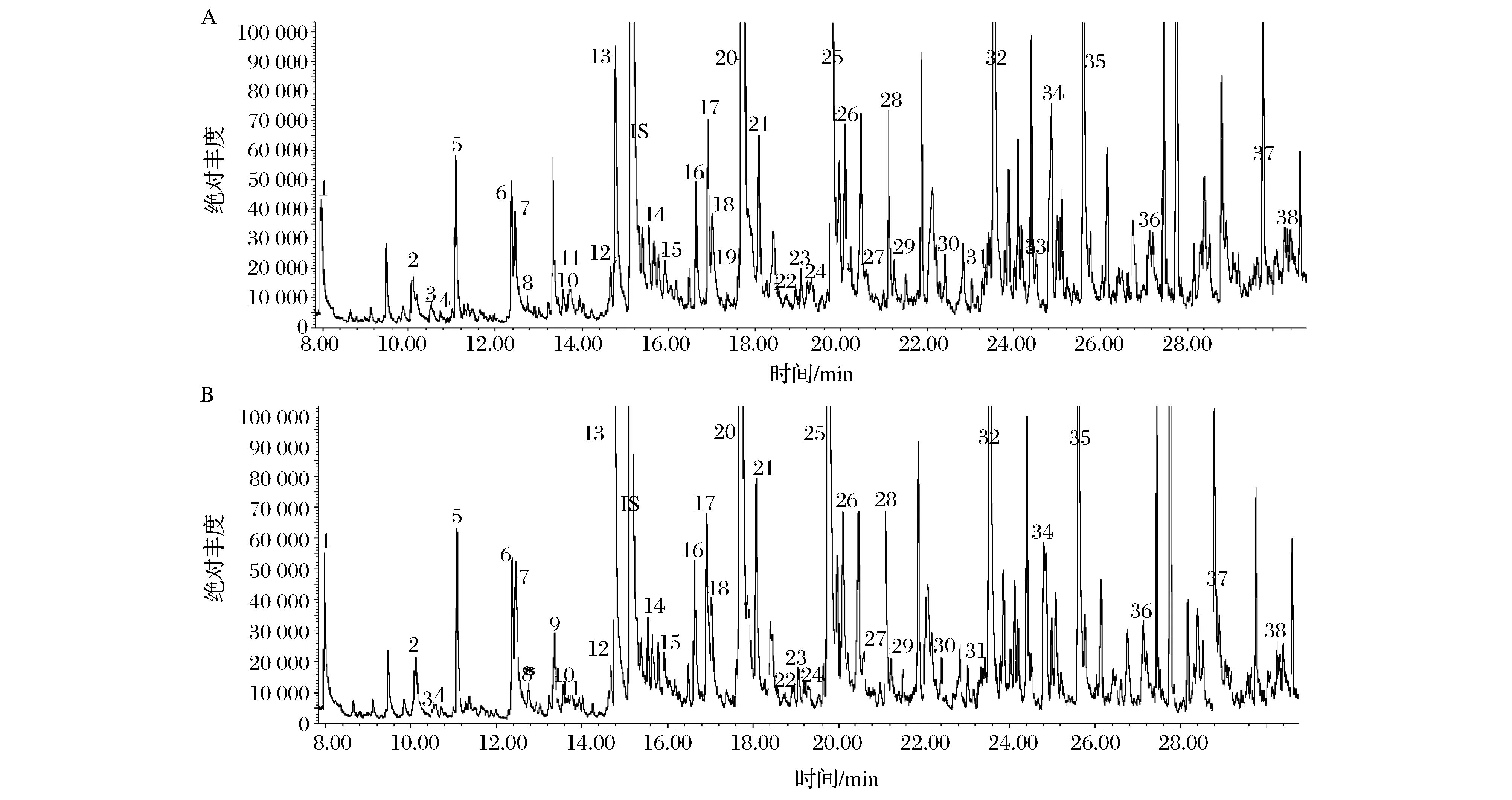
图1 高粱酶水解后挥发性化合物GC-MS总离子流图(A,粳高粱;B,糯高粱)Fig.1 GC-MS total ion current chromatogram of sorghums’ volatiles after enzymatic hydrolysis (A,non-glutinous sorghum; B,glutinous sorghum)注:图中峰号对应的化合物见表1。
2.2高粱结合态风味物质定量分析
从酶解产物定量结果看,粳、糯高粱结合态香气含量分别为28.48、25.73 mg/kg(如表1)。醛酮类是高粱结合态风味物质中最丰富的化合物,分别占粳、糯高粱总含量的32.29%和36.23%。从单个化合物来看,癸酸含量最高,粳、糯高粱中含量分别为3 538、3 559 μg/kg。
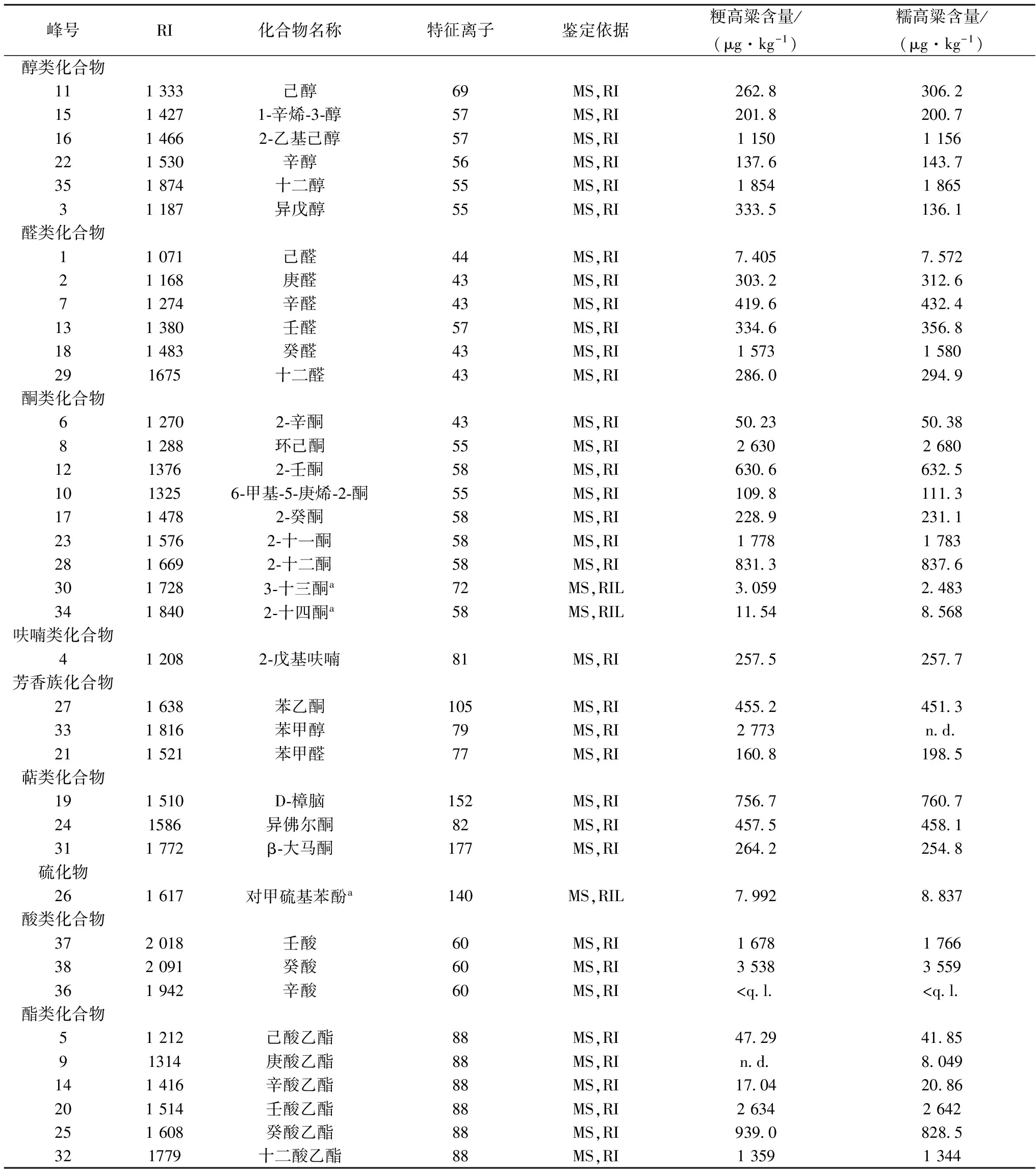
表1 高粱的结合态香气化合物含量
注:a:无标准品,为半定量结果;n.d.:表示没有检测到, 高粱结合态香气物质中共检测到6种醇类,分别是己醇、1-辛烯-3-醇、2-乙基己醇、辛醇、十二醇和异戊醇。其中,2-乙基己醇含量最高,粳、糯高粱中含量是1 150、1 156 μg/kg。十二醇首次在高粱的结合态风味中检测,粳、糯高粱中含量为1854、1865 μg/kg。C4~C9短链烷基β-葡萄糖苷属于自然存在的糖苷,是一些挥发性成分和糖分子通过糖苷键连接而成,通常以β-O-葡萄糖苷形式存在[8]。酶解条件下烷基葡萄糖苷的释放率可达到90%~100%[9]。 醛酮类化合物最丰富。在酶解液中检测到6种醛类和9种酮类化合物。其中,己醛、庚醛、十二醛、2-辛酮、2-壬酮、2-癸酮、2-十一酮、2-十二酮、环己酮、6-甲基-5庚烯-2-酮、3-十三酮首次在高粱的结合态风味中鉴定到。在醛类化合物中,癸醛含量最高,粳、糯高粱中含量1 573、1 580 μg/kg。在酮类化合物中,环己酮含量最高,粳、糯高粱中含量为2 630、2 680 μg/kg。检测到的酮类化合物均存在于饮料酒中,呈水果香、花香和柑橘香等香气[2]。醛酮类化合物可能是对应的糖苷化合物水解产生醇类的氧化产物[9]。 萜类化合物是以异戊二烯为结构单位倍数的烃类及其含氧衍生物[2],是饮料酒中的重要香气物质。在高粱水解液中检测到D-樟脑、异佛尔酮和β-大马酮,其中D-樟脑含量最高并首次在高粱结合态风味中检测到,粳、糯高粱中含量分别是756.7、760.7 μg/kg。β-大马酮是清香型白酒的特征风味成分,粳、糯高粱中含量分别是264.2、254.8 μg/kg。原料中的类胡萝卜素在酶解和酸解环境下会降解产生异佛尔酮和β-大马酮[10]。 检测到的芳香族化合物包括苯乙酮、苯甲醛和苯甲醇,苯乙酮和苯甲醛首次在高粱结合态风味中检测到,苯甲醇只有在粳高粱检测到,含量为2 773 μg/kg。苯甲醛、苯乙醛广泛存在于酒类产品中[2]。在植物中,苯丙烷类糖苷是自然存在的糖苷,被认为是风味前体物质,其中苯甲醇、β-苯乙醇被认为是普遍存在的糖苷配基[8],葡萄和葡萄酒中已经检测到苯甲基-β-D-葡萄糖苷、2-苯乙基-β-D-葡萄糖苷[11]。 此外,首次在高粱的结合态风味物质中检测到1种硫化物对甲硫基苯酚,之前未有报道。检测到3种酸类,包括壬酸、癸酸和辛酸,其中癸酸含量是所有检测到的化合物中最高的。辛酸、壬酸和癸酸均有着不愉快的气味、山羊臭、奶酪香和脂肪臭[2]。酯类化合物在粳、糯高粱的整体结合态香气中占17.54%和18.99%,可能是酶解条件下的人工产物,有报道酸可能会与糖、醛、缩醛或半缩醛等化合物反应生成酯类化合物[12]。 2.3高粱风味前驱物的酶解产物与报道的酸解产物的比较 曾有研究人员基于酸水解法检测到高粱的35种结合态香气物质,其中醇类4种、酯类3种、醛酮类10种、酸类6种、芳香族类4种、萜类6种、杂环类2种[3]。本研究采用酶法水解高粱,与酸水解比,酶解产物多了3种,尤其是检测到更多醛酮类化合物,23种化合物(包括1个硫化物)首次在高粱的结合态风味中检测到。 结合态糖苷类前体的酶解产物与酸解产物种类上的差异可能跟糖苷类前体两种途径的断键方式不同有关(如图2)。糖苷类风味前驱物是由糖苷配基(即各种挥发性成分)和糖分子通过糖苷键连接而成,多数情况下以β-糖苷键连接[13]。酶解反应的断键方式是糖苷键,而酸解反应断键方式是酯键。酸解反应通过升高温度而加速结合态风味的释放,断键较为彻底,形成的挥发性物质分子量较小,且糖配基的重排会生成不利的风味物质,无法较为真实地反应糖苷类前驱物的结构[14]。温和的酶解过程能有效地产生糖苷配基并保持配基结构不变[15]。在葡萄酒中,糖苷酶的使用是调整葡萄酒香气并使某些特殊感官特征得到提升的一个重要手段,具有一定的商业化应用前景,因而备受关注[16]。 图2 结合态糖苷类前体酸解(左)和酶解(右)反应的断键方式[14]Fig.2 Modes of cleavage of glucosides by acid(left) and enzyme(right)hydrolysis[14]注:R表示氢原子或者其他的糖单元 在白酒生产过程中,酶对高粱风味前驱物的水解作用可能存在于酒醅发酵过程中。日本曾有研究[4]发现β-葡萄糖苷酶对甘薯烧酒的风味形成有着重要的作用。在发酵过程中,熟甘薯的单萜醇糖苷被酒曲中的糖苷酶水解,产生重要风味物质。目前我国尚未对白酒大曲中的β-葡萄糖苷酶进行研究,而国外已将这一风味修饰机制运用到葡萄酒和果酒生产中。此外,有研究发现β-葡萄糖苷酶水解生氰糖苷(如亚麻苦苷)有利于去除饮料酒中有害前体氰化物[4],而氰氢酸是蒸馏酒中氨基甲酸乙酯形成的重要前体[17]。 本研究采用固相萃取结合HS-SPME-GC-MS技术定量了38种高粱的结合态风味化合物,其中23种首次在高粱的结合态风味中检测到。粳、糯高粱结合态香气含量分别为28.48、25.73 mg/kg,醛酮类化合物含量最丰富。从单个化合物来看,癸酸含量最高,粳、糯高粱中含量为3 538、3 559 μg/kg。研究表明酶水解是一种释放结合态风味较为有效的方式。 [1] GAYON P,GLORIES Y,MAUJEAN A,et al.Handbook of Enology[M].The Chemistry of Wine Stabilization and Treatments,2006. [2] 范文来,徐岩.酒类风味化学[M].北京: 中国轻工业出版社,2014. [3] 朱伟岸,吴群,李记明,等.白酒酿造谷物类原料中结合态香气物质的分离及检测分析[J].食品与生物技术学报,2015,34(5): 456-462. [4] OHTA T,OMORI T,SHIMOJO H,et al.Identification of monoterpene alcohol beta-glucosidases in sweet-potatoes and purification of a shiro-koji beta-glucosidase[J].Agricultural and Biological Chemistry,1991,55(7): 1 811-1 816. [5] CAI Ji-bao,LIU Bai-zhan,LING Ping,et al.Analysis of free and bound volatiles by gas chromatography and gas chromatography-mass spectrometry[J].Journal of Chromatography A,2002,947: 267-275. [6] VILLENA M A,PEREZ J D,UBEDA J F,et al.A rapid method for quantifying aroma precursors: Application to grape extract,musts and wines made from several varieties[J].Food Chemistry,2006,99(1): 183-190. [7] KANG Wen-huai,XU Yan,QIN Ling,et al.Effects of different β-D-glycosidases on bound aroma compounds in muscat grape determined by HS-SPME and GC-MS[J].Journal of the Institute of Brewing,2010,116(1): 70-77. [8] JERKOVIC I,MASTELIC J.GC-MS Characterization of acetylated β-D-glucopyranosides transglucosylation of volatile alcohols using almond β-glucosidase[J].Croatica Chemica Acta,2004,77(3):529-535 [9] HAMPEL D,ROBISON A L,JOHNSON A J,et al.Direct hydrolysis and analysis of glycosidically bound aroma compounds in grapes and wines: comparison of hydrolysis conditions and sample preparation methods[J].Australian Journal of Grape and Wine Research,2014,20(3): 361-377. [10] WANG Shu-lin,JIAO Ling-xiao,LI Ya-hui,et al.Degradation of β-carotene to volatile compounds in an aqueous model system to simulate the production of sea buckthorn wine[J].International Journal of Food Properties,2012,15(6): 1 381-1 393. [11] VOIRIN S C G,BAUMES R L,SAPIS J-C,et al.Analytical methods for monoterpene glycosides in grape and wine II.Qualitative and quantitative determination of monoterpene glycosides in grape[J].Journal of Chromatography,1992,595(1-2):269. [12] STAHLBISKUP E,INTERT F,HOLTHUIJZEN J,et al.Glycosidically Bound Volatiles: A Review[J].Flavour and Fragrance Journal,1993,8: 61-80. [13] 汪东风.高级食品化学[M].北京:化学工业出版社: 2009. [14] PUGLISI C J.The role of acetylenic and allenic precursors in the formation of β-damascenone[D].Flinders University,2007. [15] WILLIAMS P J,SEFTON M A,FRANCIS I L.Glycosidic precursors of varietal grape and wine flavor[J].ACS Symposium Series,1992,202(34):74-86. [16] 王玉霞,张超.葡萄酒风味提升酶的研究进展[J].酿酒科技,2013 (11): 4. [17] 张顺荣.白酒中氨基甲酸乙酯形成的氰化物途径研究[D].无锡:江南大学,2016. ResearchofboundaromasbasedonenzymehydrolysisofsorghumsforbrewingChineseliquor LV Jia-hui,FANen-lai*,XU Yan (Lab of Brewing Microbiology and Applied Enzymology,Key Laboratory of Industrial Biotechnology,Ministry of Education,School of Biotechnology,Jiangnan University,Wuxi,214122,China) In order to explore the effect of sorghums on Chinese liquor’s quality,the SPE column was employed to adsorb bound precursors,and then,which were hydrolyzed by β-glucosidase to release aroma compounds.The HS-SPME coupled with GC-MS was used to identify and quantify the volatile hydrolysate.38 kinds of volatile aroma compounds were detected in two kinds of sorghums,including 6 kinds of alcohols,6 kinds of aldehydes,9 kinds of ketones,3 kinds of aromatic compounds,3 kinds of terpenoids,6 kinds of esters,1 kind of sulfide,1 kind of furan,and 3 kinds of acids.Among these,23 kinds of volatile compounds were first detected in the enzymatic hydrolysate of sorghums,and 3 kinds of volatiles were tentatively identified.The results suggested that enzymatic hydrolysis was an effective way to release bound aromas. sorghum; β-glucosidase; bound aromas; enzymatic hydrolysate 10.13995/j.cnki.11-1802/ts.013867 硕士研究生(范文来研究员为通讯作者,E-mail:wenlai.fan@163.com)。 十三五国家重大专项(2016YFD0400500) 2017-01-17,改回日期:2017-02-19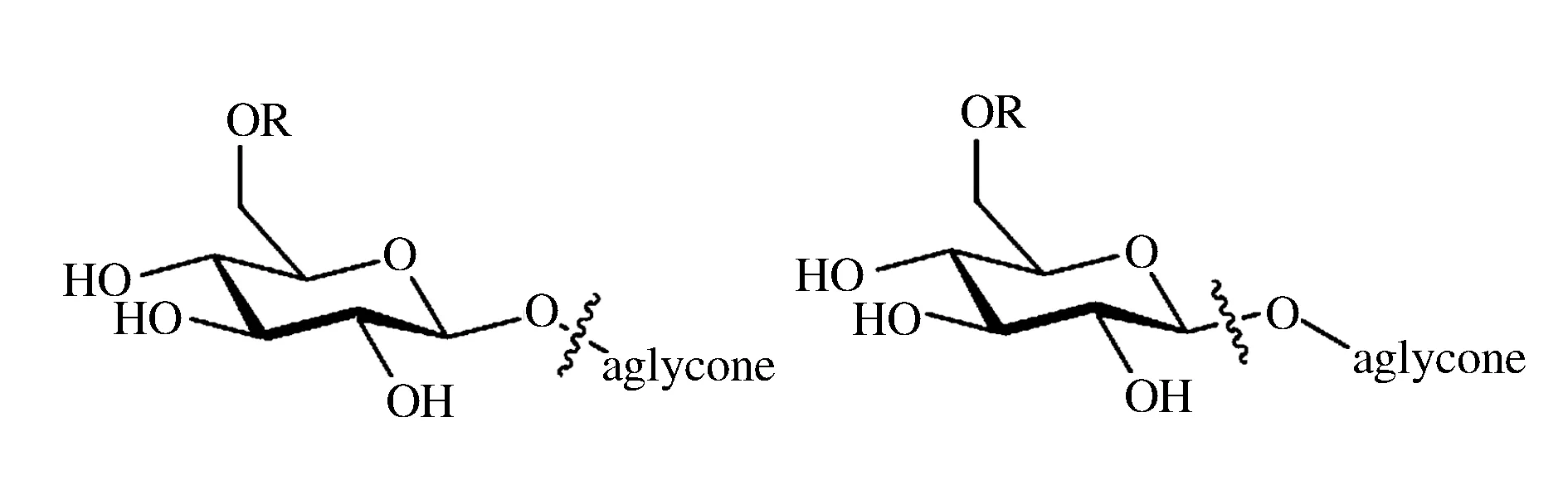
3 结论
