高抗氧化乳酸菌的筛选鉴定
2017-09-22刘珊春赵欣李键张甫生张玉钟金锋索化夷
刘珊春,赵欣,李键,张甫生,张玉,钟金锋,索化夷,2*
1(西南大学 食品科学学院,重庆,400715)2(西南大学,重庆市特色食品工程技术研究中心,重庆,400715) 3(重庆第二师范学院,重庆市功能性食品协同创新中心,重庆,400067) 4(西南民族大学 生命科学与技术学院,四川 成都,610041)
高抗氧化乳酸菌的筛选鉴定
刘珊春1,2,3,赵欣3,李键4,张甫生1,张玉1,钟金锋1,索化夷1,2*
1(西南大学 食品科学学院,重庆,400715)2(西南大学,重庆市特色食品工程技术研究中心,重庆,400715) 3(重庆第二师范学院,重庆市功能性食品协同创新中心,重庆,400067) 4(西南民族大学 生命科学与技术学院,四川 成都,610041)
为了寻找天然的抗氧化剂,对18株乳酸菌的菌体细胞和无细胞提取物的DPPH自由基清除能力、羟自由基的清除能力、超氧阴离子自由基的清除能力、还原能力、抗脂质过氧化能力等5项抗氧化指标进行比较,并对高抗氧化活性的乳酸菌进行抗性筛选,鉴定出符合要求的菌株。结果表明:18株乳酸菌具有不同的抗氧化能力,编号为L4、L5、L8、L14、L18的菌株具有较高的抗氧化活性,其中,菌株L14抗人工胃液和胆盐的能力较强,有作为天然抗氧化剂的应用前景。结合生化特性鉴定和16S rDNA鉴定,确定其为类干酪乳杆菌类干酪亚种(Lactobacillusparacaseisubsp.paracasei)。
乳酸菌;抗氧化活性;抗性;鉴定
机体在新陈代谢过程中会产生羟自由基、超氧阴离子自由基、过氧化氢等多种活性氧[1],自由基的产生和内在抗氧化系统的消减不平衡可能会引起癌症、动脉粥样硬化、肝硬化、关节炎、心血管等多种疾病[2-3]。通过膳食补充抗氧化物质可以增强机体的抗氧化能力,然而许多化学合成的抗氧化物存在安全隐患。
有研究表明,乳酸菌有降胆固醇[4]、抗氧化[5-6]、预防胃溃疡[7]、产胞外多糖[8]、防便秘[9]等多种益生功能,基于此,市场上功能性乳酸菌饮品日益增加。乳酸菌作为益生菌进入机体中发挥益生作用的首要条件是可以在胃液和肠液中存活,因此开发具有高抗氧化活性且抗人体胃肠道消化作用的具有自主知识产权的乳酸菌是非常必要的。本文对18株乳酸菌的抗氧化活性和抗性进行了研究,筛选具有高抗氧化活性且耐人体胃肠道消化的乳酸菌,为探索可作为抗氧化剂的发酵菌株提供参考。
1 材料与方法
1.1材料与试剂
1.1.1 菌株
实验中所用的18株乳酸菌编号为L1~L18,保存在西南大学食品科学学院。
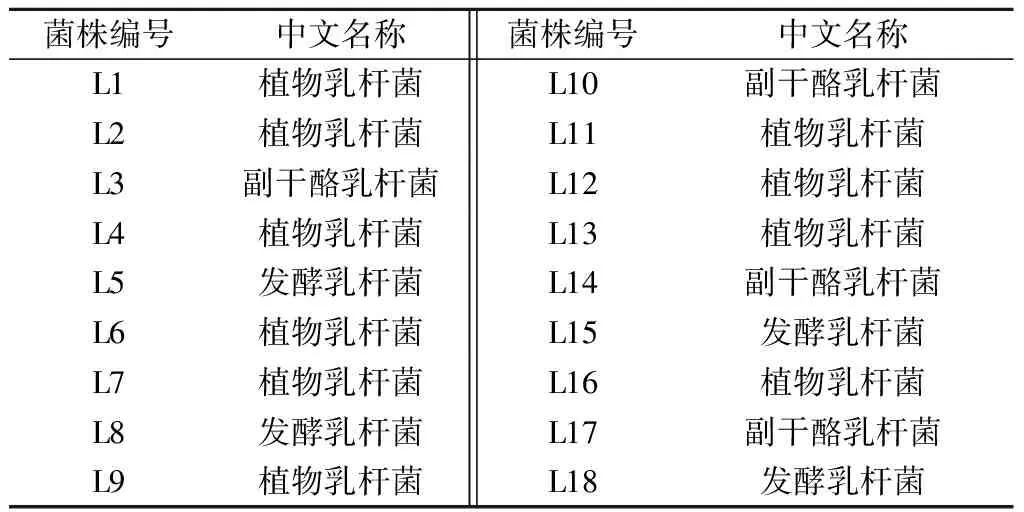
表1 实验所用菌株
1.1.2 试剂
1,1-二苯基-2-三硝基苯肼(DPPH):分析纯,美国Sigma公司;硫代巴比妥酸(TBA)、三氯乙酸(TCA)、30%H2O2、FeSO4·6H2O、FeCl3、邻苯三酚、邻菲罗啉、抗坏血酸:分析纯,上海国药集团;细菌基因组DNA提取试剂盒、DNA Lodaing Buffer、GoldView Ⅰ型核酸染色剂:生化试剂,北京索莱宝科技有限公司;100 bp DNA Ladder、2×Taq PCR Master Mix:生化试剂,天根生化(北京)科技有限公司;引物1495R、27F,上海生工生物工程公司。
1.2仪器与设备
生物显微镜(OLYMPUS-BX43),日本奥林巴斯公司;离心机(5810),德国Eppendorf 公司;梯度 PCR 仪(S1000 Thermal Cycler),美国Bio-Rad 公司;小型水平电泳槽(Mini-Sub Cell GT),美国 Bio-Rad 公司;凝胶成像系统(Gene Genius),Syngene公司;紫外分光光度计(UV-2450S(E)),日本岛津公司;超声波细胞破碎仪(JY92-IIDN),宁波新芝生物科技股份有限公司。
1.3方法
1.3.1 乳酸菌的活化、镜检
将保藏在安瓿管中的菌株在MRS液体培养基中活化,接种于MRS固体培养基中,37 ℃培养48~72 h,观察记录菌落形态并挑取单菌落均匀涂布在载玻片上,进行革兰氏染色、镜检,确定菌株为纯培养。
1.3.2 乳酸菌菌体和胞外提取物的制备
将乳酸菌按1%的接种量接种于MRS液体培养基中,37 ℃培养24 h,4 ℃、4 000 r/min离心15 min,收集菌体,用PBS缓冲液(pH=7.4)洗去培养基,然后重悬于PBS缓冲液中,调整菌体浓度为 1.0×109CFU/mL(OD600=1.0),所得菌悬液分为2组,一组作为菌体组,另一组置于冰浴中超声波破碎15 min(变幅杆:φ6;超声开1 s;超声关2 s;功率33%),4 ℃、10 000 r/min离心15 min,显微镜下检查无完整细胞,收集上清液于无菌离心管中,即为无细胞提取物[10]。
1.3.3 乳酸菌抗氧化活性的检测
1.3.3.1 乳酸菌对DPPH自由基的清除能力的测定
参照文献[11-12]所述方法,VC具有抗氧化功能,VC浓度越高,抗氧化能力越强。以不同质量浓度(0~0.40 mg/mL)的VC溶液为阳性对照,测定其DPPH自由基清除率,将不同菌株组分的DPPH自由基清除率转换为Vc当量。
1.3.3.2 乳酸菌对羟自由基的清除能力的测定
[13-14]所述方法,以VC为阳性对照。
1.3.3.3 乳酸菌对超氧阴离子的清除能力的测定
参考文献[15]所述方法,以VC为阳性对照。
1.3.3.4 乳酸菌的还原力的测定
参考文献[16]所述方法,以VC为阳性对照。
1.3.3.5 乳酸菌抗脂质过氧化能力的测定
参照文献[11]所述方法,以VC为阳性对照。
1.3.4 乳酸菌的抗性筛选
将具有高抗氧化活性的菌株进行耐人工胃液、耐胆盐等筛选试验。
1.3.4.1 菌株的抗酸能力
参照文献[17]所述方法。
1.3.4.2 菌株对胆盐的耐受力
菌株接种于MRS液体培养基中,37 ℃条件下静置培养18 h,再按2%的接种量分别接种于含0、0.1%、0.2%、0.3%、0.5%牛胆盐的MRS-THIO培养基(MRS培养基中添加0.2%巯基乙酸钠),37 ℃静置培养24 h,以未接种的MRS-THIO培养基为对照,分别测定上述不同质量浓度培养基在600 nm下的吸光度,按照公式(1)计算乳酸菌对胆盐的耐受力。
(1)
1.3.5 优良乳酸菌的鉴定
1.3.5.1 优良乳酸菌的形态学观察和生理生化鉴定
将目标菌株接种于MRS培养基中,37 ℃培养18 h。离心得到菌体并用无菌生理盐水洗涤、重悬,制成细胞悬液,进行革兰氏染色、镜检,观察菌体形态。参考梅里埃公司API 50CH说明书和OZGUN等[18]的报道进行操作,并用API lab plus软件对结果进行分析,确定目标菌株的种属。
1.3.5.2 优良乳酸菌的16S rDNA分析和系统发育进化树的建立
挑取目标乳酸菌单菌落接种于MRS液体培养基,37 ℃培养18 h,取培养液按照细菌基因组DNA提取试剂盒的操作说明对菌株进行DNA提取,并储存于-20 ℃备用。PCR所用引物为16S rDNA基因通用引物27F(5’-AGA GTT TGA TCC TGG CTC AG-3’)及1495R(5’-CTA CGG CTA CCT TGT TAC GA-3’)。PCR扩增体系(25 μL):模板DNA 1 μL,引物27F、1495R各1 μL,2×Taq PCR Master Mix 12.5 μL,无菌超纯水9.5 μL。 PCR扩增条件:94 ℃预变性5 min;94 ℃变性1.5 min,55 ℃退火1 min,72 ℃延伸1.5 min,共30个循环;72 ℃延伸10 min。扩增结束后,用1.4%琼脂糖凝胶电泳检测PCR扩增产物,电压80 V,电泳时间60 min,扩增产物送至华大基因测序。测序结果用DNAStar7.1中的SeqMan软件进行序列拼接和校准,然后在GeneBank数据库中进行BLAST(Basic Local Alignment Search Tool)比对分析。从GenBank数据库中调取15株乳酸菌的相同区段基因序列,利用ClustalX1.83软件将测序菌株与标准菌株的16S rDNA基因序列进行多序列匹配比对,使用MEGA5.05软件采用邻接法(Neighbor-Joining)计算,构建乳酸菌的系统发育树,采用自举分析进行置信度检测,自举数据集为1 000次。
1.3.6 数据处理
每个实验重复3次,结果表示为Means±S.D.。采用SPSS软件的ANOVA过程进行方差分析,Duncan确定数据间的差异,差异显著水平为P<0.01。
2 结果与讨论
2.1乳酸菌抗氧化能力比较
2.1.1 乳酸菌对DPPH自由基的清除能力
DPPH自由基是一种以氮为中心、稳定性很好的大分子自由基,可以通过测定乳酸菌菌体细胞和无细胞提取物对该自由基的清除能力表示乳酸菌的抗氧化能力[19],DPPH自由基清除率越高,表明抗氧化能力越强。由表2可知,18株乳酸菌的菌体细胞和无细胞提取物均呈现一定的DPPH自由基清除能力,但清除能力较弱且差异不大,清除范围为4.71%~18.91%。杨静秋[16]对32株浓度为109CFU/mL乳酸菌菌悬液的DPPH自由基清除能力进行测定,发现嗜酸乳杆菌874的清除率最高,为32.92%,其余31株乳酸菌的清除率为3.45%~14.91%。李默[20]对发酵肉制品中30株乳酸菌菌体细胞和胞内提取物的DPPH自由基清除能力进行测定,发现其表现出较弱的清除能力,清除范围为0~34.76%,说明乳酸菌对DPPH自由基的清除能力较弱。本实验18株乳酸菌中,L8、L13和L18菌体细胞的DPPH自由基清除率较强,L9无细胞提取物的DPPH自由基清除率较强,与其余菌株相比差异显著(p<0.01)。
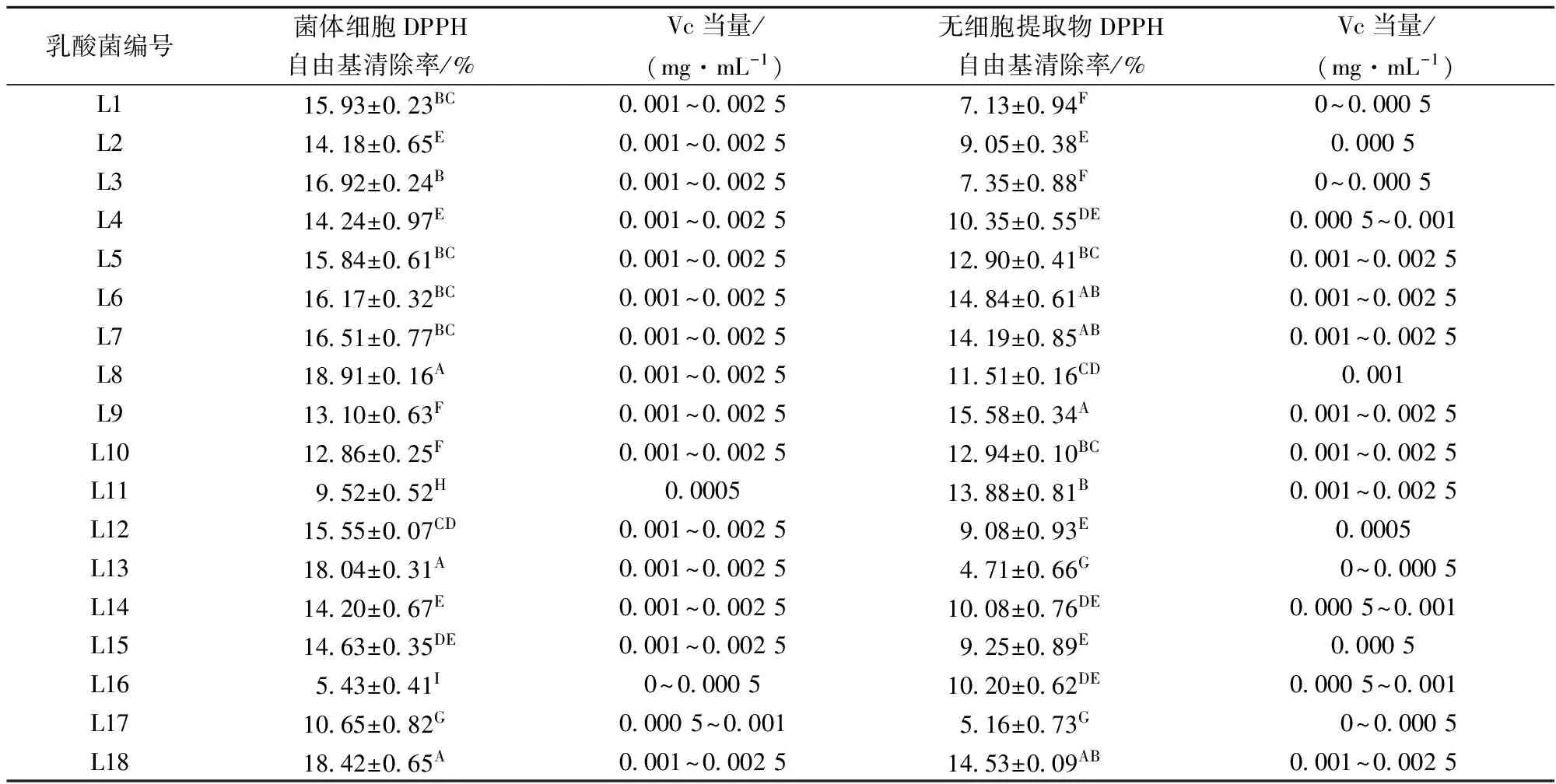
表2 乳酸菌对DPPH自由基的清除率
注:同一列数据后不同大写字母表示差异极显著(p<0.01),下同。
2.1.2 乳酸菌对羟自由基的清除能力
羟自由基是体内的一种氧化性较强的自由基,会对生物大分子造成损伤,因此,对羟自由基的清除能力是反映抗氧化性能的一个重要指标。羟自由基的清除率越高,表明抗氧化能力越强。由表3可知,18株乳酸菌的菌体细胞和无细胞提取物均呈现一定的羟自由基清除能力且差异较大,清除范围为2.32%~34.89%。L4、L9和L15这3株乳酸菌对羟基自由基清除能力较强,其中L4无细胞提取物羟基自由基清除率高达34.89%,相当于0.40mg/mL VC,与其他菌株差异显著(p<0.01)。乳酸菌具有较强的羟自由基清除能力主要是因为乳酸菌细胞内存在螯合Cu2+和Fe2+的天然物质,能够从根本上减少羟自由基。
2.1.3 乳酸菌对超氧阴离子的清除能力
由表4可知,18株乳酸菌的菌体细胞和无细胞提取物均呈现一定的超氧阴离子自由基清除能力,但清除能力较弱且差异不大,清除范围为5.36%~28.78%。L8、L12这2株乳酸菌对超氧阴离子自由基清除能力较强,其中L12的无细胞提取物的超氧阴离子自由基清除率为28.78%,相当于0.20 mg/mL VC,与其他菌株差异显著(p<0.01)。吴祖芳等[21]对20株乳酸菌的超氧阴离子清除能力进行比较,发现菌株H15菌悬液清除率最高,相当于0.095 mg/mL VC,远低于本实验中L8、L12的清除率。
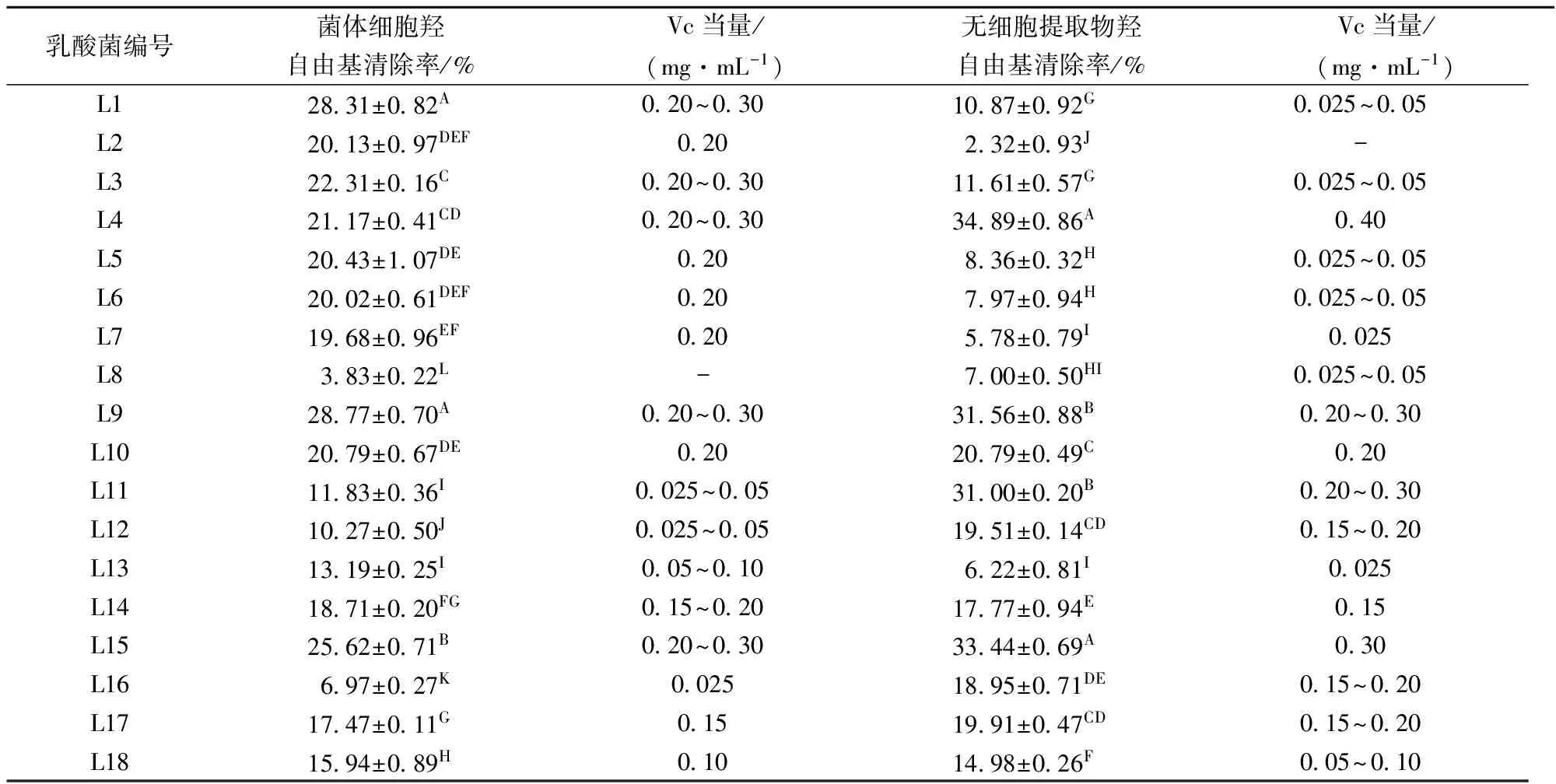
表3 乳酸菌对羟自由基的清除率
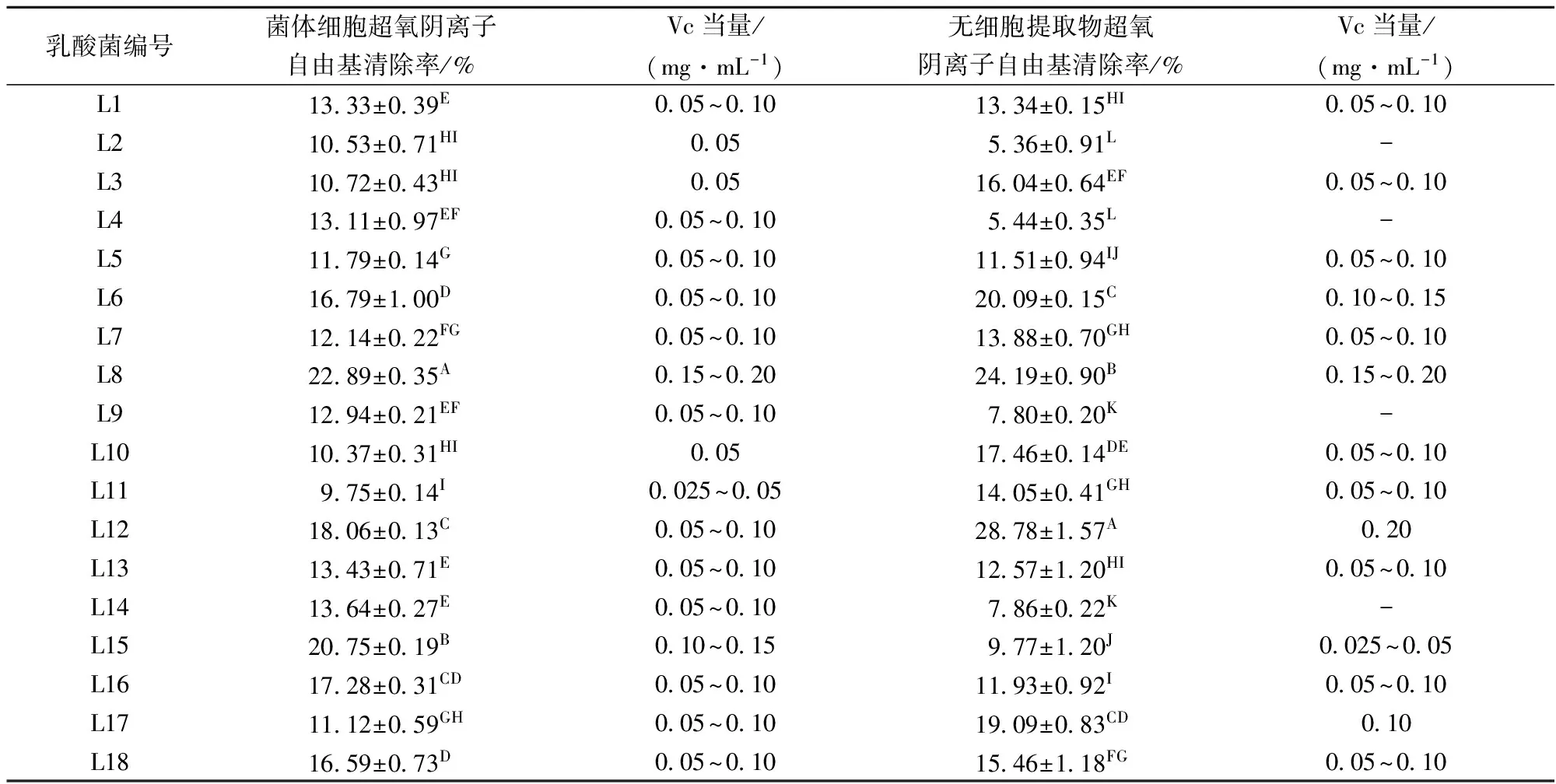
表4 乳酸菌对超氧阴离子自由基的清除率
2.1.4 乳酸菌的还原力
由表5可知,仅有3株乳酸菌的无细胞提取物不具有还原力,其他乳酸菌菌体和无细胞提取物均检测出一定的还原能力,但还原力差异较大。其中L5、L15和L18这3株菌菌体细胞和无细胞提取物的还原力均在20%以上,L5还原能力最强,其菌体细胞和无细胞提取物的还原力分别高达86.18%和89.69%,与其他菌株差异极显著(p<0.01)。
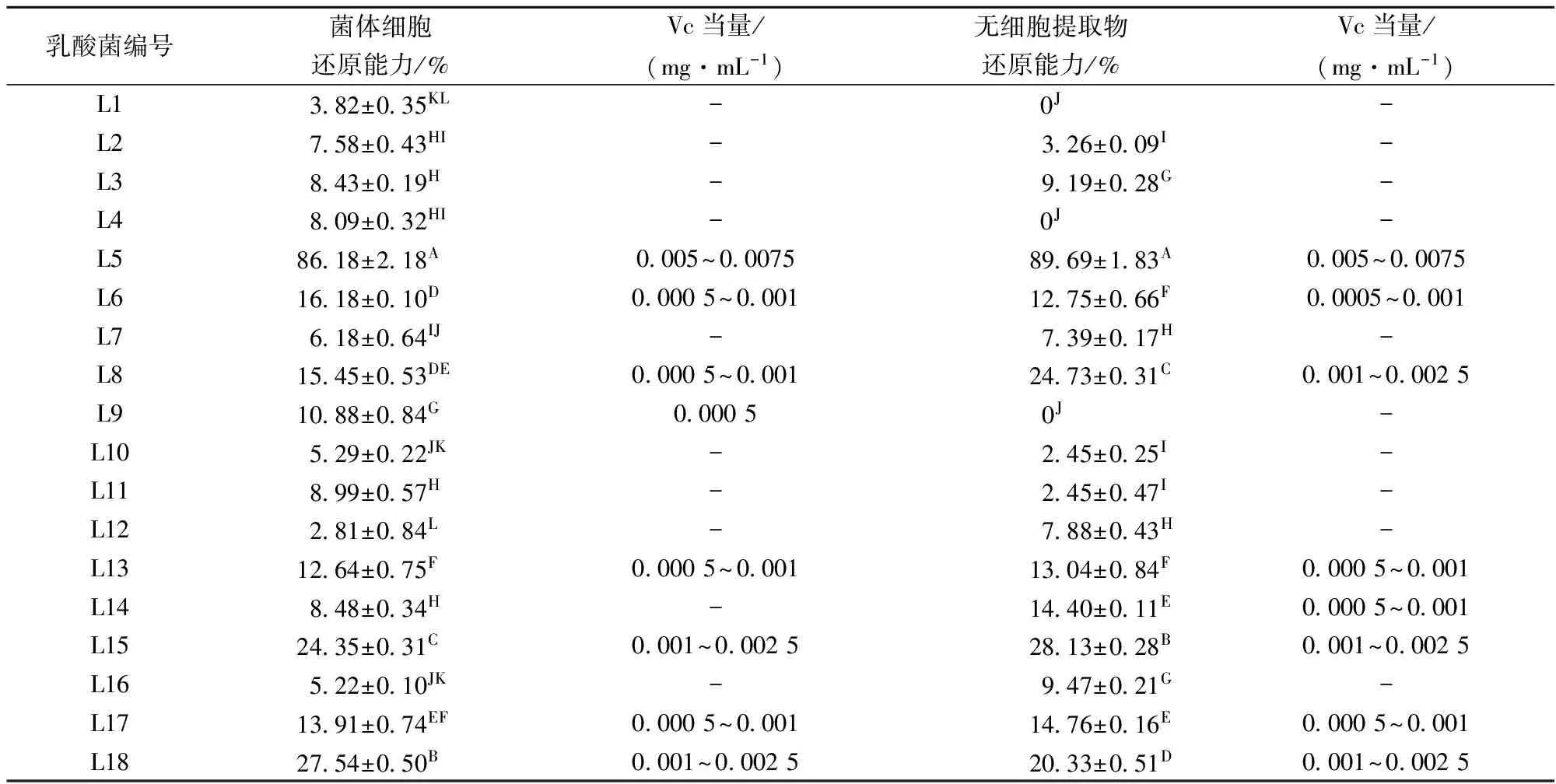
表5 乳酸菌的还原能力
2.1.5 乳酸菌的抗脂质过氧化能力
由表6可知,18株乳酸菌的菌体细胞和无细胞提取物均表现出一定的抗脂质过氧化能力,且差异较大。清除范围为0~62.48%。与黄玉军[11]等的实验结果相比,本实验中除L11外,其余17株乳酸菌抗脂质过氧化能力均优于黄玉军研究的6株人源乳酸菌。
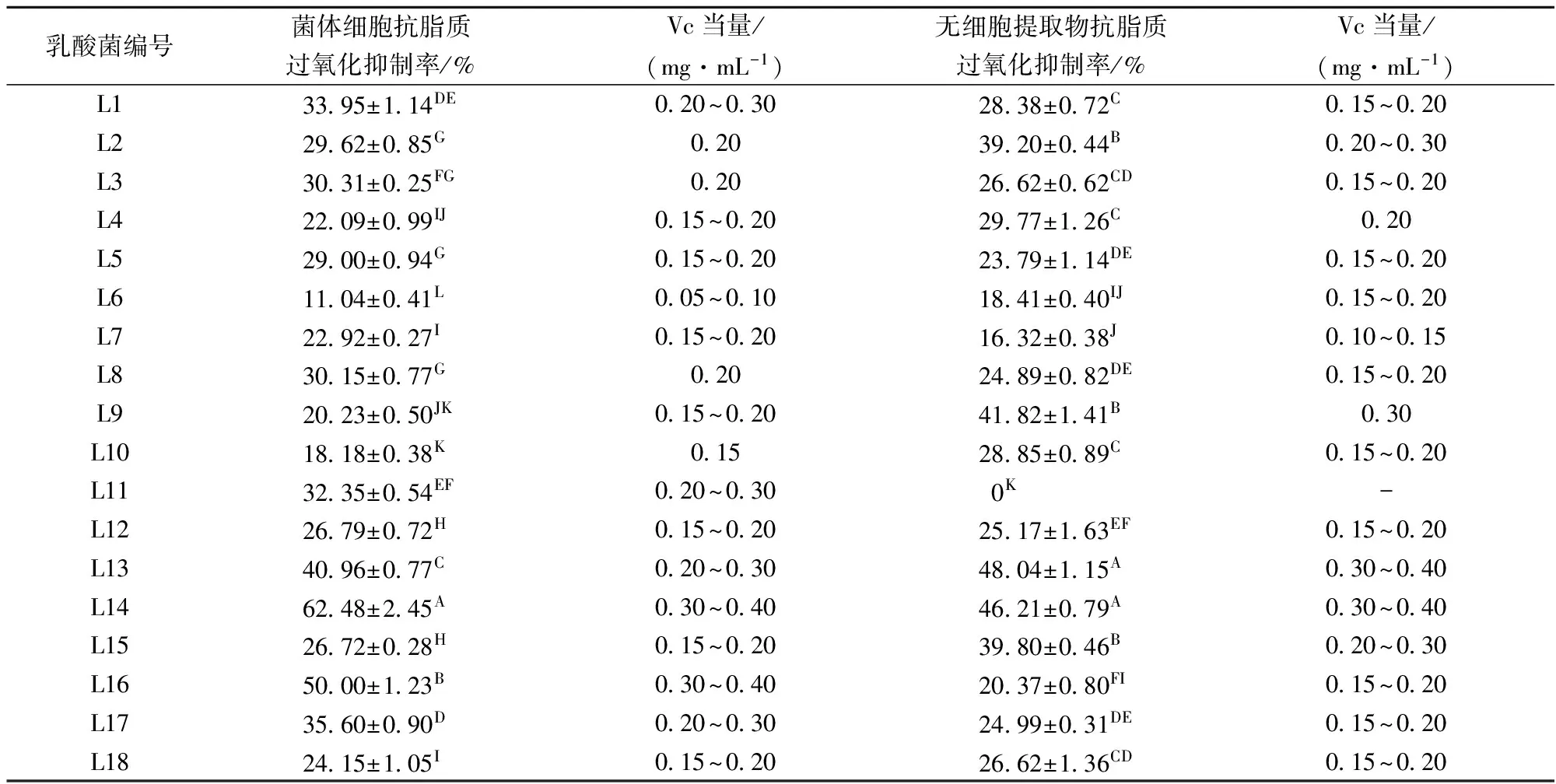
表6 乳酸菌对抗脂质过氧化的抑制率
王悦齐等[22]对自腌干鱼中分离得到的7株乳酸菌抗氧化能力进行测定,发现在菌体浓度为109CFU/mL时,菌体细胞液的抗脂质过氧化率为2.61%~7.56%,胞内提取物的抗脂质过氧化率为2.38%~13.06%。刘洋等[23]对4种乳酸菌体外抗氧化能力的比较研究,浓度为109CFU/mL的胞内提取物的抗脂质过氧化率为8.33%~17.16%。本实验中,L13、L14抗脂质过氧化能力较强,其中L14菌体细胞对脂质过氧化抑制率为62.48%,均相当于0.30~0.40 mg/mL VC,与其他菌株差异极显著(p<0.01),且远高于王悦齐、刘洋等的研究。
实验中对18株乳酸菌的不同组分的抗氧化活性进行了研究,发现其抗氧化能力不同且差异显著,L4、L5、L8、L14、L18分别在清除羟自由基、还原能力、清除超氧阴离子自由基、抗脂质过氧化和清除DPPH自由基等方面能力突出,如L5菌体细胞和无细胞提取物的还原能力分别高达86.18%和89.69%;L14菌体细胞和无细胞提取物的抗脂质过氧化能力分别高达62.48%和46.21%。故将其作为抗氧化能力较强的乳酸菌在模拟胃肠道环境中进行复筛。
2.2乳酸菌的抗性能力
2.2.1 乳酸菌的抗酸能力
乳酸菌发挥益生作用的前提是以活菌状态通过人体胃肠道,食物在胃中的消化时间一般为1~2 h,人体胃液的pH值处于不断变化的过程中,通常维持在3.0左右。胃液的酸性环境能够激活胃蛋白酶原,进而杀死随食物一起进入胃的微生物,对乳酸菌也有一定威胁。因此,乳酸菌要在人体内发挥益生功效,必须对胃酸和胃蛋白酶有一定的抗性。实验中将筛选得到的5株抗氧化能力较强的乳酸菌在pH=3.0的人工胃液中进行复筛实验,结果如表7所示,存活率在30%以上的有2株,其中L14达94.98%,与其它菌株差异极显著(p<0.01)。刘宏宇等[24]对10株乳酸菌的耐酸性进行研究,发现其在pH=3.0的人工胃液中保持2 h后存活率差异很大,3株存活率在50%以上,其余菌株基本不能存活。
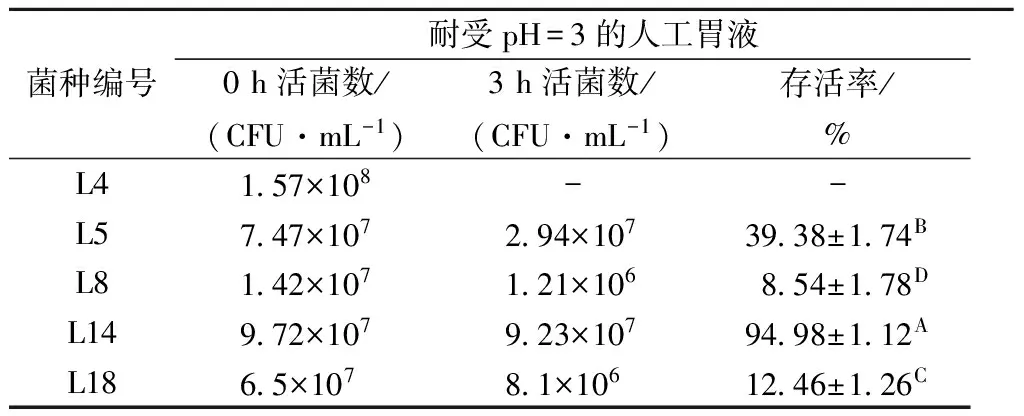
表7 乳酸菌在人工胃液中的存活率
2.2.2 乳酸菌在胆盐中的耐受力
胆盐是肝细胞分泌的胆汁酸和牛磺酸或甘氨酸结合得到的钠盐或钾盐,人体小肠中胆盐质量分数一般维持在0.03%~0.3%,胆盐能够改变菌体细胞膜的通透性,从而抑制、杀灭乳酸菌。因此,乳酸菌要在人体内发挥益生功效,除在胃液中有较高的存活率,还必须对胆盐有一定的耐受力。实验中将5株乳酸菌在质量分数分别为0.1%、0.2%、0.3%和0.5%的胆盐溶液中进行复筛实验,由表8可知,随着胆盐质量分数的增大,菌株的耐受力逐渐降低,5株乳酸菌对0.5%胆盐溶液耐受力较差。刘宏宇[24]分析10株乳酸菌对0.5%高胆盐环境的耐受力,发现大部分乳酸菌对胆盐耐受力不强,与本实验研究结果相似。5株乳酸菌中,L4和L14对胆盐耐受力较强,在0.1%和0.2%胆盐溶液中均能够存活,在0.1%胆盐溶液中耐受力分别为36.09%和15.44%。
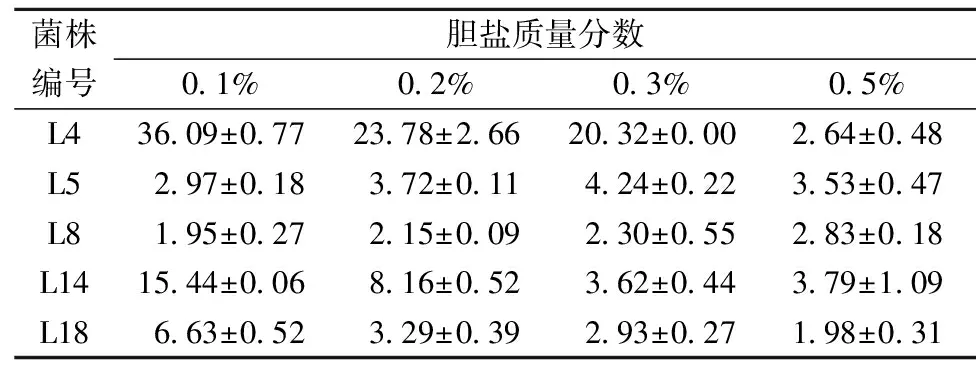
表8 乳酸菌在不同含量胆盐中的耐受力
综合乳酸菌的抗氧化活性和抗性能力,发现L14抗氧化活性较高,在人工胃液中存活率较高且在胆盐中能够存活,确定L14为目标菌株。
2.3优良乳酸菌的鉴定
2.3.1 优良乳酸菌的生化特性鉴定结果
经显微镜观察,菌株L14为杆状,革兰氏染色呈阳性。其生化特性鉴定结果如表9所示。应用梅里埃公司API lab plus软件对结果进行分析,鉴定L14为Lactobacillusparacaseisubsp.paracasei,其ID值为99.6%,T值为0.76,是很好的鉴定结果。
2.3.2 优良乳酸菌的16S rDNA分析和系统发育进化树的建立
L14的16S rDNA序列PCR扩增产物经琼脂糖凝胶电泳检测后,结果如图2所示。阴性对照无条带,说明扩增未出现污染;第3泳道大约1 500 bp的位置有特异性扩增片段,符合预期扩增片段长度。通过16S rDNA序列比对分析,发现L14与GeneBank数据库中已知乳酸菌具有高达100%的同源性。将菌株L14与GenBank中15株乳酸菌一起构建系统发育进化树,结果如图3所示,菌株L14与副干酪乳杆菌亲缘关系最近。
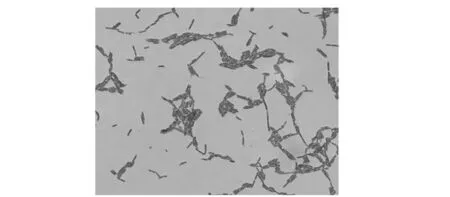
图1 L14革兰氏染色镜检图(1 000×)Fig.1 Gram staining results of L14 (1 000×)
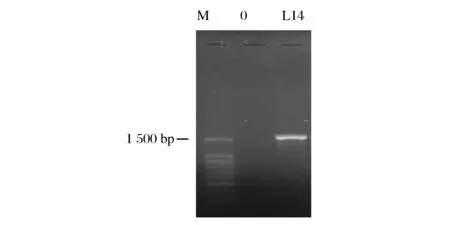
M-100bp DNA Ladder;0-阴性对照;L14-L14的16S rDNA PCR产物图2 L14的16S rDNA基因的PCR扩增产物电泳图Fig.2 Agarose gel electrophoresis of PCR amplification of L14 16S rDNA gene
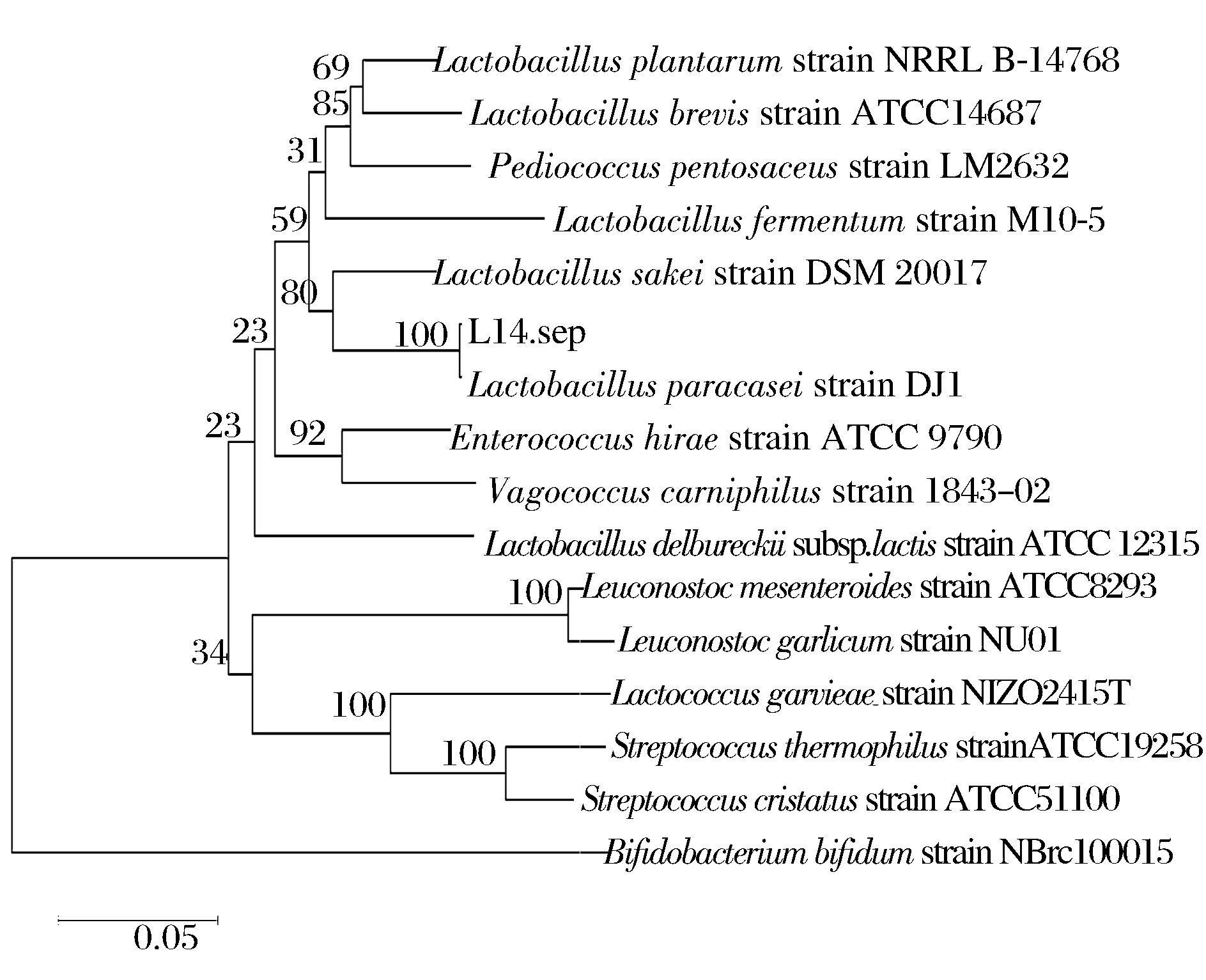
图3 菌株L14 16S rDNA序列系统发育进化树Fig.3 Phylogenetic tree based on 16S rDNA sequences of L14

管号碳水化合物反应结果管号碳水化合物反应结果0空白-25七叶灵柠檬酸铁+1甘油-26水杨苷+2赤藻糖醇-27D⁃纤维二糖+3D⁃阿拉伯糖-28D⁃麦芽糖-4L⁃阿拉伯糖-29D⁃乳糖-5D⁃核糖+30D⁃蜜二糖-6D⁃木糖-31D⁃蔗糖+7L⁃木糖-32D⁃海藻糖+8D⁃侧金盏花醇1-33菊粉-9甲基⁃βD吡喃木糖苷-34D⁃松三糖-10D⁃半乳糖+35D⁃棉子糖-11D⁃葡萄糖+36淀粉-12D⁃果糖+37糖原-13D⁃甘露糖+38木糖醇-14L⁃山梨糖-39D⁃龙胆二糖+15L⁃鼠李糖-40D⁃土伦糖+16卫茅醇-41D⁃来苏糖-17肌醇-42D⁃塔格糖+18甘露醇+43D⁃岩藻糖-19山梨醇-44L⁃岩藻糖-20甲基⁃α⁃D⁃吡喃甘露糖苷-45D⁃阿拉伯醇-21甲基⁃αD⁃吡喃葡萄糖苷-46L⁃阿拉伯醇-22N⁃乙酰葡萄糖胺+47葡萄糖酸钾+23苦杏仁苷+482⁃酮基葡萄糖酸钾-24ARBULIN+495⁃酮基葡萄糖酸钾-
注:“+”为反应阳性(七叶灵柠檬酸铁反应杯为黑色,其他为黄色);“-”为反应阴性(反应实验杯为蓝紫色)
3 结论与展望
通过对18株乳酸菌的不同组分的抗氧化活性进行了研究,发现其抗氧化能力不同且差异显著,其中菌株L4、L5、L8、L14、L18抗氧化能力较强,在菌体浓度为109CFU/mL时,L5菌体细胞和无细胞提取物的还原能力分别高达86.18%和89.69%;L14菌体细胞和无细胞提取物的抗脂质过氧化能力分别高达62.48%和46.21%。
结合抗胃酸和抗胆盐能力最终筛选得到1株具有高抗氧化能力和抗性能力菌株L14,经鉴定,其为Lactobacillusparacaseisubsp.paracasei,在今后的研究中,可对其抗氧化成分进行分析,并在此基础上,采用细胞模型或动物模型对其作为抗氧化剂的抗氧化功能进行评价。
参考文献
[1] LIN M, YEN C.Antioxidative ability of lactic acid bacteria[J].Journal of Agricultural & Food Chemistry,1999,47(4):1 460-1 466.
[2] 张江巍,曹郁生.乳酸菌抗氧化活性的研究进展[J].中国乳品工业,2005,33(1):34-37.
[3] 顾品品,邢家溧,王刚,等.几种体外评价乳酸菌无细胞提取物抗氧化活性方法的比较研究[J].食品工业科技, 2015,36(23):84-88.
[4] 石超.传统发酵牦牛酸奶中降胆固醇乳酸菌的筛选及其对高脂模型大鼠的益生作用[D].兰州:兰州大学,2014.
[5] KAIZU H,SASAKI M,NAKAJIMA H,et al.Effect of antioxidative lactic acid bacteria on rats fed a diet deficient in vitamin E[J]. Journal of Dairy Science,1993,76(9):2493-2499.
[6] ZHAO Dan-yue,SHAH N.Lactic acid bacterial fermentation modified phenolic composition in tea extracts and enhanced their antioxidant activity and cellular uptake of phenolic compounds followinginvitro,digestion[J].Journal of Functional Foods,2016, 20:182-194.
[7] 赵欣,骞宇.牦牛酸乳分离发酵乳杆菌发酵豆浆的胃溃疡预防效果研究[J].食品科学,2014,35(17):236-240.
[8] 唐超群.青海部分牧区牦牛乳制品中产胞外多糖乳酸菌的分离鉴定及特性研究[D].西宁:青海大学,2016.
[9] 邹华军,张其圣,石磊,等.直投式乳酸菌剂对便秘模型小鼠肠道功能的影响[J].食品与发酵科技,2013(5):26-29.
[10] LI Sheng-yu,ZHAO Yu-juan,ZHANG Li,et al.Antioxidant activity ofLactobacillusplantarumstrains isolated from traditional Chinese fermented foods[J].Food Chemistry,2012,135(3):1 914-1 919.
[11] 黄玉军,刘冬,赵兰凤,等. 6株人源乳酸菌体外抗氧化活性的比较[J].现代食品科技,2013(7):1 518-1 522.
[12] HE Zhong-mei,WANG Xiao-hui,LI Guo-feng,et al.Antioxidant activity of prebiotic ginseng polysaccharides combined with potential probioticLactobacillusplantarumC88[J].International Journal of Food Science & Technology,2015,50(7):1 673-1 682.
[13] 张书文.抗氧化乳酸菌的筛选及其特性研究[D].呼和浩特:内蒙古农业大学,2009.
[14] ZHANG Shu-wen,LIU Lu,SU Yan-ling,et al.Antioxidative activity of lactic acid bacteria in yogurt[J].African Journal of Microbiology Research,2011,5(29):5 194-5 201.
[15] 张江巍,曹郁生,李海星,等.乳酸菌抗氧化活性及检测方法[J].中国乳品工业,2005,33(9):53-56.
[16] 杨静秋.抗氧化乳酸菌的筛选及其对氧化损伤的CT-26细胞的保护作用[D].无锡:江南大学,2009.
[17] 陈孝勇,李键,赵欣,等.传统发酵牦牛酸乳中益生性乳酸菌的体外筛选[J].食品与发酵工业,2016,42(4):85-90.
[18] OZGUN D,VURAL H.Identification ofLactobacillusstrains isolated from faecal specimens of babies and human milk colostrum by API 50 CHL system[J].Journal of Medical Genetics & Genomics,2011.
[19] LIN M,CHANG F.Antioxidative effect of intestinal bacteriaBifidobacteriumlongumATCC 15708 andLactobacillusacidophilusATCC 4356[J].Digestive Diseases and Sciences,2000,45(8):1 617-1 622.
[20] 李默.发酵肉制品中抗氧化乳酸菌的筛选及鉴定[D].吉林:吉林农业大学,2016.
[21] 吴祖芳,洪松虎,沈锡权,等.乳酸菌高抗氧化活性菌株的筛选及鉴定[J].中国食品学报,2010,10(1):73-78.
[22] 王悦齐,李来好,蔡秋杏,等.分离自腌干鱼的抗氧化发酵菌株的筛选及鉴定[J].南方水产科学,2016,12(3):74-83.
[23] 刘洋,郭宇星,潘道东.4种乳酸菌体外抗氧化能力的比较研究[J].食品科学,2012,33(11):25-29.
[24] 刘宏宇,汪立平,艾连中,等.乳酸菌的抗氧化活性和耐酸耐胆盐性能的研究[J].食品工业科技,2014,35(2):92-96.
Screeningandidentificationofhighantioxidantlacticacidbacteria
LIU Shan-chun1,2,3,ZHAO Xin3, LI Jian4,ZHANG Fu-sheng1,ZHANG Yu1,ZHONG Jin-feng1,SOU Hua-yi1,2*
1(College of Food Science, Southwest University, Chongqing 400715, China) 2(Chongqing Engineering Research Center of Regional Food, Chongqing 400715, China) 3(Chongqing Collaborative Innovation Center for Functional Food, Chongqing University of Education, Chongqing 400067, China) 4(College of Life Science and Technology, Southwest University for Nationalities, Chengdu 610041, China)
In order to obtain the natural antioxidant, intact cells and cell-free extracts of 18 lactic acid bacteria were evaluated based on their DPPH free radical scavenging ability, hydroxyl radical scavenging ability, superoxide anion radical scavenging ability, reducing capacity and inhibitory rate of lipid peroxidation. And the strains with high antioxidant activity were screened through resistance selection to obtain strains meet the requirements. The results showed that the 18 strains of lactic acid bacteria had different antioxidant capacities, and the strains L4, L5, L8, L14 and L18 had higher antioxidant activity. Among them, strain L14 had better tolerance for gastric acid and bile salts, which would have an application prospect as a natural antioxidant in the future. Strain L14 was identified asLactobacillusparacaseisubsp.paracaseiby biochemical characterization and 16S rDNA identification.
lactic acid bacteria;antioxidant activity;resistance;identification
10.13995/j.cnki.11-1802/ts.013844
硕士研究生(索化夷副教授为通讯作者,E-mail:birget@swu.edu.cn)。
国家公益性行业(农业)科研专项(201303085);重庆市社会民生科技创新专项(cstc2015shmszx80021);中央高校基本业务费项目(xdjk2016A018);重庆市特色食品工程技术研究中心能力提升项目(cstc2014ptgc8001);重庆市功能性食品协同创新中心建设项目(167001)
2017-01-15,改回日期:2017-04-23
