重组人胰岛素样生长因子-1对坐骨神经损伤的修复作用
2017-09-22黄慧慧俞昌喜
黄慧慧, 杨 渐, 俞昌喜
重组人胰岛素样生长因子-1对坐骨神经损伤的修复作用
黄慧慧, 杨 渐, 俞昌喜
目的在大鼠坐骨神经钳夹损伤模型上,探讨重组人胰岛素样生长因子-1(hIGF-1)融合蛋白的治疗作用。方法40只Wistar大鼠随机分为假手术组、模型组及hIGF-1融合蛋白高(0.02 mg)、低(0.002 mg)剂量处理组,建立大鼠坐骨神经钳夹损伤模型;以大鼠行为学、坐骨神经功能指数(SFI)、坐骨神经-腓肠肌诱发电位、组织形态学变化为指标,综合考察hIGF-1融合蛋白对损伤坐骨神经的影响。结果术后20~32 d,各测定时间点hIGF-1融合蛋白高、低剂量组大鼠SFI值及SFI恢复率显著高于模型组(P<0.05),作用呈剂量依赖性。术后35 d,hIGF-1融合蛋白高、低剂量组大鼠坐骨神经-腓肠肌诱发电位振幅显著高于模型组(P<0.01),作用随剂量增大而增强。H-E染色显示,hIGF-1融合蛋白高、低剂量组大鼠坐骨神经损伤区再生神经排列较模型组规则,有髓神经纤维增多,髓鞘较厚且完整。结论重组hIGF-1融合蛋白能促进大鼠坐骨神经损伤的修复。
胰岛素样生长因子-1; 坐骨神经; 坐骨神经病; 大鼠
人胰岛素样生长因子-1(human insulin-like growth factor-1,hIGF-1)在神经细胞分化、物质代谢、个体生长发育中起着极为重要的作用,其异常与糖尿病、胰岛素抵抗、骨骼发育不良、肾功能衰竭等多种疾病密切相关[1-5]。其中,周围神经损伤发生率高,治疗困难,是当今医疗面临的难题之一。然而,在周围神经损伤时内源性的hIGF-1已不能满足神经功能恢复的需要,补充外源性hIGF-1对其可能具有治疗作用,具有开发利用价值。课题组前期通过基因重组技术在大肠杆菌表达并已以钴金属螯和亲和层析技术分离纯化获得较高纯度重组hIGF-1融合蛋白[6],为考察其药理活性,选用大鼠坐骨神经钳夹损伤模型,探讨其对坐骨神经损伤后神经再生与功能修复的影响。
1 材料与方法
1.1 材料
1.1.1 动物 雄性Wistar大鼠40只,体质量200~250 g,清洁级[上海斯莱克实验动物有限责任公司,许可证号:SCXK(沪)2007-0005]。动物均在光暗周期12/12 h、温度21~25 ℃、湿度45%~55%的环境饲养,自由饮水进食。所有针对大鼠的实验操作均遵守国际及本地实验动物使用和保护委员会颁布的条例。
1.1.2 试剂 hIGF-1融合蛋白干粉由福建医科大学药学院神经药理课题组提供,纯度约95%,用生理盐水配制成所需浓度溶液;水合氯醛(天津科密欧化学试剂有限公司);青霉素钠粉针剂(华北制药股份有限公司);其余试剂为国产分析纯。
1.1.3 仪器 多道生理信号采集处理系统(RM6240B,成都仪器厂);全自动显微照相装置(日本奥林巴斯公司);组织包埋机(日本樱花检验仪器株式会社);石蜡切片机(德国莱卡公司);自动组织脱水机(德国莱卡公司);推片烤片机(宏业医用仪器公司)。
1.2 方法
1.2.1 大鼠坐骨神经钳夹损伤模型 参照文献[7]的方法,将大鼠用10%水合氯醛腹腔注射麻醉,取俯卧位,无菌条件下沿股骨走向切开右下肢臀大肌,暴露坐骨神经干,在距梨状肌下缘约8 mm处用特制无齿血管钳末端钳夹坐骨神经干1 min,造成宽度约3 mm的损伤区,5-0丝线标记后缝合。术后腹腔注射青霉素10万U预防感染,每天1次,持续3 d。
1.2.2 坐骨神经功能指数(sciatic functional index,SFI)测定 参照文献[8-9],建模后4 d行足迹实验。在足迹行走箱底垫入与箱底等大白纸,将大鼠双后足浸入黑色碳素墨水染色后由行走箱右侧面放入(图1),大鼠自行走向暗室端并由另一端开口走出,记录3~4个清晰的足印,晾干测量。正常侧记为N(Normal),手术侧记为E(Experimental),测定以下3个指标:(1)足印长度(print length,PL):从足跟到足尖的最长距离;(2)足趾宽度(toe spread,TS):第1趾到第5趾连线距离;(3)中间足趾距离(intermediary toe-spread,IT):第2趾到第4趾连线距离。每次测量取最大一组数据,精确到mm。根据Bain公式计算SFI值[8]:

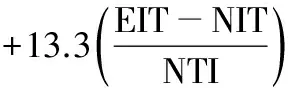
正常时SFI=0,坐骨神经完全离断时SFI=-100。同时计算SFI恢复率。
图1 大鼠足迹行走箱Fig 1 Diagram of footprints collection box
1.2.3 坐骨神经-腓肠肌诱发电位测定 采用1.2.1方法暴露坐骨神经,将作为刺激电极(双极钩保护电极)刺入坐骨神经干上距梨状肌下缘约5 mm处,记录电极(同芯针电极)则插入腓肠肌中,给予电压2 V、波宽2 ms的单个方波脉冲刺激,记录其波形,并计算振幅;钳夹损伤术前测1次,术后再次测定,二者比较,验证钳夹损伤对坐骨神经动作电位传导功能的影响。
1.2.4 组织形态学观察 电位测定完毕迅速切下包括钳夹伤部位在内的上下各5 mm坐骨神经干,随即浸入10%甲醛过夜固定,经酒精梯度脱水后,石蜡包埋,4 μm切片,苏木精-伊红(H-E)染色,显微镜下观察形态。
1.2.5 实验设计 大鼠随机分为假手术组、模型组、hIGF-1融合蛋白高剂量(0.1 mg/mL)处理组和低剂量(0.01 mg/mL)处理组,每组10只。行坐骨神经钳夹损伤术。假手术组暴露坐骨神经干后,只打一个松结,不钳夹。模型组与hIGF-1高、低剂量处理组建模方法同前。取一大小为0.5 cm×0.5 cm的无菌吸收性明胶海绵,轻轻压扁后用1 mL注射器小心注入液体0.2 mL使其蘸满(假手术组、模型组给予生理盐水,hIGF-1高、低剂量组分别为0.1 mg/mL与0.01 mg/mL浓度的hIGF-1融合蛋白溶液),覆盖于损伤处或标记线结表面,如前缝合并给予青霉素预防感染;各组大鼠于术后4,8,12,16,20,24,28,32 d分别测定SFI;术后35 d,10%水合氯醛麻醉大鼠,同1.2.3法给予电刺激并记录坐骨神经-腓肠肌诱发电位的波形,计算振幅;电位记录完毕,快速切下线结标记上下各0.5 cm段坐骨神经干,剪去线结,随即泡入10%福尔马林固定备用,行H-E染色。
2 结 果
2.1 大鼠行为学观察 术后2 d,各组大鼠术肢均有不同程度的足趾红肿、下垂、无法伸展症状。其中假手术组大鼠行走时术肢以足底着地,呈跛行步态;模型组及hIGF-1融合蛋白高、低剂量处理组则以足背部着地呈拖曳步态;术后4 d,模型组及hIGF-1融合蛋白高、低剂量处理组大鼠行走时术肢可以足底及膝关节着地,呈趾屈曲跛行步态,各组无明显差别;术后21 d,假手术组大鼠行走步态基本正常,活动灵活,hIGF-1融合蛋白高、低剂量处理组次之,模型组最差;各组大鼠无死亡,伤口无感染,愈合良好。
2.2 hIGF-1融合蛋白对钳夹损伤大鼠SFI的影响 各组大鼠SFI值及其随时间变化情况见图2。术后4~32 d各个测定时间点模型组大鼠SFI值与假手术组比较,差别均有统计学意义(P<0.05);术后20 d开始,hIGF-1融合蛋白高剂量组、低剂量组SFI值较模型组显著增高(P<0.05),作用随剂量增大而增强,持续12 d。SFI恢复率结果显示,术后4~32 d各测定时间点模型组大鼠SFI恢复率显著低于假手术组(P<0.05);术后20~32 d,hIGF-1融合蛋白高、低剂量组大鼠SFI恢复率较模型组显著增高(P<0.05),作用随剂量增大而增强(表1)。
2.3 hIGF-1融合蛋白对钳夹损伤大鼠坐骨神经-腓肠肌诱发电位的影响 术后35 d,再次测定各组大鼠坐骨神经-腓肠肌诱发电位,记录波形(图3)。假手术组波形与术前较为相似,提示与正常时接近;而模型组波形不规则,振幅小,时限宽;hIGF-1融合蛋白高、低剂量组的波形则较为规则,振幅较大。经计算分析,模型组大鼠坐骨神经-腓肠肌诱发的动作电位振幅降低,与假手术组比较,差别具有统计学意义(P<0.01);hIGF-1融合蛋白高、低剂量组动作电位振幅较模型组显著增高(P<0.01)(图4)。
2.4 hIGF-1融合蛋白对钳夹损伤大鼠坐骨神经形态的影响 H-E染色形态学观察显示,假手术组大鼠坐骨神经损伤区神经纤维排列整齐,髓鞘完整,密度高,与正常神经纤维无明显区别(图5)。模型组再生神经纤维较细,数目少,排列紊乱、不规则,髓鞘较薄,部分神经纤维未见髓鞘和轴突。hIGF-1融合蛋白高、低剂量组损伤区镜下表现相似,横切面染色结果显示,轴突髓鞘较完整,低剂量组的神经纤维相对高剂量组松散;纵切面可见神经纤维排列较为整齐,施旺细胞较多,部分已连成有序的条索状。
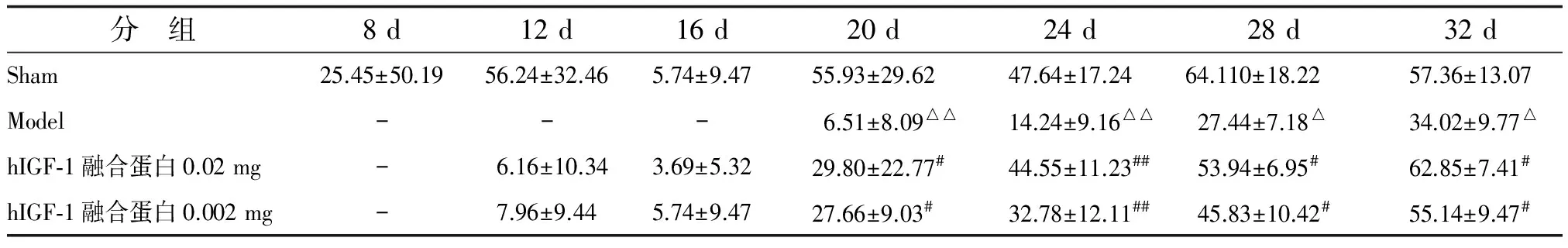
表1 术后不同时间各组大鼠SFI恢复率
n=10. Sham:假手术; Model:模型; hIGF-1:重组人胰岛素样生长因子-1; SFI:坐骨神经功能指数. “-”:SFI恢复率为负值. 与假手术组比较,△:P<0.05,△△:P<0.01; 与模型组比较,#:P<0.05,##:P<0.01.
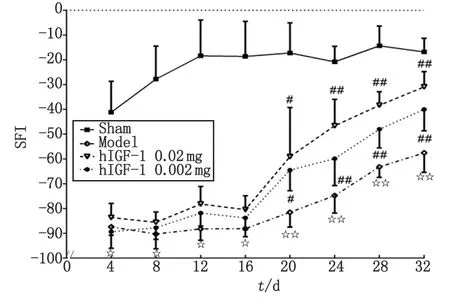
n=10. SFI:坐骨神经功能指数. Sham:假手术; Model:模型; hIGF-1:重组人胰岛素样生长因子-1. 与假手术组比较,☆:P<0.05, ☆☆:P<0.01; 与模型组比较,#:P<0.05, ##:P<0.01.图2 hIGF-1融合蛋白对钳夹损伤大鼠坐骨神经功能指数的影响Fig 2 Effect of hIGF-1 fusion protein on SFI in rats with sciatic nerve crush injured
3 讨 论
周围神经损伤后,轴突再生的数目与质量决定了神经功能的恢复情况[10]。研究指出,IGF-1具有促进施旺细胞增殖和存活,抑制其凋亡,促进神经损伤后轴突再生和髓鞘化,参与神经元的保护、损伤后突触的重构以及抑制神经肌肉萎缩等作用[11-12],表明神经营养因子IGF-1既能有效促进神经损伤的修复与生长又能保证再生神经纤维的功能。因此,笔者通过探讨采用基因重组技术获得的高纯度hIGF-1融合蛋白对周围神经损伤的治疗作用,为其可能研制成治疗周围神经损伤的新药奠定基础。
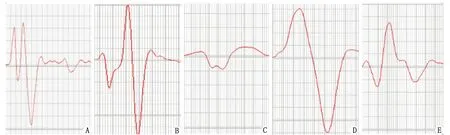
A:术前; B:Sham; C:Model; D:hIGF-1 0.02 mg; E:hIGF-1 0.002 mg. Sham:假手术;Model:模型;hIGF-1:重组人胰岛素样生长因子-1.图3 各组大鼠坐骨神经-腓肠肌诱发电位波形Fig 3 The waveforms of sciatic nerve evoked potential
大鼠坐骨神经钳夹损伤模型广泛用于周围神经再生与修复的实验研究,也称作轴索断伤,其为非离断性损伤,操作简单易行,损伤程度易把握,重复性好,个体差异小,恢复快,建模后数天即可进行神经行为学指数测定[13]。神经再生室在临床上被广泛用于修复周围神经损伤,其能促进内源性或外源性的神经营养物质在局部蓄积,从而发挥神经修复作用。建立坐骨神经钳夹损伤模型时,由于钳夹伤后神经外膜的连续性并未离断,因此笔者认为在神经修复时局部能模拟形成神经再生室结构,hIGF-1融合蛋白能够通过吸收性明胶海绵的弥散作用透过被膜渗入其内,在损伤组织产生浓聚作用,类似临床上神经再生室局部给药。
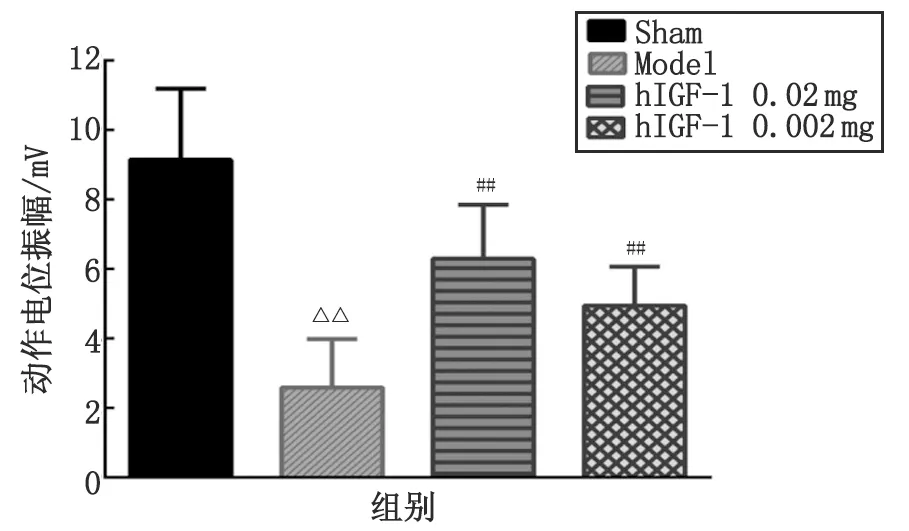
n=10. Sham:假手术;Model:模型;hIGF-1:重组人胰岛素样生长因子-1.与假手术组比较, △△:P<0.01;与模型组比较, ##:P<0.01.图4 hIGF-1融合蛋白对钳夹损伤大鼠坐骨神经-腓肠肌诱发电位振幅的影响Fig 4 Effect of hIGF-1 fusion protein on the amplitude of compound muscle action potential in sciatic nerve injuried rats
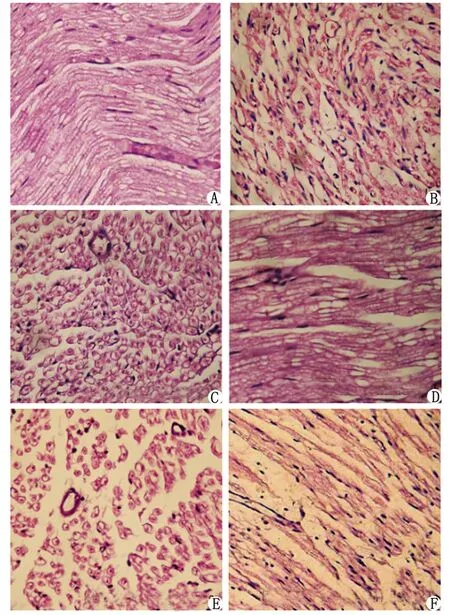
hIGF-1:重组人胰岛素样生长因子-1. A:假手术组; B:模型组; C:hIGF-1 0.02 mg组横切面; D:hIGF-1 0.02 mg组纵切面; E:hIGF-1 0.002 mg组横切面; F:hIGF-1 0.002 mg组纵切面.图5 大鼠坐骨神经染色结果(H-E ×100)Fig 5 HE staining of sciatic nerve (H-E ×100)
SFI是评价坐骨神经损伤神经再生与功能恢复的可靠方法[14]。通过对大鼠的足迹分析,笔者发现,各测定时间点模型组大鼠SFI值及SFI恢复率较假手术组显著降低,说明钳夹方式能有效损伤坐骨神经;而hIGF-1融合蛋白则可显著提高模型大鼠SFI值和SFI恢复率,这提示hIGF-1融合蛋白具有促进坐骨神经损伤后神经行为功能恢复的作用。坐骨神经-腓肠肌诱发电位的检测能够反映神经损伤后残余坐骨神经纤维的数量及其同步兴奋程度,是一个较客观的量化评价。当坐骨神经受到电刺激后,动作电位的振幅与其支配的腓肠肌神经纤维兴奋的数量呈正相关。本研究使用hIGF-1融合蛋白35 d后大鼠坐骨神经-腓肠肌诱发电位波形较规则,振幅显著高于模型组,表明hIGF-1融合蛋白对大鼠坐骨神经的电生理传导功能的恢复具有促进作用。神经轴突的结构与数目是其功能的基础,一般而言,成熟度高的神经纤维镜下可见排列规则,致密,髓鞘较厚且完整;而成熟度低的神经纤维则直径较细,髓鞘较薄或缺失,排列紊乱。本研究发现,hIGF-1融合蛋白对大鼠坐骨神经钳夹损伤的结构恢复具有一定的促进作用。
综上所述,重组hIGF-1融合蛋白对坐骨神经损伤大鼠的神经行为功能恢复、电生理传导特性恢复及神经再生具有促进作用,为hIGF-1用于治疗周围神经损伤提供了药效学依据。
[1] Emel E,Ergün S S,Kotan D,etal.Effects of insulin-like growth factor-I and platelet-rich plasma on sciatic nerve crush injury in a rat model:Laboratory investigation [J].JNeurosugery, 2010, 114(2):522-528.
[2] Drogan D,Schulze M B,Boeing H.Insulin-like growth factor 1 and insulin-like growth factor-binding protein 3 in relation to the risk of type 2 diabetes mellitus:results from the EPIC-potsdam study[J].AmJEpidemiol, 2016,183(6):553-560.
[3] Armakolas N,Armakolas A,Antonopoulos A,etal.The role of the IGF-1 Ec in myoskeletal system and osteosarcoma pathophysiology[J].CritRevOncolHematol, 2016,108:137-145.
[4] Pardo J,Uriarte M,Cónsole G M,etal.Insulin-like growth factor-I gene therapy increases hippocampal neurogenesis, astrocyte branching and improves spatial memory in female aging rats[J].EurJNeurosci,2016,44(4):2120-2128.
[5] Russo V C,Gluckman P D,Feldman E L,etal.The insulin-like growth factor system and its pleiotropic functions in brain[J].EndocrineReviews,2005,26(7):916-943.
[6] 陈 理,杨 渐,俞昌喜.重组人胰岛素样生长因子-1大肠杆菌高密度发酵研究[J].福建医科大学学报,2013,47(1):32-35.
[7] 张 蕾,芮永军,王 骏.足迹分析法评定超短波促进大鼠坐骨神经损伤后功能恢复的研究[J].交通医学,2007,21(5):485-486.
[8] Bain J R,Makinnon S E,Hunter D A.Functional evaluation of complete sciatic, peroneal, and posterior tibial nerve lesions in the rat[J].PlasticandReconstructiveSurgery,1989,83(1):129-136.
[9] 王 维,苑秀华,王中莉,等.坐骨神经损伤模型大鼠神经传导速度及损伤运动神经元内生长相关蛋白43表达与磁刺激干预[J].中国组织工程研究与临床康复,2011,15(46):8617-8620.
[10] Moradzadeh A,Brenner M J,Whifloch E L,etal.Bipolar eleetrocautery:a rodent model of sunderland third-degree nerve injury[J].ArchivesofFacialPlasticSurgery,2010,12(1):40-47.
[11] Mohammadi R,Esmaeil-Sani Z,Amini K.Effect of local administration of insulin-like growth factor I combined with inside-out artery graft on peripheral nerve regeneration[J].Injury,2013,44(10):1295-1301.
[12] Wang C,Peng Y,Pan S,etal.Effect of insulin-like growth factor-1 on corneal surface ultrastructure and nerve regeneration of rabbit eyes after laser in situ keratomileusis[J].NeurosciLett, 2014,558:169-174.
[13] Mclean J,Batt J,Doering L C,etal.Enhanced rate of nerve regeneration and directional errors after sciatic nerve injury in receptor protein tyrosine phosphatase sigma knock-out mice[J].JNeurosci,2002,22(13):5481-5491.
[14] Sta M,Cappaert N L,Ramekers D,etal.The functional and morphological characteristics of sciatic nerve degeneration and regeneration after crush injury in rats[J].JNeurosciMethods,2014,222(1):189-198.
(编辑:张慧茹)
Effects of Recombinant Human Insulin-like Growth Factor-1on Sciatic Nerve Injury
HUANG Huihui, YANG Jian, YU Changxi
College of Pharmacy, Fujian Medical University, Fuzhou350122, China
Objective To explore the therapeutic effect of hIGF-1 fusion protein on sciatic nerve crush injured rats. Methods 40 Wistar rats were randomly divided into 4 groups: sham-operation group, model group, 0.02 mg hIGF-1 fusion protein treated group and 0.002 mg hIGF-1 fusion protein treated group. After sciatic nerve crush injury surgery, the functional evaluation of behavior, sciatic functional index(SFI), neurophysiological assessment, histomorphological assessment were performed. Results On 20thto 32thdays after surgery, the SFI and SFI recovery rate of hIGF-1 fusion protein in high and low dose groups were significantly higher than those in model group (P<0.05), and it shows a dose -dependent manner. The amplitude of compound muscle action potential in the hIGF-1 groups was statistically significantly higher than that in model group(P<0.01)on 35thday, and the effect was enhanced with the dose increasing. H-E staining showed that the count of myelinated nerve fibers in experimental group exceeded those in model group and they were thickened and complete. Conclusion hIGF-1 fusion protein can effectively promote nerve regeneration after sciaticnerve crush injury in rats.
insulin-like growth factor 1; sciatic nerve; sciatic neuropathy; rats
2017-03-14
福建省高校产学合作科技重大项目(2010Y4002); 福建省教育厅A类科技项目(JA09115)
福建医科大学 药学院,福州 350122
黄慧慧,女,助理实验师,医学硕士
俞昌喜. Email:changxiyu@mail.fjmu.edu.cn
R348; R392.11; R745.42
: A
: 1672-4194(2017)04-0207-05
