苹果属植物叶中α-葡萄糖苷酶抑制剂的初步研究△
2017-09-21申洁李珮毕武何春年肖培根
申洁,李珮,毕武,何春年,肖培根
(1.中国医学科学院 北京协和医学院 药用植物研究所,北京 100193;2.教育部中草药物质基础与资源利用重点实验室,北京 100193;3.中南大学湘雅医院卫生部肿瘤蛋白质组学重点实验室,湖南 长沙 410008)
·基础研究·
苹果属植物叶中α-葡萄糖苷酶抑制剂的初步研究△
申洁1,2,李珮1,2,毕武1,2,3,何春年1,2*,肖培根1,2
(1.中国医学科学院 北京协和医学院 药用植物研究所,北京 100193;2.教育部中草药物质基础与资源利用重点实验室,北京 100193;3.中南大学湘雅医院卫生部肿瘤蛋白质组学重点实验室,湖南 长沙 410008)
目的:初步评价苹果叶提取物及主要化合物对α-葡萄糖苷酶的抑制活性。方法:采用经典α-葡萄糖苷酶活性测定方法,对苹果属不同种(品种)、不同产地来源的20种共40份苹果叶提取物与3种主要化合物进行了α-葡萄糖苷酶抑制活性筛选,并与阳性对照药阿卡波糖进行比较。结果:在样品浓度为2 mg·mL-1的浓度体系下,所测样品对α-葡萄糖苷酶均有不同程度的抑制作用,其中23份提取物和2个化合物(根皮素和槲皮素)的IC50值低于阿卡波糖的IC50值,且绝大多数提取物的IC50值低于其所含的化合物IC50值。结论:根皮素、槲皮素和根皮苷等成分是苹果属植物叶提取物抑制α-葡萄糖苷酶的活性物质基础,且可能还含有其它协同作用的成分存在,值得深入研究;不同种(品种)、不同产地来源的苹果属植物叶片提取物对α-葡萄糖苷酶的抑制活性存在一定的差异,多数提取物显示了较强的活性。本实验为苹果属植物叶片资源的可持续利用和开发提供一定的科学依据。
苹果属;苹果属叶片;α-葡萄糖苷酶;抑制活性;资源利用
苹果属(Malus)为蔷薇科(Rosaceae)植物,分布于北温带广大地区。我国是世界苹果属植物的起源中心和多样性中心,具有丰富的野生资源和繁多的栽培品种,其中苹果MaluspumilaMill.是世界上最著名的水果之一,栽培面积和果实产量均为世界最高[1-4]。以前该属植物的研究主要集中于食品行业对其果实的风味、品质和产量等方面,对该属植物叶片资源研究相对较少。
苹果属约有35种,在我国约有20余种[2],部分苹果属植物叶有一定的药用保健价值,例如:西府海棠的果可入药,主治泄泻、痢疾[1];苹果叶,能凉血解毒[1],据《滇南本草》记载:“敷脐上治阴症。又治产后血迷,经水不调,蒸热发烧,服之效”[2]。尖嘴林檎和楸子的果实都可健脾消食[1];毛山荆子叶可入药,可用于痉挛性酸痛和急性腹泻[1];湖北海棠嫩叶常做茶饮,可消暑,也具有消积化食,温和健脾的功效[1-2]。现代研究表明苹果属植物叶中含有丰富的多酚类化合物,主要化合物有根皮苷、根皮素、槲皮素等[5-7]。该属植物叶具有降糖、抗氧化、抗过敏、抗龋齿、降低胆固醇、防治心脑血管疾病等多种药理活性[8-11]。
α-葡萄糖苷酶抑制剂(α-glucosidase inhibitors,AGI)是一类通过延缓肠道内碳水化合物的水解和吸收从而到达有效控制餐后血糖上升的糖尿病治疗药物,具有控制餐后血糖、保护胰岛细胞功能及改善多种糖尿病并发症等作用,目前已经成为单纯饮食控制不佳的2型糖尿病患者的首选药物及1型糖尿病患者使用胰岛素治疗的首选辅助药物。从天然植物中寻找具有更低毒副作用、更高效的α-葡萄糖苷酶抑制剂一直是国内外研究的热点。已有文献报道,湖北海棠和平邑甜茶的叶片做茶饮具有一定的降糖作用。苹果叶的主要化合物根皮素,也有一定的降糖作用,但针对整个苹果属植物叶降糖方面的研究较少。鉴于我国苹果属植物叶资源丰富且有潜在的降糖价值,但未得到系统比较研究和有效利用的现状,本课题组广泛取样,选取40份苹果属植物样品,涵盖26份野生种和11份常见栽培品种,以及文献报道样品中含有的主要化合物根皮素、根皮苷和槲皮素等成分。开展了苹果属植物叶抑制α-葡萄糖苷酶的初步活性评价,旨在为该属丰富的资源利用奠定基础。
1 材料与仪器
1.1 材料
苹果属植物叶片于2014年9月底和10月初采自北京市和辽宁省兴城市,由中国农业科学院果树研究所程存刚研究员和北京农学院姚允聪研究员鉴定,保存在中国医学科学院药用植物研究所亲缘中心,样品信息见表1。本实验所用为其干燥叶片的70%乙醇提取物。苹果属植物叶片主要化合物根皮苷、根皮素(自制,为本实验室从多穗柯甜茶中分离得到,并经UV、IR、NMR 等光谱鉴定,HPLC检测纯度大于98 %),槲皮素(购于成都普瑞法科技开发有限公司)。
α-葡萄糖苷酶(α-glucosidase,G5003-100UN,美国Sigma公司);4-硝基苯基-α-D-吡喃葡萄糖苷(4-N-trophenyl-α-D-glucopyranoside,PNPG,N1377-1G,美国Sigma公司);阿卡波糖(德国Bayer公司),其他试剂均为国产分析纯。
1.2仪器
SPE-111中药秒级程控提取机(北京金鼎科技发展有限公司),BioRad550型微孔板扫描酶标仪(美国BioTek公司),AL204电子天平(梅特勒-托利多仪器有限公司)。
2 方法与结果
2.1 提取物的制备
将苹果属植物叶片阴干,粉碎,取约20 g,精密称定,加入70%的乙醇500 mL浸泡5 min,利用中药秒级程控提取装置提取3 min,所得提取溶液过滤,收集滤液,滤液用旋转蒸发仪蒸干,得流浸膏,进一步用真空干燥箱烘干,获得干浸膏粉末,保存于-20 ℃冰箱中。
准确称取样品干浸膏粉末5 mg,置Eppendorf管中,加入1 mL DMSO溶解,配置成浓度约5 mg·mL-1的样品溶液母液,待用。
2.2 PNP标准曲线的测定
精密称取对硝基苯酚(PNP)约0.01 g,于10 mL容量瓶中,加入PBS溶解并定容至刻度,得到PNP储备液10.10 mmol·L-1。将PNP储备液稀释为0.1、0.08、0.04、0.02、0.01、0.005、0 mmol·L-1的浓度,吸取不同浓度的PNP溶液150 μL于96孔酶标板内,再依次分别加入0.2 mol·L-1的碳酸钠溶液100 μL终止反应,混匀,在405 nm下测定吸光值。以PNP浓度为横坐标和吸光度值为纵坐标,制标准曲线。得回归方程:Y=7.308 3X-0.0011,r=0.999 0,表明PNP在0~0.1 mmol·L-1范围内线性关系良好。
2.3 酶活性测定方法和酶活性抑制率的计算
为适应本实验筛选的实际要求,按照已有方法[12-15]改进,以PNPG为底物,α-葡萄糖苷酶可以特异性地水解PNPG中的糖苷键,生成的水解产物 PNP在405 nm下有吸光值,通过测定吸光值计算水解产物PNP的含量,来计算样品提取物对α-葡萄糖苷酶抑制活性。确定以96孔板为反应载体,最终反应体积为250 μL。
因样品母液,用PBS稀释时会产生混悬物,故样品仍选用DMSO稀释,据相关文献报道[16]DMSO会对使测定的吸光度(A)值升高。本实验反应体系中DMSO的终体积浓度为4%,使A值升高1.40%,影响较小,故仍选择终体积浓度4%的DMSO样品液进行α-葡萄糖苷酶活性测试反应。
反应体系:分别吸取0.1 mol·L-1的磷酸盐缓冲液(pH 6.8)40 μL和待测样品溶液10 μL,加入2 mmol·L-1的PNPG和0.1 U·mL-1的α-葡萄糖苷酶各50 μL,摇匀,在37 ℃保温反应20 min后,加入0.2 mol·L-1碳酸钠溶液100 μL终止反应,于405 nm下测定吸光度。随行用磷酸盐缓冲液代替酶液作空白对照,重复3次,取平均值,根据反应产生的PNP含量变化来计算α-葡萄糖苷酶活性。
由于样品提取物都含有色素,因此样品需要测定背景吸收,以10 μL的DMSO代替样品溶液进行校正,α-葡萄糖苷酶活性的抑制率按下式计算:
抑制率(%)=(Am-Ay)/Am× 100
式中:Am为酶与底物反应后的吸收度值(扣除相应空白);Ay为加入抑制剂后酶反应的吸收度(扣除相应空白)。
2.4 反应体系酶浓度的确定
按照“2.3”项下方法,用0.1 mol·L-1的磷酸盐缓冲液(pH 6.8)代替样品溶液,加入浓度分别为0、0.02、0.04、0.06、0.08、0.10、0.12 U·mL-1的酶溶液,其他条件不变,反应结束后,在405 nm处测定吸光度值,计算回归方程为Y=11.58X+0.0403,r=0.998 9。在其它组分浓度不变的条件下,反应体系中酶浓度加大则反应速度越快,当酶浓度为0.1 U·mL-1时,酶量与反应产物PNP之间呈良好的浓度依赖关系,酶反应速度可以达到筛选测定的要求,最终实验选定浓度为0.1 U·mL-1的α-葡萄糖苷酶溶液进行测定。结果见图1。
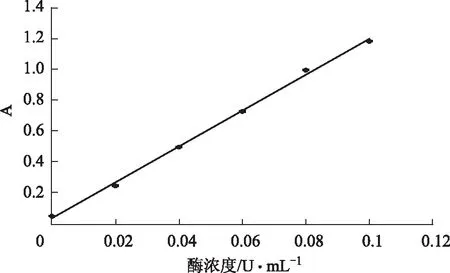
图1 α-葡萄糖苷酶浓度对酶活性测定的影响(n=3)

图2 阿卡波糖对α-葡萄糖苷酶活性的抑制作用(n=3)
2.5 阿卡波糖对α-葡萄糖苷酶的抑制活性
按照“2.3”项下方法,用浓度分别为0、0.2、0.4、0.8、1.6、2、2.4、3、4 mg·mL-1阿卡波糖阳性药溶液代替样品溶液,其它条件不变,反应结束后,在405 nm处测定吸光度值。实验结果如图2所示,在固定底物和酶浓度的情况下,改变阿卡波糖的浓度,阿卡波糖对α-葡萄糖苷酶的抑制作用具有良好的量效关系,其抑制曲线良好,其IC50值为1.377 mg·mL-1(2.133×10-3mol·L-1)结果见图2,说明本实验体系符合此次筛选的需要。
2.6 测定苹果属植物叶片提取物及主要化合物对α-葡萄糖苷酶的抑制活性
按“2.3”项下方法对40份苹果属叶提取物和3种主要化合物进行初步筛选,样品初筛浓度为2 mg·mL-1。筛选结果如表1所示,根据样品初步筛选的结果,对26份抑制率高于50%的提取物进行了复筛(因砬山品种样品份数较多,砬山1-6、1-7、1-9样品未测定)。复筛时样品稀释成6个合适的浓度梯度,按照“2.4”项下方法进行筛选,通过Graphpad Prism 7软件计算出各个样品的IC50值。除红花丽江山荆子(pgs-07)、垂瓣垂丝海棠(pgs-09)、窄叶海棠(pgs-06)叶片提取物溶液测定时不稳定,对α-葡萄糖苷酶的抑制活性不成量效关系,未测得IC50值外,其它23份样品均获得IC50值,结果见表1。
测定结果表明,苹果属植物叶提取物对α-葡萄糖苷酶均具有一定的抑制作用,其中有26份提取物与根皮素和槲皮素2个化合物在2 mg·mL-1浓度时对α-葡萄糖苷酶的活性较好,抑制率均高于80%。在测得的23份有IC50值的样品中,除6份样品(黄卢氏湖北海棠pgs-39、楸子pgs-40、樱叶海棠pgs-43、红果三叶海棠pgs-41、陇东海棠pgs-44和砬山1-4 pgs-54)IC50值大于0.1 mg·mL-1外,其余17份样品IC50值均小于0.1 mg·mL-1,明显低于阳性对照药阿卡波糖的IC50值1.377 mg·mL-1和三个化合物的IC50值。表明所测样品有一半以上具有较强的抑制α-葡萄糖苷酶活性。
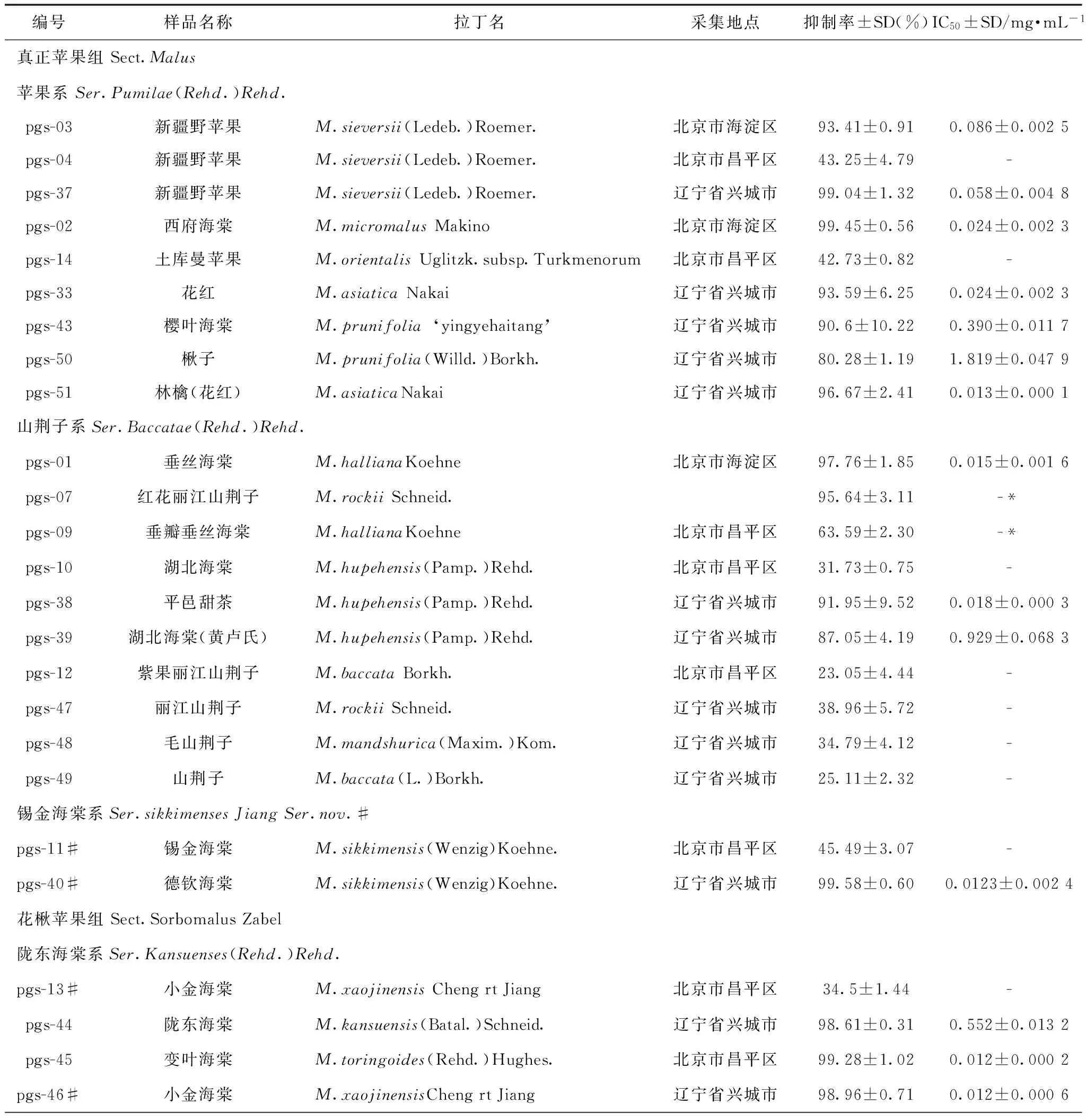
表1 苹果属植物叶片提取物及其主要化合物对α-葡萄糖苷酶活性的抑制率和IC50值(n=3)

表1(续)
注:-.在2 mg·mL-1时,抑制率低于50%,未测定IC50值;-*.未测得IC50值;本文主要参照1974《中国植物志》第36卷中对苹果属的分类系统[17],同时结合李育农[18]教授的分类处理(文中标注#)。
4 讨论
本实验在经典的α-葡萄糖苷酶活性测定方法的基础上,对实验具体条件和参数进行了优化,可以快速评价苹果属植物叶片提取物和化合物的活性。通过对40份苹果属植物叶提取物和3种主要化合物对α-葡萄糖苷酶抑制活性研究,发现苹果属不同种(品种)、不同产地来源的20种共40份苹果叶提取物与3种主要化合物对α-葡萄糖苷酶的抑制活性存在一定的差异,多数苹果属植物叶片显示了较强的活性,为苹果属植物叶片资源进一步的开发利用提供一定的参考依据。
从苹果属植物分类来看,真正苹果组的苹果系9份样品多具有较高的抑制率和较低的IC50值;山荆子系10份样品中的不同种海棠样品也多具有较高的抑制率和较低的IC50值,而不同的山荆子种多具有较低的抑制率。花楸苹果组测定的样品数虽然相对较少,但陇东海棠系和三叶海棠系的5种样品种有4份显示较高的抑制率和较低的IC50值。11份栽培品种除个别活性不强外,大多具有较高的抑制率和较低的IC50值。北美引进的两个种抑制率较低。日本引进的朱眉海棠(pgs-42)活性较强,其IC50值是所有样品中最低的。但由于本次实验测定样本量较少,该属植物叶对α-葡萄糖苷酶抑制作用的规律尚需进一步比较研究。
本实验所测样品主要来源于辽宁兴城和北京昌平两个地方,采集时间均为秋天,前后相差约10 d,但从测定结果比较来看,相同种的样品,来源于北京昌平的样品活性相对较低,如新疆野苹果(pgs-04)、湖北海棠(pgs-10)、垂丝海棠(pgs-09)、锡金海棠(pgs-11)和小金海棠(pgs-13)等,推测原因可能为,这段采集时间为叶片中成分快速变化的阶段,因采集时间的不同而导致叶片中有效成分变化较大;或因两个产地引进原生种后,不同的小气候与土壤等的因素,影响了叶片中有效成分变化,但确切的原因还需要进一步的比较研究。
文献报道根皮素、槲皮素和根皮苷等是苹果属植物叶中主要成分,其中根皮苷在苹果属叶片中普遍存在且含量较高,本文实验结果表明根皮素和槲皮素对α-葡萄糖苷酶的抑制活性优于阿卡波糖,但根皮苷的IC50值却远高于它们,这个结果与文献报道根皮苷有较好的降糖活性不相符[9],推测可能是因为根皮苷分子中含有葡萄糖氧基,测定时,葡萄糖氧基断裂消耗了α-葡萄糖苷酶,使得最后测得根皮苷的IC50值较大,这可以从根皮苷的苷元根皮素的IC50值较低得到解释。这个现象同时也说明了经典的α-葡萄糖苷酶测定评价降糖活性方法的不足。因大多数苹果属植物叶提取物的IC50值低于3个化合物的IC50值,推测苹果叶提取物中可能还含有其他抑制α-葡萄糖苷酶的具有协同作用的活性成分,值得进一步研究发现。
本实验初步开展了苹果属植物叶在降糖方面相关的物质基础和活性评价研究,由于采用的测定方法仅为降糖活性评价诸多方法中的一种,受到方法本身的限制,上述结果尚需更多的研究加以完善。
致谢:本文所用苹果属植物样品在采集中得到中国农业科学院果树研究所王昆研究员、李壮博士和北京农学院秦晓晓博士的大力帮助,特此感谢!
[1] 国家中医药管理局《中华本草》编委会.中华本草:第10 卷·第4册[M].上海:上海科学技术出版社,2004:162-164.
[2] 中国科学院植物研究所.中国高等植物图鉴:第2 册[M].北京:科学出版社,2002:235-236.
[3] 兰茂原,于乃义,于兰馥.滇南本草[M].昆明:云南科技出版社,2004:103.
[4] 钱关泽,汤庚国.苹果属植物分类学研究进展[J].南京林业大学学报:自然科学版,2005,29(3):94-98.
[5] 方荣,杨茜,李莉,等.湖北海棠中根皮苷含量测定[J].实用医学进修杂志,2007,33(4):247-249.
[6] 赵艳敏,王皎,宋光明,等.苹果树枝和叶中根皮苷及根皮素含量变化研究[J].食品研究与开发,2013(7):95-98.
[7] 李萍.苹果属植物叶片类黄酮的含量及多样性研究[D].北京:中国农业科学院,2010.
[8] 王轶.湖北海棠叶水煎液对高血糖小鼠血糖的影响[J].科技风,2009:224
[9] 董华强,宁正祥,于立静,等.多穗柯黄酮根皮苷对糖尿病小鼠的降血糖血脂效果[J].食品科学,2006,27(12):714-717.
[10]Lu Y,Foo L Y.Antioxidant and radical scavenging activities of polyphenols from apple pomace[J].Food Chemistry,2000,68(1):81-85.
[11]金莹.苹果多酚的超声波提取及其抗氧化性研究[D].泰安:山东农业大学,2006.
[12]范莉,王业玲,唐丽.天然来源α-葡萄糖苷酶抑制剂筛选方法的研究进展[J].天然产物研究与开发,2016,28(2):313-321.
[13]郭凤霞,曾阳,陈振宁.来源于天然产物的α-葡萄糖苷酶抑制剂筛选研究进展概述[J].青海师范大学学报:自然科学版,2012,28(1):76-80.
[14]TingL I,Zhang X D,Song Y W.A microplate-based screening method for α-glucosidase inhibitors[J].Chinese Journal of Clinical Pharmacology & Therapeutics,2005,10(10):1129.
[15]许芹永,朱靖博,宋青楠,等.药食两用中药中α-葡萄糖苷酶抑制剂的高通量筛选[J].食品工业科技,2012,33(13):110-113.
[16]査鑫垚,靳翠丽,陈毓遒,等.海绵共附生微生物中具有α-葡萄糖苷酶抑制活性菌株的筛选与初步鉴定[J].应用海洋学学报,2012,31(3):380-386.
[17]中国科学院中国植物志编辑委员会.中国植物志:第36卷[M].北京:科学出版社,1974:372.
[18]杨晓红,李育农.苹果属植物苹果组及山荆子组花粉形态及其演化研究[J].西南大学学报(自然科学版),1995(4):279-285.
PreliminaryStudyonα-glucosidaseInhibitorfromMalusLeaves
SHENJie1,2,LIpei1,2,BIWu1,2,3,HEChunnian1,2*,XIAOPengen1,2
(1.InstituteofMedicinalPlantDevelopment,ChineseAcademyofMedicalScience,PekingUnionMedicalCollege,Beijing100193,China; 2.KeyLaboratoryofBioactiveSubstancesandResourcesUtilizationofChineseHerbalMedicine,MinistryofEducation,Beijing100193,China; 3.KeyLaboratoryofCancerProteomicsofMinistryofHealthofChina,XiangyaHospital,CentralSouthUniversity,Changsha410008,China)
Objective:The aim of this study is to evaluate the α-glucosidase inhibition of extracts and main compounds inMalus’ leaves.Methods:The effect of extracts on α-glucosidase activity was investigated by enzymatic method in vitro.Forty extracts and three main compounds fromMalus’leaves were screened,and then compared with positive control(acarbose IC501.377 mg·mL-1).Results:The extracts and compounds fromMalus’leaves showed α-glucosidase inhibition obviously.The IC50of 23 categories extracts and 2 compounds(phloretin,quercetin)were lower than acarbose.Some extracts in the leaves ofMalushad remarkable inhibitory effect on α-glucosidase activity and almost had lower IC50compared to 3 compounds.Conclusion:Phloretin,quercetin and phlorizin are the basic composition for inhibiting α-glycosidase enzymes,and it also has potential research about synergistic components of extracts.Different extracts from dissimilar locations have distinctive activities of α-glycosidase inhibition;fortunately,most extracts have strong inhibiting activities.This experiment provides the scientific basis for the plant resources ofMalus’ leaves that can keep on to utilize and develop.
Malus;Malus’ leaves;α-glucosidase;inhibitory activity;resource utilization
中国医学科学院医学与健康科技创新工程经费资助(2016-I2M-1-012)
] 何春年,副研究员,研究方向:药用植物亲缘学研究;Tel:(010)57833165,E-mail:cnhe@ implad.ac.cn
10.13313/j.issn.1673-4890.2017.4.013
2016-11-07)
*[
