衰老模型大鼠空间记忆的改变及抑郁样行为的研究
2017-09-21李莉李晓秀郭鹏骥朱启文
李莉,李晓秀,郭鹏骥,朱启文
(沈阳医学院基础医学院病理生理学教研室,沈阳 110034)
衰老模型大鼠空间记忆的改变及抑郁样行为的研究
李莉,李晓秀,郭鹏骥,朱启文
(沈阳医学院基础医学院病理生理学教研室,沈阳 110034)
目的建立一种大鼠衰老模型,观察其认知障碍和抑郁样行为的变化,并初步探讨该模型引发的2种疾病的共病机制。方法SD 雄性大鼠经 D-半乳糖和三氯化铝联合给药后,采用 Morris水迷宫测定其学习记忆能力,采用强迫游泳实验检测抑郁样行为的改变,采用高尔基染色观察海马区神经元的发育情况,检测超氧化物歧化酶(SOD)和丙二醛(MDA)含量,并分析氧化应激指标的改变。结果与对照组相比,模型组大鼠在水迷宫中逃避潜伏期延长(P< 0.05),平台停留时间和经过平台的次数减少(P < 0.05),强迫游泳实验中在水中的不动时间明显延长(P < 0.01),高尔基染色显示模型组大鼠海马区树突棘密度明显降低(P< 0.01),海马区 SOD 活力下降(P< 0.05),MDA 含量增加(P < 0.05)。结论建立了一种新的并发认知障碍和抑郁的动物模型,这2种疾病的共病机制可能与自由基超载和代谢失衡过程中神经系统生长发育遭到破坏有关。
衰老;学习记忆;抑郁;高尔基染色;神经元树突
随着全世界老年人口数量的增加,老龄化已成为世界性的问题[1],衰老也成为许多疾病的重要风险因素[2-3]。已有研究证实衰老可以引发认知障碍和抑郁症,但其病因病理机制尚未明确,有待进一步研究讨论。本研究利用D-半乳糖和三氯化铝联合长期造模方法,模拟衰老大鼠的生物学特点,通过行为学及分子生物学方法分析大鼠认知障碍及抑郁样行为的改变,并探讨D-半乳糖联合三氯化铝诱导的衰老大鼠认知障碍与抑郁样行为的变化可能存在的共同作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物:健康雄性清洁级 SD 大鼠 40 只,11周鼠龄,体质量(180±20)g,由沈阳市长生生物有限公司提供,生产许可证号 SCXK(辽)2015-0001。经Morris水迷宫剔除运动力不佳的大鼠,筛选出运动迅速灵活的大鼠。饲养温度(23±2)℃,湿度 50%~60%,通风良好,12 h 光照和 12 h 黑暗交替,统一饲养。
1.1.2 药物及试剂:分析纯(A.R.)D-半乳糖、三氯化铝购自美国 Sigma公司;分析纯(A.R.)氯 化 汞、重铬酸钾购自成都艾克达试剂有限公司;分析纯(A.R.)无水乙醇购自西陇化工股份有限公司;Golgi-cox optimStain:HITO、超 氧 化 物 歧 化 酶(superoxide dismutase,SOD)试剂盒(WST-1 法)、丙二醛(malondialdehyde,MDA)试剂盒(TBA法)、BCA蛋白定量试剂盒均购自南京建成生物工程研究所。
1.1.3 仪器:水迷宫检测系统(成都太盟软件有限公司);震动切片机(型号VT1200S,德国莱卡仪器有限公司);正置光学显微镜(CKX41,日本OLYMPUS公司);微孔板发光检测仪(infinite200,瑞士 Tecan公司);可见分光光度计(722N,上海精密科学仪器有限公司);电热恒温水槽(上海精宏实验设备有限公司);高速冷冻离心机(Allegra X-30R,美国贝克曼库尔特有限公司)。
1.2 方法
1.2.1 分组及造模:将筛选出的 30 只雄性 SD 大鼠随机分为正常对照组和模型组,每组15只。适应饲养 1 周后,模型组大鼠腹腔注射 D-半乳糖(120 mg·kg-1·d-1)联合三氯化铝灌胃(15 mg·kg-1·d-1),正常对照组用同等剂量的生理盐水替代。
1.2.2 行为学评价:
1.2.2.1 Morris水迷宫实验 前 5 d 训练大鼠为了逃避游泳而寻找水下平台,时间上限为 120 s,如果大鼠在规定时间内未能找到平台,则牵引大鼠识别象限内的平台,并在平台上停留 10 s[4-5]。将大鼠从放入水中到找到水下平台的时间记为逃避潜伏期。第6天撤去平台,观察大鼠平台位置停留时间、经过平台次数及大鼠在平台象限的距离和总路程,用以分析大鼠空间记忆的保持能力[6]。
1.2.2.2 强 迫游 泳实 验(forced swimming test,FST)将大鼠放入透明的有机玻璃圆筒中(底面直径30 cm,高 60 cm),桶内装有 45 cm 高的水,水深以大鼠漂浮在水中时尾尖不接触到圆筒底部为宜。大鼠初入水中会拼命游泳,但很快放弃挣扎,呈现出漂浮不动状态(即大鼠仅露鼻孔呼吸,偶尔滑动四肢以维持身体漂浮,或下沉到桶底至少 1 min)。从大鼠进入水中到出现不动状态的时间称为潜伏期。实验开始前 1 d 练习 15 min,正式实验时先让大鼠在水中适应 1 min,然后开始记录大鼠在 5 min 内的潜伏期和不动时间[7-8]。
1.2.3 大 鼠 海 马 神 经 元 高 尔 基 染 色 :(1)药 品 配置。将 5.25 g 重铬酸钾粉末、5.25 g 氯化汞粉末和250 mL Solution1*B 大力混匀,配置成 S1 号液体;将Solution1*B 与 S1 按照 1∶1 的比例混匀,配成 S2 号液;严格密封保存,避光 24 h,1 个月内使用有效。(2)高尔基染色步骤。各组随机选取4只大鼠,25%乌拉坦麻醉后断头取脑,双蒸水去血渍后将脑组织浸泡于配置好的S1+S2溶液中,室温(20~25 ℃)避光保存。次日更换S1+S2液,2周后更换S3液(试剂盒中自带的试剂),12 h 之后再次更换 S3 液,于 24~72 h内进行组织包埋、切片(厚度 150 μm),自然风干后在 72 h 内进行冲洗、浸泡、冲洗、脱水(50%、75%、95%乙醇,依次各 5 min;100%乙醇,3 次/5 min)、透明,显微镜下观察并拍照[9]。(3)树突和树突棘的分析。用光学显微镜、CCD 图像记录软件及 Image J图片分析软件对切片进行处理分析,选取海马DC区和CA1区的部分神经树突,分析发育发展情况,每组选取8张切片分析,每张切片选取一部分完整的树突作为分析对象,统计树突长度和树突棘的密度。选取神经树突时应注意选取完整并有众多分支的细胞,树突必须与其他的组织结构分开,以免混淆软件的判断,排除个人主观行为的干扰。
1.2.4 氧化应激指标检测方法:各组大鼠 25%乌拉坦麻醉后,在冰盒上迅速断头取脑,双蒸水去血渍后分离皮质和海马组织,加入 1 mL 生理盐水,用匀浆机匀浆,4 ℃、3 000 r/min 离心 15 min,静止后取上清待测。
1.3 统计学分析
采用 SPSS 16.0 统计软件进行统计学分析。所有数据均以x ± s表示,对 Morris 水迷宫测定中定位航行实验指标的比较进行重复测量的数据分析,其他实验指标的比较采用单因素方差分析。P< 0.05为差异有统计学意义。
2 结果
2.1 Morris水迷宫对大鼠认知能力的检测结果
定位航行实验中,与正常对照组相比,模型组大鼠在第3、4、5天的逃避潜伏期明显延长,差异有统计学意义(P< 0.05),见图 1。以空间探索实验检测大鼠空间记忆的保持能力,与正常对照组相比,模型组大鼠平台象限的运动距离明显缩短,差异有统计学意义(P < 0.05),但总路程无明显变化(P >0.05),见图 2。说明模型组大鼠平台象限运动距离减少和运动能力无关。与正常对照组相比,模型组大鼠平台停留时间和经过平台的次数有明显变化,差异有统计学意义(P< 0.05),见表1。
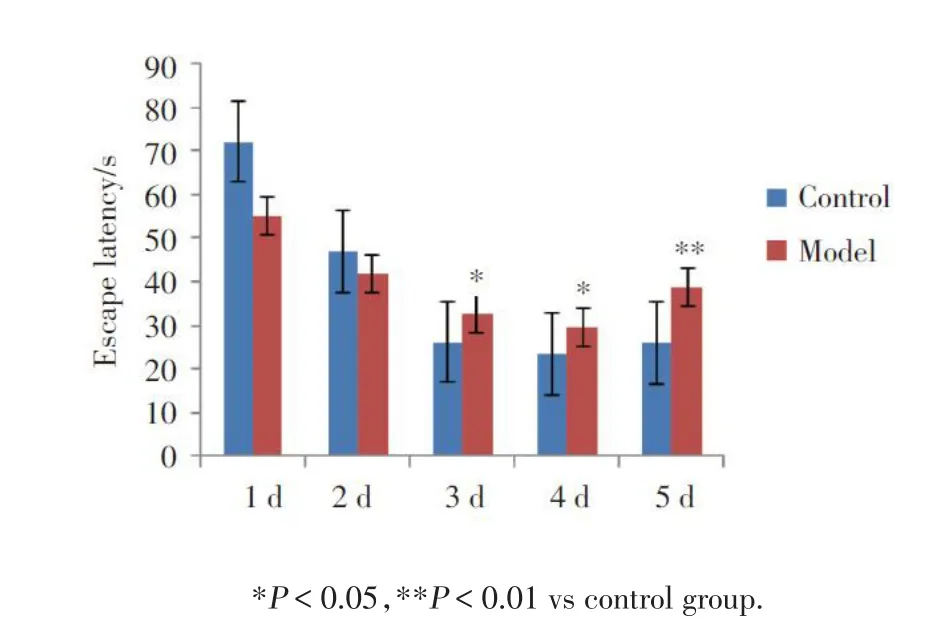
图1 Morris 水迷宫大鼠逃避潜伏期Fig.1 Morris water maze rats’escape latency
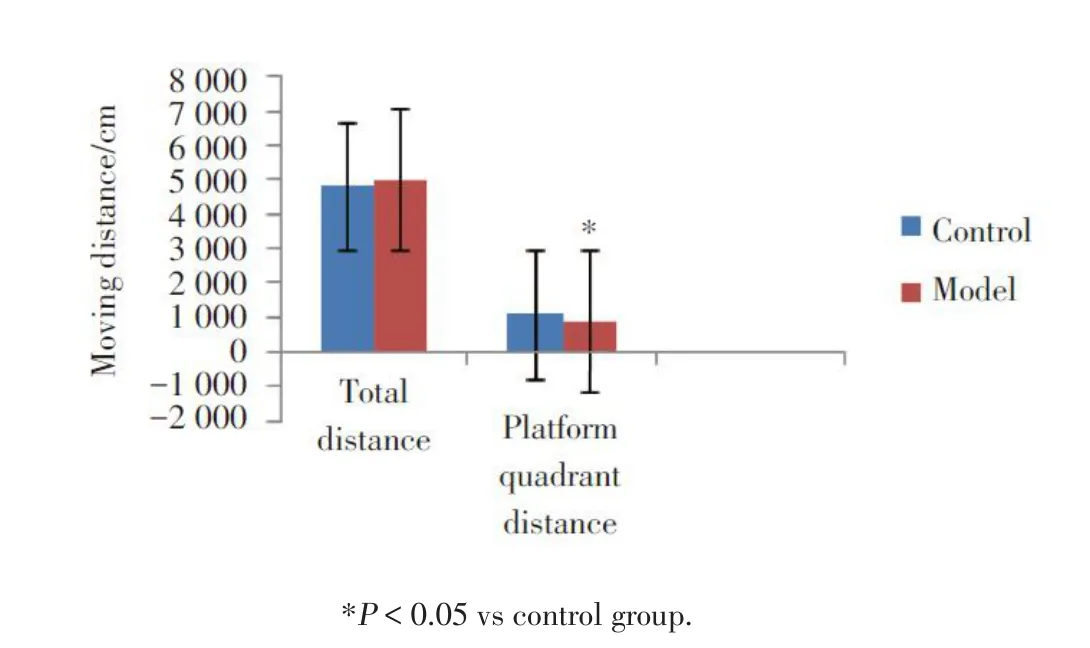
图2 大鼠平台象限距离和总路程Fig.2 Platform quadrant distance and total distance of the rats

表1 2组大鼠的平台停留时间和经过平台的次数Tab.1 Residence time on and number of times passing through the platform of rats in two groups
2.2 FST结果
通过FST检测2组大鼠在水中出现不动状态的潜伏期及不动时间。与正常对照组相比,模型组大鼠的潜伏期明显缩短,在水中的不动时间明显延长(P< 0.01),见表2。
2.3 高尔基染色结果

表2 强迫游泳大鼠潜伏期和不动时间(s)Tab.2 Latency and motionless time of forced swimming in rats(s)
高尔基染色和形态分析结果显示,与正常对照组相比,模型组大鼠海马区神经元萎缩、树突棘形态严重受损、密度明显降低,见图3、4。
2.4 大鼠海马内SOD及MDA的变化情况
与正常对照组相比,模型组大鼠海马区SOD活性下降,差异有统计学意义(P< 0.05);与正常对照组相比,模型组大鼠海马区MDA含量增加,差异有统计学意义(P< 0.05),见表3。
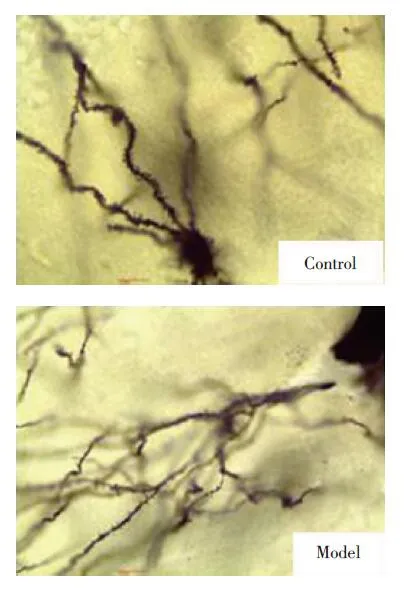
图3 神经元树突生长情况Fig.3 Dendritic growth of neurons in two groups

图4 神经元树突密度Fig.4 The dendritic density of neurons

表3 大鼠海马中SOD活性和MDA含量Tab.3 SOD activity and MDA levels in the hippocampus of rats
3 讨论
目前,衰老已经成为许多疾病的重要风险因素,特别是由年龄发展引起的疾病。近年来,采用自然衰老动物模型或人为因素干预导致的衰老动物模型是研究衰老病因及机制的主要手段。1985年我国学者首次提出D-半乳糖致衰老动物模型,并得到广泛应用。D-半乳糖是生物体内天然存在的一种还原糖,在代谢过程中可以产生活性氧,当生物体内的D-半乳糖增加时,会加快超氧阴离子和自由基的衍生,诱导氧化应激,引起认知功能障碍及神经、组织损伤和炎症[10]。同时,铝作为一种重金属,其慢性毒性也能引起生物体脑内神经元的丢失和细胞凋亡,目前已被认为是引起认知障碍的主要风险因素[11]。有实验研究长期慢性造模方法,D-半乳糖和三氯化铝常规造模6~8周即可引起大鼠认知障碍[12],2 种药物联合应用 105 d 会使大鼠产生自然衰老的表征,引起大鼠学习记忆能力下降,但并未分析此 模型抑郁样行 为的变化[13]。 也有研究[14]表明大剂量(300 mL·kg-1·d-1)的 D-半乳糖造模 7 d 后大鼠除了有衰老的迹象外,还伴有抑郁和焦虑的改变。
本研究证明了D-半乳糖和三氯化铝长期慢性造模 16 周后,大鼠在 Morris水迷宫中出现了认知障碍,学习记忆能力下降,这与2种药物致大鼠脑区神经毒性有关;FST结果显示,大鼠表现出低落、消极的精神状态,出现抑郁样行为,可能与药物代谢性应激有关。提示该模型动物在出现认知能力下降的同时,也出现了抑郁样行为的改变。同时,经高尔基染色发现,海马区神经元细胞萎缩、坏死,树突长度和树突棘数量明显减少,说明衰老模型大鼠出现了神经器质上的改变,经过2种药物造模后,大鼠脑区神经发育受到抑制,原有的神经网络被破坏,导致大鼠认知障碍,学习能力下降,同时情感受到剥夺,抑郁样情绪明显。SOD和MDA的检测结果显示,抗氧化酶活性改变,MDA的氧化应激增加,这与氧自由基不能被有效地清除,脂质过氧化加速了衰老的进程有关,均可导致神经元的损失和神经递质水平的减少。综上所述,本研究证明了D-半乳糖和三氯化铝长期慢性联合作用会使大鼠抗氧化防御系统下降,氧化损伤则会促进老年认知障碍和抑郁的发生、发展。
研究[15]证实,SUB 小鼠的海马依赖性记忆减退与抑郁样表型之间存在联系。在SUB小鼠中可以观察到神经营养因子表达变化和相关的突触可塑性变化,均与认知能力下降有关,充分证明了抑郁症和年龄相关的认知功能障碍潜在共享的分子机制。本研究通过D-半乳糖和三氯化铝联合造模的方法,分析了这种新的模型式动物出现衰老症状的病因和病理机制,并进一步发现联合造模下的新型模型动物出现了2种不同的生理学改变,证明了具体造模方式下的认知障碍和抑郁的共同作用机制可能与氧化应激下神经元的损伤和抗氧化应激系统功能下降导致代谢性应激作用有关。D-半乳糖和三氯化铝含量过高产生代谢毒素,诱发机体氧化应激,自由基超载,引起大鼠出现认知障碍,同时,在自由基代谢失衡的过程中,海马神经系统生长发育遭到破坏,海马神经元损伤,神经网络不完整,导致大鼠出现情感淡漠、认知能力下降、抑郁样行为表现。
本研究不仅从理论上补充了认知障碍和抑郁症共有的作用机制,也为进一步探讨其发病机制提供了更多的可能方向,同时为认知障碍和抑郁症的共病研究提供了一种新的动物模型。
[1]RATTAN SI.Aging is not a disease:implications for intervention[J].Aging Dis,2014,5(3):196-202.DOI:10.14336/AD.2014. 0500196.
[2]ARENDS M,VAN DUSSEN L,BIEGSTRAATEN M,et al.Malignancies and monoclonal gammopathy in Gaucher disease:a systematic review of the literature[J].Br J Haematol,2013,161(6):832-842.DOI:10.1111/bjh.12335.
[3]COX CJ,SHARMA M,LECMAN JF,et al.Brain human monoclonal autoantibody from Sydenham chorea targets dopaminergic neurons in transgenic mice and signals dopamine D2 recceptor:implications in human disease [J].J Immunol,2013,191(11):5524-5541. DOI:10.4049/jimmunol.1102592.
[4]LE FRECHE H,BROUILLETTE J,FERNANDEZ-GOMEZ FJ,et al.Tau phosphorylation and sevoflurane anesthesia:an association to postoperative cognitive impairment[J].Anesthesiology,2012,116(4):779-787.DOI:10.1097/ALN.0b013e31824be8c7.
[5]LAURENT C,EDDARKAOUI S,DERISBOURG M,et al.Beneficial effects of caffeine in a transgenic model of Alzheimer’s diseaselike tau pathology[J].Neurobiol Aging,2014,35(9):2079-2090.DOI:10.1016/j.neurobiolaging.2014.03.027.
[6]王爱梅,陈亚奇,李旻,等.山茱萸多糖对衰老模型大鼠学习记忆能力及海马突触可塑性的影响[J].中国实验方剂学杂志,2016,22(13):131-136.DOI:10.13422/j.cnki.syfjx.2016130131.
[7]傅锦华 .新型抗抑郁中药疏肝解郁胶囊对抑郁模型大鼠的作用机制研究[D].湖南:中南大学湘雅二医院,2014.
[8]孙世光,刘健,鹿岩,等.昆明小鼠强迫游泳实验与悬尾实验抑郁模型相关性[J].中国药理学与毒理学志,2014,28(1):107-112. DOI:10.3867/j.issn.1000-3002.2014.01.016.
[9]JIANG X,CHAI GS,WANG ZH,et al.Spatial training preserves associative memory capacity with augmentation of dendrite ramification and spine generation in Tg2576 mice[J].Sci Rep,2015,5:9488.DOI:10.1038/srep09488.
[10]LI WJ,NIE SP,XIE MY,et al.Ganoderma atrum polysaccharide attenuates oxidative stress induced by D-galactose in mouse brain[J].Life Sci,2011,88(15/16):713-718.DOI:10.1016/j.lfs.2011. 02.010.
[11]ZHEN YZ,LIN YJ,LI KJ,et al.Effects of rhein lysinate on D-galactose-induced aging mice[J].Exp Ther Med,2016,11(1):303-308.DOI:10.3892/etm.2015.2858.
[12]ZHANG Q,HUANG YG,LI XK,et al.GM 1 ganglioside prevented the decline of hippocampal neurogenesis associated with D-galactose[J].Neuroreport,2005,16(12):1297-1301.DOI:10.1097/ 01.wnr.0000174405.24763.bc.
[13]CHU H,ZHANG A,HAN Y,et al.Metabolomics approach to explore the effects of Kai-Xin-San on Alzheimer’s disease using UPLC/ESI-Q-TOF mass spectrometry[J].J Chromtogr B Analyt Technol Biomed Life Sci,2016,1015/1016:50-61.DOI:10.1016/ j.jchromb.2016.02.007.
[14]SAIDA H,LARAIB L,SIDRAH S,et al.A high dose of short termexogenous D-galactose administration in young male rats produces symptoms simulating the natural aging process[J].Life Sci,2015,124:110-119.DOI:10.1016/j.lfs.2015.01.016.
[15]MOSHE G,ANTON S,ELIMELECH N,et al.Early onset of cognitive impairment is associated with altered synaptic plasticity and enhanced hippocmpal GluA1 expression in mouse model of depression[J].Neurobiol Aging,2015,36(5):1938-1952.DOI:10.1016/ j.neurobiolaging.2015.02.015.
(编辑 王又冬)
Changes in Spatial Memory and Depressive-like Behavior in an Aging Rat Model
LI Li,LI Xiaoxiu,GUO Pengji,ZHU Qiwen
(Department of Pathophysiology,School of Basic Medicine,Shenyang Medical College,Shenyang 110034,China)
ObjectiveTo establish an animal model of aging,to observe changes related to cognitive impairment and depression-like behavior,and to explore the mechanisms of the two diseases caused by the model.MethodsMale Sprague-Dawley(SD)rats were treated with D-galactose and alchlor;after simultaneous administration of both drugs,their learning and memory abilities were assessed using the Morris water maze test. The depression-like behavioral changes were observed in the forced swimming test.Golgi staining was performed to observe the development of hippocampal neurons;oxidative stress index changes in superoxide dismutase(SOD)activity and malondialdehyde(MDA)levels were analyzed in the hippocampus.ResultsCompared with a control group,rats in the model group showed reduced escape latency(P < 0.05)from the platform in the water maze,reduced residence time on and a reduced number of times passing through the platform(P < 0.05);the real time in the water during the forced swimming test was significantly prolonged(P < 0.01).Golgi staining indicated that dendritic spine density in the hippocampus in model rats was decreased(P < 0.01),as was hippocampus SOD activity(P < 0.05),while MDA levels were increased(P < 0.05).ConclusionWe established a new animal model of aging with cognitive impairment and depression.The common disease mechanisms of these two diseases might be related to the destruction of the nervous system during the process of overload caused by free radicals and the resulting metabolic imbalance.
aging;learning and memory;depression;Golgi staining;neuronal dendrites
R338.2
A
0258-4646(2017)09-0816-05
http://kns.cnki.net/kcms/detail/21.1227.R.20170906.1318.020.html
10.12007/j.issn.0258-4646.2017.09.011
李莉(1991-),女,硕士研究生.
朱启文,E-mail:Qwzhu18@163.com
2016-10-26
网络出版时间:2017-09-06 13:18
