雷帕霉素对老龄帕金森病模型小鼠线粒体损伤的改善作用
2017-09-21张忠霞马晓伟王彦永邱会卿王铭维
张忠霞,马晓伟,王彦永,邱会卿,王铭维
(河北医科大学第一医院神经内科,河北省脑老化与认知神经科学实验室,石家庄 050031)
雷帕霉素对老龄帕金森病模型小鼠线粒体损伤的改善作用
张忠霞,马晓伟,王彦永,邱会卿,王铭维
(河北医科大学第一医院神经内科,河北省脑老化与认知神经科学实验室,石家庄 050031)
目的探讨雷帕霉素(RAPA)对老龄帕金森病(PD)模型小鼠线粒体损伤的改善作用。方法选用12月龄快速老化小鼠P8 系(SAMP8)40只,随机分为空白组、模型组、RAPA低剂量组、中剂量组和高剂量组。对模型组、RAPA低、中、高剂量组小鼠皮下注射 1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)制成 PD 模型小鼠。RAPA 低、中、高剂量组从制模前 7 d、制模过程中 5 d、制模后 7 d 分别按 1、2、4 mg·kg-1·d-1持续给予 RAPA;空白组、模型组同法注射等体积无菌生理盐水。给药结束后对各组小鼠进行行为学检测及黑质多巴胺(DA)含量检测,分析各组小鼠线粒体跨膜电位及线粒体复合物活性的差异。结果与空白组小鼠相比,模型组小鼠的行为学成绩、黑质 DA 含量、线粒体跨膜电位和复合物Ⅰ活性均显著下降(P < 0.05);与模型组小鼠相比,RAPA 不同剂量组小鼠的上述指标均显著改善(P< 0.05);不同剂量 RAPA 组之间无统计学差异。结论RAPA 对老龄 PD 模型小鼠具有保护作用,其机制可能与保护其线粒体损伤有关。
雷帕霉素;老龄;帕金森病;线粒体
帕金森病(Parkinson’s disease,PD)是多因素介导的中老年退行性疾病。衰老因素可与毒素、遗传等协同加速 PD 的发生和发展[1],衰老对 PD 病理改变中线粒体的影响已成为目前的研究热点之一[2]。研究[3]显示,哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路参与细胞衰老、机体老化和年龄相关的疾病。雷帕霉素(rapamycin,RAPA)对 PD 的改善作用也已有报道[4],多认为与抑制老化过程中的自噬有关。本研究拟选用快速 老 化 小 鼠 P8 系(senescence-accelerated prone mouse 8,SAMP8),使用经典神经毒素 1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-tetra-hydropyridine,MPTP)制备 PD 模型,从抑制老化过程中线粒体损伤的角度探讨RAPA对PD的保护作用。
1 材料与方法
1.1 实验动物与试剂
清洁级、健康、雌性、12月龄SAMP8小鼠40只,体质量(30±2)g,由香港中文大学解剖学系惠赠。自由饮食水,12 h 昼夜,室温(22±2)℃饲养。
RAPA购自美国Sigma公司,线粒体复合物试剂盒购自美国 GENMED 公司;流式细胞仪(FACSCalibur)购自美国 BD 公司,荧光染色剂购于美国 Bio Vision公司。
1.2 方法
1.2.1 PD 模 型 制 备 与 给 药 :按 随 机 数 字 表 法 将SAMP8小鼠随机分为空白组、模型组、RAPA低剂量组、RAPA 中剂量组和 RAPA 高剂量组,每组各 8只。对模型组、RAPA不同剂量组的小鼠皮下注射MPTP 制 备 亚 急 性 PD 模 型 ,连 续 注 射 5 d,27 mg·kg-1·d-1;RAPA 低、中、高剂量组分别按 1、2 和 4 mg·kg-1·d-1剂量,在 PD 模型制备前 7 d、制模过程中5 d 和制模后 7 d 每天持续给予 RAPA 溶液灌胃。对RAPA粉剂使用蓖麻油进行溶解。空白组与模型组小鼠同法灌注等体积蓖麻油。
1.2.2 行为学测试及黑质多巴胺(dopamine,DA)含量水平检测:给药结束后,对各组老龄SAMP8小鼠进行滚轴实验检测其运动功能。滚轴活动仪购自意 大 利 Ugo Basile 公 司(型 号 为 47650 Rota-Rod)。正式测试之前令小鼠在活动仪上适应 2 min,之后开始正式测试。转速为 20 r/min,记录 3 min 内小鼠从滚轴上掉落的次数,并记录从测试开始至第1次掉落的时间,视为掉落潜伏期。行为学测试后各组取3只小鼠快速断头处死,冰上分离中脑部分,液氮冷冻,高效液相—电化学法测定DA含量。
1.2.3 线粒体跨膜电位及线粒体复合物Ⅰ活性的检测:行为学实验完成后,冰上分离各组老龄SAMP8小鼠中脑黑质部分,使用线粒体分离试剂盒进行线粒体的分离和提取。按试剂盒说明书步骤操作。使用流式细胞仪检测线粒体膜电位。选用FL-1 和FL-2通道,加入 JC-1 荧光试剂及线粒体,对捕获的绿色和红色荧光信号进行分析。绿色荧光值代表单体含量,红色荧光值代表聚合体,红绿荧光值的比值代表膜电位的高低,数值越小,膜电位越小。采用分光光度法检测各组老龄SAMP8小鼠线粒体复合物Ⅰ的活性,以每分钟每毫克蛋白中消耗的烟 酰 胺腺 嘌 呤二核 苷 酸(nicotinamideadenine dinucleotid,NADH)的检测值表示。
1.3 统计学分析
采用 SPSS 16.0 统计学软件进行分析。各组之间比较采用单因素方差分析,两两比较采用LSD检验,P< 0.05为差异有统计学意义。
2 结果
2.1 各组小鼠滚轴实验结果
与空白组比较,模型组小鼠在滚轴上运动的掉落潜伏期显著缩短,掉落次数明显增加(P< 0.05);而与模型组相比,不同剂量RAPA组小鼠掉落潜伏期延长,掉落次数减少,差异有统计学意义(P<0.05);RAPA 低、中、高剂量组之间无统计学差异(P< 0.05)。见表1。
表1 各组小鼠滚轴实验成绩Tab.1 Rolling test performance on mice in every group(x±s)
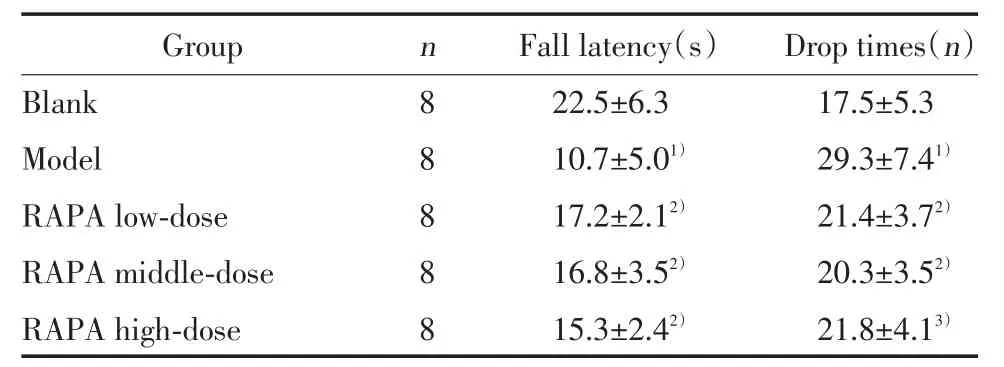
表1 各组小鼠滚轴实验成绩Tab.1 Rolling test performance on mice in every group(x±s)
1)P < 0.01 vs blank group;2)P < 0.05 vs model group;3)P < 0.01 vs model group.
Group n Fall latency(s) Drop times(n)Blank 8 22.5±6.3 17.5±5.3 Model 8 10.7±5.01) 29.3±7.41)RAPA low-dose 8 17.2±2.12) 21.4±3.72)RAPA middle-dose 8 16.8±3.52) 20.3±3.52)RAPA high-dose 8 15.3±2.42) 21.8±4.13)
2.2 各组小鼠黑质DA含量
与空白组小鼠黑质 DA 含量[(632.33±89.21)nmol/L]比较,模型组小鼠黑质 DA 含量[(107.52± 28.15)nmol/L]下降 83.0%(P < 0.05);与模型组比较,RAPA 低、中、高剂量组黑质 DA 含量[(433.26± 76.10) nmol/L,(478.21 ± 80.91) nmol/L,(482.26 ± 66.43)nmol/L]均显著升高,差异有统计学意义(P <0.05);RAPA 不同剂量组之间无统计学差异(P >0.05)。
2.3 各组小鼠黑质线粒体膜电位及线粒体复合物Ⅰ活性
与空白组相比,模型组小鼠黑质线粒体膜电位、线粒体复合物Ⅰ活性显著下降(P< 0.05);与模型组相比,各剂量RAPA组小鼠的上述指标显著增加,差异有统计学意义(P < 0.05);而各剂量 RAPA组之间比较无统计学差异(P> 0.05)。 见表 2。
表2 各组小鼠黑质线粒体膜电位、线粒体复合物Ⅰ活性Tab.2 Mitochondrial membrane potential and mitochondrial complex I activity in the substantia nigra of mice in each group(x±s)
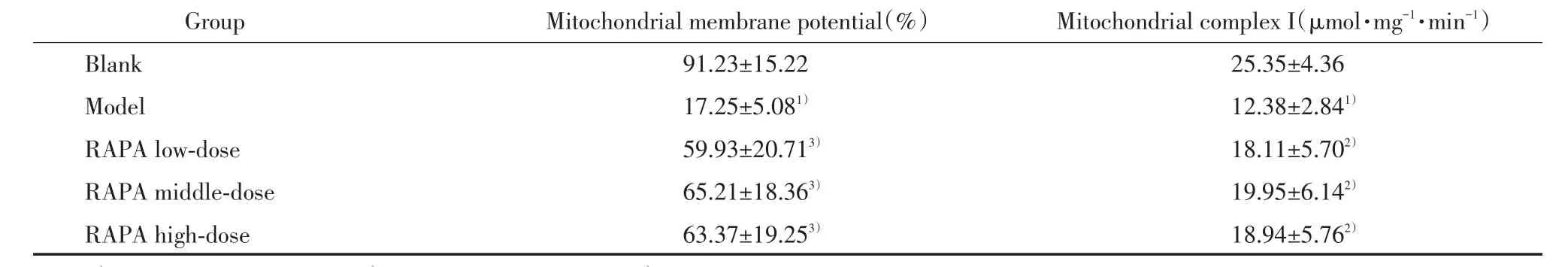
表2 各组小鼠黑质线粒体膜电位、线粒体复合物Ⅰ活性Tab.2 Mitochondrial membrane potential and mitochondrial complex I activity in the substantia nigra of mice in each group(x±s)
1)P < 0.01 vs blank group;2)P < 0.05 vs model group;3)P < 0.01 vs model group.
Group Mitochondrial membrane potential(%) Mitochondrial complex I(μmol·mg-1·min-1)Blank 91.23±15.22 25.35±4.36 Model 17.25±5.081) 12.38±2.841)RAPA low-dose 59.93±20.713) 18.11±5.702)RAPA middle-dose 65.21±18.363) 19.95±6.142)RAPA high-dose 63.37±19.253) 18.94±5.762)
3 讨论
衰老因素的PD致病性越来越受到重视,它与环境毒素、遗传因素等共同作用,导致氧化应激、免疫炎症等改变,加速 PD 的发生和发展[5-7]。而 PD 线粒体的生物学改变及其功能障碍也是目前被关注的热点。一方面,线粒体产生ATP,供给DA能神经元所需能量,保证 DA 的足量释放[8];另一方面,线粒体内存在部分α突触核蛋白,可以选择性地与线粒体膜相互作用[9]。线粒体结构功能异常时,α 突触核蛋白过表达,导致神经递质和纹状体 DA 释放减少[10]。 本 研 究 结 果 显 示 ,在 MPTP 作 用 于 老 龄SAMP8小鼠所致的亚急性PD模型中,其运动功能和黑质DA含量比正常老龄小鼠显著降低,线粒体复合物Ⅰ活性和线粒体膜电位显著下降。
RAPA作为一种传统的大环内酯类抗生素,不仅可以作为免疫抑制剂应用于器官移植,还可用于治疗心血管疾病,防止血管再狭窄[11];目前,越来越多的研究表明,RAPA对于年龄相关的神经退行性疾病模型具有治疗作用,表现出很强的抗老化效果。本课题 组 的 前期研究[12]发现,向培养的老 龄SAMP8 系原代神经元中加入 RAPA,可有效抑制mTOR通路活性,降低神经元内Tau蛋白磷酸化的水平,从而有效保护海马区神经元。MALAGELADA等[13]将 RAPA 作用于 PD 的体内和体外模型,通过抑制影响神经元存活、mTORC1依赖的细胞前体凋亡蛋白 RTP801/REDD1/Ddit4 的翻译,抑制 Akt激酶的脱磷酸化,阻止了神经元的死亡。DEHAY 等[14]亦认为RAPA通过恢复PD体内、外模型中溶酶体的病理性损毁抑制PD相关的DA能神经性退化。另有研究[15]报道,对 6-OHDA 诱导的 PD 模型大鼠给予 RAPA预处理,可以通过抑制氧化应激起到抗氧化、抗凋亡的作用,有效保护DA能神经元。本研究使用老龄的SAMP8系制成PD模型,给予RAPA制作模型前、中、后的处理,从抑制老龄小鼠线粒体损伤的角度进行观察分析,发现RAPA确实能够改善PD小鼠的运动功能和DA水平,其降低的线粒体膜电位和线粒体复合物Ⅰ活性均明显增高;同时,本研究设计了不同剂量的RAPA进行干预,发现不同剂量组的效果一致,证实RAPA对老龄PD模型小鼠具有保护作用,为临床诊治PD提供了新的思路,但具体的使用剂量和相关机制需要进一步的探索。
[1]RODRIGUEZ-NOGALES C,GARBAYO E,CARMONA-ABELLAN MM,et al.Brain aging and Parkinson’s disease:new therapeutic approaches using drug delivery systems[J].Maturitas,2016,84:25-31.DOI:10.1016/j.maturitas.2015.11.009.
[2]YAND W,LI X,LI X,et al.Neuronal hemoglobin in mitochondria is reduced by forming a complex with α -synuclein in aging monkey brains[J].Oncotarget,2016,7(7):7441-7454.DOI:10.18632/oncotarget.7046.
[3]KENNEDY BK,LAMMING DW.The mechanistic target of rapamycin:the grand conducTOR of metabolism and aging[J].Cell Metab,2016,23(6):990-1003.DOI:10.1016/j.cmet.2016.05.009.
[4]SASAZAWA Y,SATO N,UMEZAWA K,et al.Conophylline protects cells in cellular models of neurodegenerative diseases by inducing mammalian target of rapamycin(mTOR)-independent autophagy [J].J Biol Chem,2015,290(10):6168-6178.DOI:10.1074/jbc.M114.606293.
[5]BOLNER A,MICCIOLO R,BOSELLO O,et al.A panel of oxidative stress markers in Parkinson’s disease[J].Clin Lab,2016,62(1/ 2):105-112.
[6]ROCHA EM,SMITH GA,PARK E,et al.Progressive decline of glucocerebrosidase in aging and Parkinson’s disease [J].Ann Clin Transl Neurol,2015,2(4):433-438.DOI:10.1002/acn3.177.
[7]HUANG Y,ZHAO Z,WEI X,et al.Long-term trihexyphenidyl exposure alters neuroimmune response and inflammation in aging rat:relevance to age and Alzheimer’s disease[J].J Neuroinflammation,2016,13(1):175.DOI:10.1186/s12974-016-0640-5.
[8]STERKY FH,HOFFMAN AF,MILENKOVIC D,et al.Altered dopamine metabolism and increased vulnerability to MPTP in mice withpartial deficiency of mitochondrial complex Ⅰ in dopamine neurons[J].Hum Mol Genet,2012,21(5):1078-1089.DOI:10.1093/hmg/ ddr537.
[9]NAKAMURA K,NEMANI VM,WALLENDER EK,et al.Optical reporters for the conformation of alpha-synuclein reveal a specific interaction with mitochondria[J].J Neurosci,2008,28(47):12305-12317.DOI:10.1523/JNEUROSCI.3088-08.2008.
[10]LUNDBLAD M,DECRESSAC M,MATTSSON B,et al.Impaired neurotransmission caused by overexpression of α -synuclein in nigral dopamine neurons[J].Proc Natl Acad Sci USA,2012,109(9):3213-3219.DOI:10.1073/pnas.1200575109.
[11]BAROJA-MAZO A,REVILLA-NUIN B,RAMIREZ P,et al.Immunosuppressive potency of mechanistic target of rapamycin inhibitors in solid-organ transplantation[J].World J Transplant,2016,6(1):183-192.DOI:10.5500/wjt.v6.i1.183.
[12]MA Q,QIANG J,GU P,et al.Age-related autophagy alterations in the brain of senescence accelerated mouse prone 8(SAMP8)mice[J].Exp Gerontol,2011,46(7):533-541.DOI:10.1016/j.exger. 2011.02.006.
[13]MALAGELADA C,JIN ZH,JACKSON-LEWIS V,et al.Rapamycin protects against neuron death in in vitro and in vivo models of Parkinson’s disease[J].J Neurosci,2010,30(3):1166-1175. DOI:10.1523/JNEUROSCI.
[14]DEHAY B,BOVE J,RODRIGUEZ-MUELA N,et al.Pathogenic lysosomal depletion in Parkinson’s disease[J].J Neurosci,2010,30(37):12535-12544.DOI:10.1523/JNEUROSCI.1920-10.2010.
[15]JIANG J,JIANG J,ZUO Y,et al.Rapamycin protects the mitochondria against oxidative stress and apoptosis in a rat model of Parkinson’s disease[J].Int J Mol Med,2013,31(4):825-832.DOI:10.3892/ijmm.2013.1280.
(编辑 王又冬)
Protective Effect of Rapamycin against Mitochondrial Injury in an Aging Parkinson’s Disease Mouse Model
ZHANG Zhongxia,MA Xiaowei,WANG Yanyong,QIU Huiqing,WANG Mingwei
(Department of Neurology,the First Hospital of Hebei Medical University,Brain Aging and Cognitive Neuroscience Laboratory of Hebei Province,Shijiazhuang 050031,China)
ObjectiveTo investigate the effect of rapamycin(RAPA)on mitochondrial injury in a mouse model of aging Parkinson’s disease(PD).MethodsForty senescence-accelerated prone mice 8(SAMP8)(12-month old)were randomly divided into 5 groups:blank group,model group,and RAPA low-,middle-,and high-dose groups.Mice in the model group and three RAPA groups were administered a subcutaneous injection of MPTP to generate the PD model.RAPA at 1,2,and 4 mg·kg-1·d-1was administered from 7 days before,5 days during,and 7 days after the PD model preparation to the RAPA groups;an equal volume of sterile saline was administered to the other two groups.After the administration,behavioral test scores,dopamine levels,transmembrane potential of mitochondria,and activity of mitochondrial complexⅠ in the 5 groups were evaluated.ResultsBehavioral scores,dopamine levels,transmembrane potential,mitochondrial complex Ⅰ activity of mice in the model group were significantly decreased compared with the blank group(P < 0.05 respectively).All indexes in the RAPA groups were significantly improved compared to the model group(P < 0.05 respectively).There was no significant difference among the three RAPA groups.ConclusionRAPA has a protective effect on aging PD model mice,and its mechanism may be related to the protection against mitochondrial damage.
rapamycin;aging;Parkinson’s disease;mitochondria
R743
A
0258-4646(2017)09-0783-04
http://kns.cnki.net/kcms/detail/21.1227.R.20170906.1317.008.html
10.12007/j.issn.0258-4646.2017.09.004
河北省医学科学研究重点课题计划(20160202);河北医科大学第一医院“星火”青年科研项目(XH201711)
张忠霞(1982-),女,主管技师,硕士.
邱会卿,E-mail:807148832@qq.com
2016-12-05
网络出版时间:2017-09-06 13:17
