槲皮素PLGA-TPGS纳米粒对小鼠肝癌异位实体瘤治疗效果的研究
2017-09-21徐红张成鸿关欣董浩徐荣谦陈雨高萌田燕
徐红,张成鸿,关欣,董浩,徐荣谦,陈雨,高萌,田燕
(大连医科大学 1. 基础医学院机能学实验室;2. 药学院药剂学教研室;3. 八年制2016级临床医学专业,辽宁 大连 116044)
槲皮素PLGA-TPGS纳米粒对小鼠肝癌异位实体瘤治疗效果的研究
徐红1,张成鸿1,关欣2,董浩2,徐荣谦3,陈雨3,高萌2,田燕2
(大连医科大学 1. 基础医学院机能学实验室;2. 药学院药剂学教研室;3. 八年制2016级临床医学专业,辽宁 大连 116044)
目的考察槲皮素 PLGA-TPGS 纳米粒(QPTN)在体内对荷腹水型肝癌高淋巴道转移细胞 HCa-F 小鼠异位移植实体瘤的治疗效果。方法建立荷 HCa-F 肝癌细胞小鼠模型后,随机分为阴性对照组、空白纳米粒组、5-氟尿嘧啶溶液(FS)组、槲皮素溶液(QTS)组、槲皮素 PLGA 纳米粒(QPN)组和 QPTN 组。尾静脉给药,每 2 d 1 次,连续给药 20 d 后处死小鼠,剥离肿瘤,称质量,测量肿瘤体积,根据公式计算肿瘤体积增长量和抑瘤率;行HE染色观察肿瘤,全面评价QPTN对荷瘤小鼠的治疗效果。结果小鼠体内给药 10 次后,QPTN 组、QPN 组、FS 组的肿瘤体积增长量与阴性对照组相比明显减小(P < 0.05 或P < 0.01),QPTN 组抑瘤率(59.07%)明显高于 QTS 组(23.94%)、FS 组(35.14%)和 QPN 组(46.14%)。HE 染色结果也显示 QPTN 组对小鼠肿瘤的治疗效果最明显。结论与QPN、QTS和FS相比,QPTN对荷HCa-F肝癌细胞小鼠异位实体瘤具有较好的治疗效果。
槲皮素;纳米粒;小鼠;肿瘤;HCa-F肝癌细胞;抑瘤率
肝癌是最常见的、死亡率较高的恶性肿瘤之一[1]。采用纳米粒(nanoparticles,NPs)等靶向给药系统不仅可增加药物对肿瘤组织的靶向性,减少用药量,从而降低对正常细胞的毒性,还可改变药物的体内溶解性和体外稳定性,提高其在靶部位的生物利用度,是目前常见的肝癌治疗手段之一[2]。槲皮素(Quercetin,QT)主要分布在槐花、丹皮、菊花等多种植物的花、叶、果实中,来源非常广泛,具有抗炎、抗病毒、抗肝癌等多种药理作用[3-7]。本研究拟建立荷腹水型肝癌高淋巴道转移细胞HCa-F小鼠异位移植肿瘤模型[8],采用自制材料乳酸羟基乙酸共聚物-维生素 E 聚乙二醇 1000 琥珀酸酯(polylacticco-glycolic acid tocopherol polyethylene glycol 1000 succinat,PLGA-TPGS)为载体,制备 QT 纳米粒(QT-loaded PLGA-TPGS NPs,QPTN),并 以 市 售 材 料PLGA 为 载 体 制 备 的 QT PLGA 纳 米 粒(QT-loaded PLGA NPs,QPN)作对照,通过计算给药后肿瘤体积增长量、抑瘤率(tumor inhibition rate,TIR)、瘤内 QT含量和观察肿瘤切片苏木素和曙红(HE)染色,定量、定性地全面考察QPTN对小鼠体内异位实体瘤的治疗效果。
1 材料与方法
1.1 材料
1.1.1 试剂:QT 对照品(中国药品生物制品检定所,批号 100081-200907,纯度 99%);QT(美仑生物公司,批号 20140105,纯度 96%);QPTN(药剂学教研室自制,批号 20140910,QT:215 mg/g);QPN(药剂学教研室自制,批号 20140910,QT:150 mg/g);5-氟尿嘧啶注射液(25 mg/mL,上海旭东海普药业有限公司,批号1402181);香兰素(分析纯,北京化学试剂公司,批号010901,纯度99%)。
1.1.2 细胞株:小鼠腹水型高淋巴道转移 HCa-F 细胞株由大连医科大学形态学实验室提供。
1.1.3 实验动物:健康 8 周龄昆明种小鼠(SPF 级),体质量 20~25 g,由大连医科大学实验动物中心提供,许可证号 SCXK(辽)2008-0002。
1.2 方法
1.2.1 瘤内测定 QT 的色谱条件:色谱柱为 Hypersil C18(4.6 mm×250 mm,5 μm);检测波长为 360 nm;流速为 0.8 mL/min;流动相为乙腈∶0.3%磷酸水溶液(33∶67);柱温为 30 ℃;进样量为 20 μL。
1.2.2 动物分组及给药方案:参考文献[8]建立荷HCa-F细胞小鼠肝癌异位实体瘤模型,将实体瘤长径(12~15 mm)符合要求的小鼠随机分为阴性对照组、空白纳米粒(EPTN)组、5-氟尿嘧啶溶液(5-fluorouracil solutions,FS)组、槲皮素溶液(QTS)组、QPN组和QPTN组,每组8只,采用尾静脉给药方式,每2 d 给药 1 次,持续给药 20 d。阴性对照组注射含 20% PEG40 的 生理盐水溶液 0.2 mL;EPTN 组注射不 含QT的空白纳米粒,材料及浓度与QPTN相同;FS组注射 FS(取 25 mg/mL 的 5-氟尿嘧啶溶液 1 mL 置 10 mL量瓶中,加入含20%PEG400的生理盐水溶液定容 至 刻 度)10 mg/kg;QTS 组 注射 QTS(取 QT 12.50 mg置 10 mL 量瓶中,加入含 20%PEG400 的生理盐水溶液溶解、定容至刻度)10 mg/kg;QPN 组、QPTN组 分 别 注 射 相 当 于 10 mg/kg QT 的 QPN 混 悬 液 或QPTN 混悬液(取 QPN 82.78 mg 或 QPTN 57.87 mg置10 mL量瓶中,加入含20%PEG400的生理盐水溶液分散、定容至刻度,注射前在100 W超声条件下超声1 min 后备用)。
1.2.3 检测指标:
1.2.3.1 肿瘤体积增长量 在给药前后,用游标卡尺测量小鼠肿瘤的长径及短径,计算肿瘤体积[体积=长径×(短径)2/2]和实体瘤体积增长量(实体瘤体积增长量=给药后实体瘤体积-给药前实体瘤体积)。
1.2.3.2 小鼠体质量监测 给药期间在每次给药前测定每只小鼠的体质量,按照实际体质量调整给药剂量,并记录各组小鼠体质量变化。
1.2.3.3 TIR 在停药次日,颈椎脱位法处死小鼠,小心剥离瘤体,称质量。计算 TIR(%)=(阴性对照组平均瘤质量-给药组平均瘤质量)/阴性对照组平均瘤质量×100。
1.2.3.4 瘤内 QT 含量的测定 (1)QT 和香兰素对照贮备液的配制。取干燥至恒重的 QT 对照品 5.0 mg,用甲醇溶解、定容至 50 mL,配成浓度为 100 μg/mL的 QT 对照贮备液。取香兰素对照品 25.0 mg,加甲醇溶解、定容至 10 mL,配成浓度为 2.5 mg/mL 的内标对照贮备液,4 ℃贮存备用。(2)QT 系列浓度对照溶液的配制。取 QT 对照贮备液 5、10、20、40、80、160、320 μL 于 10 mL 量瓶中,分别加入香兰素内标对照贮备液 100 μL,加甲醇定容至刻度,配成浓度为 0.5、1.0、2.0、4.0、8.0、16.0、32.0 μg/mL 的 QT 系列对照溶液(含香兰素 25.0 μg/mL),4 ℃贮存备用。(3)QT标准曲线的绘制。随机选取阴性对照组的2只小鼠,剖取实体瘤后称质量,加入4倍量的生理盐水后研磨成匀浆。量取实体瘤匀浆 400 μL 7 份,分别置 5 mL 离心管中,每份分别加入 QT 系列浓度对照溶液 100 μL,涡旋 1 min 混合均匀,加入乙酸乙酯 2 mL 萃取,涡旋混合 1 min,10 000 r/min 离心 10 min。分离出有机层并用氮气流吹干,残留物加入甲醇0.2 mL 复溶,涡旋 1 min 后,按 1.2.1 色谱条件测定。(4)瘤内 QT 含量的测定。随机选取 QTS、QPN、QPTN组中的6只小鼠,剖取实体瘤,称质量,加入4倍量的生理盐水后研磨成匀浆,按照 1.2.1 色谱条件测定QT与内标峰面积,再计算QT含量。
1.2.3.5 标本采集与 HE 染色处理 随机选取 2 个称质量后的肿瘤,切取适宜部位的组织并将其及时固定在 10%中性甲醛缓冲液中,固定 24 h,冲洗、脱水透明、浸蜡、包埋并制石蜡切片,行HE染色,观察肿瘤组织形态学的改变。
1.3 统计学分析
采用 SPSS 13.0 统计软件进行统计学分析。数据用x± s表示,采用方差分析比较多组资料,P<0.05为差异有统计学意义。
2 结果
2.1 瘤内测定QT的色谱条件
在 1.2.1 色谱条件下,QT 与其他各组分峰和内标物香兰素(1.0 μg/mL)色谱峰能达到基线分离,空白小鼠肿瘤匀浆对样品的测定均无干扰,保留时间分别为 7.2 min、5.1 min,理论板数按 QT 峰计算不低于 3 000,其肿瘤匀浆的色谱图见图1。以QT 与香兰素峰面积(A)的比值对浓度C进行线性回归,得到肿瘤匀浆中 QT 的标准曲线方程为 A=0.058 4C+ 0.008,r=0.9991。结果表明,QT 在肿瘤匀浆中 0.5~32.0 μg/mL 范围内线性关系良好。以信噪比为 3 和10作为QT的检测限与定量限,测得二者分别为 0.3 μg/mL 与 0.5 μg/mL,方法学考察结果均符合相关规定。
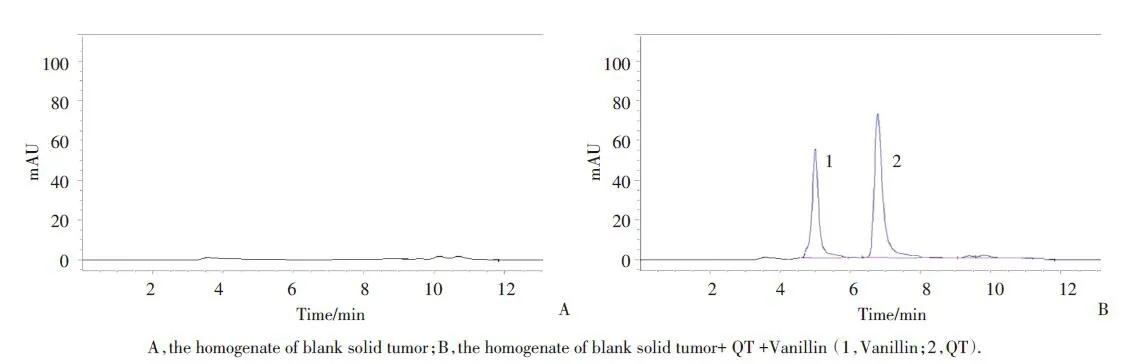
图1 QT的反相高效液相色谱图Fig.1 RP-HPLC images of QT
2.2 小鼠体质量的监测
给药期间各组小鼠的体质量均有一定程度的增长(图2),其中,阴性对照组和EPTN 组小鼠增长较明显;QPTN组小鼠的体质量改变相对较小,但与阴性对照组和EPTN组相比差异无统计学意义(P>0.05);各 组 之 间 比 较 ,差 异 无 统 计 学 意 义(P > 0.05)。
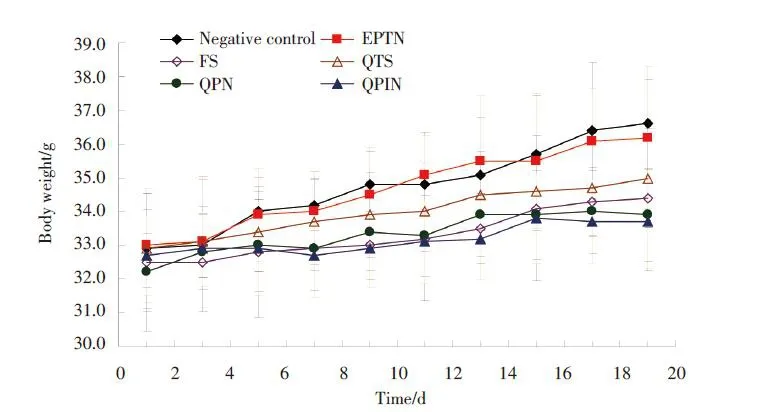
图2 荷瘤小鼠给药期间体质量变化(n=8)Fig.2 The average body weight of the mice in each group during the administration period(n=8)
2.3 肿瘤体积增长量和TIR 的测定结果
给药前后小鼠肿瘤体积增长量和TIR测定结果见表1。结果表明,给药后,FS组、QPN组、QPTN组的肿瘤体积增长量与阴性对照组相比具有统计学差异(P< 0.05),说明这 3 组均能在不同程度上抑制肿瘤的生长,QTS组也有一定程度的减小,但与阴性对照组相比差异无统计学意义,而EPTN组没有明显效果。与QTS组相比,QPTN组、QPN组抑制肿瘤生长的效果更为明显,小鼠肿瘤体积增长量分别降低了 1.57、0.93 cm3,但差异无统计学意义;TIR 分别增加了 35.13%、22.14%,且 QPTN 效果更显著,TIR较 QPN 组增加了 12.93%,肿瘤体积增长量减少了0.64 cm3。与 FS 组相比,QPTN 组、QPN 组对肿瘤的抑制作用也相对更明显,2组小鼠肿瘤体积增长量比 FS 组分别降低了 1.48、0.84 cm3,但差异无统计学意义,TIR 分别增加了 23.93%、11.00%,表明自制纳米粒组比市售的5-氟尿嘧啶注射液对荷瘤小鼠肿瘤的生长具有更好的抑制效果。
2.4 肿瘤内QT含量的测定
表1 给药前后肿瘤体积增长情况、抑瘤率及瘤内QT含量Tab.1 Tumor volumes,tumor inhibition rates,and QT content in each group(
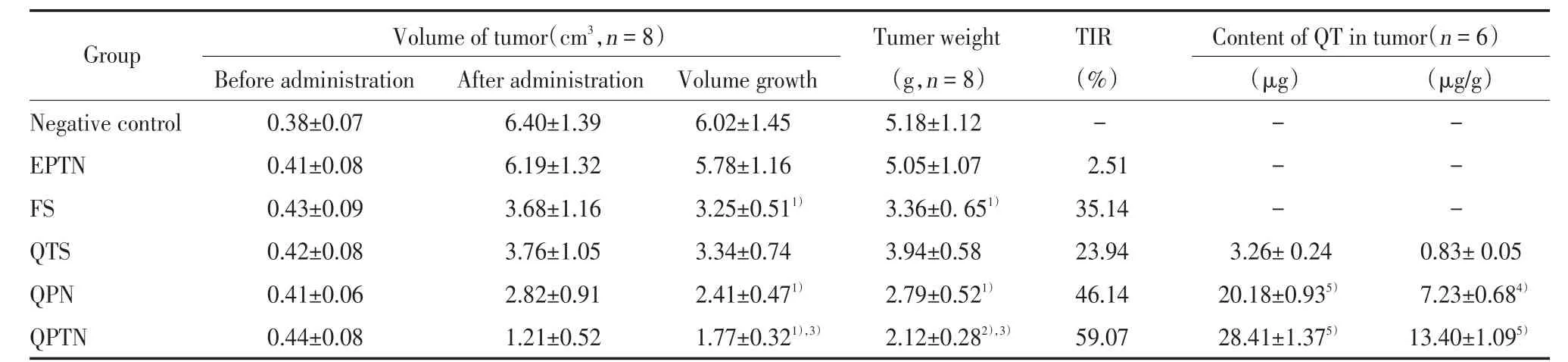
表1 给药前后肿瘤体积增长情况、抑瘤率及瘤内QT含量Tab.1 Tumor volumes,tumor inhibition rates,and QT content in each group(
1)P < 0.05,2)P < 0.01 vs the negative control group and EPTN group,respectively;3)P < 0.05 vs corresponding QTS group;4)P < 0.05,5)P < 0.01 vs corresponding QTS group,respectively.TIR,tumor inhibition rate.
Group Volume of tumor(cm3,n=8) Tumer weight TIR Content of QT in tumor(n=6)Before administration After administration Volume growth (g,n=8) (%) (μg) (μg/g)Negative control 0.38±0.07 6.40±1.39 6.02±1.45 5.18±1.12 - - -EPTN 0.41±0.08 6.19±1.32 5.78±1.16 5.05±1.07 2.51 - -FS 0.43±0.09 3.68±1.16 3.25±0.511) 3.36±0.651) 35.14 - -QTS 0.42±0.08 3.76±1.05 3.34±0.74 3.94±0.58 23.94 3.26± 0.24 0.83± 0.05 QPN 0.41±0.06 2.82±0.91 2.41±0.471) 2.79±0.521) 46.14 20.18±0.935) 7.23±0.684)QPTN 0.44±0.08 1.21±0.52 1.77±0.321),3) 2.12±0.282),3) 59.07 28.41±1.375) 13.40±1.095)
采用 RP-HPLC 法测定 QTS、QPN和 QPTN 组小鼠给药后肿瘤内的QT含量,结果见表1。可见2个纳米粒组瘤内QT含量均比QTS组高,差异有统计学意义(P < 0.05 或P < 0.01)。
2.5 HE染色
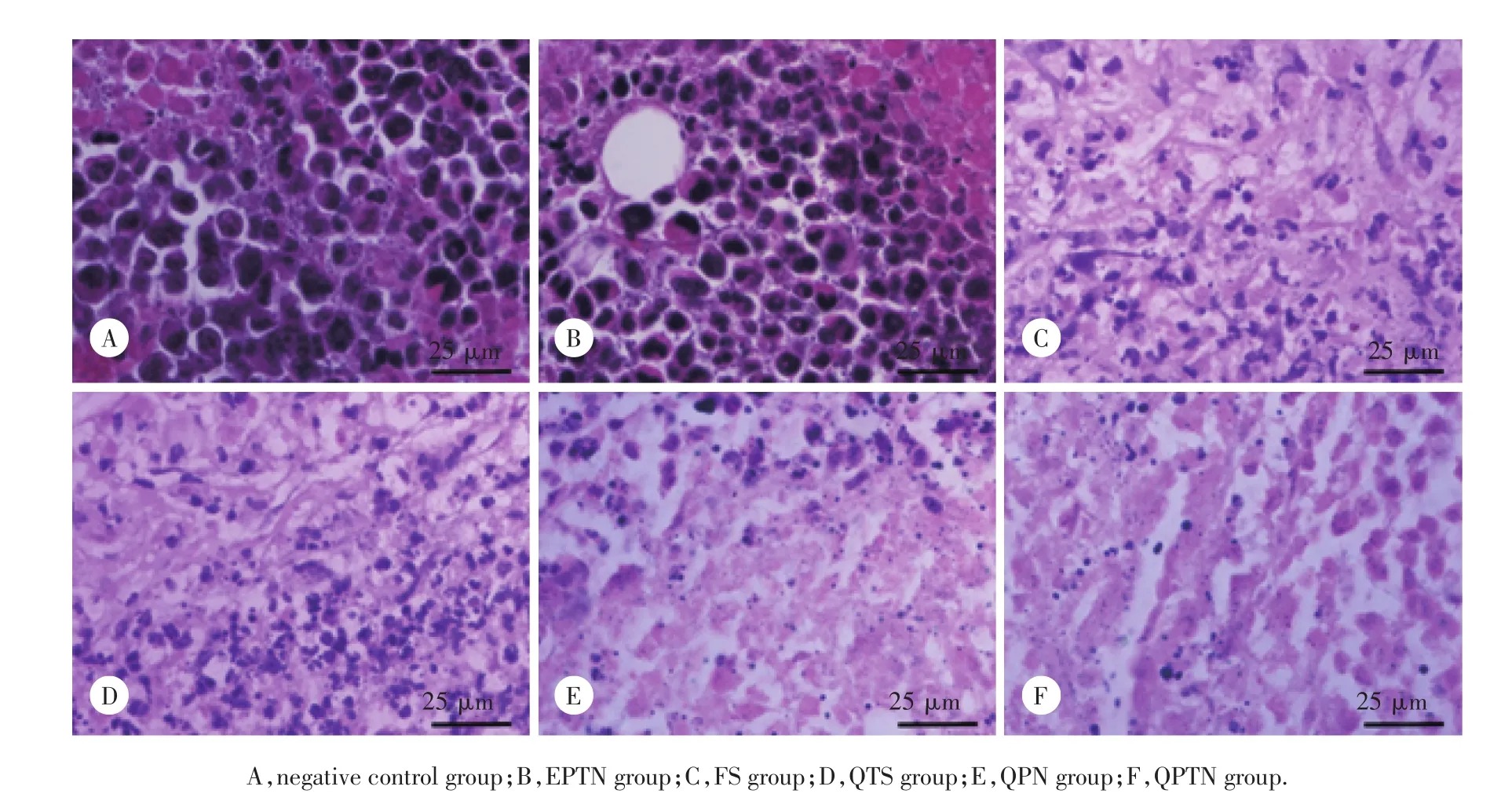
图3 代表性的HCa-F细胞肝癌实体瘤组织切片 HE ×400Fig.3 Representative images of HCa-F hepatocarcinoma solid tumors HE×400
将称质量后的肿瘤切片行HE染色、镜检,典型图片结果见图3。阴性对照组(图3A)肿瘤细胞形态完整,生长旺盛、浆少核大,多为单核或多核,位于细胞中央位置。EPTN组(图3B)与阴性对照组无明显差异,细胞数量多、排列紊乱、密集成团。FS组(图3C)肿瘤组织内出现大面积的坏死区域,细胞核的颜色逐渐变浅。与QTS组(图3D)相比,QPTN组(图3F)有更多的破碎和结构不完整的细胞出现,边缘形态较为模糊,而QPN组(图3E)介于二者之间,可见纳米粒较QT溶液抑制肿瘤的效果更加显著。结果表明,无论从肿瘤体积增长量、TIR定量方面,还是从病理学切片定性方面,QPTN对肿瘤的治疗效果最好,其次是QPN,且纳米粒载体材料PLGATPGS对肿瘤生长无明显的抑制作用(图3B)。
3 讨论
本研究组在预实验中曾采用 1 次/d 的给药频率,结果FS组小鼠在第4天出现死亡,其他组小鼠(尤其 QTS 组)精神状态不佳,故改为每 2 d 1 次尾静脉给药,连续给药20 d。同时,延长给药间隔使纳米粒可以更加完全地发挥其缓释作用,从而达到更好的治疗效果。
本研究结果显示,与其他组相比,QPTN对荷HCa-F细胞小鼠肝癌异位实体瘤具有良好的治疗效果。分析其原因是由于QPTN粒径较小、表面带负电荷(绝对值较大),具有较好的被动靶向性,并且PLGA-TPGS是两亲性载体材料,本研究前期采用超声乳化—溶剂挥发法制备的QPTN属于纳米球型纳米粒,模型药物QT可以分子或无定型粉末状态高度分散在载体材料中,材料在体液或细胞质中溶解较慢,故有很好的缓释作用;同时,由于TPGS具有一定的水溶性,材料在体内可以逐渐溶解和降解,故可将药物更完全地释放出来、更好地发挥其抗肿瘤作用[9-11]。与 QTS 组和 FS 组比较,QPTN 和 QPN 这 2种纳米粒对肿瘤都发挥了较好的治疗效果,这是因为纳米粒在体内能缓慢而持续地释放药物,能被肿瘤细胞更好地摄取,对肿瘤组织具有良好的靶向作用[9-11],而 QTS 和 FS 静脉注射给药后没有选择性和缓释性,故治疗效果不如纳米粒组。在2种纳米粒中,QPTN对肿瘤生长的抑制作用比QPN好,这是由于与QPN相比,QPTN具有更小的粒径,更高的载药量,可以被肿瘤细胞摄取的更多,进入细胞内的QT量也更大,同时,制备QPTN的自制载体上所连接的TPGS不仅可降低肿瘤细胞内P-糖蛋白介导的多药耐药性,减少 QT 从细胞中外排[12],加强 QT 的吸收,还由于TPGS具有良好的亲水性,可以使QT在细胞内释放、溶解的更多,从而更好地发挥对肿瘤的治疗作用。
[1]EL-SERAG HB.Hepatocellular carcinoma:an epidemiologic view[J].J Clin Gastroenterol,2002,35(Suppl 2):S72-S78.
[2]MEHTA RG,MURILLO G,NAITHANI R,et al.Cancer chemoprevention by natural products:how far have we come? [J].Pharm Res,2010,27(6):950-961.DOI:10.1007/s11095-010-0085-y.
[3]张志琴,朱双雪 .槲皮素的药理活性与临床应用研究进展[J].药学研究,2013,32(7):400-403.
[4]DAJAS F.Life or death:neuroprotective and anticancer effects of quercetin[J].J Ethnopharmacol,2012,143(2):383-396.DOI:10.1016/j.jep.2012.07.005.
[5]赵旭林,徐国昌,贺利民,等.槲皮素诱导人肝癌 HepG2细胞凋亡的实验研究[J].实用心脑肺血管病杂志,2010,18(3):310-311.
[6] TAN J,WANG B,ZHU L.Regulation of survivin and Bcl-2 in HepG2 cell apoptosis induced by quercetin[J].Chem Biodivers,2009,6(7):1101-1110.DOI:10.1002/cbdv.200800141.
[7]舒毅,谭陶,张思宇,等 .槲皮素的药理学研究进展[J].华西药学杂志,2008,23(6):689-691.
[8]GAO M,XU H,ZHANG CH,et al.Preparation and characterization of curcumin thermosensitive hydrogels for intratumoral injection treatment[J].Drug Dev Ind Pharm,2014,40(11):1557-1564. DOI:10.3109/03639045.2013.838579.
[9]顾晓华,秋泽文,徐红,等 .齐墩果酸/PLGA-TPGS 纳米粒在小鼠体内的分布及肝靶向性研究[J].中国药房,2012,23(33):3086-3089.DOI:10.6039/j.issn.1001-0408.2012.33.06.
[10]BAO X,GAO M,XU H,et al.A novel oleanolic acid-loaded PLGATPGS nanoparticle for liver cancer treatment[J].Drug Dev Ind Pharm,2015,41(7):1193-1203.DOI:10.3109/03639045.2014. 938081.
[11]LIU H,GAO M,XU H,et al.A promising Emodin-loaded poly(lactic-co-glycolic acid)-d-α-tocopheryl polyethylene glycol 1000 succinate nanoparticles for liver cancer therapy[J].Pharm Res,2016,33(1):217-236.DOI:10.1007/s11095-015-1781-4.
[12]GUO Y,LUO J,TAN S,et al.The applications of vitamin E TPGS in drug delivery[J].Eur J Pharm Sci,2013,49(2):175-186. DOI:10.1016/j.ejps.2013.02.006.
(编辑 王又冬)
The Therapeutic Effect of Quercetin-loaded PLGA-TPGS Nanoparticles on the Hepatocarcinoma Ectopic Solid Tumor-bearing Mice
XU Hong1,ZHANG Chenghong1,GUAN Xin2,DONG Hao2,XU Rongqian3,CHEN Yu3,GAO Meng2,TIAN Yan2
(1.Laboratory of Medical Function,College of Basic Medical Sciences,Dalian Medical University,Dalian 116044,China;2.Department of Pharmaceutics,College of Pharmacy,Dalian Medical University,Dalian 116044,China;3.Students at Grade 2016 in Clinical Medical Eight Grade,Dalian Medical University,Dalian 116044,China)
ObjectiveTo investigate the therapeutic effects of Quercetin(QT)-loaded PLGA-TPGS nanoparticles(QPTN)on solid tumor-bearing mice with HCa-F hepatocarcinoma in vivo.MethodsThe model of HCa-F hepatocarcinoma solid tumor-bearing mice was established by implanting HCa-F cells into 48 mice.The mice were divided into 6 groups randomly:the negative control,empty PLGA-TPGS nanoparticles,5-Fluorouracil solutions(FS),Quercetin solutions(QTS),QT-loaded PLGA nanoparticles(QPN),and QPTN groups.Each group was treated using tail vein twice a day for 20 days;then,all mice were sacrificed.The increment tumor volumes and tumor growth inhibition rate were counted.Then,tumor specimens were prepared for hematoxylin&eosin(HE)staining and observed under a microscope.ResultsThe results showed that the increment tumor volumes of mice in the QPTN,QPN,and FS groups were significantly smaller than that in the negative control group(P < 0.05 or P < 0.01).The tumor growth inhibition rate of the QPTN group was 59.07%,which was much higher than that of the QTS group(23.94%),the FS group(35.14%),and the QPN group(46.14%).The results of the HE staining on the tumor sections also indicated that the QPTN group showed a better therapeutic outcome compared to the other groups.ConclusionThe QPTN has a better therapeutic effect on the model of solid tumor using HCa-F cells-bearing mice than the QPN,QTS,and FS.
Quercetin;nanoparticles;mice;tumor;HCa-F hepatocarcinoma cells;tumor growth inhibition rate
R944.9
A
0258-4646(2017)09-0791-05
http://kns.cnki.net/kcms/detail/21.1227.R.20170906.1318.010.html
10.12007/j.issn.0258-4646.2017.09.006
辽宁省自然科学基金(2015020308)
徐红(1970-),女,实验师,本科.
田燕,E-mail:tiany2004@126.com
2016-12-08
网络出版时间:2017-09-06 13:18
