miR-126 对 HL-60 细胞系增殖和凋亡等生物学行为的影响
2017-09-21张贺洋张蕊王萍萍王玥王赫李艳
张贺洋,张蕊,王萍萍,王玥,王赫,李艳
(中国医科大学附属第一医院血液科,沈阳 110001)
miR-126 对 HL-60 细胞系增殖和凋亡等生物学行为的影响
张贺洋,张蕊,王萍萍,王玥,王赫,李艳
(中国医科大学附属第一医院血液科,沈阳 110001)
目的观察转染微小 RNA(miR)-126 mimics/inhibitor对人类急性早幼粒细胞白血病细胞系(HL-60)增殖与凋亡的影响。方法培养 HL-60 细胞,RT-PCR 测定 miR-126 相对表达水平,利用瞬时质粒转染技术,转染 miR-126 mimics/inhibitor,通过CCK-8,流式细胞技术及克隆形成实验检测 HL-60 细胞增殖、凋亡能力。结果miR-126 mimics组 0 h、24 h、48 h、72 h 细胞增殖能力显著减低(P < 0.05);G1期、S 期、G2期细胞增殖明显受抑制(P < 0.05);晚期凋亡及早期凋亡(UR+LR)凋亡率增高(P <0.05);平均克隆形成率显著减低(P < 0.05);miR-126 inhibitor组 0 h、24 h、48 h、72 h 细胞增殖能力明显增强(P < 0.05);G1期、S期、G2期增殖能力增强(P < 0.05);UR+LR 明显减低(P < 0.05);平均克隆形成率显著升高(P < 0.05)。结论miR-126 能够抑制HL-60细胞增殖能力,促进细胞凋亡,可能作为抑癌性的微RNA在白血病的发生发展中发挥作用。
微小RNA-126;急性白血病;增殖;凋亡;急性早幼粒细胞白血病
微小 RNA(microRNA,miRNA)是从 DNA 转录而来,在真核生物中广泛存在的一类长度约为21~23个核苷酸的非编码核糖核酸分子,通过调控靶基因的表达发挥生物学作用[1]。现已发现 miRNA 在正常细胞发育、肿瘤细胞形成及造血链系分化中发挥重要作用[2-3]。研究[4-5]表明 在急性髓系白 血病(acute myeloid leukemia,AML)和急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)中存在差异表达。微 RNA(miR)-126 位于 9q34,是内皮细胞特异性 miRNA,参与血管新生、干细胞分化、炎症反应、细 胞 凋 亡 等 多 种生 理 过 程[6-7]。 研 究[6,8]表 明 miR-126可以发挥癌基因和抑癌基因的双重作用,它既可促进肿瘤血管新生加速肿瘤发展,亦可以负向调控细胞传导通路控制肿瘤细胞的增殖及侵袭。国外研究[8]显示,miR-126 在核心结合因子相关急性髓系 白 血 病(core binding factor associated acute myeloid leukemia,CBF-AMLs)中高表达,可促进白血病细胞的增殖、抑制凋亡、发挥癌基因的作用,但在t(15;17)白血病患者中低表达,其在这类白血病中起何种生物学作用目前国内外尚无相关研究。本研究通过瞬时转染技术,转染 miR-126 mimics/inhibitor,上调/下调 miR-126 的表达,利用细胞增殖活性 8(cell counting kit-8,CCK-8),流式细胞技术及克隆形成实验,观察对人类急性早幼粒细胞白血病细胞系(human promyelocytic leukemia cell-60,HL-60)细胞增殖、凋亡的影响。
1 材料与方法
1.1 材料
HL-60来至中国医科大学附属第一医院血液研究室;RPMI-1640 购置于 Gibco 公司;miR-126 mimics/inhibitor由上海吉凯公司合成;Attractene Transfection Reagent购置于 QIAGEN 公司;RNase 固相清除剂购置于天恩泽公司;胎牛血清购置于 Hyclone公司;50×TA 购置于海利克思公司;SYBR Green 购置于 Solarbi公司;SuperM-MLV 反转录酶、高纯总RNA 快速提取试剂盒、2×Power Taq PCR、MasterMix购置于 BioTeke 公司;CCK-8 购置于碧云天公司;PBS购置于双螺公司;细胞周期检测试剂盒购置于Wanleibio 公司;甲基纤维素购置于 Adamas-beta 公司;细胞凋亡试剂盒购置于万类生物公司;miR-126引物及U6由万类生物公司合成。
1.2 HL-60细胞培养
10%胎牛血清培养基,37 ℃,5%CO2细胞培养箱中培养,经3次传代,台盼蓝染色检测细胞存活率>97%时,用于实验。半量换液,3 d 传代1 次。
1.3 实时荧光定量PCR
选择U6作为内参对照,引物序列如下:miR-126上游序列为 5’-CGACGGCATTACTTTTGG-3’,下游序列为 5’-GTGCAGGGTCCGAGGTATTC-3’,U6上游序列为 5’-GTCGTTCGGCAGCACA-3’,下游序列为5’-AACGCTTCACGAATTTGCGT-3’。
1.4 CCK-8 细胞增殖实验
培养HL-60细胞至密度为90%左右。离心后加入 1 mL 的完全培养基。96 孔板,6×103/孔,37 ℃、5% CO2培养 30 min。每孔 10 μL 无血清培养基,0.5 μL转染试剂及 0.12 μg质粒,室温放置 20 min。将混合液加入孔中混匀,37 ℃、5%CO2培养 24 h、48 h、72 h。进行CCK-8检测。
1.5 流式细胞技术细胞周期实验
培养HL-60细胞至密度为90%左右。离心,加入 1 mL 完全培养基。6 孔板,5×105/孔,100 μL 无血清培养基,1.2 μg 质粒及 4.5 μL 转染试剂。培养 48 h离心收集细胞,PBS清洗2次,70%乙醇4 ℃固定4 h。PBS 清洗 2 次,加入 100 μL RNase A 重悬,37 ℃避光温育。500 μL 碘化丙啶染色液,4 ℃避光孵育30 min。随即进行流式检测。
1.6 流式细胞技术细胞凋亡实验
培养HL-60细胞至密度为90%左右,6孔板,5× 105/孔,100 μL 无血清培养基,1.2 μg 质粒和 4.5 μL转染试剂培养 48 h。收集细胞,残留 50 μL PBS,加入 500 μL Binding Buffer,5 μL Annexin V-FITC,5 mL 碘化丙啶孵育 15 min。随即进行流式检测。
1.7 克隆形成实验
培养HL-60细胞至密度为90%左右,6孔板,5× 105/孔,100 μL 无血清培养基,1.2 μg 质粒、4.5 μL 转染试剂培养 30 min。转染 48 h 后,进行克隆形成实验。3%甲基纤维素与 RPMI-1640 培养基 1∶1 混合,4 ℃过夜,混匀。每皿接种200个细胞,37 ℃、5%CO2培养3周,进行计数。
1.8 实验分组及统计学分析
HL-60细胞系,10%胎牛血清培养基,37 ℃、5% CO2细胞培养箱中培养,经3次传代,台盼蓝染色检测细胞存活率>97%时,用于实验。随机分成空白(Control)组、阴性对照(NC)组、miR-126 mimics 组、miR-126 inhibitor组 。 应 用 SPSS 17.0 统 计 软 件 分析,计量资料以x± s表示,计量资料组间比较满足方差齐性和正态分布者采用单因素方差分析,不满足则采用秩和检验。计数资料采用 χ2检验,P< 0.05为差异有统计学意义。
2 结果
2.1 转染前后 HL-60 细胞系 miR-126 的表达
实时荧光 PCR 技术测定 HL-60 细胞系 miR-126相对表达量 2-△△Ct均值为 1.00±0.03;NC 2-△△Ct均值为 1.03 ± 0.03;转 染 miR-126 mimics 后 相 对 表 达 量2-△△Ct均值为 2.51±0.16,miR-126 上调(P < 0.05);转染 miR-126 inhibitor 后 相 对 表 达 量 2-△△Ct均 值 为0.45±0.13,miR-126 下调(P< 0.05)。见图 1。
2.2 转染 miR-126 mimics/inhibitor后细胞增殖活性的改变

图1 转染前后 HL-60 细胞中 miR-126 的表达Fig.1 miR-126 expression levels in HL-60 cells observed post-transfection
CCK-8 实验结果显示:Control组 0 h、24 h、48 h、72 h OD 均 值 分 别 为 0.309 ± 0.030、0.491 ± 0.046、0.647±0.062、0.734±0.076;NC 组 0 h、24 h、48 h、72 h OD 均 值 分 别 为 0.305 ± 0.034、0.459 ± 0.048、0.597 ± 0.053、0.664±0.664,无统计学差异(P > 0.05);miR-126 mimics 组 0、24 h、48 h、72 h OD 均 值 分 别 为 0.308 ± 0.031、0.354 ± 0.043、0.424 ± 0.056、0.537 ± 0.059,细胞增殖能力显著减低(P < 0.05);miR-126 inhibitor组 0、24 h、48 h、72 h OD 均值分别为 0.304± 0.035、0.573±0.051、0.794±0.077、0.894±0.08,细胞增殖能力显著增强(P< 0.05)。见图2。
2.3 转染 miR-126 mimics/inhibitor后细胞周期的改变

图2 转染 miR-126 mimics/inhibitor后细胞增殖能力比较Fig.2 Comparison of cell proliferation after transfection with either the miR-126 mimics or inhibitor
流式细胞技术测定细胞周期结果显示:Control组 G1期 均 值(48.16 ± 2.50)% ,S 期 均 值(21.35 ± 1.31)%,G2期均值(30.27±1.24)%;NC 组 G1期均值(48.78±2.68)%,S 期均值(22.11±1.21)%,G2期均值(28.12±1.48)%,无统计学差异(P > 0.05);miR-126 mimics组 G1期均值(59.91±2.77)%,S 期均值(16.70± 2.03)%,G2期均值(22.69±0.76)%,细胞增殖明显受抑(P < 0.05);miR-126 inhibitor组 G1期均值(36.68± 2.53)%,S 期均值(25.47±2.32)%,G2期均值(36.36± 0.24)%,细胞增殖显著提高(P< 0.05)。见图 3。
2.4 转染 miR-126 mimics/inhibitor细胞凋亡的变化
转染后培养 48 h 流式细胞计数测定细胞凋亡率。Control组 UR(%)+LR(%)为 3.44±0.45;NC 组UR(%)+LR(%)为 4.14± 0.42(P > 0.05);miR-126 mimics 组 UR(%)+LR(%)为 21.42±2.03,凋亡率明显增高(P < 0.05);miR-126 inhibitor 组 UR(%)+LR(%)为 1.93±0.72,凋亡率显著减低(P < 0.05)。见图4。

图3 转染 miR-126mimics/inhibitor 48 h 后细胞周期变化情况Fig.3 Cell cycle changes 48 hours post-transfection
2.5 转染 miR-126 mimics/inhibitor后细胞克隆形成的影响
转染后培养 48 h,将细胞接种于 35 mm 的培养皿内,每个平皿 200 个细胞,3 周观察克隆。Control组平均克隆形成率(20.17±2.36)%;NC 组平均克隆形成率(19.17±2.25)%,与 Control组相比无明显变化(P > 0.05);miR-126 mimics 组 平 均 克 隆形 成 率(9.67±1.26)%,克隆形成率明显减低(P< 0.05);miR -126inhibitor组平均克隆形成率(32±3.12)%,克隆形成率显著升高(P< 0.05)。见图 5。
3 讨论
急性白血病(acute leukemia,AL)是血液系统常见的恶性肿瘤之一。骨髓中原始细胞及幼稚细胞大量增殖、分化受阻和凋亡受抑,正常造血功能受到严重抑制。临床表现为发热、贫血、出血和感染等。同时伴有肝脏、脾脏、淋巴结等髓外脏器的浸润。目前AL病因尚不清楚,可能与环境因素、电离辐射、化学毒物接触相关。随着免疫学、细胞遗传学及分子生物学研究的不断进步,白血病的致病基因及染色体核型异常逐渐被发现。靶向药物如全反式维甲酸、格列卫的应用,使部分AL的预后得到了明显改善,甚至治愈。但大部分AL患者目前仅能采取化疗治疗,总体预后不佳。
目前研究[9]认为 AL 如同其他恶性肿瘤一样,是多基因突变的结果。主要的肿瘤事件如染色体重排、缺失、倒位等,但是这不足以单独导致白血病的发生,仍然需要第2种或多种基因协助完成致癌作用[10]。miRNA 是内生型,非编码蛋白 RNAs,通过调控靶基因,抑制转录后表达,被认为是多种肿瘤如AL、肝癌、肺癌、前列腺癌等的调控基因[11-12],miRNA同时也参与造血链系分化[3]。值得注意的是,miR-126不仅在造血干细胞分化、细胞凋亡等生理过程中起调控作用,也可能作为癌基因和/或抑癌基因参与血液系统恶性肿瘤的发生发展[15]。
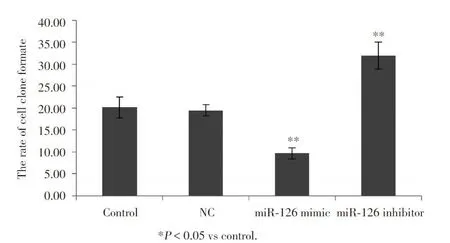
图5 转染 miR-126 mimics/inhibitor后细胞克隆形成率变化Fig.5 Clonal formation rates after transfection with either a miR-126 mimics or inhibitor
国内外关于 miR-126 作为癌基因在 AL 及实体肿瘤中发挥作用的研究[9]显示,miR-126 在不同类型AL 中表达不同,在 AML 患者中 miR-126 高表达,尤其是 CBF-AMLs。体外实验结果[16]显示,过表达 miR-126能够抑制CBF-AMLs细胞凋亡,增加细胞增殖活性,同时小鼠骨髓体外培养上调 miR-126 表达,亦可增强细胞增殖活性及克隆形成率,尤其是伴有AML1-ETO 突变的白血病细胞系。然而,同是在CBF-AMLs中关于 miR-126 的研究却出现了不一样的结果。一般认为某一功能基因的缺失或突变,将会导致相反作用的出现。但是研究[17]中发现抑制miR-126 表达同样可以促进白血病的发展。LI等[17]同时也提出 miR-126 高表达患者预后差,miR-126 低表达对常规化疗药物敏感。由此可见,miR-126 在CBF-AMLs中作为癌基因发挥作用还为时尚早。在乳腺癌及肺癌患者中发现,miR-126 能够靶向调控血管内皮生长因子参与血管新生发挥癌基因作用,体外实验上调 miR-126 能够增强肿瘤细胞增殖及成瘤能力[18-20]。
前期研究及国内外研究均有报道[6],miR-126 在伴有t(15;17)白血病患者中表达减低,不同于CBFAMLs,所以 miR-126 在此类白血病中发挥何种生物学作用目前尚不清楚。本研究选取HL-60细胞系,通过RT-PCR技术测定miR-126相对表达量,通过瞬时 转 染 技 术 ,转 染 miR-126 mimics/inhibitor,应 用CCK-8,流式细胞技术及克隆形成技术,检测转染后HL-60细胞增殖,凋亡等生物学活性。研究结果可见,转染 miR-126 mimics后 HL-60 细胞增殖活性降低,克隆形成率下降,细胞凋亡率升高,细胞周期出现 G1比率增高,增殖受抑。转染 miR-126 inhibbitor后细胞增殖活性增高,克隆形成率上升,细胞凋亡率减低。本研究说明在HL-60 细胞系中,miR-126 可以抑制白血病细胞的增殖能力,诱导凋亡,可能起到类似抑癌基因的作用。在实体瘤研究[21-25]中发现,胃癌、非小细胞肺癌、肾癌、肝癌、骨肉瘤中miR-126表达降低,体外实验显示可抑制肿瘤细胞增殖活性,可能通过靶向调控 CrK,SOX2,EGFL7,Sirt1 等基因起抑癌基因作用。
miRNA 通过与靶信使核苷酸特异结合,从而抑制转录后基因表达。既然这样,miRNA 调控何种靶基因通过何种信号通过参与AL发生,将成为接下来研究的重点。最近一项研究[17]从 674 种可能为 miR-126 的靶基因进行筛选,最终发现只有 PLK2 和SPRED1存在明显相关,进一步研究证实仅PLK2是miR-126 的靶基因,增强白血病细胞增殖活性及克隆形成,同时抑制细胞凋亡。而在 miR-126 低表达白血病中,可能通过诱导 FZD7 表达发挥作用[15],但能否通过 miR-126 的表达情况,预测白血病复发、预后及白血病危险分层也需要进一步研究。
本研究较清晰的阐述了 miR-126 能够抑制 HL-60细胞系细胞增殖活性,抑制细胞凋亡,起抑癌基因作用。有关 miR-126 在不同白血病亚型发病中起到何种作用以及 miR-126对于急性髓系白血病诊断及预后判断,则需要更多的基础及临床实验进一步证实[26]。相信随着研究的进一步深入,miR-126 有可能成为治疗急性髓系白血病的新靶点。
[1]MEISTER J,SCHMIDT MHH.miR-126 and miR-126*:new players in cancer[J].Scientific World Journal,2010,10:2090-2100.DOI:10.1100/tsw.2010.198.
[2]MUSIYENKO A,BITKO V,BARIK S.Expression of miR-126*,anintronic product of the vascular endothelial EGF-like 7 gene,regulates prostein translation and invasiveness of prostatecancer LNCaP cells[J].J Mol Med(Berl),2008,86(3):313-322.DOI:10.1007/ s00109-007-0296-9.
[3]BAI Y,BAI X,WANG Z,et al.microRNA-126 inhibits ischemia-induced retinal neovascularization via regulating angiogenio growth factors[J].Exp Mol Pathol,2011,91(1):471-477.DOI:10.1016/j. yexmp.2011.04.016.
[4] YANAIHARA N,CAPLEN N,BOWMAN E,et al.Unique micro RNA molecular profiles in lung cancer diagnosis and prognosis[J]. Cancer Cell,2006,9(3):189-198.DOI:10.1016/j.ccr.2006.01. 025.
[5]FENG R,CHEN X,YU Y,et al.miR-126 functions as a tumour suppressor in human gastric cancer[J].Cancer Lett,2010,298(1):50-63.DOI:10.1016/j.canlet.2010.06.004.
[6]CHO WC,CHOW AS,AU JS,et al.Restoration of tumour suppressor hsa-miR-145 inhibits cancer cell growth in lung adenocarcinoma patients withepidermal growth factor receptor mutation [J].Eur J Cancer, 2009, 45 (12) : 2197-2206.DOI: 10.1016/j.ejca.2009.04.039.
[7]SAITO Y,FRIEDMAN JM,CHIHARA Y,et al.Epigenetic therapy upregulates the tumor suppressor microRNA-126 and its host gene EGFL7 inhuman cancer cells[J].Biochem Biophys Res Commun,2009,379(3):726-731.DOI:10.1016/j.bbrc.2008.12.098.
[8]杨东,张红 .microRNA-126 的生物学功能[J].现代生物医学进展,2012,12(12):2773--2777.
[9]LECHMAN ER,GERNTNER B,VAN GP,et al.Attenuation of miR-126 activity expands HSC in vivo without exhaustion[J].Cell Stem Cell,2012,11(6):799-811.DOI:10.1016/j.stem.2012.09.001.
[10]PUI CH,JEHA S.New therapeutic strategies for the treatment of acutelymphoblastic leukaemia[J].Nat Rev Drug Discov,2007,6(2):149-165.DOI:10.1-38/nrd2240.
[11]BARTEL DP.microRNAs:genomics,biogenesis,mechanism,and function[J].Cell,2002,116(2):281-297.
[12]WU W,SUN M,ZOU G,et al.microRNA and cancer:current statusand prospective [J].Int J Cancer,2007,120:953-960.DOI:10.1002/ijc.22454.
[13]CROCE CM,CALINGA.miRNAs,cancer,and stem cell division[J].Cell,2005,122(1):6-7.DOI:10.1016/j.cell.2005.06.036.
[14] HATA A,KASHIMA R.Dysregulation of microRNA biogenesis machinery in cancer[J].Crit Rev Biochrm Mol Biol,2016,51(3):121-134.DOI:10.3109/10409238.2015.1117054.
[15] TESTA U,PELOSI E.microRNAs expressed in hematopoietic stem/progenitor cells are deregulated in acute myeloid leukemias[J].Blood,2015,126(17):2005-2015.DOI:10.3109/10428194. 2014.955019.
[16]LI Z,LU J,SUN M,et al.Distinct microRNA expression profiles in acute myeloid leukemia with common translocations[J].Proc Natl Acad Sci USA,2008,105(40):1535-1540.DOI:10.1073/pnas. 0808266105.
[17]LI Z,CHEN P,SU R,et al.Overexpression and knockout of miR-126 both promote leukemogenesi[J].Blood,2002,126(17):2005-2015.DOI:10.1182/blood-2015-04-639062.
[18]LIU B,PENG XC,ZHENG XL,et al.miR-126 restoration downregulate VEGFR and inhibit the growth of lung cancer cell lines in vitro an in vivo[J].Lung Cancer,2009,66(2):169-175.DOI:10.1016/j.lungcan.2009.01.010.
[19]ZHU N,ZHANG D,XIE H,et al.Endotheial-specific intron-derived miR-126 is down-regulated in human breast cancer and targets both VEGFR and PIK3R2[J].Mol Cell Biochem,2011,351(1/2):157-164.DOI:10.1007/s11010-011-0723-7.
[20]SASATIRA T,KURIHARA M,BHAWAL UK,et al.Downregulation of miR-126 induces angiogegesis and lymphangiogenesis by activation of VEGFR-A in oral cancer[J].Br J Cancer,2012,107(4):700-706.DOI:10.1038/bjc.2012.330.
[21]MIKO E,MARQITAI Z,CZIMMERER Z,et al.miR-126 inhibits proliferation of small cell lung cancer cells by targeting SLC7A5[J].Febs Lett,2011,585(8):1191-1196.DOI:10.1016/j.febslet.2011.03.039.
[22]SUN Y,BAI Y,ZHANG F,et al.miR-126 inhibits non-small cell lung cancer cells proliferation by targeting EGFL7[J].Biochem Biophys Res Commun,2010,391(3):1483-1489.DOI:10.1016/j. bbrc.2009.12.098.
[23]CRAMFORD M,BRAWNER E,BATTE K,et al.microRNA-126 inhibits invasion in non-small cell lung carcinoma cell lines[J]. Biochem Biophys Res Commun,2008,373(4):607-612.DOI:10.1016/j.bbrc.2008.06.090.
[24]YANG C,HOU C,ZHANG H,et al.miR-126 functions as a tumor suppressor in osteosarcoma by targeting SOX2[J].Int J Mol Sci,2014,15(1):423-437.DOI:10.3390/ijms15010423.
[25]OTSUBO T,AKIYAMA Y,HASHIMOTO Y,et al.microRNA-126 inhibits SOX2 expression and contributes to gastric carcinogenesis[J].PloS One,2011,6(1):16617-16620.DOI:10.1371/journal. pone.0016617.
[26]LECHMAN ER,GENTNER B,VAN G,et al.Attenuation of miR-126 activity expands HSC in vivo without exhaustion [J].Cell Stem Cell,2012,11(6):799-811.DOI:10.1016/j.stem.2012.09. 001.
(编辑 北 辰)
Role of miR-126 in the Biological Behavior of HL-60 Cell Line
ZHANG Heyang,ZHANG Rui,WANG Pingping,WANG Yue,WANG He,LI Yan
(Department of Hematology,The First Hospital,China Medical University,Shenyang 110001,China)
ObjectiveTo cultivate human leukemia cells(HL-60)which were transiently transfected either a miR-126 mimic or inhibitor,and then to characterize the proliferation and apoptotic behavior of the transfected leukemia cells.MethodsThe leukemia cell line was developed and RT-PCR was performed to evaluate miR-126 expression levels.An instantaneous plasmid transfection technique was used to transfect cells with either the miR-126 mimic or inhibitor.CCK-8,FCM,and clone formation tests were performed to analyze the proliferative and apoptotic behaviors of the leukemia cells.ResultsProliferation was significantly decreased in cells transfected with the miR-126 mimic for 0,24,48,and 72 hours(P < 0.05).Specifically,the G1,S,and G2phases were significantly inhibited(P < 0.05),the late and early apoptosis(UR+LR)rate increased(P < 0.05),and the average rate of colony formation was also significantly decreased(P < 0.05).Additionally,proliferation was significantly increased in cells transfected with the miR-126 inhibitor for 0,24,48,and 72 hours(P < 0.05).Specifically,the G1,S,and G2phases were increased(P < 0.05),the UR+LR decreased significantly(P < 0.05),and the average rate of colony formation was significantly increased(P <0.05).ConclusionIn HL-60 cells,miR-126 can inhibit proliferation and promote apoptosis;thus,miR-126 may play an important role in the occurrence and development of leukemia as a tumor-suppressor miRNA.
miR-126;leukemia;proliferation;apoptosis;acute promyelocytic leukemia
R318.12
A
0258-4646(2017)09-0796-06
http://kns.cnki.net/kcms/detail/21.1227.R.20170906.1318.014.html
10.12007/j.issn.0258-4646.2017.09.007
辽宁省科学技术计划(201302103)
张贺洋(1986-),男,主治医师,硕士.
李艳,E-mail:liyan2@medmail.com.cn
2016-12-29
网络出版时间:2017-09-06 13:18
