介孔二氧化锰制备及其催化臭氧氧化草酸研究
2017-09-20张建琳,陈硕,全燮,于洪涛,张耀斌
张 建 琳, 陈 硕, 全 燮, 于 洪 涛, 张 耀 斌
( 大连理工大学 环境学院, 辽宁 大连 116024 )
介孔二氧化锰制备及其催化臭氧氧化草酸研究
张 建 琳, 陈 硕, 全 燮*, 于 洪 涛, 张 耀 斌
( 大连理工大学 环境学院, 辽宁 大连 116024 )
采用纳米刻蚀法制备了介孔二氧化锰臭氧催化剂,并考察了其催化臭氧氧化降解草酸的性能.该催化剂高比表面积(142 m2·g-1)的有序纳米棒有利于催化剂活性位点的暴露和物质的吸附,从而增强了催化剂的催化活性.羟基自由基是催化臭氧氧化过程中产生的主要活性氧物种,该催化剂的羟基自由基产率是非介孔二氧化锰的2倍;朗缪尔吸附模型表明该催化剂对草酸的吸附能力是非介孔二氧化锰的9.42倍;该催化剂催化降解草酸的准一级反应动力学常数是非介孔二氧化锰的3倍.
介孔二氧化锰;催化臭氧氧化;羟基自由基;草酸
0 引 言
溶液中的非均相臭氧催化氧化反应是发生在气、液、固三相间的反应,臭氧分子首先与催化剂作用产生活性氧物种,例如羟基自由基、超氧自由基等,进而降解甚至矿化吸附在催化剂表面的有机污染物[1-2].催化剂的表面活性位点暴露量以及吸附污染物能力对其降解污染物至关重要,而这些又与其比表面积、孔体积、孔径等性质息息相关[3].
在众多臭氧催化剂中,金属氧化物具有较强的稳定性,但比表面积和孔体积相对较低,吸附能力和分散性相对较差,从而限制了其催化活性.近年来,为了提高金属氧化物的催化活性,多种介孔材料如碳、硅、铝等以载体的形式对金属氧化物分散性和活性位点暴露进行修饰.载体虽然提高了金属氧化物的催化效果,但是作为没有催化性能的组分在催化剂中的含量过高,在实际应用中是一种资源浪费.因此,经济的金属氧化物催化剂不应依赖于载体的修饰,而应通过制备方法的改进使其自身具有高比表面积、大孔体积等特点.纳米刻蚀的方法就是一种理想的制备方法,该方法以介孔材料作为模板,合成前驱体浸渍到模板中反应成型,经模板洗脱后,最终获得与模板具有相似形态结构的目标物[4].
有序介孔材料SBA-15具有大的比表面积,且中空纳米结构有利于前驱体填充形成纳米棒状结构,是一种制备金属氧化物臭氧催化剂的理想模板;而二氧化锰是一种研究最为深入的高效臭氧催化剂[5].因此,本文以SBA-15为模板,采用纳米刻蚀的方法制备具有高比表面积的介孔二氧化锰,并从形貌、吸附动力学、羟基自由基产率和草酸降解等方面对其进行研究.
1 实验部分
1.1 介孔二氧化锰的制备
该纳米刻蚀制备介孔二氧化锰(M-MnO2)的方法以商业SBA-15为模板,以硝酸锰溶液为前驱体,制备过程如图1所示.将3 g SBA-15分散到50 mL乙醇溶液中持续搅拌30 min;再向SBA-15悬浊液中加入4.65 mL质量分数50%的硝酸锰溶液,继续搅拌2 h;悬浊物经过滤干燥后,在400 ℃条件下煅烧4 h生成二氧化锰与SBA-15模板的复合物(MnO2/SBA-15);用2 mol/L的NaOH溶液将SBA-15模板去除后,再用高纯水洗至中性,并用乙醇清洗一次后获得介孔二氧化锰.对照材料非介孔二氧化锰(C-MnO2)的制备方法除没有加SBA-15模板外,与制备介孔二氧化锰的方法相同.

图1 M-MnO2制备过程示意图[6]
1.2 表征方法
采用场发射扫描电子显微镜(FESEM,S4800,Hitachi)和投射电子显微镜(TEM,Tecnai 30F,FEI,USA)分析催化剂的微观结构;采用X射线衍射光谱仪(D/Max 2400, Rigaku)分析催化剂的晶体结构;采用全自动氮气吸附脱附分析仪(Quanta, USA)分析催化剂的比表面积、孔体积和孔径等.
1.3 催化臭氧氧化实验
1.3.1 草酸的吸附实验 草酸吸附实验在20 ℃下进行,分别配制初始浓度为1、2、3和4 mmol/L的草酸溶液各100 mL,分别加入二氧化锰催化剂2 mg,待吸附平衡后,取1 mL溶液分析检测.使用高效液相色谱(Waters,2695)检测草酸的浓度,色谱柱为反相C18柱,流动相为甲醇和质量分数0.2%的磷酸二氢铵溶液(体积比为2∶98),流速为0.8 mL/min.
1.3.2 活性氧自由基的检测 利用电子顺磁共振仪检测活性氧物种.检测条件为:羟基自由基的检测以水为溶剂,催化剂浓度为0.1 g/L,5,5-二甲基-1-氧化吡咯啉(DMPO)浓度为80 μmol/L;超氧自由基的检测以甲醇为溶剂,催化剂浓度为0.1 g/L,DMPO浓度为80 μmol/L.
1.3.3 催化臭氧氧化草酸 草酸的催化臭氧氧化实验在一个自制的500 mL长颈玻璃反应器中进行.实验过程中,氧气源臭氧发生器产生的臭氧持续通入含有20 mg/L催化剂的200 mL 1 mmol/L 草酸溶液中,并在指定的取样时间取适量体积的草酸溶液,测定其浓度.
2 结果与讨论
2.1 介孔二氧化锰的表征
图2显示了SBA-15、MnO2/SBA-15和M-MnO2的XRD表征结果.SBA-15在2θ=22°处有一个典型的介孔二氧化硅的宽特征峰[7];MnO2/SBA-15不仅含有该宽特征峰,还在2θ=28.7°, 37.3°, 42.8° 和56.6°处出现了4个微弱的特征峰,这些特征峰与标准谱图PDF# 24-0735一致,分别对应二氧化锰晶体的(110)、(101)、(111) 和 (211)面,表明二氧化锰在SBA-15中合成;而M-MnO2在2θ=22°处没有宽峰,表明模板SBA-15被去除.
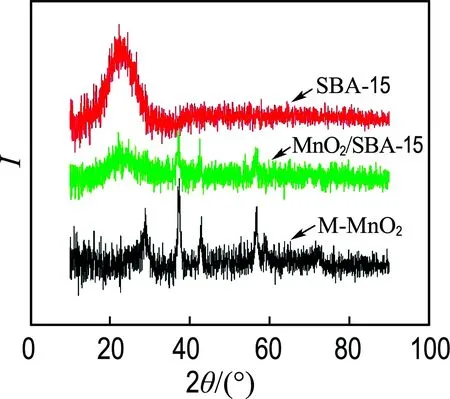
图2 SBA-15、MnO2/SBA-15和M-MnO2的XRD图
Fig.2 XRD pattern of SBA-15, MnO2/SBA-15 and M-MnO2
图3(a)显示了SBA-15、MnO2/SBA-15、M-MnO2和C-MnO2的氮气吸附脱附曲线.除C-MnO2外,所有材料均呈现带有H3类型滞后环的Ⅳ型曲线,表明这些材料具有介孔结构.图3(b) 显示SBA-15和MnO2/SBA-15的孔径分布相似,这与表1中它们具有相同的孔径3.13 nm 相一致.但是,与SBA-15相比,MnO2/SBA-15的比表面积从506 m2·g-1降低到了236 m2·g-1,孔体积从0.63 cm3·g-1降低到了0.39 cm3·g-1,表明在浸渍煅烧的制备过程中,SBA-15的中空纳米结构没有被破坏,且二氧化锰填充到该中空结构中.M-MnO2的微观结构如图4所示,该催化剂呈现有序纳米棒状结构,其直径约3 nm,与SBA-15的孔径相近,进一步表明SBA-15的中空结构被二氧化锰填充,在SBA-15模板去除后继而形成了纳米棒状结构.纳米棒间的距离约2 nm,与M-MnO2的孔径分布一致,表明该催化剂具有高的比表面积和孔隙率.而表1证实,与其他材料相比,M-MnO2确实在比表面积和孔体积上具有优势,其值分别是142 m2·g-1和0.21 cm3·g-1.并且图4表明M-MnO2高度结晶,0.311 nm晶格间距对应的是二氧化锰(110)面的间距,进一步证实了XRD的结果.综上结果,证明成功制得了具有有序纳米棒状结构的M-MnO2.


(a) 氮气吸附脱附曲线

(b) 孔径分布

图3 不同材料的氮气吸附脱附曲线和孔径分布
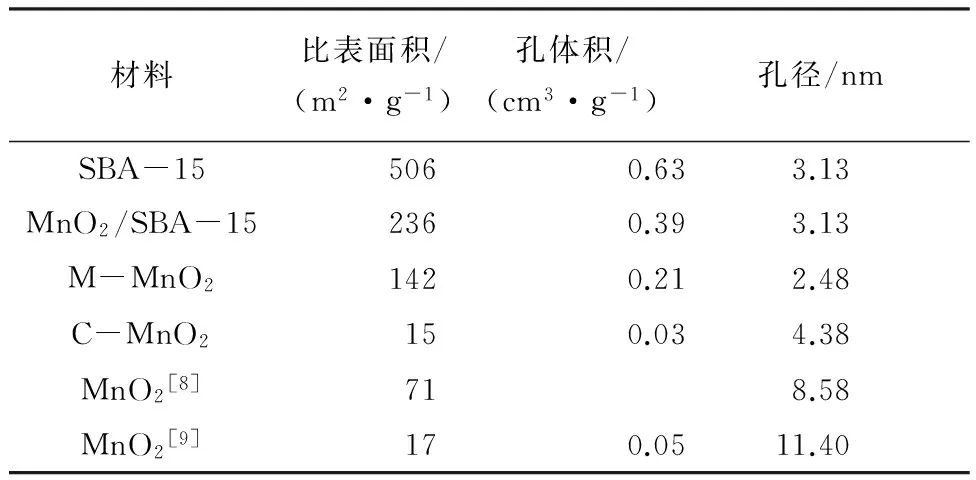
表1 不同材料的参数
2.2 催化臭氧氧化
非均相催化臭氧氧化反应是一种界面反应,主要包括污染物吸附、活性氧自由基生成和自由基降解污染物3个过程.为了评估M-MnO2催化臭氧氧化的能力,以草酸作为目标物,对上述3个过程进行了研究.

图4 M-MnO2的TEM图
2.2.1 草酸的吸附 图5(a)显示了不同草酸初始浓度条件下,M-MnO2与C-MnO2的草酸平衡吸附量.显然,M-MnO2对草酸具有更高的吸附能力,表明M-MnO2的有序纳米介孔结构有利于草酸的吸附.为了进一步理解吸附过程,利用朗缪尔吸附模型来模拟两种材料的最大吸附量(Qm)和吸附动力学常数(Ka)[10-11],其公式如下:
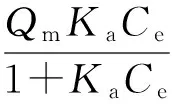
重新整理公式得

其中qe是草酸的平衡吸附量,Ce是平衡时草酸的浓度.图5(b)显示了1/qe与1/Ce的线性关系,Qm和Ka分别可以从图中线性关系的截距和斜率计算获得.相关结果如表2所示,M-MnO2的草酸最大吸附量(5 294.0 mg·g-1)约是C-MnO2的9.42倍,该结果与M-MnO2的比表面积是C-MnO2的9.47倍相一致.由于M-MnO2的孔径(2.48 nm)低于C-MnO2的孔径(4.38 nm),其吸附动力学常数(0.001 1 L·mg-1)也低于C-MnO2的(0.004 2 L·mg-1),尽管如此,由模型计算得知M-MnO2的平衡吸附量约是C-MnO2的2.5倍,进一步证实M-MnO2较C-MnO2具有更高的传质吸附能力.
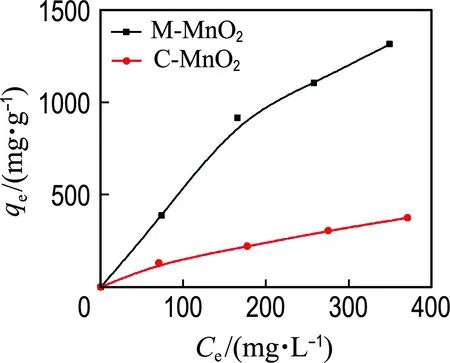
(a) qe-Ce

(b) 1/qe-1/Ce
图5 催化剂饱和吸附量与草酸浓度的关系
Fig.5 Relationship between amount of the catalyst adsorption equilibrium and the concentration of oxalic acid

表2 1/qe与1/Ce的线性参数
2.2.2 活性氧自由基的产生 羟基自由基和超氧自由基是金属氧化物催化臭氧氧化过程中公认的两大主要活性氧物种.为了确定M-MnO2催化臭氧氧化产生的活性氧物种,采用电子自旋顺磁共振仪检测活性氧物种与DMPO形成的加合物,从而直接判断相应活性氧物种的生成.图6中并未有DMPO-·O2-加合物的特征信号显示,表明超氧自由基没有生成或者浓度太低而没有检出;而5,5-二甲基-2-酮基-1-氧化吡咯啉(DMPOX)的超精细分裂信号显示明显,该信号是DMPO被羟基自由基充分氧化后呈现的[12],表明羟基自由基是该催化反应的主要活性氧物种.
羟基自由基产生于臭氧与催化剂表面活性位点间的反应,羟基自由基产率的计算是评估催化剂活性位点暴露量的有效方法.由于羟基自由基的浓度缺乏直接检测方法,Elovitz和von Gunten对其提出了间接的计算方法[13],其公式如下:


图6 M-MnO2催化臭氧氧化过程中DMPO与活性氧物种加合物的电子顺磁共振检测结果
Fig.6 EPR detection result of DMPO-ROS adducts generated from the catalytic ozonation by M-MnO2
臭氧催化氧化过程中,草酸的去除遵循以下动力学方程:

式中:KO3=5.5 mol·L-1·s-1,是草酸与臭氧的反应动力学常数;KOH= 7.7×106mol·L-1·s-1,是草酸与羟基自由基的反应动力学常数;Kads是草酸与催化剂的吸附动力学常数;c(O3)、c(OA)、c(·OH)和c(catalyst)分别是臭氧、草酸、羟基自由基和催化剂的浓度;t是反应时间.由于催化剂对草酸的吸附量较低,公式中吸附部分可以忽略不计,因此,公式可简化为
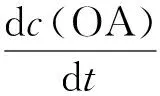
KOHc(·OH)c(OA)
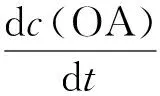
将Rct代入上述公式并积分得
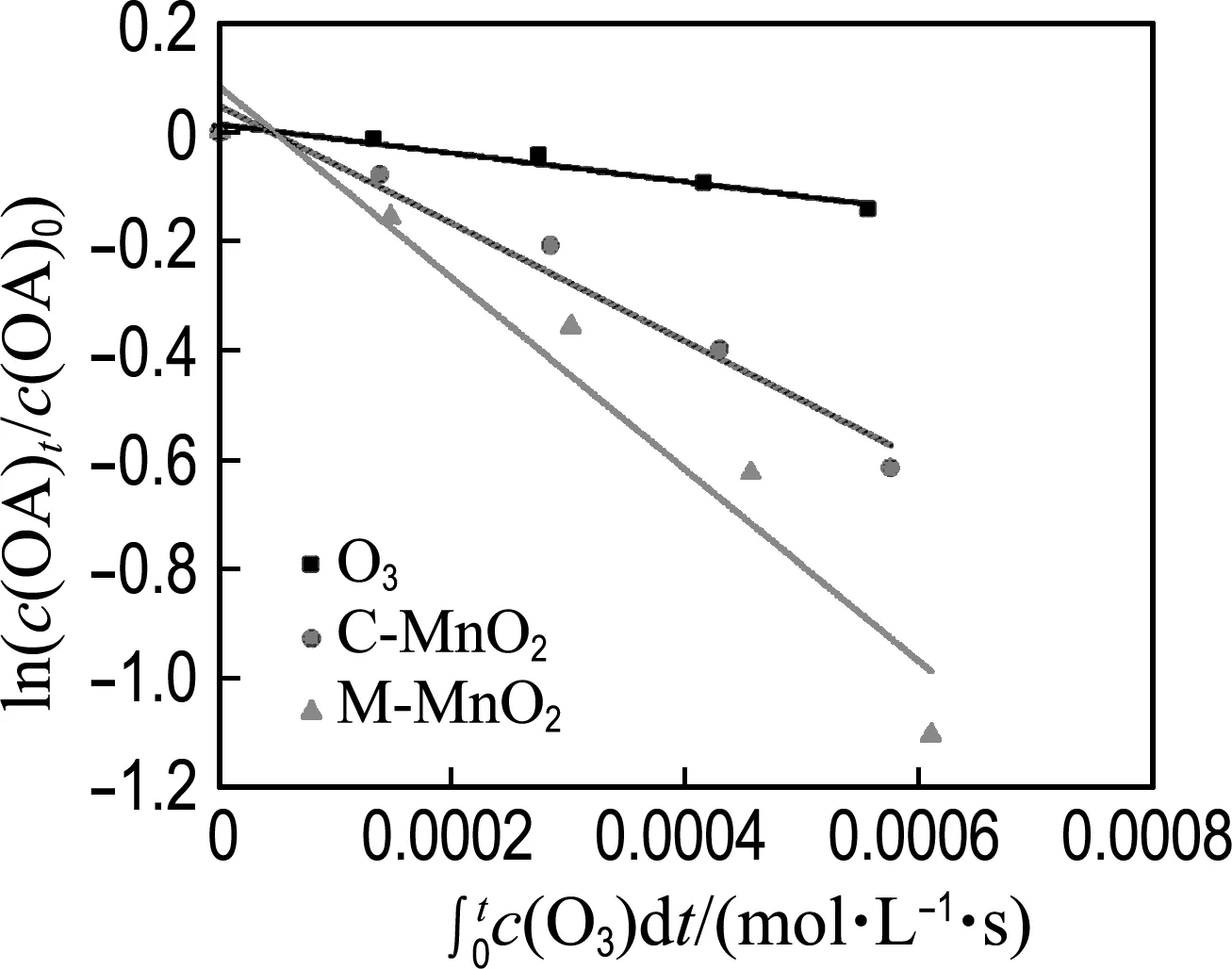
图7 不同条件下羟基自由基产率
2.2.3 草酸的催化臭氧氧化降解 图8(a)对比了单独臭氧氧化、M-MnO2和C-MnO2催化臭氧氧化的草酸降解效果.催化剂悬浊液在30 min后达到吸附平衡,M-MnO2的草酸吸附量(8.6%)高于C-MnO2的吸附量(2.4%),进一步证实M-MnO2比C-MnO2具有更高的吸附能力.反应1 h后,单独臭氧氧化仅降解了10.0%的草酸,而C-MnO2和M-MnO2催化臭氧氧化分别降解了31.7% 和70.0%的草酸,表明催化过程中,M-MnO2催化臭氧氧化草酸的能力是C-MnO2的2倍多.另外,催化臭氧氧化降解草酸遵循准一级反应动力学方程,即


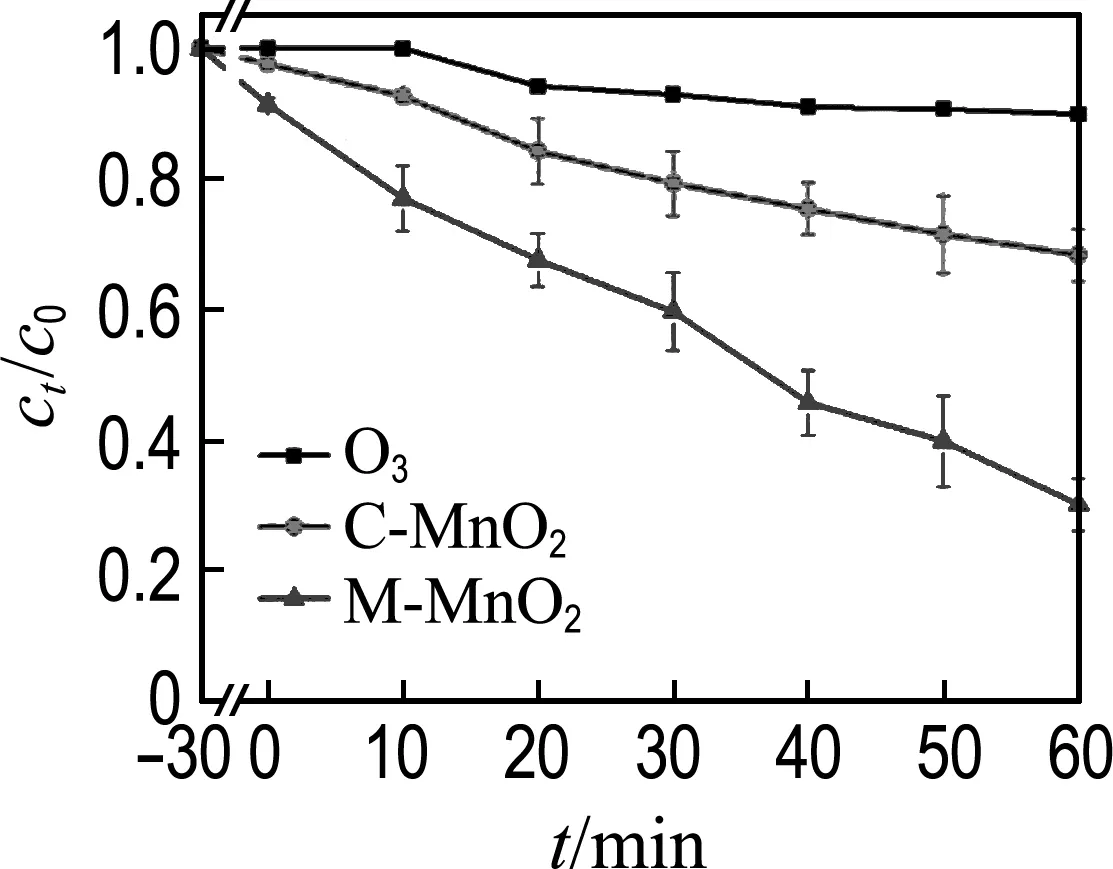
(a) 草酸降解

(b) 表观动力学曲线
图8 不同材料的草酸降解和表观动力学曲线
Fig.8 Degradation of oxalic acid andkplot with different materials
其中k是催化臭氧氧化的表观动力学常数,ct是反应t时间后的草酸浓度.从图8(b)中计算得M-MnO2、C-MnO2和单独臭氧降解草酸的表观动力学常数分别为0.018、0.006、0.002 min-1.显然,M-MnO2的表观动力学常数分别是C-MnO2和单独臭氧的3倍和9倍.
3 结 论
(1)采用纳米刻蚀的方法成功制备了介孔二氧化锰催化剂,该催化剂具有有序纳米棒状结构和142 m2·g-1的比表面积.
(2)M-MnO2较C-MnO2具有更高的草酸吸附能力,其平衡吸附量约是C-MnO2的2.5倍.
(3)羟基自由基被证实是该二氧化锰催化臭氧氧化过程中产生的主要活性物种,M-MnO2的羟基自由基产率约是C-MnO2的2倍.
(4)M-MnO2催化臭氧氧化降解草酸效果优于C-MnO2,其表观动力学常数是C-MnO2的3倍.
[1] GAO Guoying, SHEN Jimin, CHU Wei,etal. Mechanism of enhanced diclofenac mineralization by catalytic ozonation over iron silicate-loaded pumice [J].SeparationandPurificationTechnology, 2017,173:55-62.
[2] WANG Yuxian, XIE Yongbing, SUN Hongqi,etal. Efficient catalytic ozonation over reduced graphene oxide for p-hydroxylbenzoic acid (PHBA) destruction:Active site and mechanism [J].ACSAppliedMaterialsandInterfaces, 2016,8(15):9710-9720.
[3] HAO Shumeng, QU Jin, ZHU Zhongshuai,etal. Hollow manganese silicate nanotubes with tunable secondary nanostructures as excellent Fenton-type catalysts for dye decomposition at ambient temperature [J].AdvancedFunctionalMaterials, 2016,26(40):7334-7342.
[4] XIA Yongde, YANG Zhuxian, MOKAYA R. Mesostructured hollow spheres of graphitic N-doped carbon nanocast from spherical mesoporous silica [J].JournalofPhysicalChemistryB, 2004,108(50):19293-19298.
[5] NAWROCKI J, KASPRZYK-HORDERN B. The efficiency and mechanisms of catalytic ozonation [J].AppliedCatalysisB:Environmental, 2010,99(1/2):27-42.
[6] LU Anhui, SCHÜTH F. Nanocasting:A versatile strategy for creating nanostructured porous materials [J].AdvancedMaterials, 2006,18(14):1793-1805.
[7] LIU Fenghui, YU Jie, TU Guangyuan,etal. Carbon nitride coupled Ti-SBA15 catalyst for visible-light-driven photocatalytic reduction of Cr(Ⅵ) and the synergistic oxidation of phenol [J].AppliedCatalysisB:Environmental, 2017,201:1-11.
[8] LI Na, ZHU Xiaohong, ZHANG Caiyun,etal. Controllable synthesis of different microstructured MnO2by a facile hydrothermal method for supercapacitors [J].JournalofAlloysandCompounds, 2017,692:26-33.
[9] ZHAO Hui, DONG Yuming, JIANG Pingping,etal. An α-MnO2nanotube used as a novel catalyst in ozonation:performance and the mechanism [J].NewJournalofChemistry, 2014,38(4):1743-1750.
[10] TAN Xiuqin, WAN Yifeng, HUANG Yajing,etal. Three-dimensional MnO2porous hollow microspheres for enhanced activity as ozonation catalysts in degradation of bisphenol A [J].JournalofHazardousMaterials, 2017,321:162-172.
[11] ZHAO Rui, LI Xiang, SUN Bolun,etal. Diethylenetriamine-assisted synthesis of amino-rich hydrothermal carbon-coated electrospun polyacrylonitrile fiber adsorbents for the removal of Cr(Ⅵ) and 2, 4-dichlorophenoxyacetic acid [J].JournalofColloidandInterfaceScience, 2017,487:297-309.
[12] ZHANG Xiaoling, FENG Mingbao, WANG Liansheng,etal. Catalytic degradation of 2-phenylbenzimidazole-5-sulfonic acid by peroxymonosulfate activated with nitrogen and sulfur co-doped CNTs-COOH loaded CuFe2O4[J].ChemicalEngineeringJournal, 2017,307:95-104.
[13] ELOVITZ M S, VON GUNTEN U. Hydroxyl radical/ozone ratios during ozonation processes. I. The Rct concept [J].Ozone:ScienceandEngineering, 1999,21(3):239-260.
PreparationofmesoporousMnO2forcatalyticozonationofoxalicacid
ZHANG Jianlin, CHEN Shuo, QUAN Xie*, YU Hongtao, ZHANG Yaobin
( School of Environmental Science and Technology, Dalian University of Technology, Dalian 116024, China )
A mesoporous MnO2is prepared by the nanocasting method, and its performance as a catalyst for catalytic ozonation of oxalic acid is investigated. The ordered nanorods with high surface area (142 m2·g-1) benefit the active sites exposition and the mass adsorption, thus enhance the efficiency of catalytic ozonation. In the catalytic ozonation, hydroxyl radical is identified as the main reactive oxygen species, and the productive rate of hydroxyl radical by the mesoporous MnO2is about 2 times as high as that by the non-mesoporous MnO2. The adsorption capacity of oxalic acid by the mesoporous MnO2is 9.42 times as high as that by the non-mesoporous MnO2calculated by the Langmuir adsorption model. The pseudo first-order reaction kinetics constant of the catalytic ozonation of oxalic acid by the mesoporous MnO2is 3 times as much as that by the non-mesoporous MnO2.
mesoporous MnO2; catalytic ozonation; hydroxyl radical; oxalic acid
2017-01-18;
2017-07-12.
国家自然科学基金资助项目(21590813).
张建琳(1986-),男,博士生,E-mail:11118019@mail.dlut.edu.cn;全 燮*(1960-),男,教授,博士生导师,E-mail:quanxie@dlut.edu.cn.
1000-8608(2017)05-0447-06
X703
A
10.7511/dllgxb201705002
