桔梗皂苷D联合伊马替尼对K562细胞的增殖抑制作用及机制研究
2017-09-20代群葛宇清
代群 葛宇清
●论 著
桔梗皂苷D联合伊马替尼对K562细胞的增殖抑制作用及机制研究
代群 葛宇清
目的 探讨桔梗皂甙D(p latycod in,PD)与伊马替尼(imatinib,IM)联合用药抑制慢性粒细胞白血病细胞株K562的作用及机制研究。方法 体外培养CML细胞株K562,CCK-8测定PD和IM单药及联合用药对K562细胞增殖的抑制作用;流式细胞仪检测Annexin V/PI标记的细胞凋亡率,Western b lot方法检测cleaved casp ase-3、cleaved caspase-9、PARP、cleaved PARP、Bcr/ab l、p-AKT、p-mTOR蛋白表达。结果 联合用药组对K562细胞的增殖抑制作用和诱导细胞凋亡率较单独用药组效果明显,差异均有统计学意义(均P<0.01)。与单药组比较,联合用药组可以明显上调cleaved casp ase-3、cleaved casp ase-9、cleaved PARP蛋白表达,同时下调PARP、Bcr/abl、p-AKT、p-mTOR蛋白的表达,差异均有统计学意义(P<0.01或0.05)。结论PD与IM联合用药在抑制细胞增殖、诱导凋亡、抑制Bcr/ab l蛋白和PI3K/AKT/mTOR信号通路方面明显优于单独用药。
梗皂甙D 伊马替尼 K562 Bcr/ab l融合基因 PI3K//AKT/mTOR信号途径
慢性粒细胞白血病(chronic myelogenous leukemia, CML)是一种多能造血干细胞恶性克隆性疾病。Bcr/abl融合基因表达的蛋白具有异常的络氨酸蛋白激酶活性,能激活下游多种信号传导,使白血病细胞具有较强的增殖和抗凋亡能力[1]。尽管临床应用Bcr/abl抑制剂进行治疗取得很好的疗效,但慢性期CML患者出现耐药现象较为普遍,且临床复发率较高[2-3]。因此,发现新药物、提出新的临床治疗方法显得尤为重要。联合用药是治疗肿瘤的新趋势,体内外研究证实联合用药可以提高肿瘤细胞对化疗药物的敏感性,增强疗效,减少化疗药物的用量[4]。桔梗皂苷D(platycodin,PD)是从桔梗中提取的主要活性成分,前期研究发现PD有抑制白血病细胞增殖和诱导凋亡的作用[5]。本文旨在探讨低剂量PD联合Bcr/abl酪氨酸激酶抑制剂伊马替尼(imatinib,IM)对K562细胞作用的分子机制。
1 材料和方法
1.1 试剂和材料 人CML细胞株K562购自中科院上海细胞生物研究所。PD购自成都曼思特生物科技有限公司(批号15030619,纯度>98%),利用二甲基亚砜(DMSO)配置成50μmol/L的工作母液;IM(北京诺华制药有限公司)利用二甲基亚砜(DMSO)配置成10μmol/L的工作母液;胎牛血清购自美国Giboc公司(批号:1227693);RPMI1640培养液培养基购自杭州科易生物技术有限公司(批号:2016011603);CCK-8试剂盒为日本Dojindo公司产品(批号:KM671);细胞凋亡检测试剂盒购自美国BD公司(批号:5306537);抗体cleaved caspase-3(9661S)、cleaved caspase-9、PARP、cleaved PARP、Bcr/abl、p-AKT、p-mTOR均购自美国Cell Signal公司;β-actin及抗兔和抗鼠的二抗均为美国Santa Cruz公司产品。
1.2 方法
1.2.1 细胞增殖活性检测 采用CCK8法,设加入的药物终浓度为10μmol/L PD的单药组和0.5μmol/L IM的单药组及两者联合用药组,并设立不加任何药物的空白对照组(control),均培养24h。收集对数生长期的K562细胞,调整细胞悬液浓度为5×104/ml接种于96孔培养板中,每孔100μl,按照上述分组情况加入药物,每组设置3个复孔,于37℃、5%CO2培养箱中继续培养24h后,每孔加入10μl CCK-8试剂,置于恒温培养箱内继续培养4h,酶标仪450nm处检测吸光光度值(OD值),根据OD值计算细胞存活率,细胞存活率=给药孔平均值/对照孔平均值×100%,并作量效曲线,求出药物对细胞50%生长抑制浓度(IC50)。
1.2.2 细胞凋亡检测 采用流式细胞术分析,取上述4组K562细胞,以5×104/ml密度接种于6孔板,每孔1ml。按试剂盒说明书进行操作,冷PBS缓冲液洗2次,重悬于1×结合缓冲液,调整细胞密度为1×106/L。取100μl细胞悬液加5μl Annexin-V FITC标记液和5μl碘化丙啶(PI,50μg/ml)混匀,室温避光孵育15min后,加400μl结合缓冲液,流式细胞仪检测,分析细胞凋亡率。
1.2.3 凋亡相关蛋白cleaved caspase-3、cleaved caspase-9、PARP、cleaved-PARP表达检测 采用Western-Blot法,收集4组K562细胞(每组2×106个细胞),PBS洗涤2次,加入细胞裂解液100μl,冰上裂解30min,12 000r/min离心15min,用BCA方法定量蛋白浓度,取30μg蛋白,加入上样缓冲液,100℃变性10min,进行10%的聚丙烯酰胺凝胶电泳后,恒流260mA、90~120min将蛋白质转移至PVDF膜上,5%脱脂牛奶封闭1h后加入一抗,4℃孵育过夜,用TBST缓冲液漂洗膜3次,10min/次;再使用对应的二抗室温孵育2h,TBST缓冲液漂洗膜3次,10min/次,过氧化物酶法显色,Bio-Rad凝胶成像系统采集和分析数据。
1.3 统计学处理 采用SPSS17.0统计软件,计量资料以表示,组间比较采用t检验。P<0.05为差异有统计意义。
2 结果
2.1 PD和IM单药及联合用药对K562细胞存活率的影响 见图1、2。
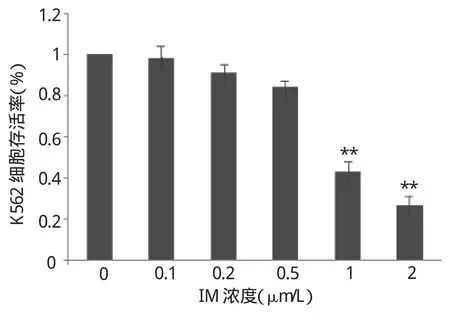
图1 IM对K562细胞存活率的影响(与空白对照组比较,**P<0.01)
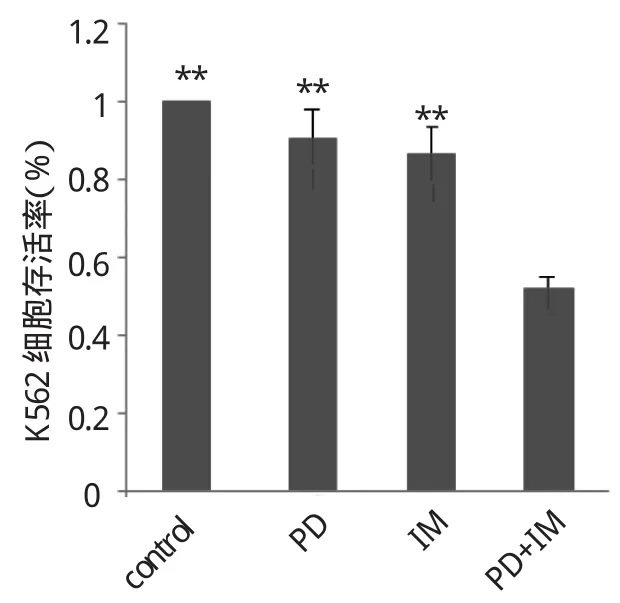
图2 PD和IM单药及联合用药对K562细胞存活率的影响(与联合用药组比较,**P<0.01)
由图1可见,IM处理细胞24h对K562细胞增殖有抑制作用,该作用呈剂量依赖性,0.1、0.2、0.5、1、2μmol/L IM处理K562细胞24h,细胞存活率分别为(98.34±3.96)%、(92.24±4.62)%、(83.35±4.12)%、(39.62±5.34)%、(26.73±3.67)%,IM对细胞增殖有抑制作用,且呈剂量依赖性,1、2μmol/L的IM明显抑制细胞增殖,与空白对照组比较差异均有统计学意义(均P<0.01)。IM的IC50为(0.97±0.27)μmol/L,PD的IC50为(23.63±0.51)μmol/L[4]。由图2可见,与空白对照组、PD单药组、IM单药组相比,联合用药组细胞存活率显著降低(均P<0.01)。
2.2 PD和IM单药及联合用药对K562细胞凋亡率的影响 见图3。
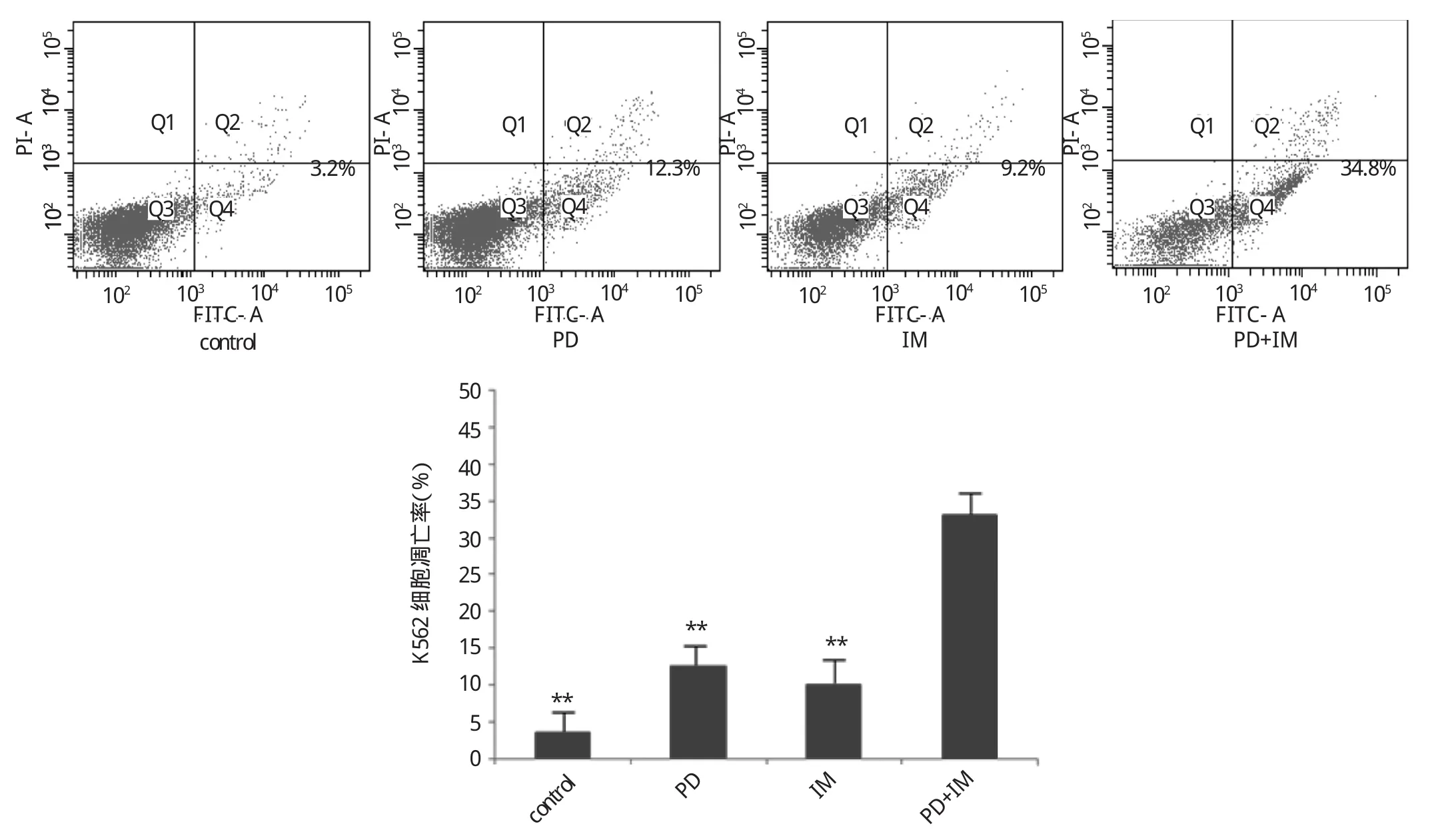
图3 PD和IM单药及联合用药对K562细胞凋亡率的影响(与联合用药照组比较,**P<0.01)
由图3可见,空白对照组细胞凋亡率(3.4±2.7)%、PD单药组(12.9±4.6)%、IM单药组(10.6±5.4)%,联合用药组(33.6±5.2)%,联合用药组细胞凋亡率显著高于其余3组,差异均有统计学意义(均P<0.01)。
2.3 PD和IM单药及联合用药对K562细胞凋亡相关蛋白表达的影响 见图4。
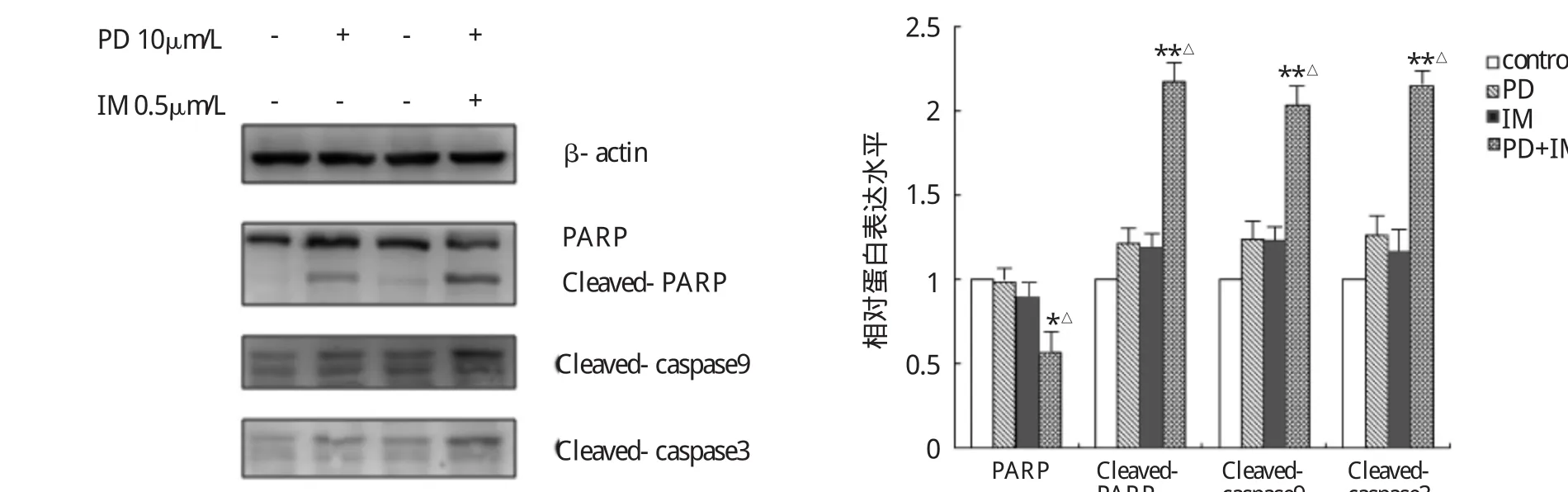
图4 PD和IM单药及联合用药对K562细胞凋亡相关蛋白表达的影响(与空白对照组比较,*P<0.05,**P<0.01;与PD、IM单药组比较,△P<0.05)
由图4可见,与空白对照组、PD单药组、IM单药组相比,联合用药组细胞凋亡相关蛋白cleaved caspase-3、cleaved caspase-9和cleaved-PARP表达明显上调,总PARP表达显著下调。半定量分析结果显示联合用药组与空白对照组、PD单药组、IM单药组比较差异均有统计学意义(P<0.05或0.01)。
2.4 PD对K562细胞Bcr/abl融合蛋白及下游PI3K/ AKT/mTOR信号通路的影响 见图5。
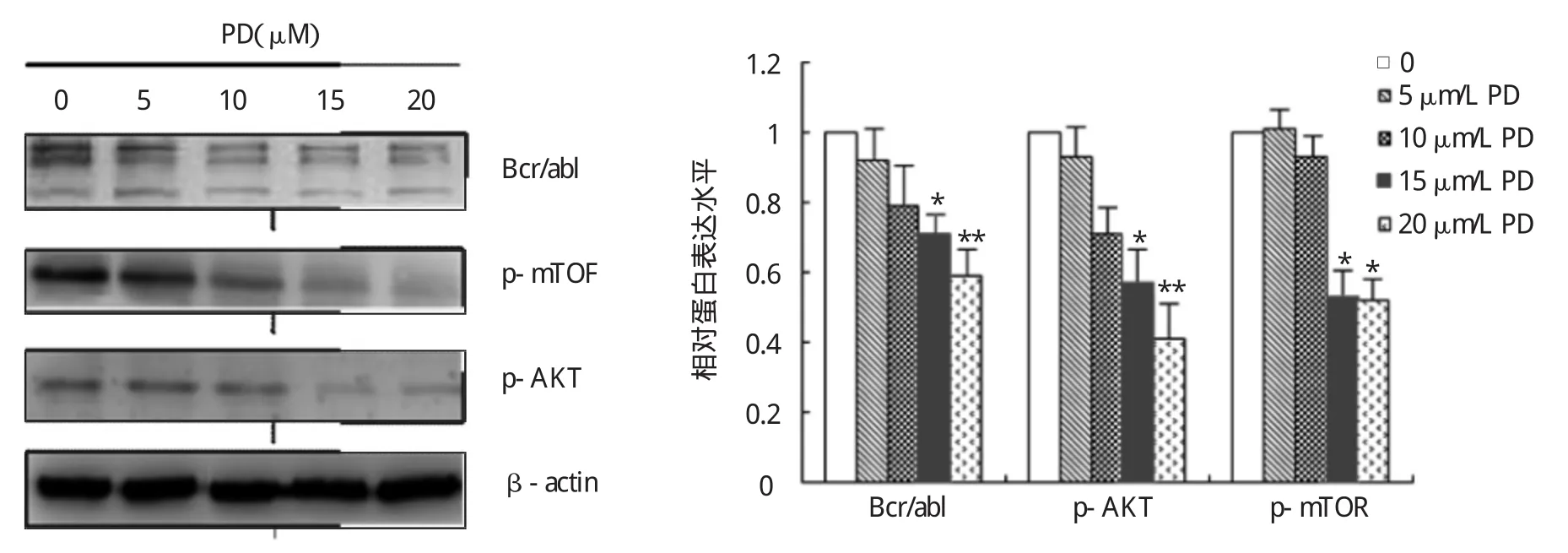
图5 PD对K562细胞Bcr/abl、p-AKT、p-mTOR的影响(与空白组比较,*P<0.05,**P<0.01)
由图5可见,随着PD浓度的增加,Bcr/abl、pAKT、pmTOR蛋白表达明显下调。半定量分析结果显示,随着药物浓度的增高,15、20μmol/L的PD抑制作用与空白对照组比较差异均有统计学意义(P<0.05或0.01)。
2.5 PD和IM单药及联合用药对Bcr/abl和PIK/AKT/ mTOR信号通路蛋白表达的影响 见图6。
由图6可见,与空白对照组、PD单药组、IM单药组相比,联合用药组Bcr/abl、p-AKT、p-mTOR蛋白表达明显下调。半定量分析结果显示联合用药组与空白组、PD单药组、IM单药组比较差异均有统计学意义(均P<0.01)。
3 讨论
CML是起源于造血体统的恶性肿瘤,其发病机制为Bcr/abl融合基因导致酪氨酸激酶活性增强[6]。IM是一种酪氨酸激酶抑制剂(turosine kinase inhibitors,TKI),目前作为治疗CML的一线药物应用于临床,与传统治疗药物羟基脲、沙利度胺、干扰素比较,具有很好的治疗效果[7]。但临床发现初始治疗有效率高达80%的慢性期患者用药1年后出现继发耐药率约20%,停药2年内的复发率高至69%[2-3]。研究表明患者对IM发生耐药是多种机制的综合结果,且过程复杂,其具体机制也有待研究。寻求治疗CML的新药或协同IM治疗的新方案,减少其耐药的发生,提高疗效并改善患者预后成了当前急需解决的问题。针对其耐药的发生,文献报道联合传统的中药提取物,明显提高CML细胞对IM敏感性,联合用药可以提高IM的治疗效果,发挥协同治疗作用[8-9]。PD是常用传统中药桔梗的主要活性成分,笔者前期研究也报道了PD对白血病细胞K562的抑制作用[4]。国外研究发现其抑制白血病细胞的作用机制包括通过p21信号途径下调weel和CDK2蛋白,抑制细胞核内DNA复制和纺锤体形成,阻止有丝分裂[10];降低c-Myc和SP1蛋白表达水平,下调其与DNA结合能力,抑制hTERT的磷酸化及核转位发挥抑制细胞增殖的能力[11];通过抑制Egr-1的活化、ROS的产生、MMP的分解诱导白血病细胞凋亡[12]。本研究发现,PD联合IM组相对于空白对照组、单独用药组,细胞存活率明显降低、凋亡率明显增加,表明两药有协同效应,PD增强IM对K562细胞抑制增殖和诱导凋亡的作用,本实验进一步明确了PD可以抑制融合基因Bcr/abl及其下游信号通路P13K/AKT/mTOR从而抑制白血病细胞的生长。
PIK/AKT/mTOR途径是Bcr/abl融合基因下游的一条重要信号通路。融合基因Bcr/abl激酶可通过SH2结构域与P13K的p85调节亚基相结合,导致P13K/Akt信号通路激活引起细胞发生恶性转化[1]。细胞启动翻译信号及细胞由G0/G1期进入S期必须通过mTOR信号通路,同时mTOR信号也能调节细胞的分解和合成代谢,与蛋白合成、细胞周期的调控相关[13]。P13K/Akt下游最重要的效应分子是mTOR,mTOR磷酸化的水平在CML患者的骨髓细胞中明显升高[14-15],mTOR途径呈现异常激活状态,提示CML的发生与mTOR途径的异常激活有关[16]。研究表明当小鼠造血干细胞中P13K/AKT/ mTOR途径被激活后,干细胞更容易向白血病性转化[17]。本实验发现PD联合IM在抑制Bcr/abl融合蛋白表达、抑制PI3K/AKT/mTOR信号传导方面均明显优于单药,表明PD增强IM抗K562细胞作用,对CML的治疗可以在应用IM作为一线治疗药物的同时尝试联合应用PD,以减少CML患者对IM的耐药性,为白血病的基因治疗提供科学的理论依据。
[1]Dipta T F,Datta A,Tarif A,etal.Evaluation ofBcr-Ab lGene Rearrangement among Bang lad eshi Chronic Myeloid Leukaemia Patients[J].Mymensing h Med J,2017,26(2):380-387.
[2]赵彩芳,陈燕,黎纬明,等.慢性中性粒细胞白血病5例分析[J].浙江医学,20126,38(15):1290-1292.
[3]Mahon F X,Rea D,Guilhot J,etal.Discontinuation ofimatimib in p atients with chronic myeloid leukaemia who have maintained comp lete molecular remission for at least 2 years:the prosp ective,multicentre Stop Imatinib(STIM)trial[J].Lancet Oncol,2010, 11(11):1029-1035.
[4]谢华夏,徐志远,郑国淀,等.槐耳清膏联合顺铂改变胃癌SGC7901细胞周期分布的实验研究[J].浙江医学,2017,39(14):1155-1157.
[5]代群,葛宇清,王海兵,等.桔梗皂苷D抑制人白血病细胞株K562的增殖和诱导凋亡的作用[J].浙江中医杂志,2011,46(12):911-913.
[6]LuattiS,Bald azziC,Marzocchi G,et al.Cryptic BCR-ABL fusion g ene as variant rearrangement in chronic myeloid leukemia: molecular cytog enetic characterization and influence on TKIs therapy[J].Oncotarg et,2017,8(18):29906-29913.
[7]Jabb our E,Cortes J,Giles F,etal.Currentperspectives on the treatmentof patients with chromc myeloid leukemia:an mmvlmla-1zed ap roach totreatment[J].Cancer J,2007,13(6):357-365.
[8]葛宇清,陈汝滨,杨波,等.隐丹参酮对白血病细胞伊马替尼敏感性和P-糖蛋白表达作用的研究[J].中国中药杂志,2015,40(12):2389-2395.
[9]Ge Y,Yang B,Xu X,etal.Cryp totanshinone acts synergistically with imatinib to ind uce ap optosis of human chronic myeloid leukemia cells[J].Leuk Lymphoma,2015,56(3):730-738.
[10]Kim MO,Moon D O,ChoiYH,etal.Platycodin D ind uces mitotic arrestin vitro,leading to endored up lication,inhibition ofp roliferation and ap optosis in leukemia cells[J].Int J Cancer,2008, 122(12):2674-2681.
[11]Kim MO,Moon DO,ChoiYH,etal.Platycod in D ind uces ap optosis and d ecreases telomerase activity in human leukemia cells[J].Cancer Lett,2008,261(1):98-107.
[12]Shin D Y,Kim G Y,Li W,et al.Imp lication of intracellular ROS formation,casp ase-3 activation and Egr-1 ind uction in p latycod on D-ind uced apop tosis of U937 human leukemia cells[J]. Biomed Pharmacother,2009,63(2):86-94.
[13]Ed ing er AL,Thomp son C B.Aktmaintains cellsize and survival byincreasing mTOR-d epend entnutrientuptake[J].MolBiolCell, 2002,13(7):2276-2288.
[14]Xu Q,Thompson J E,CarrollM.mTOR regulates cellsurvivalafter etoposide treatment in primary AML cells[J].Blood,2005, 106(13):4261-4268.
[15]TambufiniJ,Green AS,BardetV,etal.Protein synthesis is resistant to rapamycin and constitutes a promising therapeutic targ etin acute myeloid leukemia[J].Blood,2009,114(8):1618-1627.
[16]Martelli A M,Tazzari P L,Evangelisti C,et al.Targeting the phosphatidylinositol 3-kinase/Akt/mammalian target of rapamycin module for acute myelog enous leukemia therapy:from bench to bed side[J].Curr Med Chem,2007,14:2009-2023.
[17]Hom S,Bergholz U,Jucker M,etal.Mutations in the catalytic sub unitofclass IAPI3Kconfers leukemog enic potentialto hematop oietic cells[J].Oncogene,2008,27:4096-4106.
(本文编辑:马雯娜)
《浙江医学》对作者署名的一般要求
同时具备以下3项条件者方可署名为作者:(1)参与选题和设计或资料的分析与解释者;(2)起草或修改论文中关键性理论或其他主要内容者;(3)能对编辑部的修改意见进行核修,在学术界进行答辩,并最终同意该文发表者。仅参与研究项目资金的获得或收集资料者不能列为作者,仅对科研小组进行一般管理者也不宜列为作者。对文章中的各主要结论,均必须至少有1位作者负责。作者中如有外籍作者,应征得其同意,并在投稿时向编辑部提供相应证明材料。集体署名的文稿,在题名下列出署名单位,于文末列出整理者姓名,并须明确该文的主要负责人,在论文首页脚注通信作者姓名、单位、邮政编码及E-mail地址。通信作者一般只列1位,由投稿者确定。如需注明协作组成员,则于文末参考文献前列出协作组成员的单位及姓名。作者的具体排序应在投稿前即确定,在编排过程中不应再改动,确需改动时必须出示单位证明。
本刊编辑部
Effect of platycodin D combined with imatinib on K562 cell in vitro
DAI Qun,GE Yuqing.Central Laboratory of First Affiliated Hospital of Zhejiang Chinese Medical University,Hangzhou310006,China
Objective To investig ate the effectand mechanism of Platycodin(PD)comb ined with imatinib(IM)on chronic myelogenous leukemia K562 cells in vitro. Methods Cultured K562 cells were treated with PD and imatinib alone or in comb ination.Cell proliferation was examined b y CCK8 assay.Cell ap optosis were d etected b y Annexin V FITC/PI d oub le staining.The chang e of mitochond rial trans-memb rane p otential was measured b y JC-1 staining.The p rotein exp ression of cleaved casp ase-3,cleaved casp ase-9,PARP,cleaved PARP,Bcr/ab l,p-AKT and p-mTOR were d etected b y Western b lot. Results The inhib itory effects of PD comb ined with imatinib on p roliferation and ap op tosis of K562 cells were sig nificantly hig her than those of the controlg roup or sing le d rug g roup s(all P<0.01).The exp ression of cleaved casp ase-3,cleaved casp ase-9 and cleaved PARP p roteins was sig nificantly up-reg ulated in the comb ination g roup,and the exp ression of PARP,Bcr/ab l, p-AKT and p-mTOR p roteins was sig nificantly d own-reg ulated(P<0.01 or 0.05). Conclusion Platycod in D comb ined with imatinib can sig nificantly increase the inhib itory effect on cell p roliferation and ind uce ap op tosis of K562 cells comp ared with sing le d rug s,which may b e related to Bcr/ab lp rotein and PI3K/AKT/mTOR sig naling p athway.
Platycod in D Imatinib K562 Bcr/ab lfusion g ene PI3K/AKT/mTOR sig nalp athway
2017-03-22)
10.12056/j.issn.1006-2785.2017.39.17.2017-622
国家自然科学基金自助项目(81673755)
310006杭州,浙江中医药大学附属第一医院中心实验室
葛宇清,E-mail:chengleiqing@163.com
