卵巢生长性畸胎瘤综合征并文献复习
2017-09-19宋汉香郭乔楠
宋汉香,郭乔楠
卵巢生长性畸胎瘤综合征并文献复习
宋汉香,郭乔楠
目的探讨卵巢生长性畸胎瘤综合征(growing teratoma syndrome, GTS)的临床病理特征、治疗及预后。方法回顾性分析1例卵巢GTS的临床和病理资料,总结其特殊的病程特点和病理学变化。结果超声检查见右侧卵巢包块大小93 mm×72 mm,肿瘤大体呈囊实性,实性区以菜花样组织为主,质软,囊内见少量毛发及油脂;镜下肿瘤实性区见多灶未成熟原始神经管;免疫表型:NSE呈阳性,Syn、S-100、CD99、CD56呈局灶阳性;术前肿瘤标志物AFP 48.7 ng/mL、CA125 84.2 U/mL,手术切除右侧卵巢包块、子宫、双侧附件、大网膜及阑尾,术后化疗2次。患者术后17个月复发盆腔包块,彩超示大小47 mm×35 mm×24 mm,肿瘤肉眼观察呈实性,质软,部分为骨性组织,镜下可见少量不成熟软骨及间叶组织,肿瘤标志物在正常范围,行盆腔内包块切除,左、右盆腔行淋巴结清扫。术后1个月复查CA125轻度升高,给予连续5次化疗。随访19个月,患者无复发。结论GTS的诊断需结合全部病程,术后复发肿瘤病理诊断为成熟性畸胎瘤是鉴别GTS的重要提示,故应定期检测肿瘤标志物和行腹盆腔超声检查,依据患者个体情况进行合理治疗,避免不必要的化疗。保留年轻患者生育能力和防治术后并发症,是保证良好预后的关键。
卵巢肿瘤;生长性畸胎瘤综合征;临床特点;免疫组织化学;治疗
生长性畸胎瘤综合征(growing teratoma syndrome, GTS)是未成熟畸胎瘤或混合性恶性生殖细胞肿瘤化疗中或化疗后的特殊合并症,表现为转移性并逐渐增大的肿瘤结节或包块,但组织学仅含有成熟畸胎瘤成分的现象。绝大多数临床GTS局限于盆腔、腹腔和腹膜后,与卵巢生殖细胞肿瘤较少发生远处转移的特点一致[1]。GTS好发于睾丸,卵巢少见。本文报道1例原发于已育女性患者的卵巢GTS,并复习相关文献,总结和分析卵巢GTS的临床病理特征、治疗及预后。
1 材料与方法
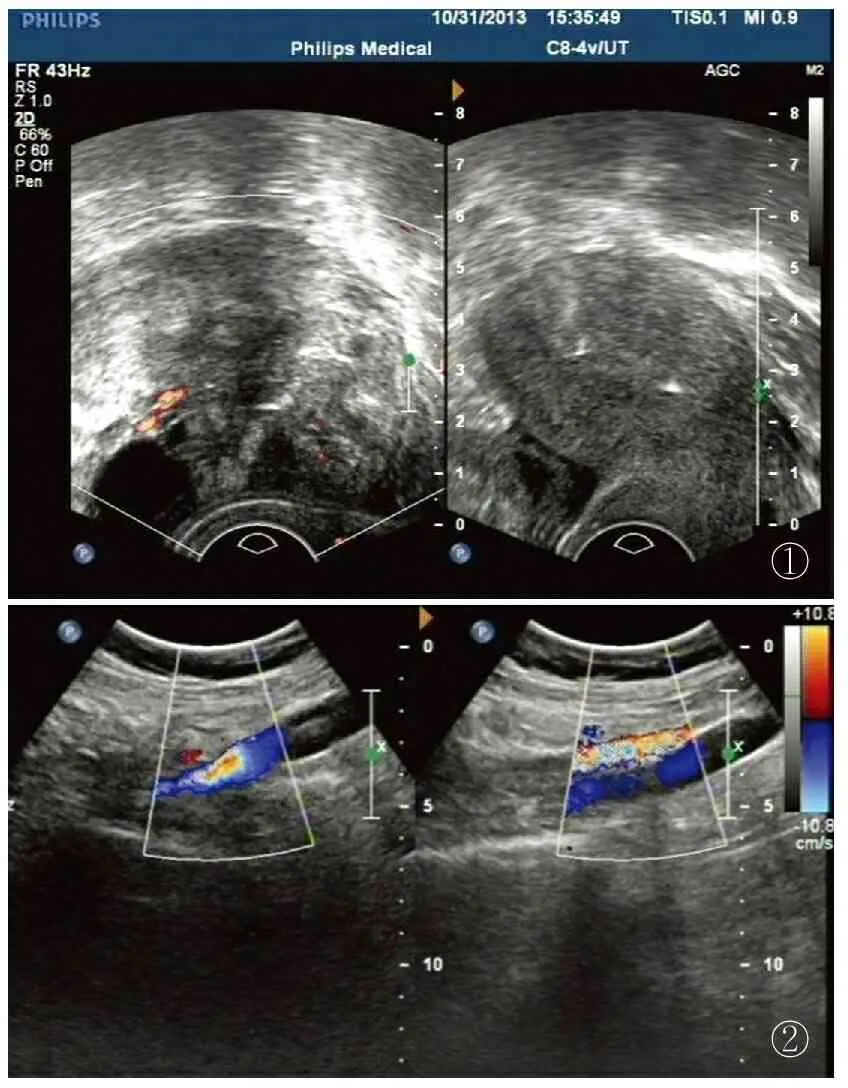
1.1临床资料患者,35岁,孕5产1。2013年11月因卵巢未成熟畸胎瘤进行手术,术后17个月发现盆腔包块9个月入院。病史及治疗:17个月前体检彩超发现子宫右前方混合性包块,大小93 mm×72 mm,边界不清,以实性为主(图1)。肿瘤标志物AFP:48.7 ng/mL(正常值0~10 ng/mL)、CA125:84.2 U/mL(正常值0~35 U/mL);术中所见:右侧卵巢包块,大小120 mm×100 mm×80 mm,有部分组织突破卵巢皮质,左侧附件未见异常,子宫增大如孕50天,盆腔内见淡黄色黏液,大网膜增厚,包块内含头皮、少量毛发,未见脂肪组织。行全子宫+双侧附件+大网膜及阑尾切除,术后化疗2次(化疗方案:顺铂+依托泊苷)。9个月前复查发现盆腔直径30 mm包块,后逐渐增大。第2次手术时彩超示盆腔右侧可见大小47 mm×35 mm×24 mm不均质回声块影,形态不规则,边界不清晰,以高回声为主(图2)。肿瘤标志物AFP:2.17 ng/mL、CA125 11.5 U/mL,行盆腔内包块切除,左、右盆腔淋巴结清扫。术后1个月复查CA125轻度升高37.6 U/mL,化疗(方案同前)1个疗程后恢复至正常范围,随后连续化疗4次(图3),患者二次术后随访19个月,未见肿瘤复发,肿瘤标志物无异常。
1.2方法组织标本经10%中性福尔马林固定,取材大小为2 cm×2 cm×0.2 cm,脱水,石蜡包埋,常规制片,HE染色,光镜观察。免疫组化染色采用EnVision两步法。一抗(即用型)NSE、Syn、S-100、CD99、CD56、Ki-67,均购自福州迈新公司。染色同时设空白对照和阳性对照。
2 结果
2.1眼观首次腹腔镜手术切除右侧卵巢肿物:灰白、灰红色破碎组织一堆,大小11.5 cm×9 cm×4.5 cm,大部分呈菜花样外观,另见少量毛发及囊壁样组织,囊壁实性区灰白、灰红色,质中偏软;切除全子宫大小8.3 cm×7.2 cm×4.5 cm,左侧附件、右侧输卵管、大网膜组织及阑尾均未见肿瘤性占位,其中左侧卵巢大体可见呈囊实性,多个囊腔内充满褐色浑浊液体。第2次手术腹腔镜下切除盆腔包块:灰白、灰黄色碎组织一堆,大小4 cm×3.5 cm×1 cm,切面实性、质软,部分组织为骨性,清扫左侧盆腔淋巴结(7枚)、右侧盆腔淋巴结(10枚)。
①②
图1彩超示子宫右前方混合性包块占位,大小93 mm×72 mm,边界不清,以实性为主图2彩超示盆腔右侧可见一大小47 mm×35 mm×24 mm的不均质回声块影,形态不规则,边界不清晰,以高回声为主
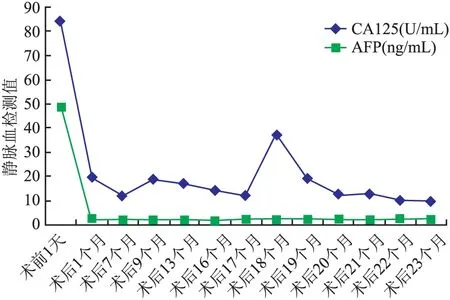
图3入院术前1天肿瘤标志物高于正常水平,术后1个月恢复正常,直至术后第18个月(二次术后1个月)CA125值轻度升高,后期均正常;化疗时间:术后1、7,19、20、21、22、23个月
2.2镜检首次右侧卵巢包块:肿瘤中见多灶未成熟原始神经管结构,细胞核深染,伴明显异形,核分裂象较多,拥挤复层的嗜碱性梭形细胞,极向紊乱,部分有管腔,部分呈片的小细胞中可见菊形团样结构(图4)。二次盆腔包块:未见未成熟原始神经管结构,以成熟畸胎瘤成分为主,可见少量不成熟软骨及间叶组织(图5)。

④⑤
图4第一次手术右侧卵巢包块:肿瘤中见未成熟原始神经管结构
图5第二次手术腹膜结节:可见不成熟软骨及间叶组织
2.3免疫表型右侧卵巢肿瘤组织内未成熟原始神经管:NSE呈阳性,Syn、S-100、CD99、CD56均呈局灶阳性。
3 讨论
Logothetis等[2]于1982年首次报道GTS,并指出未成熟畸胎瘤或混合性生殖细胞肿瘤在化疗中或化疗后出现成熟畸胎瘤的肿瘤结节伴局限腹腔内转移,肿瘤标志物术后下降,此现象曾被称为“化疗逆转”,然而Djordevic等[3]认为化疗逆转不能代表GTS的真正含义,故最终仍旧使用GTS一词。GTS一般在20岁以后首次诊断为未成熟畸胎瘤或生殖细胞肿瘤,在化疗过程中或化疗后的半年到数十年内被诊断,其好发于睾丸,发生于卵巢者少见。目前英文文献报道卵巢GTS约100例,国内报道仅有数例,我院自2004~2017年诊断1例GTS。文献报道卵巢GTS最长生存者达23年以上[4],最小诊断年龄为4岁[5]。目前,关于GTS发生、发展的潜在必要条件尚无统一共识。
卵巢GTS诊断并不困难,然而临床医师对病程的认识、外科手术技术、复发后手术的早晚、术后化疗的及时性以及密切随访等是影响肿瘤预后的关键因素。目前,已知腹腔镜手术可能导致术中肿瘤的腹腔内种植。Scavuzzo等[6]通过2例睾丸GTS患者分析,认为肿瘤复发后尽早手术对GTS整体预后很重要。另外,首次术后应及时化疗。Daher等[5]报道4岁患者在首次手术切除一侧卵巢和肿瘤后未予化疗,术后1个月肿瘤标志物降至正常,于术后4个月肿瘤标志物升高、肿瘤复发,经化疗后肿瘤标志物表达转为正常。本例在首次术后及时化疗,直到肿瘤复发和手术后肿瘤标志物表达均正常,第2次术后1个月CA125仅轻度升高,而肿瘤是成熟畸胎瘤。研究发现,化疗是通过改变细胞动力学将全能恶性生殖细胞向良性成熟细胞转化,而对未经治疗的成熟良性畸胎瘤无作用[7]。因此,多数人认为GTS患者在二次切除复发的成熟性畸胎瘤后无需化疗,但是也有少部分人持保守观点。通过回顾本例临床特点和复习相关文献,发现肿瘤复发与肿瘤标志物表达升高并不完全同步。有些医师认为患者如诊断为恶性肿瘤且随访中有肿瘤标志物表达升高,就要给予化疗,这是对GTS病程特点认识不足所致。GTS在临床病程中成熟性畸胎瘤生长缓慢,相关肿瘤标志物轻度升高。成熟性畸胎瘤虽为良性肿瘤但其生物学行为仍然具有潜在的恶性行为,如侵袭、蔓延(最常见的是腹膜),甚至远处转移,包括肺、纵隔、颈部淋巴结,甚至松果体等[8]。成熟性畸胎瘤对身体的影响主要是压迫周围组织和器官,所以肿瘤复发后应尽早手术,这与GTS的整体预后密切相关。
GTS的特点决定了首次手术后的密切随访和肿瘤复发后尽早手术的重要性,万美珍等[9]报道1例卵巢GTS,患者年龄40岁,首次手术后10年发现腹腔包块,大小10 cm×10 cm,且伴肝、脾、盆腔、腹腔广泛转移,但肿瘤标志物正常。Li等[10]也报道1例24岁患者十年前因右侧卵巢未成熟畸胎瘤而切除右侧卵巢,10年后发现腹腔包块,大小18.6 cm×15.7 cm,伴肝、脾、盆、腹腔广泛转移,肿瘤标志物增高:CA199增高200多倍,CA125增高约12.5倍,病理诊断结果为成熟性畸胎瘤。文献报道2例首次手术后和化疗后均失访。本例于术后13个月随访时发现肿瘤复发,密切随访9个月后进行手术切除,盆腔包块直径仅增大了1.7 cm。以上资料表明临床长期密切随访是保证GTS良好预后的关键,复发肿瘤的压迫可引起周围组织、器官坏死、功能衰竭,严重者致死。个别文献报道GTS患者死于肠梗阻或肺栓塞,近年随着人们健康意识的提高已经较少发生。
卵巢GTS患者后期的生育问题值得关注。Bentivegna等[4]分析38例卵巢GTS,采用保守手术治疗的患者中有5例正常怀孕,表明卵巢GTS患者怀孕是可能的。另外,Merard等[11]认为卵巢GTS较少发生在经过治疗的已孕妇女,这有待于积累更多资料以便进一步证实。
Umekawa等[12]报道1例GTS与腹膜神经胶质瘤病的关系,其结论是GTS为腹膜神经胶质瘤病的一部分。腹膜神经胶质瘤病不仅有成熟成分,也有不成熟的神经胶质成分,此时需行化疗[13],而GTS的复发肿瘤目前文献报道均为成熟畸胎瘤,无需化疗,故是否肯定地认为GTS为腹膜神经胶质瘤病的一部分,还有待进一步研究。
总之,卵巢GTS的诊断并不困难,临床医师需掌握该病病程发展特点,密切随访,早发现、早治疗;避免不必要的化疗,对尚未生育的患者应尽量保留其生育能力。另外,采用正确的手术方式和防治术后并发症也是保证卵巢GTS良好预后的关键,GTS需要与腹膜神经胶质瘤病鉴别。
[1] 陈乐真. 妇产科诊断病理学[M]. 2版. 北京:人民军医出版社, 2014:381.
[2] Logothetis C J, Samuels M L, Trindade A,etal. The growing teratoma syndrome[J]. Cancer, 1982,50(8):1629-1635.
[3] Djordjevic B, Euscher E D, Malpica A,etal. Growing teratoma syndromeof the ovary: review of literature and first reportof a carcinoid tumor arising in agrowing teratomaof the ovary[J]. Am J Surg Pathol, 2007,31(12):1913-1918.
[4] Bentivegna E, Azaïs H, Uzan C,etal. Surgical outcomes after debulking surgery for intraabdominal ovarian growing teratoma syndrome: analysis of 38 cases[J]. Ann Surg Oncol, 2015,12(3):964-970.
[5] Daher P, Riachy E, Khoury A,etal. Growing teratoma syndrome: first case report in a 4-year-old girl[J]. Pediatr Adolesc Gynecol, 2015,28(1):e5-e7.
[6] Scavuzzo A, Santana Ríos Z A, Noverón N R, Jimenez Ríos M A. Growing teratoma syndrome[J]. Case Rep Urol, 2014,139425:1-4.
[7] Gorbatiy V, Spiess P, Pisters L. The growing teratoma syndrome: current review of the literature[J]. Indian J Urol, 2009,25(2):186-189.
[8] Denaro L, Pluchinotta F, Faggin R,etal. What’s growing on? The growing teratoma syndrome[J]. Acta Neurochi, 2010,152(11):1943-1946.
[9] 万美珍,周林艳,陈玉芳. 卵巢种植性畸胎瘤综合征1例[J]. 临床与实验病理学杂志, 2015,31(8):958-959.
[10] Li X, Zhu D, LI Lv, Yu J. An uncommon recurrence of an immature teratoma: a case report[J]. Oncol Lett, 2016(11):2453-2456.
[11] Merard R, Ganesan R, Hirschowitz L.Growing teratoma syndrome: areport of 2 cases and review of the literature[J]. Int J Gynecol Pathol, 2015,34(5):465-472.
[12] Umekawa T, Tabata T, Tanida K,etal. Growing teratoma syndrome as an unusual cause of gliomatosis peritonei: a case report[J]. Gynecol Oncol, 2005,99(3):761-763.
[13] Mrabti H, El Ghissassi I, Sbitti Y,etal. Growing teratoma syndrome and peritoneal gliomatosis[J]. Case Rep Med, 2011,123527:1-12.
Ovarygrowingteratomasyndromeofreportandliteraturereview
SONG Han-xiang, GUO Qiao-nan
(DepartmentofPathology,XinqiaoHospitaloftheThirdMilitaryMedicalUniversity,Chongqing400037,China)
PurposeTo study the clinical characteristics of disease development, pathology, treatment and prognosis in ovarian growing teratoma syndrome (GTS).MethodsThe clinical and pathological data of 1 cases of ovarian GTS were analyzed retrospectively, and the special course of disease and pathological changes were summarized.ResultsUltrasound examination revealed a mass measuring 93 mm×72 mm in the right ovary. Grossly, the tumor was cystic and solid , and solid area was mainly cauliflower like, with soft texture and small amount of hair and grease. Histopathological examination showed there were multifocal immature primitive neural tube in the solid area. Immunohistochemical staining showed the tumor cell were positive for NSE and focal positive for Syn, S-100, CD99, and CD56. In the preoperation, AFP and CA125 were 48.7 ng/mL and 84.2 U/mL.The right ovary mass and uterus, bilateral appendages, omentum and appendix were resected by radical operation, and two courses of chemotherapy postoperative were given. After 17 months, a solid peritoneal mass mesauring 47mm×35mm×24mm, was found in the original position by gynecological ultrasound. Grossly, it was solid and soft with some bone tissue. Histopathological examination showed a few immature cartilage and mesenchymal tissue. Tumor markers were within the normal range, the peritoneal mass and bilateral pelvic lymph nodes were excised thoroughly. A slight elevated in CA125 one month after surgery. After successive five courses of chemotherapy, no tumor recurred for 19 months follow up.ConclusionThe diagnosis of GTS requires a combination of the overall course of the disease. The pathologic diagnosis of mature teratoma on postoperative recurred tumor are important indications for the differential diagnosis of GTS. Therefore, the tumor markers and abdominal and pelvic ultrasonography should be checked regularly, and reasonable treatment should be carried out according to the individual condition of the patient to avoid unnecessary chemotherapy. Keeping the fertility of young patients and preventing postoperative complications is the key to ensure a good prognosis
ovarian neoplasm; growing teratoma syndrome; clinical features; immunohistochemistry; treatment
时间:2017-7-18 11:51 网络出版地址:http://kns.cnki.net/kcms/detail/34.1073.R.20170718.1151.008.html
第三军医大学新桥医院病理科,重庆 400037
宋汉香,女,博士研究生,主治医师。Tel:(023)68774538,E-mail: songhanxiang2008@163.com 郭乔楠,女,博士生导师,教授,通讯作者。E-mail: qiaonan85@263.net
R 737.31
:A
:1001-7399(2017)07-0742-04
10.13315/j.cnki.cjcep.2017.07.008
接受日期:2017-05-10
