三种海洋微藻对石油烃的降解技术研究
2017-09-19张玉荣李子孟
张玉荣,徐 丹,李子孟
(浙江海洋大学海洋与渔业研究所,浙江省海洋水产研究所,农业部重点渔场渔业资源科学观测实验站,浙江省海洋渔业资源可持续利用技术研究重点实验室,浙江舟山 316021)
三种海洋微藻对石油烃的降解技术研究
张玉荣,徐 丹,李子孟
(浙江海洋大学海洋与渔业研究所,浙江省海洋水产研究所,农业部重点渔场渔业资源科学观测实验站,浙江省海洋渔业资源可持续利用技术研究重点实验室,浙江舟山 316021)
为了筛选出可以降解石油类的海洋微藻,将微绿球藻、中肋骨条藻和塔玛亚历山大藻在不同浓度的石油烃溶液中培养后测定细胞密度,叶绿素a和SOD酶变化以及结束石油烃的剩余量,结果表明微绿球藻、中肋骨条藻和塔玛亚历山大藻浓度在低于2 mg/L的石油烃中能够较好的生长,可以用来利用降解一定含有一定浓度石油烃的污染海水。
石油烃;海洋微藻;生物降解
石油类是成分复杂的混合物,含有多种难以被生物降解的有害物质[1,2]。水中较高浓度的石油类不仅影响动植物的摄食、生长和繁殖,导致不可逆的组织损伤,而且可以在生物体内富集,通过食物链传递,影响水产品的质量安全,进而危害人类健康[3-5]。海洋是石油类污染物的最终汇聚地,随着开采、加工以及使用石油类化合物总量的增加,通过各种途径进入海洋的石油类化合物总量日益增加,导致海洋生态系统结构失衡,生物多样性指数减小,渔业资源的产量和质量严重下降[6-7],据统计,从20世纪70年代到21世纪初,全球排入海洋中的石油大约有565 900 t,我国每年直接排入近海的石油约10×104t,仅渔业损失每年就达数亿元[8]。就浙江省而言,海洋石油污染状况同样严重,2014年浙江省重点海湾海水质量调查报告显示,杭州湾、象山港(湾)、三门湾、台州湾、乐清湾、温州湾几乎都属于劣四类水质海域,石油类是海洋污染的主要要素之一[9]。因此,入海石油类的治理事关海洋经济能否持续健康发展。
我国自上世纪90年代以来开始了石油生物修复研究并取得进展,中国海洋大学白洁等[10]系统开展了优势石油降解菌的最适生长条件、对石油烃的降解作用和在污染环境修复中的作用等研究,培育的混合菌株在实验室条件下对石油烃的降解率可达90%[11];杨仕美等采用分子生物学和生理生化等方法进行高效生物菌株筛选、驯化和培养,优育出多种适用于海洋石油污染治理的生物菌群;暨南大学在近海石油污染环境中筛选出高效、耐酸、耐高盐、适用范围广的菌株,构建了石油降解菌群,实现了吸油材料聚氨酯泡沫(PUF)对石油降解菌的固定化,提高了降解率[12];王佳楠等[13]对4株芽胞杆菌属菌株构建微生物组进行石油降解实验,实验表明同菌属微生物种间对石油的降解同时存在协同促进和拮抗抑制作用。
经过多年的努力,生物修复技术得到快速发展并进入实践应用阶段,成为一种经济效益与环境效益俱佳的石油污染治理手段。但是,单靠微生物难以完全去除海洋石油污染、修复生态环境[14]。开发筛选更丰富、更有效的降解石油的生物资源,已经成为国际上该领域的研究热点。本文通过筛选多种可以降解石油类的微藻,为海洋石油污染的治理提供新的思路和方法,将对海洋生态的修复和保护具有重要意义。
1 材料与方法
1.1 微藻的培养
微绿球藻Nannochloris oculata、中肋骨条藻Skeletonema costatum和塔玛亚力山大藻Alexandrium tamarense均购买于中科院海洋所海藻种质库,将天然海水(盐度27,pH 8.1)用0.45 μm滤膜过滤,高压蒸汽灭菌20 min,冷却后备用,将微藻藻种加入2 L的培养瓶,加入f/2培养基。置于光照培养架上扩大培养,培养温度20±1℃,每日摇瓶3~4次,
1.2 石油烃的制备
将0号柴油与经过滤灭菌的海水按照体积比1:9混合,室温下用超声波处理6 h,然后将混合液倒入分液漏斗中静置5 h,分离出的下层水相为石油烃母液,制备全程避光,用紫外分光光度法测定石油烃母液浓度,石油烃母液4℃避光保存,使用时根据需要浓度稀释。
1.3 微藻对石油烃的降解
石油烃对微藻的毒性胁迫实验在250 mL的三角瓶中进行。将处于对数生长期的微藻接入不同石油烃浓度梯度的培养瓶中,微绿球藻、中肋骨条藻和塔玛亚历山大藻的WAF的浓度梯度为0 mg/L、2 mg/L、4 mg/L 和 6 mg/L,分别设置 3 个平行,分别于接种后 1 d、2 d、3 d、4 d、12 d、19 d、26 d、33 d、40 d、47 d、54 d取样测定细胞密度,测定实验起始和结束时微藻的叶绿素a和SOD酶变化以及实验结束时海水中石油烃的剩余量。
1.4 叶绿素a的测定
叶绿素a含量采用Jeffrey-Humphrey(1975)的改进公式计算:
Chl a=11.85×(E664-E750)-1.54×(E647-E750)-0.08×(E630-E750)v/VL
其中,Chla为叶绿素a浓度,μg/L;v为样品提取液体积,mL;V为海水样品实际用量,L;L为测定池光程,cm;E750、E664、E647、E630分别为 750 nm、664 nm、647 nm、630 nm 波长处的吸光值。
1.5 SOD的测定
SOD采用试剂盒测定。
2 结果与分析
2.1 密度变化
从图1可以看出,微绿球藻在培养周期内,空白对照组的细胞密度呈指数增长,40 d之后到达平台期,在12 d之前,2 mg/L处理组的细胞密度增长缓慢,12 d之后呈指数增长,33 d之后进入平台期,4 mg/L和6 mg/L处理组培养期间增长缓慢。
从图2可以看出,中肋骨条藻在培养期间,空白对照组的细胞密度呈现指数增长,培养33 d之后到达平台期,在前4 d之前,2 mg/L处理组的细胞密度增长缓慢,4 d之后呈现指数增长,54 d之后进入平台期,但平台期的密度却高于空白对照组的密度,4 mg/L处理组的细胞密度有一定程度的增长,6 mg/L处理组的细胞密度几乎未增长。
从图3可以看出,塔玛亚历山大藻在培养期间,在12 d之前,空白对照组的细胞密度培养增长缓慢,12 d之后呈现指数增长,47 d之后进入平台期,2 mg/L处理组细胞增长情况和空白对照组的较为一致,也是47 d之后进入平台期,但进入平台期的密度高于空白对照组。4 mg/L和6 mg/L处理组增长缓慢。
结果表明,低于2 mg/L得到石油烃条件下,微绿球藻和中肋骨跳蚤和塔玛亚历山大藻生长状态良好,实验结束时的微绿球藻的最终浓度甚至高于对照组(图1),中肋骨条藻和塔玛亚历山大藻的最终浓度稍低于对照组(图2和图3),4 mg/L和6 mg/L处理组的三种微藻的生长均受到抑制,6 mg/L处理组的微绿球藻和塔玛亚力山大藻几乎未增长(图1~3)。
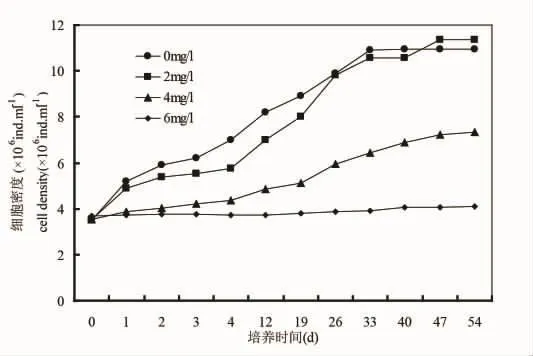
图1 不同石油烃浓度培养期间微滤球藻的生长曲线Fig.1 Growth curve of Nannochloris oculata during the incubation period of different hydrocarbon concentrations
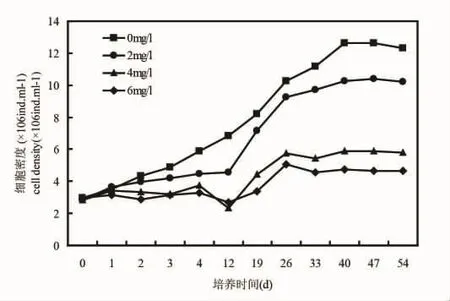
图2 不同石油烃浓度培养期间中肋骨条藻的生长曲线Fig.2 Growth curve of Skeletonema costatum during the incubation period of different hydrocarbon concentrations
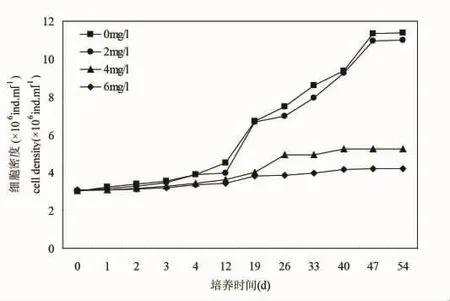
图3 不同石油烃浓度培养期间塔玛亚力山大藻的生长曲线Fig.3 Growth curve of Alexandrium tamarense during the incubation period of different hydrocarbon concentrations
2.2 叶绿素a浓度
微绿球藻、中肋骨条藻和塔玛亚力山大藻在0、2、4和6 mg/L的WAF中培养2个月之后,叶绿素a浓度和起始相比的变化情况如图4、5和6所示,三种实验微藻在不同石油烃溶液中培养2个月之后,2 mg/L处理的微绿球藻和中肋骨条藻的叶绿素a浓度比对着高,塔玛亚力山大藻的叶绿素a浓度稍低于对照组,4 mg/L和6 mg/L处理组的叶绿素a均高于起始浓度,但低于对着组。结果表明,低于2 mg/L得到石油烃条件下,微绿球藻和中肋骨跳蚤和塔玛亚历山大藻的叶绿素a浓度和对照组无差异,4 mg/L和6 mg/L处理组的三种微藻的叶绿素a浓度均小于对照组和2 mg/L处理组(图4、5和6)
2.3 SOD
由表1可知,微绿球藻、中肋骨条藻和塔玛亚历山大藻的起始SOD分别为21.02×10-8U/cell、33.6×10-8U/cell和45.8×10-8U/cell,结束时,微绿球藻的对照组和2.0 mg/L的SOD分别增加7.3和2.4%,4.0 mg/L降低21.5%,6.0 mg/L降低51.1%,中肋骨条藻的对照组和和2.0 mg/L的SOD分别增加1.5和2.7%,4.0 mg/L降低15.5%,6.0 mg/L降低38.1%,塔玛亚力山大藻的对照组和和2.0 mg/L的SOD分别降低了0.7和7.6%,4.0 mg/L降低29.3%,6.0 mg/L降低57.4%。结果表明,三种微藻的对照组和2.0 mg/L处理组起始和结束时的SOD差异不大,4.0 mg/L和6.0 mg/L处理组结束时的SOD显著降低,说明三种微藻受到高浓度石油烃的伤害。
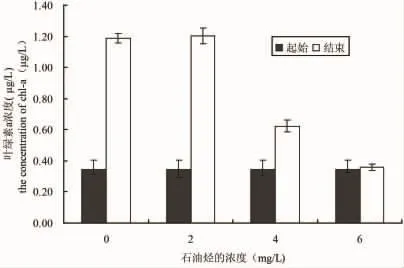
图4 在不同浓度石油烃培养条件下微绿球藻起始和结束的叶绿素a浓度Fig.4 The beginning and the end chlorophyll a concentration of N.oculata in different culture conditions of petroleum hydrocarbon
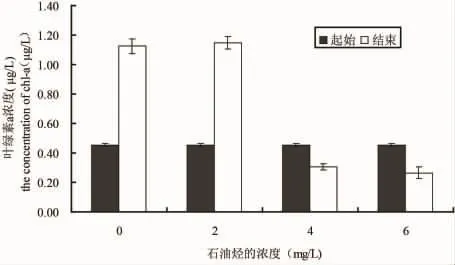
图5 在不同浓度石油烃培养条件下中肋骨条藻起始和结束的叶绿素a浓度Fig.5 The beginning and the end chlorophyll a concentration of S.costatum in different culture conditions of petroleum hydrocarbon
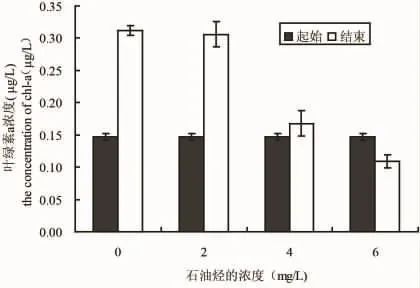
图6 在不同浓度石油烃培养条件下塔玛亚力山大藻起始和结束的叶绿素a浓度Fig.6 The beginning and the end chlorophyll a concentration of A.tamarense in different culture conditions of petroleum hydrocarbon
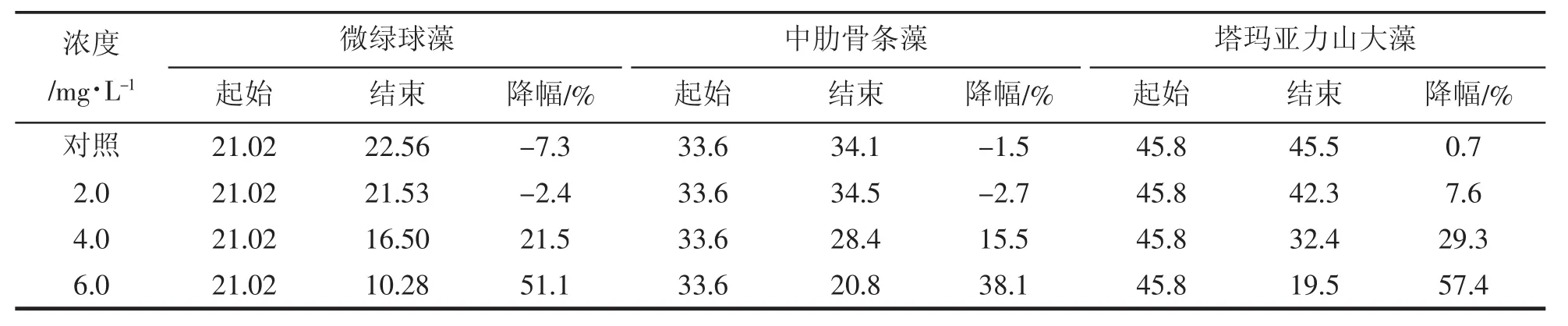
表1 3种微藻培养起始和结束SOD(×10-8U/cell)变化Tab.1 Initiation and end of SOD(×10-8U/cell)changes in cultures of three microalgae
2.4 石油烃剩余量
由表2可知,实验起始和终止,三种实验微藻的各浓度组的石油烃降低的幅度都很大,均在99%以上,其中微绿球藻起始2.0 mg/L降低到0.001,降解率为99.95%,塔玛亚力山大藻4.0 mg/L降低到0.13,降解率为99.75%,微绿球藻6.0 mg/L,降低到0.050,降解率为99.16%。结果表明,三种微藻对一定浓度的石油烃均有较理想的降解效果。
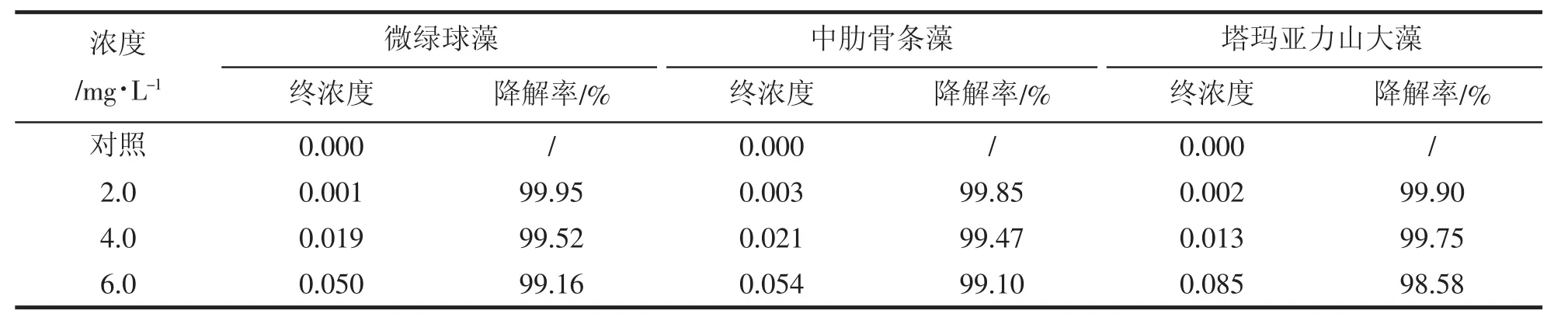
表2 微藻在不同浓度石油烃培养后石油烃的剩余量(mg/L)及降幅(%)Tab.2 The beginning and end WAF concentrations of three microalgae cultured
3 结论
将微绿球藻、中肋骨条藻和塔玛亚历山大藻在不同浓度的石油烃溶液中培养后,通过测定细胞密度,叶绿素a和SOD酶变化以及结束石油烃的剩余量,表明微绿球藻、中肋骨条藻和塔玛亚历山大藻浓度在低于2 mg/L的石油烃中能够较好的生长,许多室内和室外的实验结果表明,一定浓度的石油烃浓度可以促进浮游植物的大量生长[14],可以用来利用降解一定含有一定浓度石油烃的污染海水。
[1]NEFF J M,STUBBLEFIELD W A.Chemical and toxicological evaluation of water quality following the Exxon Valdez oil spill[C]//WELLS P G,BUTLER J N,HUGHES J S.Exxon Valdez Oil Spill:Fate and Effects in Alaskan Waters,ASTM STP1219.Philadelphia USA:American Society for Te-sting and Materials,1995:141-177.
[3]NIKOLOPOULOU M,KALOGERAKIS N.Biostimulation strategise for fresh and chronically polluted m-arine environments with petroleum hydrocarbons[J].Journal of Chemical Technllogy and Biotechnllogy,2009,84(6):802-807.
[4]KO J Y,DAY J W.A review of ecological impacts of oil and gas development on coastal ecosyst-ems in the Mississippi Delta[J].Ocean&Coastal Mamagemnet,2004,47(11/12):597-623.
[5]李 静,宫向红,乔 丹,等.石油污染对海洋贝类食品安全影响研究进展[J].中国渔业质量与标准,2015,5(1):35-41.
[6]田立杰,张瑞安.海洋油污染对海洋生态环境的影响[J].海洋湖沼通报,1999(2):65-69.
[7]郑向荣,吴新民,穆建东.海洋石油污染生物修复技术研究进展[J].河北渔业,2013(1):46-48.
[8]王君丽,刘春光,冯剑丰.石油烃对海洋浮游植物生长的研究进展[J].环境污染与防治,2011,33(4):81-86.
[9]国家海洋局.2014年海洋环境质量公报.北京:国家海洋局,2015.
[10]白 洁,崔爱玲,吕艳华.石油降解菌对石油烃的降解能力及影响因素研究[J].海洋湖沼通报,2007(3):41-48.
[10]杨仕美,张翼霄,高光军,等.不同碳源富集的石油烃降解菌群落结构的分析[J].海洋科学,2009,33(8):87-92.
[11]刘媚媚,金腊华,李文松,等.一种石油降解菌的活性炭纤维固定化研究[J].环境污染与防治,2009,31(10):48-51.
[12]王佳楠,石研云,郑力燕,等.石油降解菌的分离鉴定及4株芽胞杆菌种间效应[J].环境科学,2015,36(6):2245-2251.
[13]刘金雷,夏文香,赵亮,等.海洋石油污染及其生物修复[J].海洋湖沼通报,2006,(3):48-53.
[14]黄逸君,陈全震,曾江宁,等.石油污染对海洋浮游植物群落生长的影响[J],2011,31(2):513-521
Study on the Degradation of Petroleum Hydrocarbons by Three Kinds of Marine Microalgae
ZHANG Yu-rong,XU Dan,LI Zi-meng
(Marine and Fishery Institute of Zhejiang Ocean University,Marine Fisheries Research Institute of Zhejiang Province,Scientific Observing and Experimental Station of Fishery Resources for Key Fishing Grounds,Ministry of Agriculture,Key Laboratory of Sustainable Utilization of Technology Research for Fishery Resource of Zhejiang Province,Zhoushan 316021,China)
In order to filter out marine microalgae can degrade petroleum,three species of marine microalgaes including Nannochloris oculata,Skeletonema costatum and Alexandrium tamarense were cultured in different concentrations of petroleum hydrocarbons.By measuring cell density,changes in chlorophyll a and SOD enzymes,and the end of residual petroleum hydrocarbons,the results showed that the Noculata,Scostatum and Atamarense in the petroleum hydrocarbon below 2 mg/L can growed well,can be used to water pollution by degradation must contain a certain concentration of petroleum hydrocarbon.
petroleum hydrocarbons;marine microalgae;biodegradation
X55
A
1008-830X(2017)03-0253-04
2017-02-16
浙江省科技计划项目(2016F30023)
张玉荣(1982-),女,江苏徐州人,工程师,研究方向:海洋环境影响评价及海域使用论证.E-mail:yurongzhang2008@163.com
