As3+、Cr6+、Ni2+对黑褐新糠虾毒性效应研究
2017-09-19郭远明
钟 志,郭远明,刘 琴,石 群
(1.浙江海洋大学海洋与渔业研究所,浙江省海洋水产研究所,浙江舟山 316021;2.浙江省海洋渔业资源可持续利用技术研究重点实验室,浙江舟山 316021;3.浙江海洋大学,浙江舟山 316022)
As3+、Cr6+、Ni2+对黑褐新糠虾毒性效应研究
钟 志1,2,郭远明1,刘 琴1,石 群3
(1.浙江海洋大学海洋与渔业研究所,浙江省海洋水产研究所,浙江舟山 316021;2.浙江省海洋渔业资源可持续利用技术研究重点实验室,浙江舟山 316021;3.浙江海洋大学,浙江舟山 316022)
选取黑褐新糠虾为实验动物,采用半静态暴露法开展研究了As3+、Cr6+、Ni2+毒性效应。急性毒性实验结果表明,As3+、Cr6+、Ni2+对黑褐新糠虾的 96 h LC50分别为 92.04 μg/L、233.20 μg/L、537.10 μg/L;相关抗氧化酶系统研究结果显示,SOD和CAT两种酶对三种重金属的暴露均呈现先诱导后抑制趋势。暴露结果显示,各处理组MDA水平显著高于对照组。综合3种重金属离子对黑褐新糠虾毒性数据,3种重金属离子毒性依次为As3+>Cr6+>Ni2,且氧化压力损伤被认为是其主要致毒机制之一。
As3+;Cr6+;Ni2+;黑褐新糠虾;毒性;抗氧化酶系统
近年来,随着第一产业、第二产业发展以及对于海洋资源的开发利用,含有重金属(如As3+、Cr6+、Ni2+)的产品被广泛地使用,近海渔业海域中的重金属污染问题已成为海洋资源与环境研究中的重要内容[1]。重金属污染具有来源广、残毒时间长、难以降解、易富集等特性,被认为是海洋环境中具有潜在危害的重要污染物[2]。已有研究表明重金属污染物对生物体产生的危害与氧化应激密切相关,造成机体氧化和抗氧化作用失衡进而导致机体组织器官畸变,产生神经、生殖和免疫毒性[3]。因此抗氧化系统中酶成分、活性或含量的改变可有效地反映细胞氧化胁迫程度。超氧化物歧化酶(SOD)、过氧化氢酶(CAT)等作为污染物毒性的生物标志物已广泛应用于重金属毒理学研究[4,5]。张楠等研究指出,Zn2+能破坏大型溞的氧化应激平衡,导致体内活性氧(ROS)及脂质过氧化程度增加、抗氧化酶活性降低[5]。
黑褐新糠虾Neomysis awatschensis属节肢动物门,甲壳纲,软甲亚纲,糠虾目,是广泛分布于我国沿海的一种小型虾类,多生活于近岸水域,与对虾亲缘关系较近[6]。它能在水底生物和浮游生物之间形成纽带,是海洋生物链中的重要环节,具有生活周期短,生长快,易培养,对毒性敏感等特点,已在实验室内多年连续培养成功,因而被广泛应用于水生生物毒性实验中,具有广泛的技术前景。
本文以黑褐新糠虾为受试生物,通过剂量、毒性之间的相关性,探讨了3种重金属离子的致毒机理,以期为养殖环境评价和相关污染事故处理提供参考依据。
1 材料与方法
1.1 试剂
考马斯亮蓝蛋白试剂盒、SOD活性测定试剂盒、CAT活性试剂盒和MDA试剂盒均由南京建成生物工程研究所提供;重铬酸钾(K2Cr2O7)、硝酸镍(Ni(NO3)2·6H2O)均为分析纯,购自国药集团化学试剂有限公司;亚砷酸钠(NaAsO2),化学纯,购自湖南水口山二厂化学试剂厂。实验所用储备液均以双蒸水配置并于4℃避光保存。
1.2 仪器
台式离心机(UNIVERSAL-320R,Hettich)、紫外分光光度计(SP-752,上海光谱仪器有限公司)、1 cm标准石英比色皿、KQ3200型超声波清洗器(150W,昆山公司)、电子天平(MettleR-Toledo,Switzerland)、结晶皿(高硼硅玻璃,80 mm)、光照培养箱(PGX-450B,宁波海曙有限公司)。
1.3 实验方法
1.3.1 急性毒性实验
急性试验方法按照《近海污染生态调查和生物监测(GB 17378.7-2007海洋监测规范第7部分)》进行[7],将200只筛选后的黑褐新糠虾分别暴露于添加As3+(50.0、100.0、150.0、200.0、250.0 μg/L)、Cr6+(100.0、200.0、300.0、400.0、500.0 μg/L)和Ni2+(200、400.0、600.0、800.0、1 000.0 μg/L)的100 mL人工海水(盐度为30±2)。同时设置空白对照组,每组设置3个平行。每天更换实验溶液一次,采用半静态暴露方式。光周期为14 h:10 h(光照:黑暗),温度为25±1℃,试验周期为96 h。实验期间,于12 h内连续观察,并记录每组死亡数量,之后分别于24 h、48 h、72 h、96 h观察记录死亡情况。实验中,用玻璃棒触碰糠虾个体无任何反应表示已完全死亡,及时捞出死亡个体,防止死亡的黑褐新糠虾污染水质。
1.3.2 抗氧化酶活性及MDA水平测定
将 200 只筛选后的黑褐新糠虾分别暴露于添加(25.0、50.0、75.0、100.0、125 μg/L)As3+、Cr6+和 Ni2+的100 mL人工海水(盐度为30±2)。同时设置空白对照组,每组设置3个平行。分别于暴露第3 d、6 d随机挑取10只黑褐新糠虾,按1 g:10 mL的比例用PBS缓冲液制成质量分数10%的组织匀浆(pH=7.5),匀浆中SOD、CAT活力,分别用SOD、CAT试剂盒测定。
1.4 数据分析
根据3种重金属离子对黑褐新糠虾的急性毒性实验结果,本实验采用概率单位—质量浓度直线回归法,计算96 h LC50。安全浓度(Sc)采用下列公式计算[8]:

实验数据用SPSS 16.0软件进行处理,并进行单因素方差分析(ANOVA),P≤0.05表示显著性差异。
2 结果
2.1 As3+、Cr6+、Ni2+对黑褐新糠虾的急性毒性
3种重金属对黑褐新糠虾的急性毒性试验结果见表1。根据实验结果计算,As3+对黑褐新糠虾的96 h LC50为 92.04 μg/L,安全浓度为0.92 mg/L;Cr6+对黑褐新糠虾的 96 h LC50为 233.20 μg/L,安全浓度为 2.33 μg/L;Ni2+对黑褐新糠虾的 96 h LC50为 537.10 μg/L,安全浓度为 5.37 μg/L。

表1 As3+、Cr6+、Ni2+对黑褐新糠虾的急性毒性试验结果Tab.1 Acute toxicity of Cr6+,Ni2+and As3+to N.awatschensis

图1 Cr6+、Ni2+和As3+单独暴露对黑褐新糠虾SOD活性的影响Fig.1 Effect of Cr6+,Ni2+and As3+to the SOD activity in N.awatschensis
2.2 As3+、Cr6+、Ni2+对黑褐新糠虾 SOD 酶活性的影响
As3+、Cr6+、Ni6+诱导黑褐新糠虾体内SOD活性变化如图1所示。各处理组随浓度的升高,SOD活性均呈现先上升、后下降的趋势。3 d时,当Ni2+暴露浓度为50.0 μg/L时,SOD酶活性达到最高值,为对照组的139.2%。当Ni2+浓度为125.0 μg/L时,SOD酶活性达到最低值,为对照组的62.7%,同时Cr6+、As3+低浓度处理组较Ni2+对应浓度SOD水平低,高浓度处理组较Ni2+对应浓度SOD水平高;6 d时,各处理组SOD活性均高于3 d时对应浓度的SOD活性,Ni2+浓度组中仅最高浓度组SOD活性低于对照组,呈现显著的抑制作用,而其它浓度组均显著高于对照组,且Cr6+、As3+低浓度处理组中SOD水平较Ni2+高。整体上看来,SOD活性呈现低浓度刺激、高浓度抑制效应。
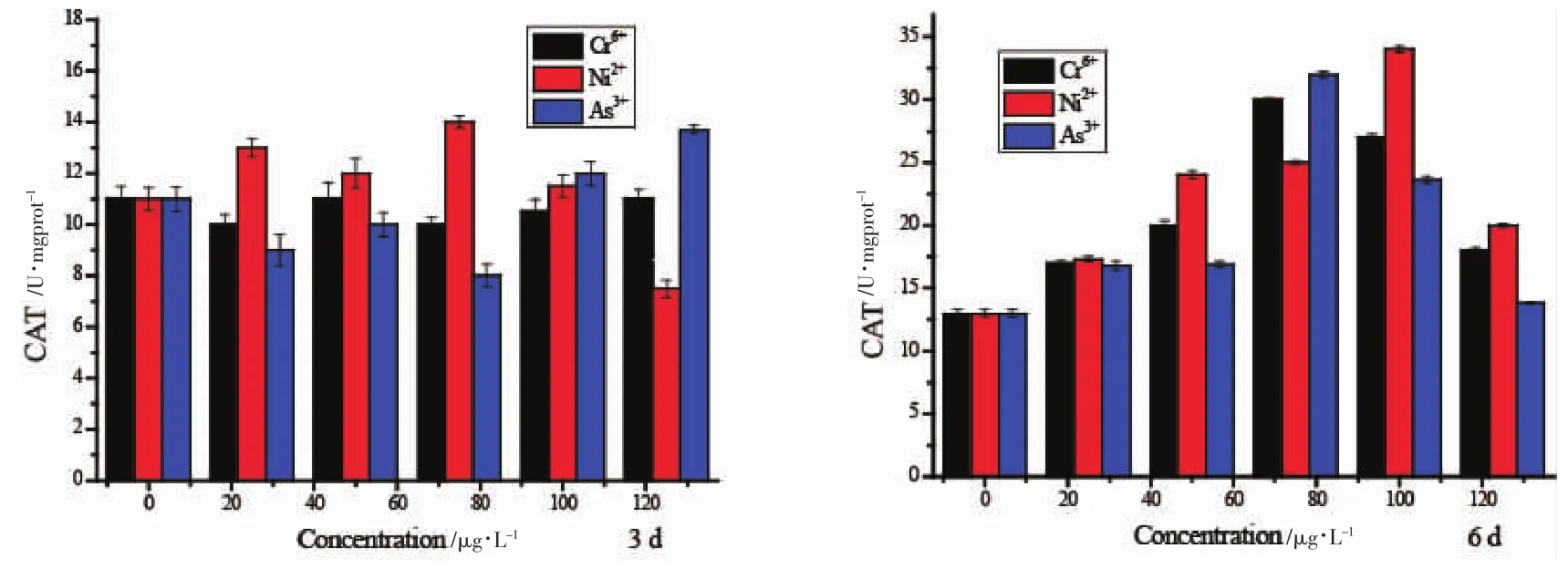
图2 Cr6+、Ni2+和As3+单独暴露对黑褐新糠虾CAT活性的影响Fig.2 Effect of Cr6+,Ni2+and As3+to the CAT activity in N.awatschensis

图3 Ni2+、Cr6+和As3+单独暴露对黑褐新糠虾MDA含量的影响Fig.3 Effect of Ni2+,Cr6+and As3+to the level of MDA in N.awatschensis
2.3 As3+、Cr6+、Ni2+对黑褐新糠虾 CAT 酶活性的影响
Ni2+、Cr6+和As3+诱导黑褐新糠虾体内CAT活性变化如图2所示。在处理3 d的情况下,Ni2+暴露组CAT活性亦存在低浓度刺激,高浓度抑制现象。而除最高浓度组外,其余处理组与对照组CAT活性差异不显著,最高浓度组酶活性与对照组相比呈现显著抑制作用,但Cr6+、As3+在暴露浓度范围内CAT活性总体呈现增加趋势,随着时间的延长,CAT活性呈现上升趋势。6 d时,三种重金属对黑褐新糠虾CAT活性均存在低浓度刺激,高浓度抑制现象,50.0、75.0、100.0 μg/LNi2+处理组呈显著诱导作用,Cr6+和 As3+75.0、100.0 μg/L处理组均呈现显著诱导作用。
2.4 As3+、Cr6+、Ni2+对黑褐新糠虾 MDA 水平的影响
Ni2+、Cr6+和As3+对黑褐新糠虾MDA含量影响见图3,3 d时各处理组MDA水平均显著高于对照组。当Cr6+和As3+暴露浓度为125.0 μg/L时,MDA水平达到最高值,分别为对应浓度Ni2+处理组129.8%、144.4%,而当Cr6+和As3+暴露浓度为75.0 μg/L时,MDA诱导水平较对应浓度Ni2+处理组最高,分别为135.5%、153.9%;6 d时,除As3+最高浓度全部死亡外,Cr6+和As3+各浓度处理组MDA水平均显著高于对应浓度Ni2+处理组,Cr6+暴露浓度为125.0 μg/L时,MDA水平达到最高值,分别为对应浓度Ni2+处理组115.5%,而当Cr6+和As3+暴露浓度为25.0 μg/L时,MDA诱导水平较对应浓度Ni2+处理组最高,分别为119.1%、128.7%,整体上看来,MDA含量随浓度、暴露时间升高而升高。
3 讨论与结论
根据国家环保局相关文件规定,96 hLC50>10 000 mg/L、1 000~10 000 mg/L、100~1 000 mg/L、1~100 mg/L、<1.0 mg/L分别为微毒、低毒、中毒、高毒、剧毒污染物[9]。按照这一等级的划分,本实验中Cr6+、Ni2+、As3+对黑褐新糠虾的 96 h LC50分别为 233.20 μg/L、537.10 μg/L、92.04 μg/L,Cr6+、Ni2+、As3+对黑褐新糠虾的毒性均为剧毒。3种重金属离子对黑褐新糠虾的毒性依次为As3+>Cr6+>Ni2+。根据急性毒性试验结果来看,Cr6+、Ni2+、As3+对大黄鱼幼鱼均具有急性毒性。
正常情况下,机体的抗氧化系统处于动态平衡中,但在重金属离子刺激下,会造成机体的氧化应激反应[10,11]。一定剂量的重金属能使生物体体内ROS增加,ROS具有高度的活性和氧化能力,能够通过氧化作用攻击生命大分子,这些物质若不能被及时清除,就会造成机体在分子细胞及组织器官水平的损伤[12,13]。SOD和CAT是机体的主要抗氧化酶,能够清除体内多余的ROS,维持机体氧化平衡[14]。机体SOD、CAT活力的高低间接反映了机体清除自由基的能力,MDA含量变化可反映机体内脂质过氧化的程度,间接反映出细胞损伤的程度[15,16]。在3 d时,25.0 μg/L Ni2+暴露组SOD活性显著高于对照组SOD活性,而Cr6+和As3+分别于50.0 μg/L和75.0 μg/L暴露浓度下SOD活性显著高于对照组。该现象表明,Ni2+、Cr6+及As3+诱导胚胎体内SOD活性与暴露剂量有关。SOD活性增加,可及时清理由污染物毒性造成的氧化损伤,保护机体正常运行。Ni2+暴露组SOD活性在最低浓度时,即产生较高的SOD活性,而Cr6+和As3+在较高浓度才出现该现象,这是由于黑褐新糠虾SOD活性变化对三种重金属表现不同的敏感性,这可能是由于Cr6+、Ni2+和As3+化学性质及结构的不同因而导致黑褐新糠虾对其生物响应的差异。6 d暴露结果显示SOD、CAT活性升高,MDA含量也增加,表明重金属对黑褐新糠虾的毒性与抗氧化酶活性变化及MDA含量变化之间存在较为密切的联系。暴露结果显示,同浓度暴露MDA诱导水平As3+>Cr6+>Ni2+,这是由于三种重金属对黑褐新糠虾抗氧化酶系统损伤程度不同,导致机体氧化损伤及脂质过氧化产物增加,从而造成机体细胞不同的毒性效应。
[1]Ayres R U.Toxic heavy metals:materials cycle optimization[J].Proceedings of the NationalAcademy of Sciences,1992,89(3):815-820.
[2]张首临,刘明星,李国基,等.3种重金属离子对海洋三角褐指藻生长影响的研究[J].海洋与湖沼,1995,26(6):582-585.
[3]张红霞,潘鲁青,刘静.重金属离子对日本蟳血淋巴抗氧化酶(SOD,CAT,GPx)活力的影响[J].中国海洋大学学报:自然科学版,2006,36(增刊):49-53.
[4]杨丽华,方展强,郑文彪,等.镉对鲫鱼鳃和肝脏超氧化物歧化酶活性的影响[J].安全与环境学报,2003,3(3).13-16.
[5]张 楠,张清靖,贾成霞,等.重金属锌对大型溞SOD,CAT酶活性和GSH含量的影响[J].西南大学学报:自然科学版,2017,39(1):69-75.
[6]李建军,杨笑波,黄 韧,等.五种重金属离子对黑褐新糠虾的急性毒性试验[J].海洋环境科学,2006,25(2):51-53.
[7]国家海洋环境监测中心.GB 17378.7海洋监测规范第7部分近海污染生态调查和生物监测[S].北京:中国标准出版社,2008.
[8]周永欣,章宗涉.水生生物毒性试验方法[M].北京:农业出版社,1989.
[9]国家质量监督检验检疫总局危险品中心实验室、中化化工标准化研究所.GB/T 21281危险化学品鱼类急性毒性分级试验方法[S].北京:中国标准出版社,2008.
[10]熊向英,黄国强,彭银辉,等.低氧胁迫对鲻幼鱼生长,能量代谢和氧化应激的影响[J].水产学报,2016,40(1):73-82.
[11]马陶武,朱 程,周 科,等.铜锈环棱螺对铅污染沉积物慢性胁迫的繁殖响应和氧化应激反应敏感性[J].生态学报,2009,29(10):5 350-5 357.
[12]张 峰,李光友.几种重金属对皱纹盘鲍血细活性氧产生的影响[J].海洋环境科学,2005,24(1):32-34.
[13]刘海芳,王 凡.重金属对水产动物污染的生物标志物的研究进展[J].水产科学,2009,28(5):299-302.
[14]潘鲁青,任加云,吴众望.重金属离子对中华绒螯蟹肝胰脏和鳃丝SOD,CAT活力的影响[J].中国海洋大学学报:自然科学版,2004,34(2):189-194.
[15]赖廷和,何斌源,范航清,等.重金属Cd胁迫对红树蚬的抗氧化酶,消化酶活性和MDA含量的影响[J].生态学报,2011,31(11):3044-3053.
[16]柯佳颖,李裕红,陈朝阳,等.重金属离子胁迫对福寿螺肝脏内丙二醛(MDA)含量的影响[J].泉州师范学院学报,2013,30(6):43-46.
Study on Toxicity of As3+,Cr6+,Ni2+to Neomysis awatschensis
ZHONG Zhi1,2,GUO Yuan-ming1,LIU Qin1,et al
(1.Marine and Fishery Research Institute of Zhejiang Ocean University,Marine Fisheries Research Institute of Zhejiang Province,Zhoushan 316021;2.Key Laboratory of Sustainable Utilization of Technology Research for FisheryResourceofZhejiangProvince,Zhoushan316021;3.ZhejiangOceanUniversity,Zhoushan316022,China)
In this study,Neomysis awatschensis was selected as the experimental animal,and the toxicity experiments of As3+,Cr6+and Ni2+were carried out in the semi-static system.The results showed that 96 h LC50values of As3+,Cr6+and Ni2+towards Neomysis awatschensis in the sea water were 233.20 μg/L,537.10 μg/L and 92.04 μg/L,respectively.The activity of SOD and CAT showed that the tendency of first inducing and then inhibiting when exposed to As3+,Cr6+and Ni2+.And the level of MDA in every treatment group was significantly higher than that of control group.By synthesising the data of acute toxicity and antioxidant enzyme systems,the toxicity of As3+,Cr6+and Ni2+was arranged in a descend order as the following:As3+>Cr6+>Ni2+,and the oxidative stress could be considered as one of the main reason for the toxicity.
As3+;Cr6+;Ni2+;Neomysis awatschensis;toxicity;antioxidant enzyme systems
X503.2
A
1008-830X(2017)03-0212-05
2017-03-12
浙江省科技计划项目(2015C32001)
钟志(1979-),男,江西萍乡人,高级工程师,研究方向:海洋环境监测与评估.E-mail:zhongzhizz@sina.com
