DNA识别受体在乙型肝炎发病机制中的作用
2017-09-18庞秀青谢冬英
黄 劲, 庞秀青, 谢冬英
(中山大学附属第三医院 肝病实验室, 广州 510630)
DNA识别受体在乙型肝炎发病机制中的作用
黄 劲, 庞秀青, 谢冬英
(中山大学附属第三医院 肝病实验室, 广州 510630)
乙型肝炎作为一种全球性疾病至今仍危害着人类健康,但是HBV导致的肝炎发病机制仍未明确。肝脏中的固有免疫系统能监测HBV感染,并且运用各种策略清除病毒,其中DNA识别受体发挥了重要的作用。DNA识别受体在胞质或者胞核中识别HBV DNA或pgRNA,通过各种信号通路激活固有免疫从而产生炎性因子及IFN,最终发挥抗病毒作用。总结了各种参与HBV致炎及HBV清除的DNA识别受体,阐述了它们的具体作用途径,并对DNA识别受体在HBV诱导的肝脏固有免疫作用中存在的问题作出讨论及展望。
肝炎, 乙型; 受体, 模式识别; 综述
现阶段全球约有20亿人感染过HBV,其中约4亿人是HBV慢性携带者,而且每年约有5千万至1百万人死于HBV相关终末期肝病或肝癌[1-2]。HBV感染导致的肝脏疾病早已进入全球疾病致死榜前10位。但是,HBV感染导致的肝炎发病机制至今仍未明确[3]。既往大量研究[4]表明,尽管HBV不会对肝细胞造成直接破坏,但是HBV感染机体后所触发的免疫应答在肝炎的发生发展以及病毒的清除过程中发挥了至关重要的作用。而关键的问题是机体的免疫系统是如何识别HBV的。随着对DNA识别受体作用认识的不断更新,为这个问题的解答带来了新的方向。本文主要总结了现阶段关于DNA识别受体参与HBV导致肝炎的发病机制的研究,并对DNA识别受体存在的问题作出讨论和展望。
1 DNA识别受体
既往研究[5]表明核苷酸在免疫应答中发挥着重要的作用,但是人们对核苷酸具体如何激发机体的免疫应答了解很少。继2000年Hemmi等[6]发现胞膜DNA识别受体——Toll样受体9后,DNA识别受体开始进入人们视线,并成为免疫学领域的一大热点。至今为止已有10余种DNA识别受体被报道,它们在对外源或内源损伤DNA识别后通过不同的方式触发机体免疫反应[7-8]。细胞中的DNA识别受体有很多,它们能识别各种不同来源的DNA,包括细菌、病毒和凋亡细胞。作为一种病原相关分子模式,外源DNA如HBV DNA能够被细胞中的模式识别受体识别,激活固有免疫应答信号通路,诱导并上调IFN和促炎性细胞因子基因的转录和表达,从而启动固有免疫防御机制,同时促进产生特异性免疫应答[9-10]。
DNA识别受体参与固有免疫的作用在HBV相关肝炎的发病机制中是否也同样存在,已有许多相关的研究证实了这一猜想。作为一种双链DNA(dsDNA)病毒,HBV感染机体后通过血液到达肝脏,其基因组DNA在肝脏中首先被固有免疫系统识别,随后诱导产生各种炎性因子,并且通过固有免疫细胞如自然杀伤细胞、自然杀伤T淋巴细胞等引起特异性免疫,最终发挥抗病毒作用[11]。其中肝脏内不同的DNA识别受体参与诱发肝脏炎症的通路可能不同,而具体的机制仍有待进一步明确。
2 参与HBV相关肝脏炎症发生的DNA识别受体
2.1 黑素瘤缺乏因子(absent in melanoma,AIM)2与人干扰素诱导蛋白(interferon-inducible protein,IFI)16 2009年,多家研究机构几乎同时报道发现AIM2[12-14]。AIM2属于PYHIN蛋白家族成员,分子结构中包含了1个HIN 200结构域和1个Pyrin结构域。HIN 200结构域能够识别dsDNA,促使AIM2寡聚化和纤维化;Pyrin结构域则介导招募凋亡相关斑点样蛋白,进而激活半胱氨酸蛋白酶(caspase)1。活化的caspase-1对IL-1β和IL-18的成熟具有重要作用[15-16]。笔者团队研究[17]发现,AIM2在慢性乙型肝炎患者的肝组织中高表达,并且其表达水平与肝炎的严重程度呈正相关。而在体外实验中,AIM2能够在转染了HBV DNA质粒的HepG2细胞中诱导产生IL-18,并且随着加入的AIM2抑制剂浓度越高,IL-18产生的量越低;而同样加入caspase-1抑制剂量越多,IL-18表达也越低。这就表明,AIM2作为一种胞浆内的DNA识别受体,可能在肝细胞中识别了HBV DNA,激活了caspase-1通路,最终诱导产生炎性因子,导致肝炎的发生[18]。
IFI16与AIM2同属于PYHIN蛋白家族成员,分子结构中包含2个HIN结构域( HIN-A和HIN-B)和1个Pyrin结构域。 IFI16能够识别多种病毒的dsDNA,通过STING-TBK1-干扰素调节因子(interferon regulatory factor,IRF)3信号通路上调IFNβ的表达。IFI16高表达于慢性乙型肝炎患者肝组织的免疫细胞中,而IFI16的表达水平同样与肝脏炎症和纤维化程度呈正相关。但是IFI16在肝脏免疫细胞中如何发挥对HBV DNA的识别,以及如何触发后续的固有免疫反应仍有待明确,这可能需要更深入的体外实验,如利用免疫细胞和肝细胞共培养来进一步探索。
2.2 环鸟苷酸-腺苷酸合成酶(cyclic GMP-AMP synthetase,cGAS) cGAS于2013年被发现,同时其也被认为在介导胞质DNA识别中起关键作用。cGAS蛋白结构与2′-5′-寡腺苷酸合成酶(2′-5′-oligoadenylatesynthase,OAS)1高度相似,OAS1能特异性识别胞内双链RNA(dsRNA),而cGAS主要识别的是细胞质中的dsDNA。未活化的cGAS以自抑制形式的二聚体存在,当外源或内源DNA进入细胞质后,每个cGAS分子都能识别并结合1个DNA分子,形成2∶2的cGAS-DNA复合物。cGAS-DNA复合物能激活环鸟苷酸-腺苷酸,并且使STING磷酸化[19-20]。活化的STING从内质网迁移至高尔基体,然后停留在位于核周的内涵体上。STING通过其C端结构域结合并磷酸化TBK1。随后,STING-TBK1复合体进入内涵体,结合并激活IRF3和核因子-κB(NF-κβ),活化的IRF3和NF-κB进入细胞核,启动固有免疫相关基因的转录[21]。2016年,日本学者Dansako等[22]运用体外实验发现cGAS能够识别HBV DNA,并且通过cGAS-STING-IRF3通路激活固有免疫反应,最后产生免疫血清球蛋白和IFN。实验还得出,cGAS-STING可以通过抑制HBV的复制起到抗病毒作用。关于cGAS-STING通路参与HBV相关肝炎的发病机制仍需要进一步证实。
2.3 DNA依赖的干扰素调节因子激活物(DNA-dependent activation of interferon regulatory factor,DAI) 2007年,日本学者[23]研究发现胞质蛋白DLM-1(又名ZBP1)能够识别胞质DNA,激活IRF3并上调Ⅰ型IFN的表达,因此将这种蛋白质命名为DAI[24]。HBV复制型质粒转染HepG2细胞后能诱导Ⅰ型IFN应答,王秋景等[25]运用RNA干扰技术下调DAI在HepG2的表达后,HBV的复制和蛋白分泌受到了抑制,并且抑制效果有剂量依赖性。接着在DAI下调后检测HBV质粒诱导的IFIT1和IL-6,结果显示二者均不受影响,说明DAI分子并没有在其中发挥作用。另一方面,当同时下调TBK1和DAI后,HBV抗原表达受到明显抑制,表明DAI分子非但不能通过Ⅰ型IFN信号通路抑制HBV,反而能支持HBV的蛋白表达。Upton等[26]早在2012年就发现DAI既不通过IFN调节因子-Ⅰ型IFN信号通路,也非通过受体相互作用蛋白激酶1-NF-κB通路,而是通过DAI与核糖体钝化蛋白(ribosome-inactivating protein,RIP)3形成复合物介导小鼠巨细胞病毒诱导的病毒感染细胞的程序性死亡,但是DAI是否真的通过RIP3参与调节HBV的复制仍有待进一步证实。
2.4 Ku70/80复合体 Ku70/80复合体在细胞中具有多种生物学功能,其中包括免疫细胞V(D)J重组、稳定端粒结构和受损DNA修复等[27]。2016年Li等[28]发现Ku70/80复合体能在细胞质中识别HBV DNA,并且在HBV DNA转染模型中上调趋化因子CCL3和CCL5的表达。Ku70/80复合体被广泛认为是损伤DNA的修复分子,它能在细胞核内监测DNA的破坏和非同源末端连接。尽管Ku蛋白早在10年前就被报道能够转移至细胞质中,但是它识别胞质DNA的能力是近年才被发现的。Zhang等[29]揭示Ku70能识别不同构型的DNA,并且通过IRF1/IRF7依赖通路促进Ⅲ型IFN的表达。另外,Ferguson等[27]研究发现Ku蛋白通过协同DNA-PKcs识别DNA,而后激活TBK1-IRF3信号通路。不仅如此,当Ku70/80复合体的DNA结合能力被病毒疫苗、细胞因子IL-6、CXCL10等阻断后,下游的固有免疫信号分子会随之下调。在转染了HBV的小鼠中,CCL3和CCL5能促进免疫效应细胞聚集在肝脏中而诱发肝脏炎症。其中可能的机制是Ku70/80复合体通过协同DNA-PKcs和聚腺苷二磷酸-核糖聚合酶(poly-ADP-ribose polymerase,PARP)1识别HBV DNA后激活IRF1依赖的信号通路,最后上调CCL3和CCL5的表达。而敲除了Ku70基因能显著抑制CCL3和CCL5的分泌。由于CCR5在乙型肝炎的致病中起着关键作用,所以Ku70/80参与识别HBV DNA后诱导CCL3和CCL5上调的机制很可能是HBV相关肝炎的致病机制之一[30]。
2.5 维甲酸诱导基因(retinoic acid-inducible gene,RIG)1 RIG-1最早被认作是HCV RNA的识别受体,并且能激活固有免疫应答发挥抗HCV作用。RIG-1通过其poly-U/UC模体识别HCV RNA,最后诱导产生Ⅰ型IFN[31]。另一方面,更早的研究[32-33]表明与HCV感染相比,HBV感染的动物模型中固有免疫应答的激活受损,而且如 IFNα、 IFNβ的Ⅰ型IFN诱导能力很难被检测出。然而,HBV是如何被人肝细胞识别以及Ⅲ型IFN的作用仍未被明确。研究[34]发现HBV感染主要诱导Ⅲ型IFN而非Ⅰ型IFN,并且这是通过RIG-1对HBV复制过程中的pgRNA 5′-ε端识别调节的。RIG-1在识别pgRNA后能阻碍HBV多聚酶(P蛋白)与pgRNA 5′-ε端相互作用而抑制HBV复制。在移植了人肝组织的小鼠体内,脂质体调节转运和表达5′-ε端的RNA能抑制HBV的复制。因此,RIG-1和病毒RNA的相互作用能激活固有免疫应答,从而诱导IFN分泌抗病毒,且RIG-1起到直接抗病毒作用。
3 总结和展望
综上所述,虽然既往的研究已经发现有DNA识别受体能参与HBV DNA或pgRNA的识别并触发固有免疫抗病毒反应(图1),但是它们各自的具体机制仍未完全明确,而且目前仍存在着许多问题。第一,DNA识别受体主要存在于细胞质中,它们是如何穿过HBV核衣壳识别基因组DNA的?近期有研究[35]发现IFI16亦存在于细胞核中,它们是否直接在细胞核内识别HBV DNA?第二,肝脏免疫细胞可吞噬坏死的肝细胞,而IFI16在HBV感染的肝脏免疫细胞中高表达,其是否可以在吞噬作用后识别坏死肝细胞释放的自身DNA加强炎症反应作用?第三,cGAS大量表达于肝衰竭患者肝细胞内,而且AIM2与IFI16的表达与肝脏炎症呈正相关,提示固有免疫与肝衰竭密切相关,这些识别受体是否协同加强固有免疫作用从而促进肝衰竭的发生发展?此外,这些不同的DNA识别受体之间是否有相互拮抗、协同或者调控作用?上述问题均有待未来更多的研究来解答。如果DNA识别受体参与HBV诱导的肝炎机制清晰化,那么DNA识别受体很可能成为乙型肝炎治疗的新靶点。
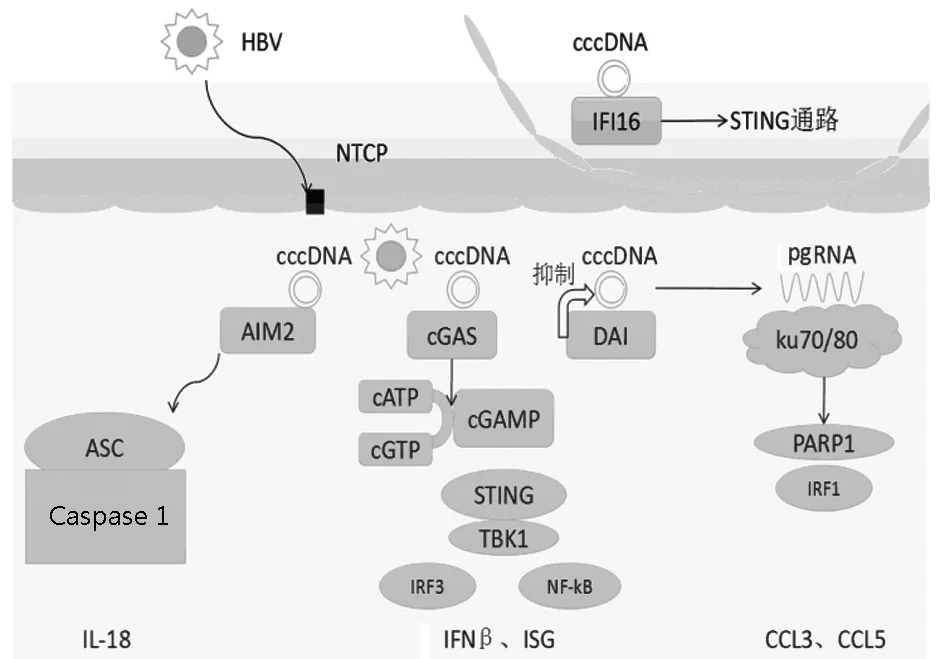
图1 DNA识别受体在肝脏中参与HBV诱导固有免疫作用
[1] GONZALEZ SA, KEEFFE EB. Chronic viral hepatitis: epidemiology, molecular biology, and antiviral therapy[J]. Front Biosci (Landmark Ed), 2011, 16: 225-250.
[2] FARAZI PA, DEPINHO RA. Hepatocellular carcinoma pathogenesis: from genes to environment[J]. Nat Rev Cancer, 2006, 6(9): 674-687.
[3] FU WZ, YANG L, HU XQ. Relationship between HBV DNA load and HBV-M, ALT, AST content in the serum of chronic hepatitis B patients[J]. Int J Virol, 2015, 22(2): 111-114. (in Chinese) 付万智, 杨丽, 胡晓勤. 慢性乙肝患者血清HBV DNA载量与HBV-M、ALT、AST含量的关系研究[J]. 国际病毒学杂志, 2015, 22(2): 111-114.
[4] BUSCA A, KUMAR A. Innate immune responses in hepatitis B virus (HBV) infection[J]. Virol J, 2014, 11: 22.
[5] HORNUNG V, ELLEGAST J, KIM S, et al. 5′-Triphosphate RNA is the ligand for RIG-I[J]. Science, 2006, 314(5801): 994-997.
[6] HEMMI H, TAKEUCHI O, KAWAI T, et al. A Toll-like receptor recognizes bacterial DNA[J]. Nature, 2000, 408(6813): 740-745.
[7] DEMPSEY A, BOWIE AG. Innate immune recognition of DNA: a recent history[J]. Virology, 2015, 479-480: 146-152.
[8] PALUDAN SR. Activation and regulation of DNA-driven immune responses[J]. Microbiol Mol Biol Rev, 2015, 79(2): 225-241.
[9] TAKEUCHI O, AKIRA S. Pattern recognition receptors and inflammation[J]. Cell, 2010, 140(6): 805-820.
[10] WU J, CHEN ZJ. Innate immune sensing and signaling of cytosolic nucleic acids[J]. Annu Rev Immunol, 2014, 32: 461-488.
[11] REVILL P, YUAN Z. New insights into how HBV manipulates the innate immune response to establish acute and persistent infection[J]. Antivir Ther, 2013, 18(1): 1-15.
[12] BÜRCKSTÜMMER T, BAUMANN C, BLÜML S, et al. An orthogonal proteomic-genomic screen identifies AIM2 as a cytoplasmic DNA sensor for the inflammasome[J]. Nat Immunol, 2009, 10(3): 266-272.
[13] FERNANDES-ALNEMRI T, YU JW, DATTA P, et al. AIM2 activates the inflammasome and cell death in response to cytoplasmic DNA[J]. Nature, 2009, 458(7237): 509-513.
[14] HORNUNG V, ABLASSER A, CHARREL-DENNIS M, et al. AIM2 recognizes cytosolic dsDNA and forms a caspase-1-activating inflammasome with ASC[J]. Nature, 2009, 458(7237): 514-518.
[15] RATHINAM VA, JIANG Z, WAGGONER SN, et al. The AIM2 inflammasome is essential for host defense against cytosolic bacteria and DNA viruses[J]. Nat Immunol, 2010, 11(5): 395-402.
[16] MORRONE SR, MATYSZEWSKI M, YU X, et al. Assembly-driven activation of the AIM2 foreign-dsDNA sensor provides a polymerization template for downstream ASC[J]. Nat Commun, 2015, 6: 7827.
[17] PANG XQ, LI XH, MO ZS, et al. Expression of absent in melanoma 2 in the liver and correlation with the degrees of liver damage in patients with chronic hepatitis B[J/CD]. Chin J Exp Clin Infect Dis: Electronic Edition, 2015, 9(3): 326-330. (in Chinese) 庞秀青, 李新华, 莫志硕, 等. 慢性乙型肝炎患者肝组织中黑色素瘤缺乏因子2表达与病变程度的相关性[J/CD]. 中华实验和临床感染病杂志: 电子版, 2015, 9(3): 326-330.
[18] PAN X, XU H, ZHENG C, et al. Human hepatocytes express absent in melanoma 2 and respond to hepatitis B virus with interleukin-18 expression[J]. Virus Genes, 2016, 52(4): 445-452.
[19] CIVRIL F, DEIMLING T, de OLIVEIRA MANN CC, et al. Structural mechanism of cytosolic DNA sensing by cGAS[J]. Nature, 2013, 498(7454): 332-337.
[20] ZHANG X, WU J, DU F, et al. The cytosolic DNA sensor cGAS forms an oligomeric complex with DNA and undergoes switch-like conformational changes in the activation loop[J]. Cell Rep, 2014, 6(3): 421-430.
[21] ISHIKAWA H, MA Z, BARBER GN. STING regulates intracellular DNA-mediated, type I interferon-dependent innate immunity[J]. Nature. 2009, 461(7265): 788-792.
[22] DANSAKO H, UEDA Y, OKUMURA N, et al. The cyclic GMP-AMP synthetase-STING signaling pathway is required for both the innate immune response against HBV and the suppression of HBV assembly[J]. FEBS J, 2016, 283(1): 144-156.
[23] TAKAOKA A, WANG Z, CHOI MK, et al. DAI (DLM-1/ZBP1) is a cytosolic DNA sensor and an activator of innate immune response[J]. Nature, 2007, 448(7152): 501-505.
[24] KAISER WJ, UPTON JW, MOCARSKI ES. Receptor-interacting protein homotypic interaction motif-dependent control of NF-kappa B activation via the DNA-dependent activator of IFN regulatory factors[J]. J Immunol, 2008, 181(9): 6427-6434.
[25] WANG QJ, LI SB, HUANG HP, et al. Effect of the cytoplasmic DNA sensor DAI on replication of hepatitis B virus[J]. Chin J Hepatol, 2015, 23(12): 934-938. (in Chinese) 王秋景, 李世波, 黄红平, 等. 胞质内DNA依赖的干扰素调节因子激活物在HBV复制中的作用[J]. 中华肝脏病杂志, 2015, 23(12): 934-938.
[26] UPTON JW, KAISER WJ, MOCARSKI ES. DAI/ZBP1/DLM-1 complexes with RIP3 to mediate virus-induced programmed necrosis that is targeted by murine cytomegalovirus vIRA[J]. Cell Host Microbe, 2012, 11(3): 290-297.
[27] FERGUSON BJ, MANSUR DS, PETERS NE, et al. DNA-PK is a DNA sensor for IRF-3-dependent innate immunity[J]. Elife, 2012, 1: e47.
[28] LI Y, WU Y, ZHENG X, et al. Cytoplasm-translocated Ku70/80 complex sensing of HBV DNA induces hepatitis-associated chemokine secretion[J]. Front Immunol, 2016, 7: 569.
[29] ZHANG X, BRANN TW, ZHOU M, et al. Cutting edge: Ku70 is a novel cytosolic DNA sensor that induces type III rather than type I IFN[J]. J Immunol, 2011, 186(8): 4541-4545.
[30] SANCHOOLI J, SANADGOL N, KAZEMI ARABABADI M, et al. CCR5 plays important roles in hepatitis B infection[J]. Viral Immunol, 2014, 27(1): 2-6.
[31] SAITO T, OWEN D M, JIANG F, et al. Innate immunity induced by composition-dependent RIG-I recognition of hepatitis C virus RNA[J]. Nature, 2008, 454(7203): 523-527.
[32] WIELAND S, THIMME R, PURCELL RH, et al. Genomic analysis of the host response to hepatitis B virus infection[J]. Proc Natl Acad Sci U S A, 2004, 101(17): 6669-6674.
[33] NAKAGAWA S, HIRATA Y, KAMEYAMA T, et al. Targeted induction of interferon-λ in humanized chimeric mouse liver abrogates hepatotropic virus infection[J]. PLoS One, 2013, 8(3): e59611.
[34] SATO S, LI K, KAMEYAMA T, et al. The RNA sensor RIG-I dually functions as an innate sensor and direct antiviral factor for hepatitis B virus[J]. Immunity, 2015, 42(1): 123-132.
[35] KERUR N, VEETTIL MV, SHARMA-WALIA N, et al. IFI16 acts as a nuclear pathogen sensor to induce the inflammasome in response to Kaposi Sarcoma-associated herpesvirus infection[J]. Cell Host Microbe, 2011, 9(5): 363-375.
引证本文:HUANG J, PANG XQ, XIE DY. Role of DNA recognition receptors in pathogenic mechanism of hepatitis B[J]. J Clin Hepatol, 2017, 33(9): 1794-1797. (in Chinese) 黄劲, 庞秀青, 谢冬英. DNA识别受体在乙型肝炎发病机制中的作用[J]. 临床肝胆病杂志, 2017, 33(9): 1794-1797.
(本文编辑:葛 俊)
RoleofDNArecognitionreceptorsinpathogenicmechanismofhepatitisB
HUANGJin,PANGXiuqing,XIEDongying.
(HepatopathyLaboratory,TheThirdAffiliatedHospitalofSunYat-SenUniversity,Guangzhou510630,China)
As a global disease, hepatitis B still threatens human health. However, the pathogenesis of hepatitis caused by HBV remains unclear. The innate immune system in the liver can detect HBV infection and use every strategy to eliminate the virus. DNA recognition receptors play an important role in this process; they recognize HBV DNA or pgRNA in cytoplasm or nucleus, activate innate immunity through various signaling pathways to produce inflammatory cytokines and interferon, and finally exert their antiviral effect. This article summarizes the DNA recognition receptors involved in inflammation induced by HBV and HBV clearance, elaborates on their detailed pathways, and discusses the issues regarding the role of DNA recognition receptors in liver innate immunity induced by HBV and related perspectives.Keywords: hepatitis B; receptors, pattern recognition; review
10.3969/j.issn.1001-5256.2017.09.037
2017-04-25;
:2017-05-12。
广东省自然科学基金项目(2015A030313022)
黄劲(1990-),男,主要从事病毒性肝炎致病机制及防治的研究。
谢冬英,电子信箱:xdy-gz@163.com。
R512.62
:A
:1001-5256(2017)09-1794-04
