IgG4阴性的自身免疫性胰腺炎2例报告并文献复习
2017-09-18杨见林季慧范郭晓林
杨见林, 季慧范, 韩 飞, 郭晓林
(吉林大学第一医院 a. 肝胆胰内科; b. 神经外科, 长春 130021)
IgG4阴性的自身免疫性胰腺炎2例报告并文献复习
杨见林a, 季慧范a, 韩 飞b, 郭晓林a
(吉林大学第一医院 a. 肝胆胰内科; b. 神经外科, 长春 130021)
免疫球蛋白G; 胰腺炎; 病例报告
自身免疫性胰腺炎(autoimmune pancreatitis,AIP)是一种炎症组织中伴IgG4阳性淋巴细胞和浆细胞浸润,血清IgG4水平升高的自身免疫相关特殊类型慢性胰腺炎,AIP发病率较低,约占慢性胰腺炎的4%~6%,发病率约为0.82/10万[1],其特点为胰腺弥漫性肿大,胰管和胆管狭窄,胰腺不同程度的内分泌或外分泌功能异常,伴有血清免疫学指标IgG4阳性,胰腺组织病理学表现为弥漫性纤维化及淋巴细胞、浆细胞浸润。目前AIP的诊断主要依靠组织学病理、特征影像学表现、其他器官受累、临床和实验室检查等4个方面,IgG4阳性的AIP较易诊断,而IgG4阴性胰腺炎诊断难度较大。本文报道了2例IgG4阴性的AIP的临床诊治并复习相关文献。
1 临床资料
病例1:患者女性,44岁,因“皮肤、巩膜黄染伴尿色加深2个月余”于2017年3月25日收入吉林大学第一医院。患者入院前2个月无明显诱因出现皮肤、巩膜黄染,伴有尿色加深,呈浓茶样,偶有恶心、无呕吐,无腹胀、腹泻、腹痛等不适症状,至当地医院就诊,经CT检查后,考虑胰腺癌可能性大。为求进一步诊治,到本院肝胆外科就诊,经过腹部CT及磁共振增强扫描检查,诊断为“梗阻性黄疸、胰腺改变(不除外占位)”,予以保肝、降黄等对症处置,同时行胆囊穿刺引流,患者黄染减轻后出院。出院后2个月患者上述症状持续存在,时轻时重。此次入院前6天上述症状再次加重入本院肝胆外科,复查腹部磁共振检查后,考虑IgG4相关性疾病可能性大,遂转至本科进一步就诊。病程中无发热及寒战,曾出现皮肤瘙痒,无灰白便,食欲可,纳差,近2个月体质量减轻约12.5 kg。既往史:入院前2个月于外院诊断为糖尿病,现应用胰岛素治疗,血糖控制尚可。查体:皮肤、巩膜黄染,腹部平坦,可见胆囊穿刺引流管一枚,引流液为黄绿色清亮液体,腹壁未见静脉曲张,腹软,右上腹部轻压痛,无反跳痛及肌紧张,肝、脾肋下未触及,墨菲征阴性,移动性浊音阴性,双下肢无水肿。辅助检查:血常规:RBC 2.97×1012/L,Hb 93 g/L;肝功能:AST 41.6 U/L,ALT 102.2 U/L,GGT 313.2 U/L,ALP 668.0 U/L,ChE 2422 U/L,总蛋白62.5 g/L,Alb 29.4 g/L,γ-Glo 3.5 g/L,TBil 83.1 μmol/L,DBil 46.9 μmol/L,IBil 36.2 μmol/L。空腹血糖8.84 mmol/L,血沉45 mm/h,凝血常规、降钙素原、血淀粉酶、血脂肪酶、尿淀粉酶均大致正常。IgG4、抗核抗体、自身免疫性肝病IgG抗体、免疫五项、抗线粒体M2抗体,核周型抗中性粒细胞胞质抗体均正常。肿瘤标志物:CA 19-9 42.32 U/ml。磁共振肝脾平扫+三期增强扫描提示:(1)肝右叶前下段胆囊旁囊肿;(2)肝左叶外上段、肝右叶前上段近肝门海绵状血管瘤;(3)胰腺所见,IgG4相关硬化性疾病可能,胰腺病变累及胆总管胰头段,继发肝内外胆管扩张;(4)符合胆囊造瘘术后,考虑胆囊炎,胆囊管低位汇入胆总管。PET-CT提示:胰头饱满伴代谢增高,待除外占位性病变。肝胆脾胰多排CT平扫+三期增强提示(图1):(1)肝S2段、S5段异常强化影,血管瘤可能性大;(2)肝S6段异常强化,考虑异常灌注;(3)胰腺呈腊肠样弥漫性肿大,IgG4相关性疾病可能,继发肝内外胆管扩张;(4)脾大;(5)肝门区、门腔间隙淋巴结略大。入院后初步诊断:梗阻性黄疸、胆囊造瘘术后、低蛋白血症、2型糖尿病、怀疑AIP、自身免疫性胆管炎。患者梗阻性黄疸诊断明确,结合临床特点,考虑AIP可能性大。为进一步确诊,建议行胰腺细针穿刺活组织检查,但患者及家属拒绝。
经全科会诊,考虑患者为IgG4阴性AIP可能性大,建议激素试验性治疗。遂予以醋酸泼尼松30 mg,1次/d,口服,同时密切监测血糖。应用激素3 d后患者面黄、目黄减轻,尿色变浅。3 d后复查肝功能:AST、ALT正常,GGT 199.7 U/L,ALP 322.3 U/L,ChE 2813 U/L,TBil 45 μmol/L,DBil 32.4 μmol/L,IBil 12.6 μmol/L,均较前明显下降,于2017年4月10日复查肝胆脾胰多排CT平扫提示:胆管壁厚程度减轻,胰腺影变小,胆道扩张程度减轻。考虑激素治疗有效,进一步支持AIP诊断。患者症状改善后出院,出院后建议继续口服醋酸泼尼松,并对患者进行随访。2017年5月8日再次复查,肝功能指标基本接近正常,肝胆脾胰多排CT平扫提示:胆管壁厚程度略减轻,胰腺形态正常(图2)。
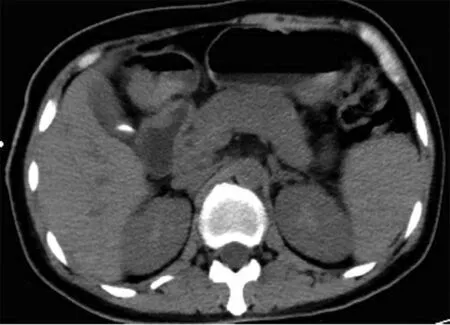
图1 肝胆脾胰多排CT平扫+三期增强 激素治疗前胰腺呈腊肠样弥漫性肿大

图2 肝胆脾胰多排CT平扫激素治疗40 d后胰腺形态大小恢复正常
病例2:患者男性,62岁,因“口干1个月,左中腹部疼痛20 d” 于2016年12月29日入本院。患者1个月前无明显诱因出现口干,入院前20 d患者出现左中上腹持续样钝痛,疼痛可放散至腰背部,口服肝胃去痛片,症状未见好转,后就诊于当地医院,行相关检查提示尿淀粉酶增高,慢性浅表性胃炎。胰腺CT平扫+增强提示“AIP”,具体治疗不详,为求进一步诊治遂来本院。既往体健。入院时查体:皮肤、巩膜无黄染,无肝掌及蜘蛛痣,腹平坦,未见胃肠型及蠕动波,未见腹壁静脉曲张,左中腹部压痛,无肌紧张。肝、脾肋下未触及,墨菲征阴性,移动性浊音阴性,双下肢无水肿。辅助检查:血常规、IgG4、尿淀粉酶未见异常。凝血常规:PT 13.9 s,PTA 73%,纤维蛋白原 4.80 g/L。空腹血糖8.84 mmol/L,血沉68 mm/h。抗核抗体阳性(1∶320 ),均质型。免疫五项:IgA 4.32 g/L,γ-Glo 4 g/ L。肿瘤标志物:CA19-9 66.95 U/ml。胰腺CT平扫+增强提示:AIP,肝内胆管扩张,胆囊形态略饱满,肝脏及右肾囊肿;腹部超声提示:胰腺增厚,回声改变,胆汁淤积;胰腺多排CT平扫+二期增强(图3):(1)胰腺改变,累及胆总管胰头段,继发肝内略胆管扩张;(2)肝内多发囊肿;(3)胆囊炎,腔内密度增高;(4)上腹部多发淋巴结。
患者虽然IgG4阴性,但结合胰腺及胆管影像仍考虑AIP,遂给予激素治疗(醋酸泼尼松30 mg,1次/d,口服)及对症支持治疗。1周后,复查CA19-9较前下降,且腹痛症状较前好转,于2017年1月9日出院。继续口服醋酸泼尼松,2017年2月9日复查肝胆脾胰多排CT平扫提示:肝内胆管、胆总管未见扩张,胰腺形态规整(图4)。治疗效果佳,进一步支持AIP诊断,继续激素维持量治疗,对患者进行随访。2017年6月8日再次复查肝胆脾胰多排CT平扫提示:肝内胆管、胆总管未见扩张,胰腺形态正常(图5)。
2 讨论
AIP是较为特殊的慢性胰腺炎,其概念由Yoshida于1995年首先提出[2],其发病机制尚未明确,可能与免疫因素、细胞凋亡与炎症、遗传因素有关。AIP在老年、男性患者中多见,具有较为典型的临床特点:(1)大多数患者具有轻微的上腹部疼痛或者不适症状,但一般情况下无急性胰腺炎表现;(2)大多数患者可见无痛性进行性阻塞性黄疸;(3)γ-Glo升高,血清IgG水平升高,红细胞血沉速度升高;(4)B超或者CT检查可见患者胰腺呈弥漫性肿大;(5)经内镜逆行胰胆管造影可见主胰管呈不规则性狭窄;(6)胰腺的内外分泌功能呈可逆性受损;(7)可继发糖尿病;(8)胰腺活组织检查可见小叶纤维化,并伴有淋巴细胞及浆细胞浸润;(9)CT检查较少见到胰腺囊肿及钙化;(10)对糖皮质激素治疗敏感。其按照病理学特点分为Ⅰ型AIP和Ⅱ型AIP。Ⅰ型AIP又称为淋巴浆细胞增多硬化型胰腺炎,主要病理表现是胰腺组织内广泛纤维化、闭塞性静脉炎、IgG4阳性细胞沉积;血清IgG4明显升高。Ⅱ型AIP又称为特发性导管中心型胰腺炎,主要病理表现为上皮细胞广泛炎性细胞浸润,通常出现胰管的破坏和闭塞,但组织中无或极少IgG4沉积,血清IgG4不高[3-4]。临床上,Ⅰ型AIP多发生在老年男性,可有涎腺、胆管、肺、肾等其他器官受累的表现,激素治疗后容易复发。Ⅱ型AIP发病人群较I型AIP年轻,且无明显性别差异,但多易累及肠道,以溃疡性结肠炎为多见,激素治疗后多不容易复发。综合实验室、影像学检查及治疗后随访等资料,结合患者的病例特点,本文2例患者为I型AIP可能性大,第1例中年女性伴胆管受累明显,第2例老年男性伴口干、涎腺受累可能性大,胆管亦受累。第1例血糖升高,胰腺外分泌部受累,随访患者经过激素治疗,症状及胰腺、胆管形态学均好转。

图3 胰腺多排CT平扫+二期增强 激素治疗前胰腺弥漫性肿大
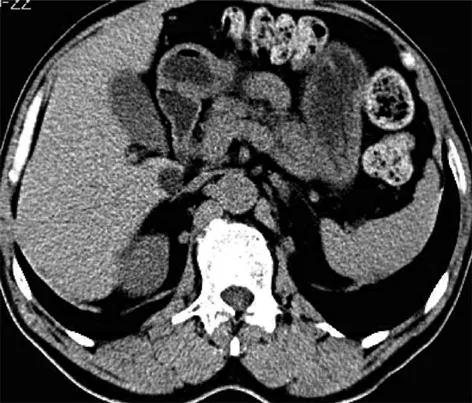
图4 肝胆脾胰多排CT平扫(2017年2月9日) 激素治疗2个月后胰腺形态恢复正常
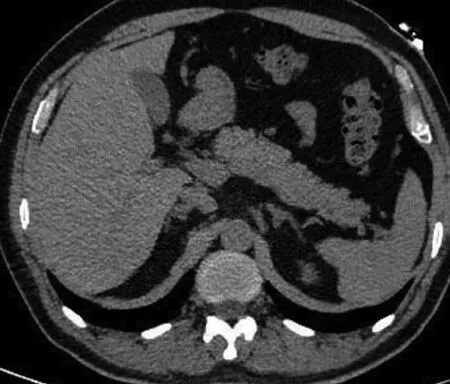
图5肝胆胰脾多排CT平扫(2017年6月8日) 激素维持量,胰腺形态正常
AIP临床不常见,且较难与胰腺癌鉴别,以上2例初步诊断均不除外胰腺占位,治疗棘手。二者从病理学和影像学上主要鉴别点为[5-6]:(1)AIP虽然表现为局部肿块性病变,但其实质是胰腺的慢性炎性细胞浸润,对邻近的血管等结构较少发生侵袭;而胰头癌的特点是侵袭性生长,大多会包绕、侵犯周围血管结构;(2)AIP在影像学上表现为胰腺局部腊肠样改变,胰腺边缘呈低密度影,不规则的主胰管扩张,增强扫描延迟期均匀强化,这与胰腺癌常见的影像学表现有较大差异。Moon等[7]提出在疑诊AIP而不能完全排除胰腺癌时,可试用激素治疗2 周以鉴别。
AIP对糖皮质激素治疗敏感,有研究[7-11]发现激素治疗可提高AIP缓解率,降低复发率及远期并发症发生率,缩短缓解所需时间,更有报道[10]称激素治疗可预防AIP继发胆管病变,国外既往研究中起始剂量多经验性给予醋酸泼尼松30~40 mg/d[11],殷涛等[2]指出AIP病情活动者进行激素治疗,口服泼尼松龙30~40 mg/d或按照0.6 mg·kg-1·d-1为起始剂量,治疗3周~1个月后,根据临床症状、实验室检查和影像学表现综合评价,如效果好可逐渐减量,每1~2周减少5 mg,再根据临床表现和实验室检查决定采用5 mg/d剂量维持或停药,停药指征为:临床症状消失,胰腺CT显示胰腺形态、密度正常,血清IgG4水平正常,胰外受累脏器病变消失。临床医生在实际治疗过程中,要注意激素治疗的禁忌证,对于老年患者伴有骨质疏松症、肺结核、肿瘤等激素治疗禁忌证时采用激素治疗要谨慎,有资料[12]报道,可应用免疫调节剂硫唑嘌呤等治疗;治疗时应严格观察患者的临床症状、关注患者的血清学水平及影像学检测结果等,及时调整激素用量,以免造成患者体质量增加、骨质疏松、感染等继发疾病。
[1] DING YX, BAI XW, WANG G, et al. Research advances in autoimmune pancreatitis[J]. Chin J Hepatobiliary Surg, 2014, 20(11): 837-840.(in Chinese) 丁乙轩, 白雪巍, 王刚, 等. 自身免疫性胰腺炎的研究进展[J]. 中华肝胆外科杂志, 2014, 20(11): 837-840.
[2] YIN T, WU HS. Progress in diagnosis and treatment of autoimmune pancreatitis[J]. J Clin Hepatol, 2015, 31(5): 665-667. (in Chinese) 殷涛, 吴河水. 自身免疫性胰腺炎的诊治进展[J]. 临床肝胆病杂志, 2015, 31(5): 665-667.
[3] van HEERDE MJ, BUIJS J, RAUWS EA, et al. A comparative study of diagnostic scoring systems for autoimmune pancreatitis[J]. Pancreas, 2014, 43(4): 559-564.
[4] CHINTANABOINA JK, PATEL BK, LALOSB AT, et al. Autoimmune pancreatitis presenting as a focal pancreatic mass mimicking pancreatic cancer: a case report and review of the literature[J]. J Med Cases, 2013, 4(1): 29-33.
[5] MA XX, SHI HP, SUN P, et al. CT perfusion imaging of type II autoimmune pancreatitis[J]. Diagn Imag Interv Radiol, 2015, 24(1): 5-8. (in Chinese) 马晓璇, 时惠平, 孙鹏, 等. II型自身免疫性胰腺炎的CT灌注成像研究[J]. 影像诊断与介入放射学, 2015, 24(1): 5-8.
[6] ZHANG AY, CHEN H, ZHAO P, et al. Differential diagnosis of autoimmune pancreatitis from pancreatic cancer[J]. J Clin Hepatol, 2015, 31(5): 783-786. (in Chinese) 张安元, 陈浩, 赵鹏, 等. 自身免疫性胰腺炎与胰腺癌的鉴别诊断[J]. 临床肝胆病杂志, 2015, 31(5): 783-786.
[7] MOON SH, KIM MH, PARK DH, et al. Is a 2-week steroid trial after initial negative investigation for malignancy useful in differentiating autoimmune panereatitis from pancreatic cancer?A prospective outcome study[J]. Gut, 2008, 57(12): 1704-1712.
[8] KAMISAWA T, SHIMOSEGAWA T, OKAZAKI K, et al. Standardsteroid treatment for autoimmune pancreatitis[J]. Gut, 2009, 58(11): 1504-1507.
[9] KAMISAWA T, OKAMOTO A, WAKABAYASHI T. et al. Appropriate steroid therapy for autoimmune pancreatitis based on long-term outcome[J]. Scand J Gastroenterol, 2008, 43(5): 609-613.
[10] HIRANO K, TADA M, ISAYAMA H, et al. Long-term prognosis of autoimmune pancreatitis with and without corticosteroid treatment[J]. Gut, 2007, 56(12): 1719-1724.
[11] ITO T, NISHIMOFI I, INOUE N, et al. Treatment for autoimmune pancreatitis;consensus on the treatment for patients with autoimmune pancreatitis in Japan[J]. J Gastroenterol, 2007, 42 (Suppl 18): 50-58.
[12] WANG CL, YANG Y, JIANG Y, et al. A case of type II autoimmune pancreatitis with mass in the head of the pancreas[J]. Chin J Hepatobiliary Surg, 2016, 22(2): 102-106. (in Chinese) 王成林, 杨雨, 江勇, 等. II型胰头肿块型自身免疫性胰腺炎一例[J]. 中华肝胆外科杂志, 2016, 22(2): 102-106.
引证本文:YANG JL, JI HF, HAN F, et al. IgG4 - negative autoimmune pancreatitis: a report of 2 cases and literature review[J]. J Clin Hepatol, 2017, 33(9): 1784-1786. (in Chinese) 杨见林, 季慧范, 韩飞, 等. IgG4阴性的自身免疫性胰腺炎2例报告并文献复习[J]. 临床肝胆病杂志, 2017, 33(9): 1784-1786.
(本文编辑:王 莹)
IgG4-negativeautoimmunepancreatitis:areportof2casesandliteraturereview
YANGJianlin,JIHuifan,HANFei,etal.
(DepartmentofHepatology,TheFirstHospitalofJilinUniversity,Changchun130021,China)
immunoglobulin G; pancreatitis; case reports
10.3969/j.issn.1001-5256.2017.09.034
2017-06-20;
:2017-07-03。
杨见林(1991-),女,主要从事胰腺炎方面的研究。
郭晓林,电子信箱:guoxiaolin0324@126.com。
R576
:B
:1001-5256(2017)09-1784-03
