干旱胁迫下油菜素内酯浸种对棉花种子萌发期NAC转录因子表达的影响
2017-09-18严晓红包秋娟张富春
严晓红,包秋娟,张富春
(新疆大学生命科学与技术学院/新疆生物资源基因工程重点实验室,乌鲁木齐 830046)
干旱胁迫下油菜素内酯浸种对棉花种子萌发期NAC转录因子表达的影响
严晓红,包秋娟,张富春
(新疆大学生命科学与技术学院/新疆生物资源基因工程重点实验室,乌鲁木齐 830046)
【目的】研究干旱胁迫下油菜素内酯浸种棉花种子萌发期NAC转录因子的表达变化,分析NAC转录因子在油菜素内酯(brassinolide,BR)调控棉花抗旱中的作用。【方法】根据陆地棉转录因子NAC家族的基因序列,扩增获得棉花新陆早17号NAC家族中的6个NAC基因(GhNAC1-6)。实时荧光定量PCR检测干旱胁迫下不同油菜素内酯浸种后,棉花种子萌发期子叶和胚根NAC基因的表达变化。【结果】棉花子叶中的GhNAC1在干旱胁迫下受不同浓度油菜素内酯的抑制,GhNAC2和GhNAC3受0.25 mg/L油菜素内酯诱导表达,GhNAC5只受0.5 mg/L油菜素内酯诱导表达,而GhNAC4和GhNAC6表达无显著变化。在棉花胚根中,GhNAC1同样受不同浓度油菜素内酯的抑制,GhNAC2和GhNAC3受0.25 mg/L油菜素内酯诱导,同时GhNAC3在2 mg/L油菜素内酯浸种也呈现高表达,GhNAC5无显著变化,GhNAC4和GhNAC6则受高浓度油菜素内酯诱导表达。【结论】棉花种子萌发期在干旱胁迫下,棉花种子萌发期子叶和胚根的GhNAC1的表达受油菜素内酯抑制,GhNAC2和GhNAC3受低浓度油菜素内酯的表达诱导,油菜素内酯能够影响GhNAC的表达响应干旱胁迫。
棉花;种子萌发;干旱胁迫;油菜素内酯;NAC转录因子;基因表达
0 引 言
【研究意义】干旱导致农作物大量减产、甚至绝收。油菜素内酯(brassinolide, BR)又名芸苔素内酯,具有提高作物抗旱的能力[1]。转录因子能与基因的顺式作用元件结合,进而调控基因的表达,在植物信号传导和基因表达调控网络中发挥重要作用[2]。探讨响应干旱的转录因子在油菜素内酯浸种下的表达变化,有助于为农作物生产中喷施BR增强农作物的抗旱能力提供理论基础。【前人研究进展】NAC转录因子典型的结构特征是N端存在一个高度保守的NAC结构域,C端是变化多样的转录调控域,也是植物中最大的转录因子家族。目前报道的水稻(Oryzasativa)基因组中有151个NAC基因,拟南芥有117个[3]、烟草 (Nicotianatabacum)和大豆 (Glycinemax) 中各有152 个成员[4-5]。NAC转录因子是植物响应干旱的转录因子,例如,水稻SNAC1 受高盐、干旱、低温和 ABA 处理诱导表达,同时也在保卫细胞中受干旱特异诱导表达[6]。Meng等[7]克隆了6个陆地棉中新型基因GhNAC1-6,检测这6个基因是否受干旱诱导,结果表明,只有GhNAC4、GhNAC5和GhNAC6受干旱诱导表达,GhNAC1和GhNAC3不受干旱诱导,GhNAC2受干旱诱导表达量较低。芒草MlNAC5在转基因的拟南芥中通过转录调节应激反应的相关基因,明显增强植物的抗旱及抗低温能力[8]。【本研究切入点】 由于针对新疆陆地棉新陆早17号在干旱胁迫下油菜素内酯对棉花抗旱能力影响的研究较少。研究选取新疆陆地棉品种新陆早17号,探讨干旱胁迫下油菜素内酯浸种是否能够影响棉花的NAC表达,进而改变棉花萌发期的抗旱能力。【拟解决的关键问题】 克隆获得新疆陆地棉品种新陆早17号的6个NAC基因,利用PEG6000模拟干旱胁迫并利用不同浓度的BR(24-EBR)对棉花种子进行浸种后,通过实时荧光定量PCR检测干旱胁迫下不同油菜素内酯浸种后,棉花子叶和胚根NAC基因的表达变化,为阐明干旱胁迫和BR处理影响转录因子表达调节植物耐旱的机制奠定理论基础。
1 材料与方法
1.1 材 料
新疆陆地棉(GossypiumhirsutumL.)品种新陆早17号种子由新疆农业科学院经济作物研究所玛纳斯实验站提供。24-表油菜素内酯(24-EBR)购自sigma公司,纯度>90%,先用一定量无水乙醇使24-EBR完全溶解,以备稀释至不同的浓度使用。SYBR Green购自QIAGEN公司,PEG6000为分析纯。
1.2 方 法
1.2.1 试验设计
挑选棉花籽粒饱满大小一致的种子,先用75%酒精浸泡1 min,蒸馏水冲洗3~4次,用15%H202浸泡5 h,蒸馏水冲洗3~4次,分别浸泡于蒸馏水和0.01、0.25、0.5、1和2 mg/L 24-EBR中24 h。在直径10 cm方形培养皿内铺2层滤纸,用19.7%PEG6000润湿,以倾斜时皿底无溶液为标准。将种子从不同浸种液中取出,剥掉种皮,播种于上述滤纸上,每隔2 d添加一次PEG6000,以保持种子始终在模拟干旱胁迫状态下生长。一周后,分别采棉花的胚根和子叶,迅速冻于液氮中备用。
1.2.2 总RNA的提取和cDNA的合成
取0.1 g棉花胚根/子叶在用液氮降温后的研钵中充分研磨,采用Omega公司Plant RNA Kit提取棉花总RNA,通过琼脂糖凝胶电泳和定量来检测所提取RNA质量。采用Revert Aid First Stand cDNA Synthesis Kit(大连-TaKaRa公司)试剂盒合成cDNA。
1.2.3 干旱胁迫下BR浸种后棉花NAC的表达
根据每个转录因子cDNA序列设计上下游引物,以棉花延伸因子EF1α为内参,检测各转录因子的表达。qRT-PCR反应体系为:cDNA 1 μL,上下游引物各0.3 μL,ROX 0.1 μL,SYBR Green 10 μL,用Rnase-free water补至20 μL。反应过程为94℃ 30 s, 94℃ 5 min, 62℃ 30 s, 72℃ 30 s, 重复40个循环。采用ABI 7500实时定量PCR仪,数据用2-ΔΔCT分析。
1.3 数据处理
所有数据在Microsoft Excel 2003中整理,用Graph Pad Prism 5.0做图及不同浓度间的单因素方差分析。
2 结果与分析
2.1 转录因子的克隆与qRT-PCR引物设计
根据陆地棉NAC转录因子基因序列克隆获得新疆陆地棉品种新陆早17号中NAC相应的同源序列,分别命名为GhNAC1,GhNAC2,GhNAC3,GhNAC4,GhNAC5和GhNAC6,根据BLAST到的序列分别设计全长序列引物,以新疆陆地棉品种新陆早17号子叶的cDNA为模板,PCR扩增后,送测PCR产物,与已知序列进行比对,比对一致后,设计qRT-PCR引物。表1,图1
2.2GhNAC1-6氨基酸序列比对及构建GhNAC1-6系统发育进化树
用DNAMAN分析GhNAC1-6氨基酸序列的一致性,分析得GhNAC1-6氨基酸序列一致性为50.41%。根据多序列比对可以看出,在GhNAC1-6 N端保守性较强,高度保守的氨基酸结构域大约由150个氨基酸残基组成,可进一步划分为A、B、C、D、E 5个亚结构域。由多序列比对结果可知GhNAC1-6是典型的NAC转录因子结构,即N端高度保守,C端高度多样性。
利用MEGA5.0对GhNAC1-6和其他已知功能的NAC构建系统发生树,以预测GhNAC1-6的功能。由系统发生树可知,GhNAC2和GhNAC3与ATAF1亲缘关系较近,GhNAC1与CsNAC亲缘关系最近,GhNAC4与RD26亲缘关系最近,GhNAC5与NAP亲缘关系最近,GhNAC6与CUC1亲缘关系最近。图2
表1 各基因全长引物及荧光定量引物
Table 1 Primer pairs used in gene cloning, semi-quantitative and real-time quantitative RT-PCR
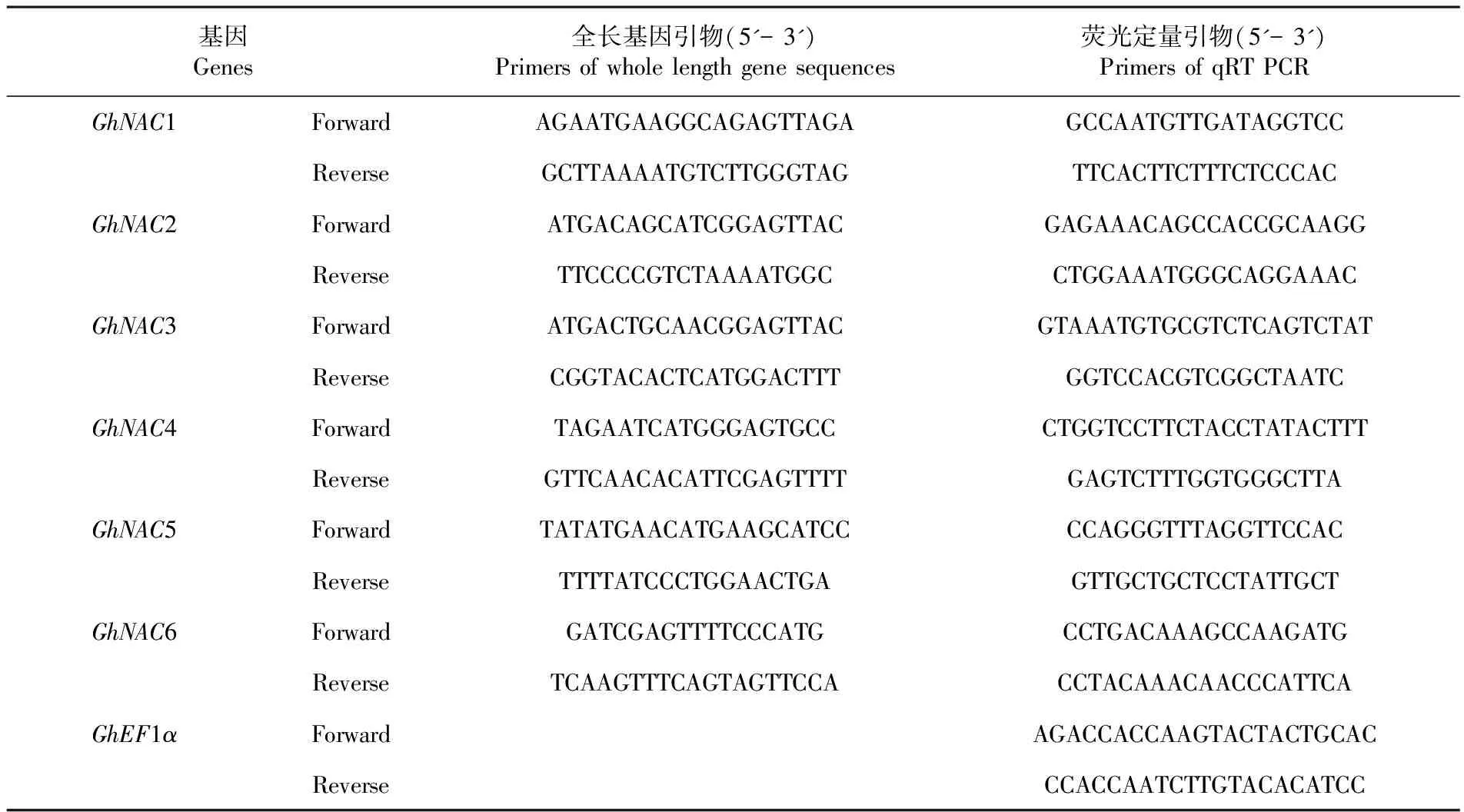
基因Genes全长基因引物(5'-3')Primersofwholelengthgenesequences荧光定量引物(5'-3')PrimersofqRTPCRGhNAC1ForwardAGAATGAAGGCAGAGTTAGAGCCAATGTTGATAGGTCCReverseGCTTAAAATGTCTTGGGTAGTTCACTTCTTTCTCCCACGhNAC2ForwardATGACAGCATCGGAGTTACGAGAAACAGCCACCGCAAGGReverseTTCCCCGTCTAAAATGGCCTGGAAATGGGCAGGAAACGhNAC3ForwardATGACTGCAACGGAGTTACGTAAATGTGCGTCTCAGTCTATReverseCGGTACACTCATGGACTTTGGTCCACGTCGGCTAATCGhNAC4ForwardTAGAATCATGGGAGTGCCCTGGTCCTTCTACCTATACTTTReverseGTTCAACACATTCGAGTTTTGAGTCTTTGGTGGGCTTAGhNAC5ForwardTATATGAACATGAAGCATCCCCAGGGTTTAGGTTCCACReverseTTTTATCCCTGGAACTGAGTTGCTGCTCCTATTGCTGhNAC6ForwardGATCGAGTTTTCCCATGCCTGACAAAGCCAAGATGReverseTCAAGTTTCAGTAGTTCCACCTACAAACAACCCATTCAGhEF1αForwardAGACCACCAAGTACTACTGCACReverseCCACCAATCTTGTACACATCC

图1 GhNAC1-6的氨基酸序列比对
Fig.1 The result of GhNAC1-6 amino acid sequence alignment
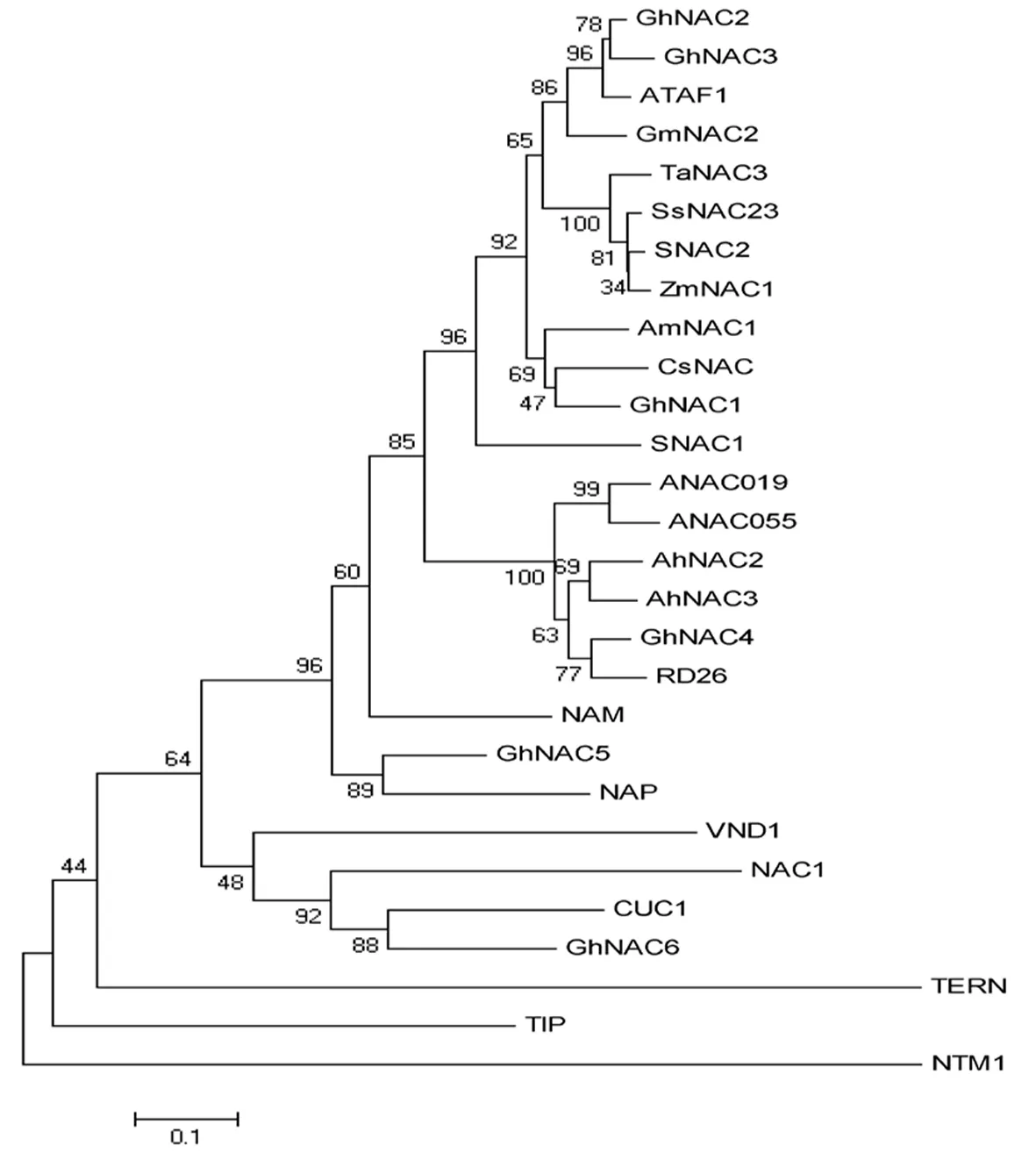
图2 GhNAC1-6与其他植物NAC转录因子的系统发生树
Fig.2 GhNAC1-6 phylogenetic tree with other NAC transcription factors
2.3干旱胁迫下BR浸种后棉花子叶NAC转录因子的表达
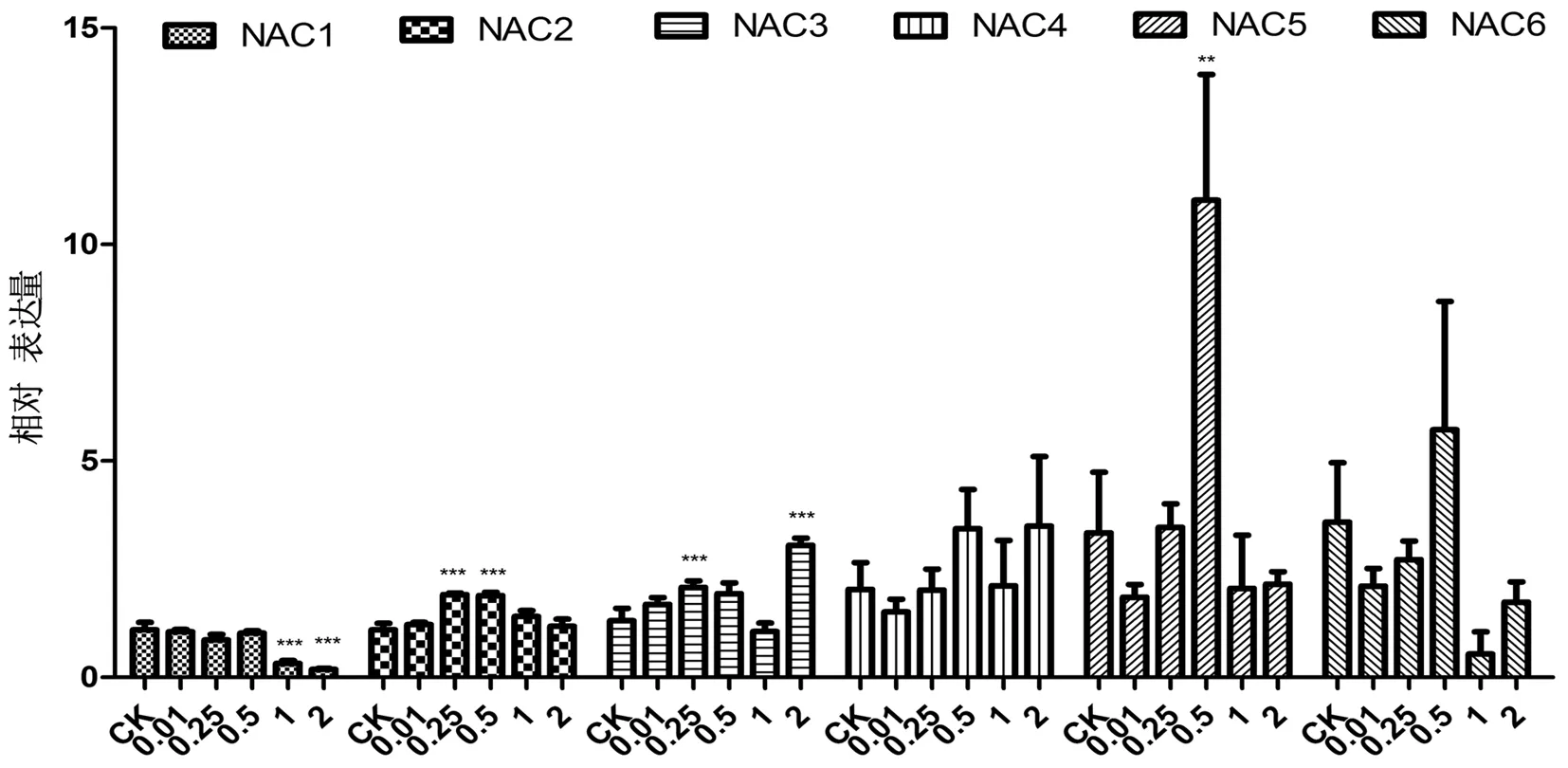
通过检测不同浓度BR浸种后干旱胁迫下NAC转录因子在棉花子叶中的表达,研究表明,在棉花子叶中,GhNAC1-3在19.7%PEG胁迫下表达量较低,GhNAC4-6在19.7%PEG胁迫下表达量较高,其中,GhNAC1在子叶中的表达随着BR浸种浓度的增大,表达量逐渐减少,在1和2 mg/L BR浸种时与对照组相比有极显著差异(P<0.01),BR浸种会抑制GhNAC1在子叶中的表达,且BR浓度越大,抑制越明显。GhNAC2和GhNAC3在子叶中的表达随着BR浸种浓度的增大呈现先升高后降低的趋势,GhNAC2在0.25和0.5 mg/L BR浸种时与对照组相比有极显著差异(P<0.01),GhNAC3在0.25和2 mg/L BR浸种时与对照组相比有极显著差异(P<0.01),GhNAC2和GhNAC3在干旱胁迫下子叶中的表达受BR诱导,低浓度BR(0.01~0.25 mg/L)可促进GhNAC2和GhNAC3的表达,浓度增大至1 mg/L时则有抑制作用。GhNAC5的表达在BR浸种浓度为0.5 mg/L时在子叶中与对照组相比有显著差异(P<0.05),GhNAC5在BR浸种浓度为0.5 mg/L时受到诱导,在其他浓度浸种诱导较小。GhNAC4和GhNAC6在子叶中的表达随着BR浓度增大无显著变化,说明GhNAC4和GhNAC6在干旱胁迫下的棉花子叶中不受BR诱导。
2.3干旱胁迫下BR浸种后棉花胚根NAC转录因子的表达
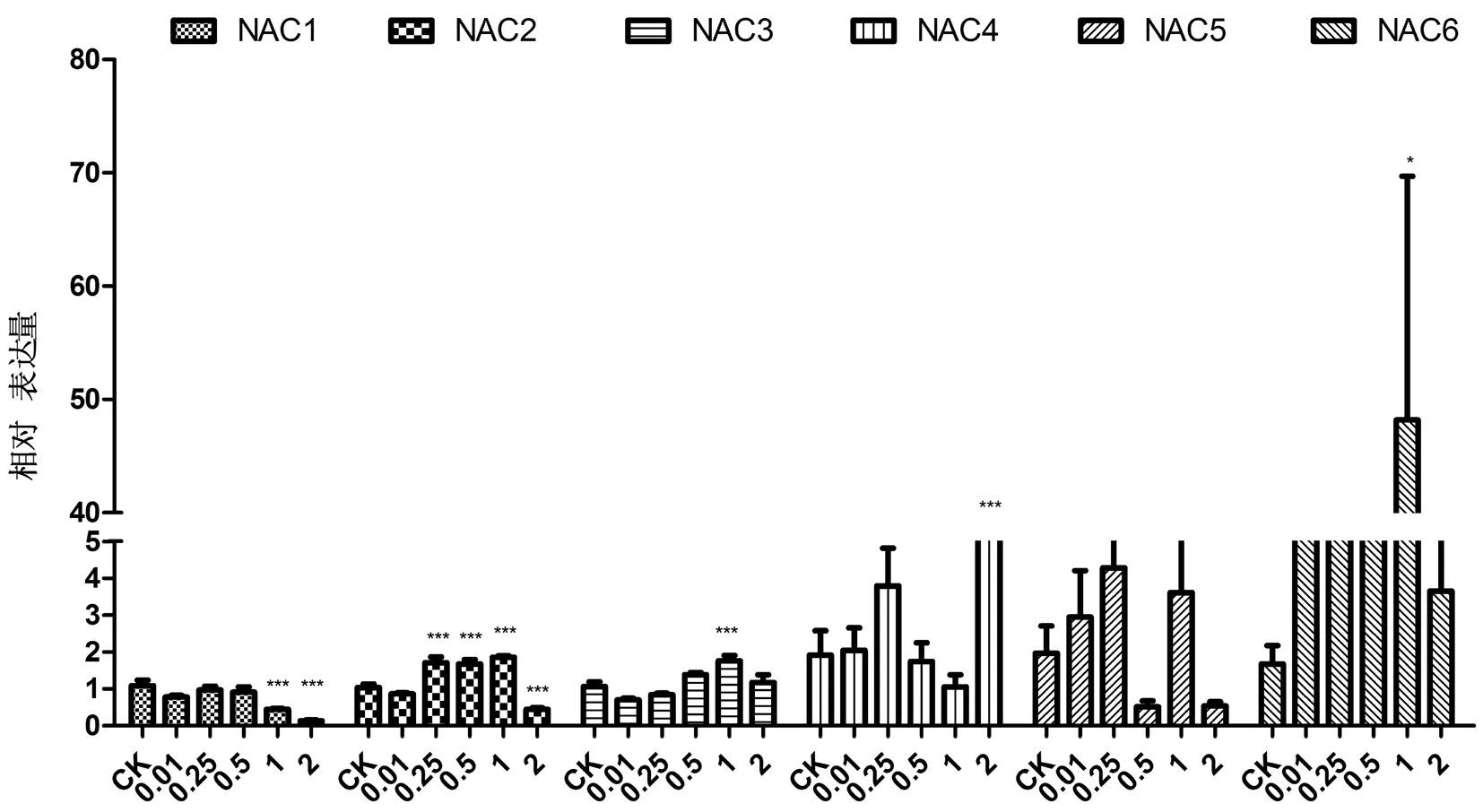
通过检测不同浓度BR浸种后干旱胁迫下NAC转录因子在棉花胚根中的表达,研究表明,在胚根中,19.7%PEG胁迫下NAC转录因子的表达与子叶中基本一致,其中,GhNAC1在胚根中的表达与在子叶中的表达趋势相似,随着BR浸种浓度增大,表达逐渐减少,在1和2 mg/L BR浸种时与对照组相比有极显著差异(P<0.01),BR浸种会抑制GhNAC1的表达,且BR浓度越大,抑制越明显。GhNAC2在胚根中的表达与子叶中的相比,表达趋势更明显,在0.25、0.5和1 mg/L BR浸种时与对照组相比有极显著的上调(P<0.01),在2 mg/L BR浸种时与对照组相比有极显著的下调(P<0.01),说明GhNAC2在胚根中受到BR的强烈诱导。GhNAC3在胚根中的表达与在子叶中的趋势相同,在1 mg/L BR浸种时达到最大值,与对照组相比有极显著差异(P<0.01)。GhNAC4在胚根中BR浸种浓度较大时(2 mg/L)与对照组相比有极显著差异(P<0.01),GhNAC6在胚根中BR浸种浓度较大时(1 mg/L)与对照组相比有差异(P<0.1),GhNAC5在胚根中的表达则随着BR浸种浓度的增大无显著差异变化。图4
注:***表示P<0.001,**表示P<0.01,*表示P<0.05,下同
Note:***indicateP<0.001,**indicateP<0.01,*indicateP<0.05,the same as below
图3 干旱胁迫下不同浓度BR处理NAC转录因子在棉花萌发期子叶中的表达变化
Fig.3 The expression of NAC transcription factors in cotton cotyledon during germination treated with different concentrations of BR under drought stress
注:***表示P<0.001,**表示P<0.01,*表示P<0.05
Note: ***indicateP<0.001,**indicateP<0.01,*indicateP<0.05
图4 干旱胁迫下不同浓度BR处理NAC转录因子在棉花萌发期胚根中的表达变化
Fig.4 The expression of NAC transcription factors in cotton radicles during germination treated with different concentrations of BR under drought stress
3 讨 论
NAC转录因子家族是植物特有的且较大的一类转录因子,广泛参与植物的多个生长发育和逆境胁迫应答[9]。NAC家族已经成为目前基因功能及表达调控的热点[10-11]。研究克隆了新疆陆地棉品种新陆早17号中NAC1-6,通过对6个基因氨基酸序列的生物信息学分析及检测用BR浸种后干旱胁迫下6个基因在棉花子叶和胚根中的表达量,为鉴定其功能提供理论基础。
通过对GhNAC1-6进行生物信息学分析发现GhNAC1-6都具有典型的NAC结构域,即N端高度保守和C端高度多样性,且C端富含酸性氨基酸,如天冬氨酸和谷氨酸时一般具有转录激活功能[12-14]。通过将GhNAC1-6与已报道的非生物逆境胁迫的蛋白[15]构建系统发生树,预测GhNAC1-6的功能,发现GhNAC2和GhNAC3与ATAF1亲缘关系较近,可能具有响应干旱和ABA胁迫的功能;GhNAC1与CsNAC亲缘关系最近,可能有响应机械损伤、缺氧、低温和乙烯胁迫的能力;GhNAC4与RD26亲缘关系最近,可能有响应干旱、盐和ABA胁迫的作用;GhNAC5与NAP亲缘关系最近,可能与植株衰老相关;GhNAC6与CUC1亲缘关系最近,可能有花器官发育方面的功能。
油菜素内酯(BR)是一种新型植物激素 ,在植物体内含量极低,但生理活性却极高 ,植物经极低浓度处理便能表现出明显的生理效应。 许多研究证明,BR具有改善植物生理代谢 ,提高品质和产量的作用 ,并能调节植物生长发育的许多过程[16-20],在生产中有极为广泛的作用。植物激素在协调植物生长、发育和抗逆应答中具有重要作用,其作用机制和信号传递过程各异,但最终都是通过引起特定基因表达水平的改变,来调控特定的生物学过程。
植物激素作用的强弱与其浓度关系不大,植物细胞对激素的敏感程度才是激素作用的控制因素[21]。研究中,不同浓度油菜素内酯浸种后干旱胁迫下各NAC转录因子的表达不完全相同,结合之前的生物信息学分析,发现GhNAC2和GhNAC3基因的变化趋势基本相同,在0.25 mg/L BR浸种后PEG干旱胁迫下棉花子叶中GhNAC2和GhNAC3基因的表达与对照组相比表达明显升高,分别是对照组的1.75和1.59倍,表明GhNAC2和GhNAC3基因在干旱胁迫下受到低浓度BR诱导,高浓度BR则对其产生抑制,这一变化规律与之前相同条件下测的生理指标[22]中的保护酶含量(POD、CAT、SOD)变化趋势相同,表明GhNAC2和GhNAC3基因可能通过调节棉花中酶的含量增强棉花抗旱性。而GhNAC1基因的表达随BR浸种浓度增大而降低,GhNAC1在1 mg/L和2 mg/L BR浸种后,在子叶和胚根中,与对照组相比,表达量显著下调,在胚根中,分别下调了2.27和7.69倍;在子叶中,分别下调了3.22和5.55倍。说明GhNAC1基因在干旱胁迫下的表达可能受BR抑制,这一结果与生物信息学分析结果相同。GhNAC4和GhNAC6基因在胚根中表达类似,都在BR浓度较高时表达有显著上升,GhNAC4在2 mg/L BR浸种时,与对照组相比,表达量升高7.34倍,GhNAC9在1 mg/L BR浸种时,与对照组相比,表达量升高28.85倍,而造成这样的原因可能是因为采样造成的误差。
4 结 论
通过对陆地棉GhNAC1-6的生物信息学分析及分析BR浸种后干旱胁迫下GhNAC1-6基因的表达,结果表明在GhNAC1-6中,GhNAC2-3在0.25 mg/L油菜素内酯处理后PEG胁迫下表达量是对照组的1.5倍左右,有较大可能在干旱胁迫下棉花萌发期受BR诱导参与棉花抗旱,油菜素内酯能够影响GhNAC的表达响应干旱胁迫。对新疆陆地棉GhNAC1-6的克隆和表达分析的探讨,将为研究干旱胁迫下油菜素内酯影响NAC的表达进而调控棉花的抗旱机制奠定理论基础,也为油菜素内酯在提高棉花抗旱大田的应用提供指导。
References)
[1] Sasse, J. M. (1997). Recent progress in brassinosteroid research.PhysiologiaPlantarum, 100(3): 696-701.
[2]Hobert, O. (2008). Gene regulation by transcription factors and micrornas.Science, 319(5871): 1,785-1,786.
[3]Nuruzzaman, M., Manimekalai, R., Sharoni, A. M., Satoh, K., Kondoh, H., & Ooka, H., et al. (2010). Genome-wide analysis of nac transcription factor family in rice.Gene, 465(1-2):30-44.
[4]Rushton, P. J. , Bokowiec M T, & Han S, et al. (2008). Tobacco Transcription Factors: Novel Insights into Transcriptional Regulation in the Solanaceae.PlantPhysiology, 147(147):280-295.
[5]Le, D. T., Nishiyama, R., Watanabe, Y., Mochida, K., Yamaguchishinozaki, K., & Shinozaki, K., et al. (2011). Genome-wide survey and expression analysis of the plant-specific nac transcription factor family in soybean during development and dehydration stress.DNAResearch, 18(4):263.
[6]Liu, G., Li, X., Jin, S., Liu, X., Zhu, L., & Nie, Y., et al. (2014). Overexpression of rice nac gene snac1 improves drought and salt tolerance by enhancing root development and reducing transpiration rate in transgenic cotton.PlosOne, 9(1): e86895.
[7]Meng, C., Zhang, T., & Guo, W. (2009). Characterization of six novel nac genes and their responses to abiotic stresses in gossypium hirsutum L.PlantScience, 176(3): 352-359.
[8]Yang, X., Wang, X., Ji, L., Yi, Z., Fu, C., & Ran, J., et al. (2015). Overexpression of a miscanthus lutarioriparius, NAC gene mlnac5, confers enhanced drought and cold tolerance in arabidopsis.PlantCellReports, 34(6): 943-958.
[9]彭辉, 于兴旺, 成慧颖,等. 植物NAC转录因子家族研究概况[J]. 植物学报, 2010, 45(2):236-248.
PENG Hui, YU Xing-wang, CHENG Hui-ying, et al. (2010). A Survey of Functional Studies of the Plant-specific NAC Transcription Factor Family [J].ChineseBulletinofBotany, 45(2):236-248. (in Chinese)
[10]Olsen, A. N., Ernst, H. A., Leggio, L. L., & Skriver, K. (2005). Dna-binding specificity and molecular functions of nac transcription factors.PlantScience, 169(4): 785-797.
[11]Zheng, X., Chen, B., Lu, G., & Han, B. (2009). Overexpression of a nac transcription factor enhances rice drought and salt tolerance.Biochemical&BiophysicalResearchCommunications, 379(4): 985-989.
[12]Sadowski, I., Ma, J., Triezenberg, S., & Ptashne, M. (1988). Gal4-vp16 is an unusually potent transcriptional activator.Nature, 335(6190):563-564.
[13]Courey, Albert, J., Holtzman, Douglas, A., Jackson, & Stephen, P., et al. (1989). Synergistic activation by the glutamine-rich domains of human transcription factor sp1.Cell, 59(5): 827-836.
[14]Mermod, N., O'Neill, E. A., Kelly, T. J., & Tjian, R. (1989). The proline-rich transcriptional activator of ctf/nf-i is distinct from the replication and dna binding domain.Cell, 58(4): 74-753.
[15]李伟, 韩蕾, 钱永强,等. 非生物逆境胁迫相关NAC转录因子的生物信息学分析[J]. 西北植物学报, 2012, 32(3):454-464.
LI Wei, HAN Lei, QIAN Yong-qiang, et al. (2012). Bioinformatics Analysis of Abiotic Stress Related NAC Transcription factors [J].ActaBotanicaBoreali-OccidentaliaSinica, 32(3):454-464. (in Chinese)
[16]朱广廉. 油菜素甾醇类植物激素的研究进展[J]. 植物生理学报, 1992,(5):317-322.
ZHU Guang-lian. (1992). Advance in the Study on Brassinosteroids [J].PlantPhysiologyCommunications, (5):317-322. (in Chinese)
[17]Thompson, M. J., Meudt, W. J., Mandava, N. B., Dutky, S. R., Lusby, W. R., & Spaulding, D. W. (1982). Synthesis of brassinosteroids and relationship of structure to plant growth-promoting effects.Steroids,39(1): 89-105.
[18]赵毓橘. 油菜素内酯研究进展[J]. 植物学报, 1995, 12(3):30-34.
ZHAO Yu-ju. (1995). Some Recent Advances in Brassinolide Research [J].ChineseBulletinofBotany,12(3):30-34. (in Chinese)
[19]周玉书, 仇贵生, 张平,等. Homobrassinolide在葡萄上的应用试验[J]. 中国果树, 2003,(5):15-16.
ZHOU Yu-shu, QIU Gui-sheng, ZHANG Ping, et al. (2003). The application of Homobrassinolide on grape test [J].ChinaFruits, (5):15-16.(in Chinese)
[20]李凯荣, 攀金拴. 新型植物激素-油菜素内酯类在农林上的应用研究进展[J]. 干旱地区农业研究, 1998,(4):103-109.
LI Kai-rong, PAN Jin-shuan. (1998). Advance of Study on and application of Brassinosteroids. [J].AgriculturalResearchintheAridAreas, (4):103-109.(in Chinese)
[21]高勇, 赵云, 刘薇,等. 激素对甘蓝型油菜(BrassicanapusL)矮化突变体幼苗生长及内源GA3含量的影响[J]. 四川大学学报(自然科学版), 2007, 44(5):1 133-1 137.
GAO Yong, ZHAO Yun, LIU Wei, et al. (2007). Effects of exogenously applied hormones on seedling elongation and content of endogenous GA3 in a dwarf mutation (BrassicanapusL). [J].JournalofSichuanUniversity(NatureScienceEdition) ,44(5):1,133-1,137. (in Chinese)
[22]常丹,杨艺,王艳,等. 24-表油菜素内酯对PEG与盐胁迫下棉花种子萌发的影响[J]. 西北农业学报,2015,(3):96-101.
CHANG Dan, YANG Yi, WANG Yan, et al. (2015). Effects of 24-Epi Brassionlide on Seed Germination under Stresses of Salt and PEG in Cotton. [J].ActaAgriculturaeBoreali-occidentalicsSinica, (3):96-101. (in Chinese)
InfluencesofBrassinolideunderDroughtStressontheExpressionsofNACTranscriptionFactorsinGerminationStageofCottonSeeds
YAN Xiao-hong, BAO Qiu-juan, ZHANG Fu-chun
(XinjiangKeyLaboratoryofBiologicalResourcesandGeneticEngineering,CollegeofLifeScienceandTechnology,XinjiangUniversity,Urumqi830046,China)
【Objective】 In order to investigate the expression of NAC transcription factors during seed germination of cotton(Gossypiumhirsutum)under drought stress and to analyze the function of NAC transcription factors in the pathway of brassinolide (BR) regulation for drought resistance in cotton. 【Method】The gene sequences of upland cotton NAC transcription factor family were used to amplify the 6 genes ofGhNACfrom cotton Xinluzao17. Quantitative RT-PCR was used to detect the change ofNACgene expression in cotyledon and radicle of cotton seeds at germination stage after seed soaked with different concentrations of brassinolide under drought stress. 【Result】In cotton cotyledons,the expressions ofGhNAC1under drought stress were suppressed by different concentrations of brassinolide, the expressions ofGhNAC2 andGhNAC3 were induced by 0.25 mg/L brassinolide. The expressions ofGhNAC5 were only induced by 0.5 mg/L brassinolide, and the expressions ofGhNAC4 andGhNAC6 did not change significantly. However, in cotton radicle, the expressions ofGhNAC1 were also inhibited by different concentrations of brassinolide, the expressions ofGhNAC2 andGhNAC3 were induced by 0.25 mg/L brassinolide. At same time, high expressions ofGhNAC3 were induced by 2 mg/L brassinolide, the expressions ofGhNAC5 did not change significantly, the expressions ofGhNAC4 andGhNAC6 were induced by the high concentration of brassinosteroids. 【Conclusion】The expressions ofGhNAC1 in cotton cotyledons and radicles during seed germination were inhibited by brassinolide, and the expressions ofGhNAC2 andGhNAC3 was induced by low concentration of brassinolide. The results showed that brassinolide could affect the expression ofGhNACin response to drought stress.
short ultivars; growth stages; major gene plus polygene inheritance; genetic analysis
ZHANG Fu-chun(1962-),male,native place: Urumqi,Xinjiang. Professor, research field:Molecular biology. (E-mail)zfcxju@xju.edu.cn
10.6048/j.issn.1001-4330.2017.08.005
2017-05-10
国家自然科学基金-新疆联合基金重点项目“棉花水分高效利用的关键基因的挖掘及抗旱种质材料的创制”(U1303282)
严晓红(1992-),女,硕士研究生,研究方向为植物分子生物学,(E-mail)527863765 @qq.com
张富春(1962-),男,教授,博士,研究方向为分子生物学,(E-mail)zfcxju@xju.edu.cn
S565.4
:A
:1001-4330(2017)08-1414-08
Supported by: Joint key fund of National Natural Science Foundation of China and Xinjiang "Exploring key genes related to high-efficiency water utilizationand creating of drought resistant materials in cotton"(U1303282)
