5-氨基酮戊酸光动力疗法对瘢痕成纤维细胞的作用研究
2017-09-18朱志娟王琪影王晓利宋凤敏
朱志娟,王琪影,王晓利,宋凤敏
(郑州大学第一附属医院 整形外科,河南 郑州450052)
5-氨基酮戊酸光动力疗法对瘢痕成纤维细胞的作用研究
朱志娟,王琪影,王晓利,宋凤敏
(郑州大学第一附属医院 整形外科,河南 郑州450052)
目的研究5-氨基酮戊酸光动力疗法(ALA-PDT)对瘢痕成纤维细胞的作用及其机制,为临床运用ALA-PDT治疗瘢痕疙瘩提供理论依据。方法取人瘢痕成纤维细胞原代培养,并将生长状态无明显差异的瘢痕成纤维细胞随机分为空白对照组、磷酸盐缓冲液(PBS)组以及6个不同浓度的5-氨基酮戊酸(ALA)培养液组。每组给予635 nm发光二极管(LED)激光器照射。采用细胞计数试剂盒(CCK-8)法检测ALA-PDT对瘢痕成纤维细胞增殖的影响,并应用实时聚合酶链反应(real-time PCR)和Western blot检测各组瘢痕成纤维细胞中胶原蛋白Ⅲ(CollagenⅢ)mRNA水平和蛋白表达水平。结果与空白对照组及PBS组比较,CCK-8结果表明,ALA-PDT能抑制瘢痕成纤维细胞生长,其抑制作用随着ALA浓度增加逐渐增强,当ALA浓度为0.500 mmol/L时抑制作用最明显。RT-PCR和Western blot结果表明,随着ALA浓度增大,CollagenⅢ mRNA水平和蛋白表达水平逐渐下降,当ALA溶液浓度达到0.500 mmol/L时下降至最低值。结论ALA-PDT能有效抑制瘢痕成纤维细胞增殖,抑制作用在ALA浓度为0.500 mmol/L时最强。ALA-PDT可能是通过抑制瘢痕成纤维细胞中CollagenⅢ的合成,进而抑制瘢痕疙瘩的形成。
5-氨基酮戊酸光动力疗法;瘢痕成纤维细胞;胶原蛋白Ⅲ
瘢痕疙瘩是一种局部皮肤组织的良性纤维增生性疾病,是遗传易感个体的皮肤组织对于损伤产生病理性伤口愈合反应的产物,并以成纤维细胞的增殖和细胞外基质(特别是胶原蛋白)的大量堆积为主要特征[1]。目前,虽然治疗瘢痕疙瘩的药物和方法有很多,但疗效有限,同时可能引起明显的不良反应和较高的复发率[2]。因此,寻找疗效好、不良反应率和复发率低的治疗方法意义重大。
光动力疗法(photodynamic therapy,PDT)是在光敏剂的参与下,运用非热能激光照射,引起光敏剂和氧的相互作用,产生活性氧和自由基,从而诱导组织损伤的治疗方法[3]。5-氨基酮戊酸(5-aminolevulinic acid,ALA)由甘氨酸、琥珀酸、辅酶A在ALA合成酶作用下合成,其本身并不是一种光敏剂,是体内合成亚铁血红素的前体物质,但在细胞内一些酶的作用下可转化为具有强光敏作用的原卟啉IX(Protoporphyrin IX,PpIX)[4]。ALA-PDT 已在皮肤性疾病领域得到越来越广泛地应用,特别是在皮肤病毒疣及皮肤肿瘤等方面具有较好的疗效。近年来,有研究证实[5],ALA-PDT对于瘢痕组织具有一定的疗效,陈金波等[6]通过研究发现光动力治疗病理性瘢痕有效率与糖皮质激素局部注射治疗差异无统计学意义,但无糖皮质激素治疗的不良反应;焦健等[7]通过研究认为ALA-PDT可能是通过Akt途径上调程序性细胞死亡因子4(programmed cell death 4,PDCD4)蛋白的表达水平,促进了异常增殖的成纤维细胞的凋亡而发挥治疗作用;孔祥明等[8]ALA-PDT干预裸鼠瘢痕疙瘩模型,观察到瘢痕疙瘩内成纤维细胞、胶原纤维均减少,瘢痕体积亦缩小,但其最佳的作用条件以及具体的作用机制尚不明确。
为此,本研究运用细胞计数试剂盒(CCK-8)法检测ALA-PDT对瘢痕成纤维细胞的作用,实时聚合酶链反应(real-time polymerase chain reaction,realtime PCR)和Western blot方法检测ALA-PDT处理后成纤维细胞中胶原蛋白Ⅲ(CollagenⅢ)的mRNA和蛋白的表达情况,探讨ALA-PDT治疗瘢痕疙瘩的可能机制,为临床运用ALA-PDT治疗瘢痕疙瘩提供理论依据。
1 材料与方法
1.1 试剂
羊抗人CollagenⅢ单克隆抗体购自美国Santa Cruz公司,羊抗人甘油醛-3-磷酸脱氢酶(GAPDH)单克隆抗体购自美国CST公司,辣根过氧化物酶(HRP)标记兔抗羊IgG购自北京中杉金桥生物技术有限公司,ALA购自美国Sigma公司,PrimeScript II 1st Strand cDNA Synthesis Kit RT试剂盒购自日本TaKaRa公司,CCK8购自日本Dojindo公司。
1.2 组织来源和细胞培养
1.2.1 瘢痕成纤维细胞来源 切取外伤后1~2年经过病理检查证实的瘢痕疙瘩,未使用任何干预治疗,并经患者知情同意。切取后即放置于无血清DMEM细胞培养液的50 ml离心管中,放入冰盒中保存。
1.2.2 瘢痕成纤维细胞的原代培养 去除离心管内的DMEM细胞培养液,用0.25%氯霉素溶液和磷酸盐缓冲液(phosphate buffered saline,PBS)反复冲洗,去除瘢痕组织内的血凝块,小心剪除脂肪。将瘢痕组织剪成1 mm宽长条状,PBS再次反复冲洗残余凝血块,放入15 ml离心管中,加入2.4μl/ml中性蛋白酶Ⅱ溶液,放置于4℃冰箱消化过夜。第2天取出离心管,吸去中性蛋白酶Ⅱ溶液,PBS冲洗2次,放入10 cm细胞培养皿中,加入DMEM细胞培养液,用眼科镊子去除表皮组织并剪成1 mm3大小组织碎片后,置入50 ml离心管中,加入5倍体积的无血清DMEM细胞培养液配制的0.3%Ⅰ型胶原酶溶液,37℃轻微震荡消化2~3 h,以200目金属滤网过滤,1 500 r/min离心5 min,弃上清,细胞沉淀用10%胎牛血清的DMEM溶液重悬,血球计数板细胞计数,将细胞悬液种于10 cm培养皿。在含10%胎牛血清的DMEM培养基(含1%青、链霉素),37℃、5%二氧化碳CO2条件下培养。
1.3 实验分组及处理
将所培养的生长状态无明显差异的瘢痕成纤维细胞接种于96孔板和6孔板,分为8组,包括空白对照组(A组),PBS组(B组),以及6个ALA培养液组(C、D、E、F、G和H)。A组只给予含10%胎牛血清的DMEM培养基,B组给予10%胎牛血清的DMEM培养基和PBS处理,6个ALA培养液组分别给予含 0.0625(C 组)、0.125(D 组)、0.250(E 组)、0.500(F 组)、1.000(G 组)和 2.000 mmol/L(H 组)ALA培养液的10%胎牛血清的DMEM培养基。5 h后,每组给予635 nm LED激光器照射10 min后继续培养24 h。96孔板细胞用于CCK-8检测成纤维细胞增殖抑制率。6孔板细胞用于提取CollagenⅢRNA和蛋白。
1.4 ALA-PD T对瘢痕成纤维细胞增殖能力的影响
向96孔板中每孔加入10μl的CCK-8溶液,将培养板在细胞培养箱内孵育1 h,用酶标仪测定在450 nm处的吸光度值。各药物浓度组的生长抑制率(%)=(1-实验孔平均OD值/对照孔平均OD值)×100%。
1.5 引物设计、R N A提取和R T-PC R
1.5.1 引物设计 RT-PCR引物采用Premier 5.0软件设计,由上海生工生物工程股份有限公司合成,CollagenⅢ正向引物:5'-AGTAGCAGTAGGAGGACT CGCAGG-3',反向引物:5'-GAAGCCTCTGTGTCCTTT CA-TACC-3',引物长度24bp,扩增片段长度227bp;内参GAPDH正向引物:5'-ACCACAGTCC-ATGCC ATCAC-3',反向引物:5'-TCCACCACCCTGTT-GCTGTA-3',扩增片段长度 450 bp。
1.5.2 RNA提取和RT-PCR 按照Trizol抽提说明书抽提各待测组细胞中总RNA。CollagenⅢ与内参基因GAPDH同管扩增,扩增条件为94℃预变性5 min,94℃变性 30 s,59℃退火 30 s,72℃延伸 60 s,维持35个循环,72℃延伸10 min。扩增产物经琼脂糖凝胶电泳,经溴化乙锭染色后应用凝胶分析软件分析目标条带的净吸光度值。
1.6 W est ern bl ot检测
胰蛋白酶消化培养瓶中不同组的成纤维细胞,用含血清培养基终止消化,离心,去上清,加入PBS洗细胞3次,加入裂解缓冲液,冰上放置20 min,收集裂解液,离心,12 000 r/min,吸取上清,紫外线分光光度仪测定各待测样品浓度,分装,冷冻保存在-80℃冰箱备用。将变性后的各蛋白样品50μg/孔上样,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)后,将蛋白转移至硝酸纤维素膜上,5%的脱脂奶粉(TBST配制)中封闭。应用TBST洗膜后进行免疫检测:一抗(分别为1∶1 000羊抗人GAPDH和1∶400羊抗人CollagenⅢ)抗体室温孵育过夜,TBST洗膜3次后加入二抗(分别为辣根过氧化物酶标记的二抗1∶40 000兔抗羊IgG)抗体室温孵育1 h。TBST洗膜后采用增强化学发光法显色曝光。分析各条带净吸光度值,并以GAPDH作为内参,计算各蛋白样品与GAPDH比值作为CollagenⅢ蛋白相对表达量。
1.7 统计学方法
采用SPSS 17.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,采用方差分析,两两比较采用LSD检验或Dunnett t3检验。P<0.05为差异有统计学意义。
2 结果
2.1 细胞形态变化
成熟的瘢痕成纤维细胞呈梭形或不规则形,细胞间以细长突起交互相连,细胞饱满,边界清晰,贴壁良好,立体感强,胞浆丰富、均匀,细胞核清晰,呈圆形或类圆形,核内染色质均匀。经635 nm LED激光器照射后10 min的A组和B组细胞形态上比较无明显变化。6个不同浓度的ALA培养液组每组给予635 nm LED激光器照射10 min后,成纤维细胞皱缩呈类球样改变,部分细胞膜、细胞壁破裂,胞内容物溢出,细胞核缩小或碎裂,胞浆内有大小不等颗粒样物,出现空泡样改变,各结构模糊(见图1)。
2.2 ALA-PD T抑制瘢痕成纤维细胞增殖
如表1和图2所示,ALA-PDT能明显抑制瘢痕成纤维细胞增殖,抑制作用随着ALA浓度增加逐渐增强(P<0.05),且ALA浓度达到0.500 mmol/L时,其抑制作用达到高峰,其后抑制作用不再随着ALA浓度增加而增强。F组与C、D、E组比较,差异有统计学意义(t=12.807、6.800 和 3.151,P=0.000、0.001和0.008);G组与C、D、E组比较,差异有统计学意义(t=13.099、7.092 和 3.443,P=0.000、0.001 和 0.005);H组与C、D、E组比较,差异有统计学意义(t=13.280、7.273 和 3.623,P=0.000、0.001 和 0.003);F组与G、H组比较,差异有统计学意义(t=0.473和0.292,P=0.645和0.775);G组与H组比较,差异有统计学意义(t=0.181,P=0.860)。
2.3 C ol l agenⅢm R N A水平

图1 不同浓度ALA-PD T对瘢痕成纤维细胞状态的影响 (光学显微镜×200)

表1 ALA-PD T对瘢痕成纤维细胞增殖能力的影响

图2 不同浓度ALA-PD T对瘢痕成纤维细胞增殖能力的影响 (±s)
如表2与图3显示,CollagenⅢ和GAPDH扩增产物电泳条带与预期一致,ALA-PDT处理后的成纤维细胞中CollagenⅢmRNA水平低于A组和B组。且随着ALA溶液浓度增加,CollagenⅢmRNA的水平逐渐下降(与A组和B组相比,P<0.05);当ALA溶液浓度达到 0.500 mmol/L时,CollagenⅢmRNA水平达到最低值,但其后不再随着ALA浓度增加而下降。CollagenⅢ mRNA:C、D、E、F、G、H 组分别与A组比较,差异有统计学意义(t=3.943、4.294、5.326、10.076、10.340 和 10.244,P=0.007、0.002、0.000、0.000、0.000 和 0.000);C、D、E、F、G、H组分别与B组比较,差异有统计学意义(t=2.271、3.623、4.654、9.405、9.668 和 9.572,P=0.022、0.002、0.002、0.000、0.000和 0.000);F 组与C、D、E 组比较,差异有统计学意义(t=8.133、5.782 和 4.750,P=0.000、0.000和 0.002);G 组与 C、D、E 组比较,差异有统计学意义(t=8.397、6.046 和 5.014,P=0.000、0.000和0.001);H组与 C、D、E 组比较,差异有统计学意义(t=8.301、5.950 和 4.918,P=0.000、0.000 和0.002);F组与G、H组比较,差异有统计学意义(t=0.264和 0.168,P=0.795和 0.869),G 组与 H 组比较,差异有统计学意义(t=0.096,P=0.925)。
2.4 C ol l agenⅢ蛋白的表达
如表2与图4显示,CollagenⅢ和GAPDH电泳结果也与real-time PCR相似,ALA-PDT处理后的成纤维细胞中CollagenⅢ蛋白表达低于空白组和PBS组,且随着ALA溶液浓度增加,CollagenⅢ蛋白表达逐渐减弱(与A组和B组相比,P<0.05);当ALA溶液浓度达到0.500 mmol/L时,CollagenⅢ蛋白表达水平达到最低值,但其后不再随着ALA浓度增加而减弱。CollagenⅢ蛋白 C、D、E、F、G、H 组分别与A组比较,差异有统计学意义(t=2.224、2.289、2.306、2.489、2.582 和 2.544,P=0.042、0.035、0.027、0.024、0.020 和 0.022);C、D、E、F、G、H 组分别与 B组比较,差异有统计学意义(t=2.324、2.405、2.471、2.877、2.969 和 2.932,P=0.031、0.029、0.025、0.011、0.009和0.010);F组与 C、D、E 组比较,差异有统计学 意 义(t=2.416、2.265 和 2.136,P=0.028、0.033 和0.047);G 组与C、D、E组比较,差异有统计学意义(t=2.508、2.807 和 2.481,P=0.023、0.017 和 0.026);H组与C、D、E组比较,差异有统计学意义(t=2.471、2.771 和 2.461,P=0.025、0.019 和 0.026);F 组分别与G、H组比较,差异有统计学意义(t=0.092和0.055,P=0.928和 0.957),G 组与H组比较,差异有统计学意义(t=0.037,P=0.971)。
表2 Collagen I I I基因mR N A与蛋白的相对表达量 (±s)
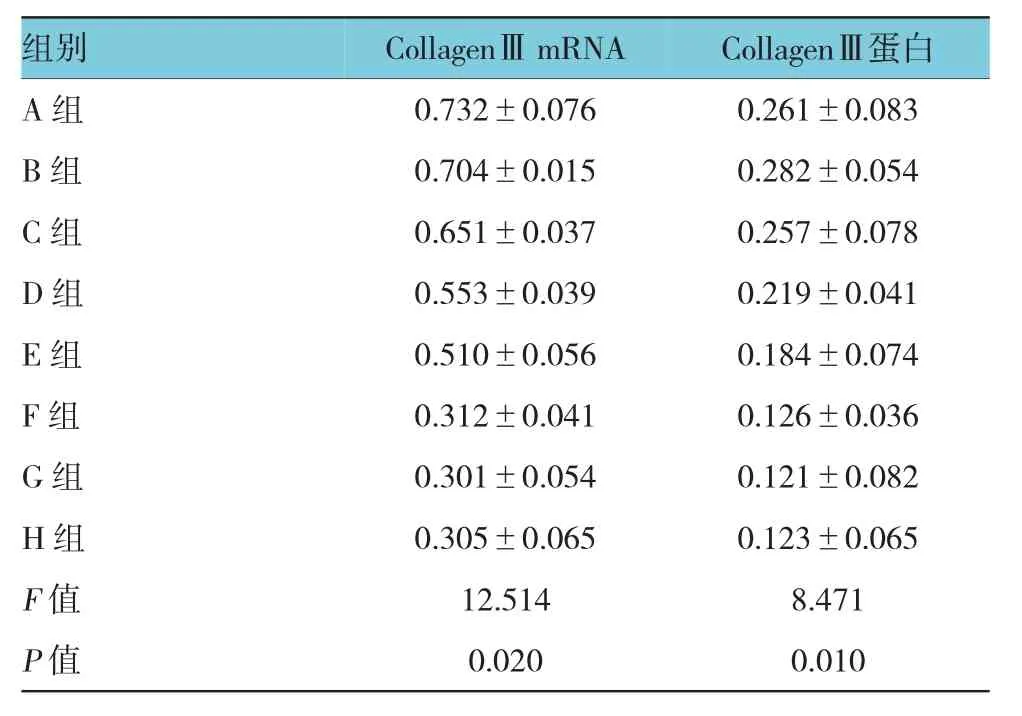
表2 Collagen I I I基因mR N A与蛋白的相对表达量 (±s)
组别CollagenⅢ蛋白A组 0.732±0.076 0.261±0.083 B组 0.704±0.015 0.282±0.054 C组 0.651±0.037 0.257±0.078 D组 0.553±0.039 0.219±0.041 E组 0.510±0.056 0.184±0.074 F组 0.312±0.041 0.126±0.036 G组 0.301±0.054 0.121±0.082 H组 0.305±0.065 0.123±0.065 F值 12.514 8.471 P值 0.020 0.010 CollagenⅢmRNA

图3 不同浓度ALA-PD T处理对成纤维细胞中C ol l agenⅢm R N A表达的影响

图4 不同浓度ALA-PD T处理对成纤维细胞中C ol l agenⅢ蛋白表达的影响
3 讨论
瘢痕疙瘩是由于损伤部位成纤维细胞过度活跃,真皮层胶原生成导致大量细胞外基质堆积引起[9]。研究表明,瘢痕组织内主要含有胶原蛋白Ⅰ、胶原蛋白Ⅲ以及少量其他型胶原蛋白[10]。临床上,瘢痕疙瘩的生物学行为与良性肿瘤相似,可越过损伤边缘影响周围健康组织,并难以治疗。
PDT是目前治疗皮肤性疾病的常见治疗方式。这种治疗方法通常与光敏剂相互作用,促进后者在目的细胞内转化为PpIX。PpIX在包含高度增殖细胞的组织内合成增加,这可能与血色素合成酶活性改变有关,它不仅与恶性细胞的生物学行为有关,而且与侵袭行为或者肿瘤细胞其他相似活性的非肿瘤细胞生物学行为有关。虽然瘢痕疙瘩是一种良性的纤维细胞增殖性紊乱,但是其具有临床侵袭性并在治疗后容易复发。ALA是第2代光敏剂,进入人体后可被增生的细胞选择性吸收,在细胞内某些酶的作用下转化为PpIX等物质,进而在特殊光的照射下生成活性氧造成细胞损伤。
本组实验结果显示与A组和B组比较,ALA组内CollagenⅢ的mRNA和蛋白表达水平明显下降。提示ALA-PDT可能通过抑制CollagenⅢ的合成,从而抑制瘢痕疙瘩的形成和发展。ALA-PDT在瘢痕疙瘩组织中产生的活性氧和自由基可诱导成纤维细胞结构蛋白和酶的巯基氧化形成二硫键,氨基酸残基氧化,胞浆及膜蛋白和某些酶交联形成而具体或者更大的聚合物。一方面合成胶原蛋白相关酶的活性受到抑制,胶原蛋白合成减少,另外细胞膜胶原蛋白功能发生改变并缺少能量,使成纤维细胞内合成的胶原蛋白无法转运至细胞外,进而使细胞外基质减少,致使胶原纤维结构模糊、成纤维细胞凋亡。
综上所述,本研究ALA-PDT可通过抑制瘢痕疙瘩纤维细胞中CollagenⅢ的合成,进而抑制瘢痕疙瘩的形成,ALA培养液的浓度达到0.500 mmol/L时,抑制作用达到高峰。这将有助于临床选择更为合适的ALA-PDT方案治疗瘢痕疙瘩。
[1]SHIH B,BAYAT A.Genetics of keloid scarring[J].Arch Dermatol Res,2010,302(5):319-339.
[2]BAYAT A,MCGROUTHER D A.Clinical management of skin scarring[J].Skin Med,2005,4(3):165-173.
[3]DOLMANS D E,FUKUMURA D,JAIN R K.Photodynamic therapy for cancer[J].Nat Rev Cancer,2003,3(5):380-387.
[4]PENG Q,SOLER A M,WARLOE T,et al.Selective distribution of porphyrins in skin thick basal cell carcinoma after topical application of methyl 5-aminolevulinate[J].J Photochem Photobiol B,2001,62(3):140-145.
[5]LI X,ZHOU Z P,HU L,et al.Apoptotic cell death induced by 5-aminolaevulinic acid-mediated photodynamic therapy of hypertrophic scar-derived fibroblasts[J].J Dermatolog Treat,2013,25(5):428-433.
[6]陈金波,李东升,夏萍,等.氨基酮戊酸光动力疗法治疗新发病理性瘢痕疗效观察[J].中国中西医结合皮肤性病学杂志,2015,3:173-175.
[7]焦健,范玉.δ-氨基酮戊酸光动力疗法对瘢痕疙瘩成纤维细胞增殖及胶原分泌的影响[J].中华整形外科杂志,2015,31(1):49-52.
[8]孔祥明,张明莉,陈楠,等.应用光动力治疗瘢痕疙瘩的实验研究[J].中国美容医学,2014,20:1704-1707.
[9]SHIH B,GARSIDE E,MCGROUTHER D A,et al.Molecular dissection of abnormalwound healing processesresulting in keloid disease[J].Wound Repair Regen,2010,18(2):139-153.
[10]LIM I J,PHAN T T,BAY B H,et al.Fibroblasts cocultured with keloid keratinocytes:normal fibroblasts secrete collagen in a keloidlike manner[J].Am J Physiol Cell Physiol,2002,283(1):C212-222.
(张蕾 编辑)
Impact of ALA-PDT on fibroblasts from keloid and its mechanism
Zhi-juan Zhu,Qi-ying Wang,Xiao-li Wang,Feng-min Song
(Department of Plastic Surgery,the First Affiliated Hospital of Zhengzhou University,Zhengzhou,Henan 450052,China)
ObjectiveTo study the impact of 5-aminolevulinic acid based photodynamic therapy(ALA-PDT)on proliferation of fibroblasts from keloid and its mechanism for guiding the use of ALA-PDT treating keloid in clinic.MethodsFibroblasts from patients'keloid were primarily cultured,then those cells without significant difference in growth state were divided into control group,PBS group and 6 ALA groups.Each group
PDT of 635 nm light emitting diode(LED)laser irradiation.Cell counting kit-8(CCK-8)was used to detect the suppressive rate of ALA-PDT on the proliferation of the fibroblasts.RT-PCR and Western blot were used to detect the mRNA and protein levels of Collagen III.ResultsCompared with the control and PBS groups,ALA-PDT inhibited the proliferation of fibroblasts and the suppressive rate was gradually enhanced with the increase of the ALA concentration.When the concentration of ALA was 0.500 mmol/L,the inhibition was the strongest.The levels of CollagenⅢmRNA and protein were decreased with the increase of the ALA concentration,and the levels of CollagenⅢmRNA and protein were the lowest when the concentration of ALA was 0.500 mmol/L.ConclusionsALA-PDT could inhibit the proliferation of fibroblasts from keloid and the inhibition would be the strongest at the ALA concentration of 0.500 mmol/L.The mechanism may be associated with the suppression of the synthesis of Collagen III in scar fibroblasts.
ALA-PDT;fibroblast;keloid;CollagenⅢ
R751
A
10.3969/j.issn.1005-8982.2017.13.008
1005-8982(2017)13-0039-05
2016-12-12
王琪影,E-mail:drqqwang@163.com
