百里醌预处理对大鼠肾缺血再灌注损伤的影响
2017-09-18宋小红李承旭吴扬蔡源董俊武
宋小红,李承旭,吴扬,蔡源,董俊武
(华中科技大学同济医学院附属普爱医院 肾内科,湖北 武汉 430034)
百里醌预处理对大鼠肾缺血再灌注损伤的影响
宋小红,李承旭,吴扬,蔡源,董俊武
(华中科技大学同济医学院附属普爱医院 肾内科,湖北 武汉 430034)
目的探讨百里醌对大鼠肾缺血再灌注损伤的影响及机制。方法随机将60只雄性SD大鼠分成假手术组(Sham组)、肾缺血再灌注损伤组(IRI组)和百里醌不同浓度预处理组(Thy组)。IRI组和Thy组用无创血管夹夹闭左侧肾蒂复制IRI模型,Sham组操作同上,但不夹闭左侧肾蒂。Thy组在缺血前45 min给予百里醌5、10、20和40 mg/kg腹腔注射。Sham组和IRI组在同一时间给予等体积生理盐水腹腔注射。再灌注24 h后处死小鼠,收集血清和肾脏标本。PAS染色检测肾脏病理改变,ELISA检测尿素氮(BUN)、肌酐(Cr)、丙二醛(MDA)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPx)、超氧化物歧化酶(SOD)的表达、白细胞介素8(IL-8)、干扰素(IFN-γ)和肿瘤坏死因子(TNF-α)的表达,Western blot检测JAK2、STAT3、P-JAK2、P-STAT3、P53和P21蛋白表达,逆转录聚合酶链反应(RT-PCR)检测IL-8、IFN-γ和TNF-α的信使RNA 水平(mRNA)。结果缺血再灌注损伤增加 BUN、Cr、P-JAK2、P-STAT3、P53、P21、MDA、IL-8、IFN-γ和TNF-α的表达以及肾组织病理改变,同时减少CAT、GPX与SOD表达。而百里醌治疗,可减少BUN、Cr、P-JAK2、P-STAT3、P53、P21、MDA、IL-8、IFN-γ 和 TNF-α 表达以及肾组织病理改变,增加 CAT、GPX 与SOD表达,3组之间JAK2和STAT3表达无差异。结论百里醌预处理可减轻肾缺血再灌注损伤,其作用机制部分是通过抑制JAK2/STAT3/P53信号通路介导的炎症和氧化应激。
百里醌;肾缺血再灌注损伤;炎症;氧化应激;JAK2/STAT3/P53
急性肾损伤(acute kidney injury,AKI)是临床上常见的危重症,好发于肾移植、肾部分切除术、心脏手术和脓毒症等危重情况。其发病率和死亡率奇高,据报道,全世界AKI每年发病率为1330万,与AKI相关的死亡率为200万[1-2]。肾脏缺血再灌注损伤(renal ischemia reperfusion injury,IRI)是导致 AKI的主要原因,并严重影响病情的转归[3]。百里醌(Thymoquinone,Thy)是从Nigella sativa植物提取的一种物质,具有抗凋亡、抗肿瘤、调节免疫以及抗氧化应激的活性[4-5]。此外,研究还发现,Thy对脑、肝脏、肠等器官缺血再灌注损伤具有保护作用[6-9]。本实验拟在动物水平探讨Thy预处理对炎症和氧化应激的影响以及相关机制,为临床防治IRI提供理论和实验支持。
1 材料与方法
1.1 主要试剂、仪器和动物
百里醌(上海哈森公司),无水乙醇(美国Sigma公司),水合氯醛(Google生物)。JAK2、P-JAK2、P-STAT3、STAT3(均美国 CST 公司),P53和 P21(美国 abgent公司),TRIzol reagent(美国 Invitrogen公司),逆转录试剂盒(美国GeneCopoeia公司),RT-PCR引物(擎科生物技术有限公司,订单号SY14032221,序列见表1),PAS试剂由同济医学院病理实验室配制。紫外分光光度计(美国Thermo fisher)、逆转录仪(德国 Eppendorf)、RT-PCR 仪(美国 BIO-RAD IQ5)、显微镜(日本 Olympus BX51)及成像系统(日本HITMAS-30)均为同济医学院提供。SD大鼠,购自武汉大学实验动物中心,SPF级,质量合格证号430121021,饲养于同济医学院动物实验中心,许可证号SYXK(鄂)2011-0027,设施使用证号00124722。
1.2 动物模型的复制与分组
60只健康雄性SD大鼠,平均体重220~250克。随机分为假手术组(Sham组),肾缺血再灌注损伤组(IRI组)和百里醌不同浓度组(Thy组)。Thy组在缺血前45 min给予 Thy 5、10、20和 40 mg/kg腹腔注射。Sham组和IRI组在同一时间给予等体积生理盐水腹腔注射。IRI组和Thy组用无创血管夹夹闭左侧肾蒂构建IRI模型,Sham组操作同上,但不夹闭左侧肾蒂。具体手术方式见参考文献[9]。
1.3 标本收集
再灌注24h后,行腹主动脉取血,室温下3000r/min离心10 min后取上清液送同济医院检验科检测血尿素氮(blood urea nitrogen,BUN)和血清肌酐(Creatinine,Cr)。开腹取左肾;1/3左肾置于多聚甲醛做石蜡切片,其余组织冷冻保存于-80°冰箱。
1.4 肾脏病理检查
取肾脏石蜡包块,4μm切片,脱蜡透明后由同济医院肾内科实验室PAS试剂进行染色,光镜下观察形态结构,半定量计数方法评估损伤程度,分别根据肾小管上皮细胞坏死、肾小管扩张、刷状缘脱落、管型等分级,5级评分如下:0分,正常;1分,<25%;2分,25%~50%;3分,50%~75%;4分,>75%。每只小鼠切片至少随机选择10个肾皮髓交界处视野(×400)[9]。见表 1。
1.5 Western blot测定 JAK2、STAT3、P-JAK2、P-STAT3、P53和P21的蛋白表达
取肾组织,加入裂解液,匀浆,收集上清液,蛋白定量后变性,SDS-PAGE电泳,转膜,脱脂牛奶封闭1 h,4℃下一抗封闭过夜;37℃下二抗孵育1 h,ECL发光,X线片显影、定影,凝胶图像系统分析灰度值。
1.6 逆转录聚合酶链反应检测肾组织中白细胞介素8、肿瘤坏死因子和干扰素表达水平
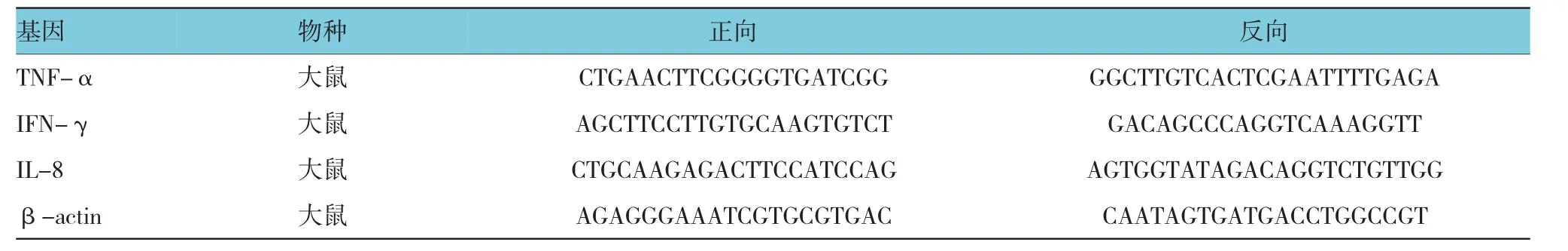
表1 引物序列
采用逆转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR) 法检测肾脏白细胞介素8(IL-8),肿瘤坏死因子(tumor necrosisfactor-α,TNF-α) 和干扰素(inteferon gamma,IFN-γ)的信使核糖核酸(mRNA)表达水平。称取适量肾脏组织,于液氮中研磨成粉末状提取总RNA,紫外分光光度计测量浓度。引物序列见表1。采用两步法PCR反应,扩增条件95℃预变性30 s;95℃变性 5 s,60℃退火延伸1 min。共 40个循环,得到每个样本的CT值法,用得到的各样本的Ct值按公式2-ΔΔCT计算相对表达量。
1.7 ELI SA检测血清中I L-8、TN F-α、I FN-γ表达水平
按照ELISA试剂盒说明书操作步骤检测血清中IL-8、TNF-α、IFN-γ表达水平。
1.8 肾组织匀浆中丙二醛、过氧化氢酶、谷胱甘肽过氧化物酶和超氧化物歧化酶含量检测
按照ELISA试剂盒说明书测定肾组织丙二醛(Malondialdehyde,MDA),过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)和超氧化物歧化酶(superoxide dismutase,SOD)的含量,具体步骤按试剂盒说明书进行。
1.9 统计学方法
应用SPSS12.0统计软件处理数据,计量资料以均数±标准差(±s)表示,组间均数比较采用单因素方差分析,计数资料采用频数描述。计量资料组间比较采用方差分析,对等级资料使用非秩和检验(Kruskal-WallisH检验)进行组间分析,两两比较则采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 Thy预处理减轻肾缺血再灌注损伤
与Sham组比较,IRI组Cr和BUN表达增高(χ2=4.34和4.56,P=0.047和 0.045)。而 Thy组与IRI组比较,Cr和 BUN 均降低(χ2=4.17、4.88、5.25、5.56、6.16、6.54 和 5.72,P=0.048、0.041、0.036、0.029、0.013、0.025、0.011 和 0.021)。结果提示Thy预处理可以呈浓度依赖性减轻肾缺血再灌注损伤,在0~40 mg/kg范围内,Thy其最佳浓度为40 mg/kg。见表2。
2.2 Thy预处理可以减轻肾组织结构的改变
与Sham组比较,IRI组肾小管明显扩张,大量肾小管细胞肿胀,空泡变性,坏死,刷状缘脱落以及肾间质炎症细胞大量浸润,其损伤评分为(4.5±1.0)分,而Sham组为(1.0±0.5)分,这提示肾脏损伤增加(χ2=11.34,P=0.004)。而 Thy 40 mg/kg组与 IRI组比较,肾小管扩张,细胞肿胀,空泡变性,坏死,刷状缘脱落,以及肾间质炎症细胞浸润均明显减少,其损伤评分为(1.5±0.5)分,这提示Thy组肾脏损伤明显减轻(χ2=5.34,P=0.032)。结果显示,Thy 40 mg/kg预处理能明显减轻肾脏病理结构改变。见图1。
2.3 Thy预处理抑制JAK2/STAT3/P53信号通路激活
与 Sham 组比较,IRI组 P-JAK2,P-STAT3,P53和 P21表达增高(χ2=4.74、4.79、5.18和 7.83,P=0.045、0.047、0.038和 0.007),但 JAK2和 STAT3表达差异无统计学意义(χ2=3.76和3.12,P=0.063和0.085)。与 IRI组比较,Thy 40 mg/kg 组 P-JAK2,P-STAT3,P53和 P21 表达降低(χ2=4.66、4.96、5.11和 8.87,P=0.044、0.039、0.27 和 0.006),而 JAK2 和STAT3表达差异无统计学意义(χ2=3.55和3.86,P=0.076和0.057)。这提示Thy 40 mg/kg预处理可以抑制JAK2/STAT3/P53信号通路激活。见图2、表3。
表2 百里醌对C r和BU N的影响 (n=10,μmol/L,±s)
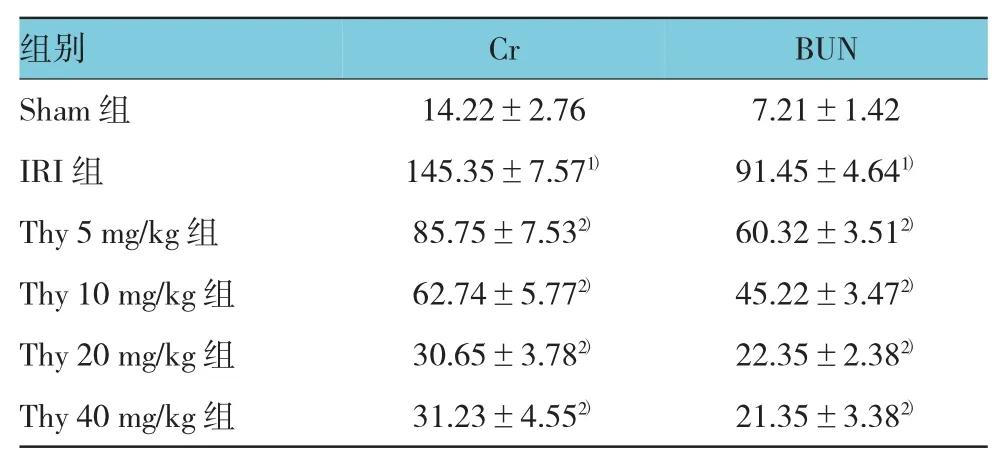
表2 百里醌对C r和BU N的影响 (n=10,μmol/L,±s)
注:1)与 Sham 组比较,P <0.05;2)与 IRI组比较,P <0.05
组别BUN Sham组 14.22±2.76 7.21±1.42 IRI组 145.35±7.571) 91.45±4.641)Thy 5 mg/kg组 85.75±7.532) 60.32±3.512)Thy 10 mg/kg组 62.74±5.772) 45.22±3.472)Thy 20 mg/kg组 30.65±3.782) 22.35±2.382)Thy 40 mg/kg组 31.23±4.552) 21.35±3.382)Cr
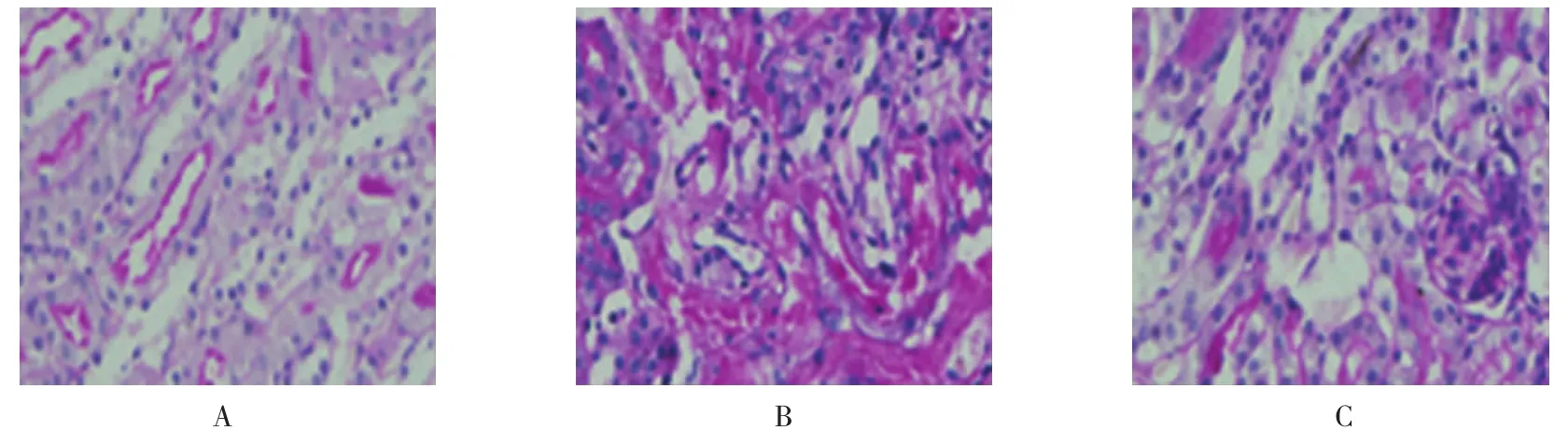
图1 Thy预处理对肾组织病理结构的影响 (PAS染色×400)
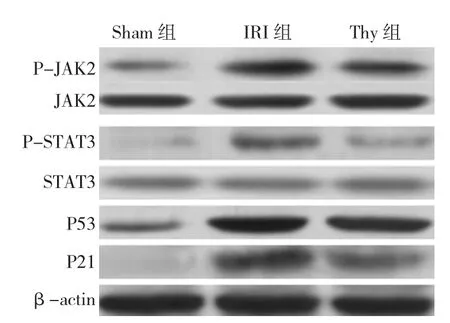
图2 Thy 预处理对 P-JAK2、P-STAT3、JAK2、STATA3、P53和P21蛋白表达的影响
表3 Thy 对 P-JAK2、P-STAT3、JAK2、STATA3、P53 和P21蛋白表达的影响 (n=10,±s)
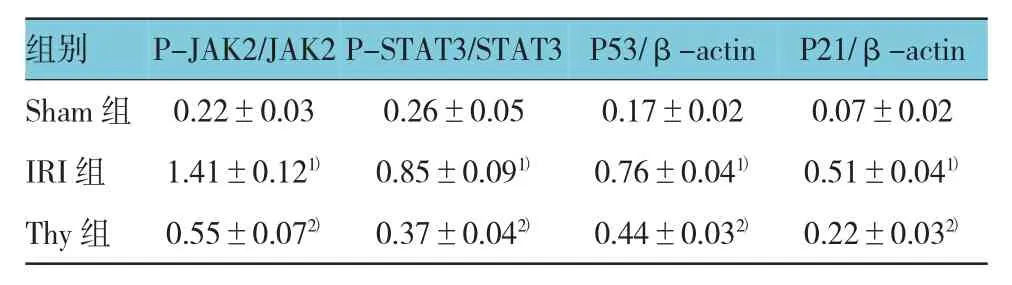
表3 Thy 对 P-JAK2、P-STAT3、JAK2、STATA3、P53 和P21蛋白表达的影响 (n=10,±s)
注:1)与 Sham组比较,P <0.05;2)与 IRI组比较,P <0.05
组别P-JAK2/JAK2P-STAT3/STAT3P53/β-actin P21/β-actin Sham 组 0.22±0.03 0.26±0.05 0.17±0.02 0.07±0.02 IRI组 1.41±0.121) 0.85±0.091) 0.76±0.041) 0.51±0.041)Thy组 0.55±0.072) 0.37±0.042) 0.44±0.032) 0.22±0.032)
2.4 Thy预处理可以减少促炎症细胞因子TN F-α、I FN-γ和I L-8的表达
与Sham组比较,IRI组促炎症细胞因子TNF-α、IFN-γ 和 IL-8 mRNA表达水平增高(χ2=4.58、4.76 和 4.91,P=0.045、0.043 和 0.041),而Thy 40 mg/kg组与IRI组比较,促炎症细胞因子TNF-α,IFN-γ 和 IL-8 mRNA表达水平降低(χ2=4.66、4.74 和 5.03,P=0.044、0.042 和 P=0.038),见表4。
2.5 Thy预处理减少促炎症细胞因子TN F-α、I FN-γ和I L-8的分泌
与Sham组比较,IRI组促炎症细胞因子TNF-α、IFN-γ 和 IL-8分泌水平增高(χ2=5.73、4.82和5.04,P=0.028、0.043 和 0.039),而 Thy 40 mg/kg组与IRI组比较,促炎症细胞因子TNF-α、IFN-γ和IL-8分泌水平降低(χ2=5.23、5.82和 5.94,P=0.036、0.028 和 0.024),见表 5。
2.6 Thy预处理减少M D A表达
Sham 组 MDA 含量为(100±20)pg/ml,IRI组MDA 含量为(2 200±300)pg/ml,Thy组 MDA 含量为(600±150)pg/ml。与 Sham 组比较,IRI组 MDA 含量增高(χ2=15.82,P=0.001),而 Thy 40 mg/kg组与IRI组比较,MDA含量明显降低(χ2=4.62,P=0.047)。
2.7 Thy预处理增加C AT、G Px和SO D的含量
与Sham组比较,IRI组CAT、GPx和SOD表达降低 (χ2=10.73、9.82 和 11.04,P=0.006、0.008 和0.004),而 Thy 40 mg/kg组与 IRI组比较,CAT、GPx和 SOD 的表达增高(χ2=4.99、5.82和 5.36,P=0.035、0.025 和 0.037),见表 6。
表4 Thy对TN F-α、I FN-γ和I L-8 mR N A表达水平的影响(n=10,±s)
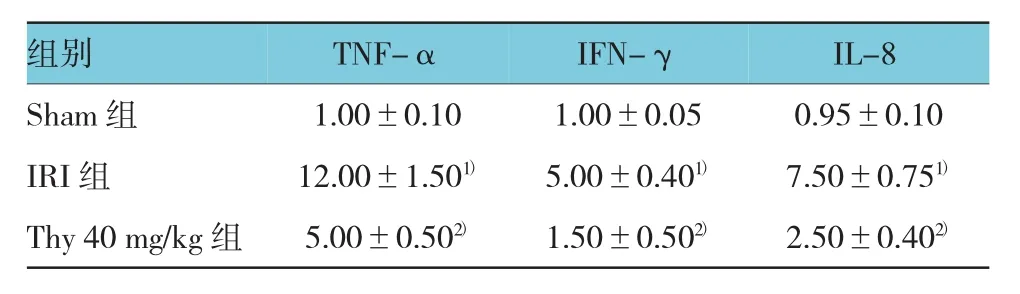
表4 Thy对TN F-α、I FN-γ和I L-8 mR N A表达水平的影响(n=10,±s)
注:1)与 Sham 组比较,P <0.05;2)与 IRI组比较,P <0.05
组别IL-8 Sham组 0.95±0.10 IRI组 7.50±0.751)Thy 40 mg/kg 组 2.50±0.402)IFN-γ 1.00±0.10 1.00±0.05 12.00±1.501) 5.00±0.401)5.00±0.502) 1.50±0.502)TNF-α
表5 Thy对TN F-α,I FN-γ和I L-8分泌水平的影响(n=10,pg/ml,±s)

表5 Thy对TN F-α,I FN-γ和I L-8分泌水平的影响(n=10,pg/ml,±s)
注:1)与 Sham组比较,P <0.05;2)与 IRI组比较,P <0.05
组别IL-8 Sham组 100±20 IRI组 750±501)Thy 40 mg/kg 组 350±402)IFN-γ 100±10 120±20 1200±2001) 550±501)400±1502) 200±302)TNF-α
表6 Thy对C AT,G Px和SO D的表达影响(n=10,pg/ml,±s)
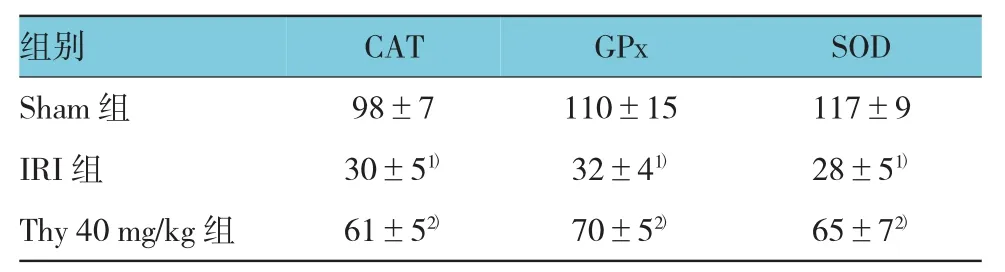
表6 Thy对C AT,G Px和SO D的表达影响(n=10,pg/ml,±s)
注:1)与 Sham组比较,P <0.05;2)与 IRI组比较,P <0.05
组别SO Sham组 117 IRI组 28±GPx 98±7 110±15 30±51) 32±41)2) 2)CAT D±9 51)Thy 40 mg/kg组 65±72)61±570±5
3 讨论
目前,急性肾损伤乃至急性肾功能衰竭在临床上的发生率很高,其预后也差。作为急性肾损伤常见原因的肾缺血再灌注损伤的治疗,目前也越来越成为关注的热点。既往研究表明,缺血再灌注损伤的发病机制包括钙离子超载,炎症反应,细胞凋亡和氧自由基增加[1-2]。肾脏缺血再灌注损伤可通过多条信号途径如JAK2/STAT3,PI3K/AKT等对肾脏损伤进行调节[3-4]。近来,P65信号蛋白也成为肾脏缺血再灌注损伤致病机制的研究热点[10]。
既往研究发现,Thy对脑,肝脏,肠道等器官缺血再灌注损伤具有明显的保护作用,还可增加GPx,MDA以及IL-6等细胞因子水平,在一定程度上是通过抑制氧化应激以及炎症反应诱发的损伤而下调器官损害用[6-9]。多种研究提示,Thy可与多种信号传导分子相互影响,对MAPK、Ras、PI3K/AKT等多条胞内信号途径产生作用,调控机体功能[4-5]。
有研究显示,JAK2/STAT3信号途径的激活对细胞增殖、炎症、凋亡、氧化应激乃至存活起着重要作用[11]。本实验主要在活体大鼠研究Thy预处理对大鼠肾脏缺血再灌注损伤的作用,并研究Thy对JAK2/STAT3-P65在肾脏再灌注损伤过程中的作用,结果显示,Thy在一定程度上对JAK2及STAT3的激活具有抑制作用,以及可减小JAK2/STATA3的靶向分子P21的表达,表明Thy对JAK2/STAT3信号通路的激活具有抑制效应。此外,P65蛋白是JAK2/STATA3信号通路的下游分子[11],其对氧化应激以及炎症反应都具有调控作用,可调节如MDA、SOD、IL-6、TNF-α以及趋化因子的表达[12]。但对肾脏P65信号蛋白的表达是否具有调节作用,目前尚不清楚。本实验结果显示,Thy预处理可明显减少促炎症细胞因子TNF-α、IL-8和IFN-γ以及促氧化应激产物MDA表达,但可加抗氧化应激产物CAT、GPx和SOD的表达,其调节机制可能与抑制缺血诱发的JAK2/STAT3信号通路激活,从而抑制P65信号蛋白的活化,进而抑制氧化应激和炎症反应,从而起到了肾脏保护作用,但其具体作用机制尚需进一步研究。
本实验证实,Thy能减少氧化应激反应和炎症细胞因子的产生,其作用机制可能是通过抑制JAK2/STAT3-P65信号通路,从而对肾脏缺血再灌注损伤具有保护作用。但是,在动物体内,Thy调节相关信号通路的具体机制极其复杂,对于肾脏损伤后JAK2/STAT3-P65信号通路的变化以及肾脏缺血再灌注损伤确切的作用机制仍需进一步深入研究。
[1]GLODOWSKI S D,WAGENER G.New insights into the mechanisms of acute kidney injury in the intensive care unit[J].J Clin Anesth,2015,27(2):175-180.
[2]JANG H R,RABB H.Immune cells in experimental acute kidney injury[J].Nat Rev Nephrol,2015,11(2):88-101.
[3]CHATAURET N,BADET L,BARROU B,et al.Ischemia-reperfusion:From cell biology to acute kidney injury[J].Prog Urol,2014,24 Suppl 1:S4-12.
[4]DARAKHSHAN S,POUR A B,COLAGAR A H,et al.Thymoquinone and its therapeutic potentials[J].Pharmacol Res,2015,95/96:138-158.
[5]AHMAD A,HUSAIN A,MUJEEB M,et al.A review on therapeutic potential of Nigella sativa:A miracle herb[J].Asian Pac J Trop Biomed.2013,3(5):337-352.
[6]SILACHEV D N,PLOTNIKOV E Y,ZOROVA L D,et al.Neuroprotective effects of mitochondria-targeted plastoquinone and thymoquinone in a rat model of brain ischemia/reperfusion injury[J].Molecules,2015,20(8):14487-14503.
[7]ABD EL-GHANY R M,SHARAF N M,KASSEM L A,et al.Thymoquinone triggersanti-apoptotic signaling targeting death ligand and apoptotic regulators in a model of hepatic ischemia reperfusion injury[J].Drug Discov Ther,2009,3(6):296-306.
[8]EL-ABHAR H S,ABDALLAH D M,SALEH S.Gastroprotective activity of Nigella sativa oil and its constituent,thymoquinone,against gastric mucosal injury induced by ischaemia/reperfusion in rats[J].J Ethnopharmacol,2003,84(2/3):251-258.
[9]LV J,FENG M,ZHANG L,et al.Protective effect of epigallocatechin gallate,a major constituent of green tea,against renalischemia-reperfusion injury in rats[J].Int Urol Nephrol.2015,47(8):1429-1435.
[10]WANG L,LIU X H,CHEN H,et al.Picroside II protects rat kidney against ischemia/reperfusion-induced oxidative stress and inflammation by the TLR4/NF-κB pathway[J].Exp Ther Med,2015,9(4):1253-1258.
[11]LV J,WANG X,LIU S Y,et al.Protective effect of Fenofibrate in renal ischemia reperfusion injury:Involved in suppressing kinase 2(JAK2)/transcription 3(STAT3)/p53 signaling activation[J].Pathol Biol(Paris),2015,63(6):236-242.
[12]YAO H,YANG S R,KODE A,et al.Redox regulation of lung inflammation:role of NADPH oxidase and NF-kappaB signalling[J].Biochem Soc Trans,2007,35(Pt 5):1151-1155.
(张蕾 编辑)
Influence of Thymoquinone pretreatment on renal ischemiareperfusion injury in rats
Xiao-hong Song,Cheng-xu Li,Yang Wu,Yuan Cai,Jun-wu Dong
(Department of Nephrology,Puai Hospital of Tongji Medical College,Huazhong University of Science and Technology,Wuhan,Hubei 430034,China)
ObjectiveTo explore the influence of Thymoquinone(Thy)on kidney ischemia-reperfusion injury(IRI)and the mechanism.MethodsSixty male Sprague-Dawley rats were randomly divided into sham operation(sham)group,IRI group and IR plus different concentration of Thy preconditioning groups.Thy groups were preconditioned with Thy(5,10,20 and 40 mg/kg)by intraperitoneal injection at 45 min prior to operation,and the other 2 groups were pretreated by equal volume of saline.The rats in the IRI and Thy groups were kept in 37℃infant incubators for 45 min after their left renal pedicles were clamped with noninvasive endoclips,and then their right kidneys were removed.The rats in the sham group underwent the same process,except for clamping the left renal pedicles.After 24-h reperfusion,blood samples and renal tissues were collected.The pathological changes of kidney tissues were observed using PAS staining.The expression levels of serum creatinine(Cr),urea nitrogen(BUN),IL-8,IFN-γ,TNF-α,MDA,CAT,GPX and SOD were measured by ELISA.The expression of JAK2,STAT3,p-JAK2,p-STAT3,p53 and p21 were measured by Western blot.Moreover,the mRNA levels of IL-8,IFN-γ and TNF-αwere examined by RT-PCR.ResultsIRI markedly enhanced renal pathological changes and the expressions of BUN,Cr,p-JAK2,p-STAT3,p53,p21,MDA,IL-8,IFN-γ and TNF-α,meanwhile reduced the expressions of CAT,GPX and SOD.Thymoquinone pretreatment significantly decreased renal pathological changes and the expressions ofBUN,Cr,p-JAK2,p-STAT3,p53,p21,MDA,IL-8,IFN-γ and TNF-α,at the same time up-regulated the expressions of CAT,GPX and SOD.There was no significant difference in the expression of JAK2 or STAT3 among the three groups.ConclusionsThymoquinone pretreatment can alleviate kidney ischemia-reperfusion injury in rats partly by inhibiting inflammation and oxidative stress mediated by JAK2/STAT3/p53 signaling pathway.
Thymoquinone;renal ischemia-reperfusion injury;inflammation;oxidative stress;JAK2/STAT3/p53
R-332
A
10.3969/j.issn.1005-8982.2017.13.004
1005-8982(2017)13-0019-05
2016-12-05
