反相高效液相色谱法测定花生中的β-谷甾醇
2017-09-16张志舟蔡大川郑家概王和平许泽群丁少曼蔡群娣梁柳咏
张志舟,蔡大川,郑家概,张 飞,王和平,许泽群,丁少曼,陈 轶,蔡群娣,梁柳咏
(中国广州分析测试中心 广东省化学危害应急检测技术重点实验室,广东 广州 510070)
反相高效液相色谱法测定花生中的β-谷甾醇
张志舟,蔡大川,郑家概,张 飞,王和平,许泽群,丁少曼,陈 轶,蔡群娣,梁柳咏
(中国广州分析测试中心 广东省化学危害应急检测技术重点实验室,广东 广州 510070)
建立了测定花生中β-谷甾醇的反相高效液相色谱法。样品经过氢氧化钾—乙醇皂化提取后,采用高效液相色谱法进行含量测定。色谱条件为:C18柱(4.6 mm×250 mm,5μm);流动相为乙腈/异丙醇=50/50;流速1.0 mL/min;紫外检测器:波长210 nm;进样量10μL,外标法定量。结果表明:β-谷甾醇在5.0~250 mg/L范围内线性良好,线性相关系数为0.9999,方法回收率为90%~103%,RSD为3.74%,检出限为3.0 mg/kg。本方法准确、重复性好、灵敏度高,可用于花生中β-谷甾醇的含量测定。
β-谷甾醇;花生;高效液相色谱法
花生作为一种主要油料作物,广泛种植于温带和热带地区。我国花生产量居于世界第一,全国各地都可以种植,其中我国50%~60%的花生用于榨油[1]。花生仁营养丰富,含有多种功效成分,主要包括植物甾醇、天然维生素E、蛋白质等,其中植物甾醇中β-谷甾醇含量最高[2]。
β-谷甾醇是以环戊烷全氢菲为骨架的一种类固醇化合物,广泛存在于动植物细胞膜中[3]。研究表明:β-谷甾醇是一种重要的药物原料,具有较为广泛的药理活性,它不仅可以降低胆固醇、抑制肿瘤、抗菌抗炎、调节免疫力等功效,还可以保养皮肤,延缓皮肤角质化[4-9]。此外,β-谷甾醇还广泛用于纺织柔软剂、颜料分散剂和汽油乳化剂等方面。
目前,现行的国家标准方法主要采用气相色谱法检测β-谷甾醇,还没有相关的液相色谱方法[10]。本实验参照β-谷甾醇标准方法的前处理过程,建立了反相高效液相色谱法测定花生中的β-谷甾醇检测方法,为筛选富含β-谷甾醇的花生品种提供方法支持,也为其它坚果中β-谷甾醇的检测提供技术参考。
1 实验部分
1.1 实验仪器
Agilent 1260 高效液相色谱仪-紫外检测器(VWD)(安捷伦科技(中国)有限公司);电热恒温水浴锅(广东环凯微生物科技有限公司);R-210旋转蒸发仪(瑞士BUCHI实验室仪器公司);KQ-2200型超声波清洗仪(昆山市超声仪器有限公司); XFB-200高速中药粉碎机(吉首市中诚制药机械厂);BT125D电子天平(Sartorius);UV-2450紫外分光光度计(岛津企业管理(中国)有限公司)。
1.2 标准与试剂
β-谷甾醇(≥98.0%,北京中科质检生物科技有限公司);氢氧化钾(广州化学试剂厂,分析纯);乙腈(Honeywell色谱纯);异丙醇(天津市富语精细化工有限公司 色谱纯);无水乙醇(广州化学试剂厂,分析纯);正己烷(广州化学试剂厂,分析纯);去离子水;无水硫酸钠(广州化学试剂厂,分析纯)。
1.3 标准溶液配制
准确称取β-谷甾醇对照品0.02553 g于50.0 mL容量瓶中,用无水乙醇溶解定容,作为标准储备液。
1.4 样品前处理
将晒干后的花生样品,去壳,用高速粉碎机粉碎。
样品皂化:准确称取样品约2.0 g于250 mL平底烧瓶中,加入30 mL无水乙醇混合均匀,再加10mL 50%氢氧化钾溶液,置于80℃水浴锅中皂化回流50min,皂化后立即放入冰水浴中冷却。
样品萃取:将上述溶液转移至500 mL分液漏斗中,用60 mL的去离子水分3次清洗平底烧瓶的残留物,洗液一并倒入分液漏斗中,加入50 mL正己烷,震摇萃取3min,静置分层,将下层水相溶液转移到另外一个分液漏斗中,再重复萃取两次,合并上层正己烷。用去离子水洗至中性。
过滤:将洗至中性的正己烷过装有适量无水硫酸钠的滤纸,滤液装在200 mL三角瓶内,用少量正己烷洗涤无水硫酸钠及滤纸合并于滤液。
浓缩定容:将滤液用氮气在30℃旋转蒸发至干,准确加入10 mL甲醇,在超声波清洗器中轻摇超声溶解残留物,摇匀后,溶液过0.45μm滤头,滤液供液相色谱上机测试。
1.5 色谱条件
色谱柱:月旭C18(4.6 mm×250 mm,5 μm);流速:1.0 mL/min;进样量:10 μL;柱温40 ℃;检测波长:波长210 nm,流动相:乙腈/异丙醇=50/50。
2 结果与讨论
2.1 样品前处理方法的选择
目前,关于β-谷甾醇的前处理方法主要有皂化提取法、索氏提取法和超声波提取法[11-12]。 如果样品中β-谷甾醇的来源是人为添加的,则首选索氏提取法和超声波提取法。皂化提取法适用于天然的、油脂含量较高的样品。由于花生中蛋白质、粗脂肪、硬油脂、脂肪酸的含量较高[13],所以本实验选用皂化提取法。花生经过皂化提取后,不仅可以充分提取天然β-谷甾醇,而且还可以除去基质中蛋白质和脂肪酸的干扰。
2.2 色谱条件的优化
2.2.1 检测波长的选择
采用紫外可见分光光度计在190~400 nm范围内对50 mg/L的β-谷甾醇的标准溶液进行光谱扫描,可知β-谷甾醇在紫外区最大吸收波长为210 nm,因此选择210 nm作为检测波长。
2.2.2 流动相的选择
采用高效液相色谱测定β-谷甾醇时,常用流动相体系主要有:乙腈-异丙醇,甲醇-水体系。由于甲醇在210 nm吸收较强,有较大的背景干扰,对基线影响较大,因此,本实验选择乙腈-异丙醇体系。本实验分别考察了乙腈-异丙醇(70∶30)、乙腈-异丙醇(50∶50)和乙腈-异丙醇(30∶70)对β-谷甾醇分离的影响。结果表明流动相为乙腈-异丙醇(50∶50)时,分离度能够到达日常检测需求,色谱峰形较好,出峰时间合适,作为最终流动相。标准色谱图见图1。
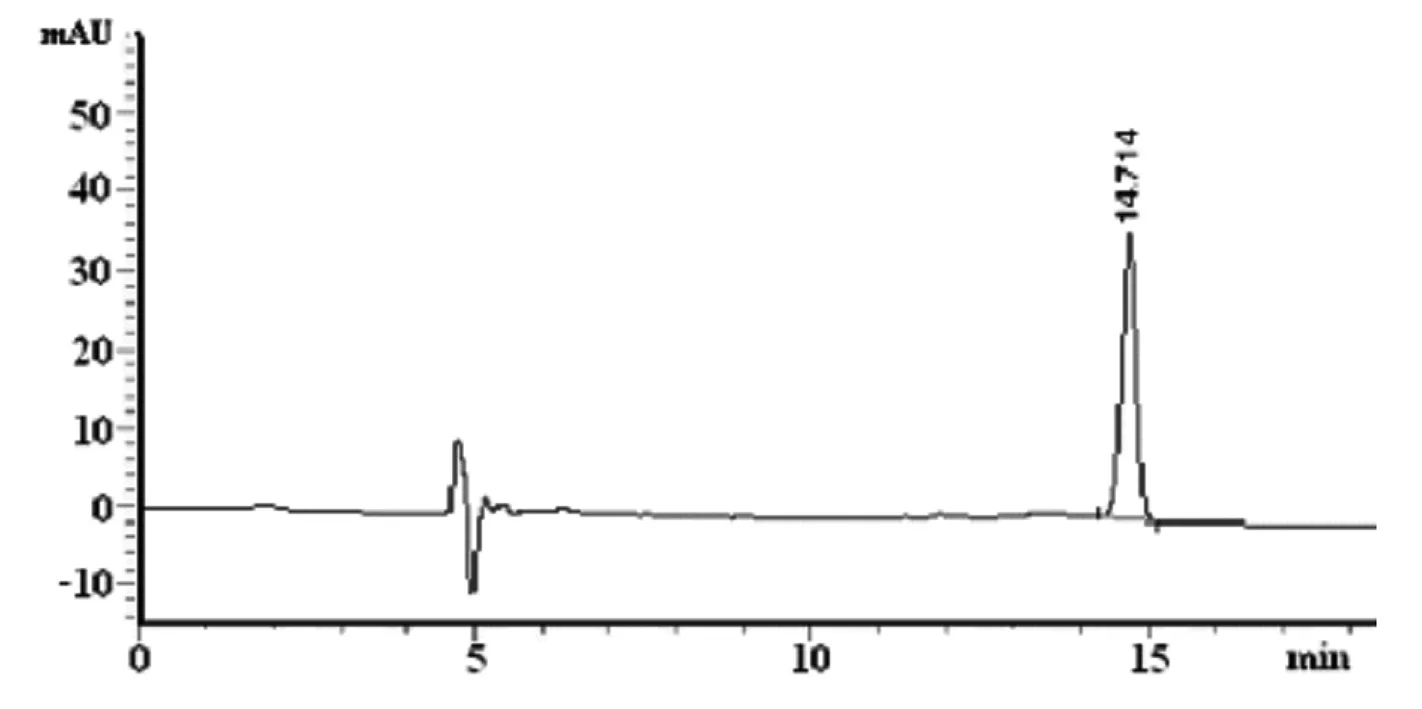
图1 标准溶液的液相色谱图
Fig.1 Chromatogram of standard solution
2.3 花生中β-谷甾醇的测定
花生的前处理过程见“1.4”,制得样品提取液,过滤上机测定,色谱条件同“1.5”,得到的样品色谱图见图2。
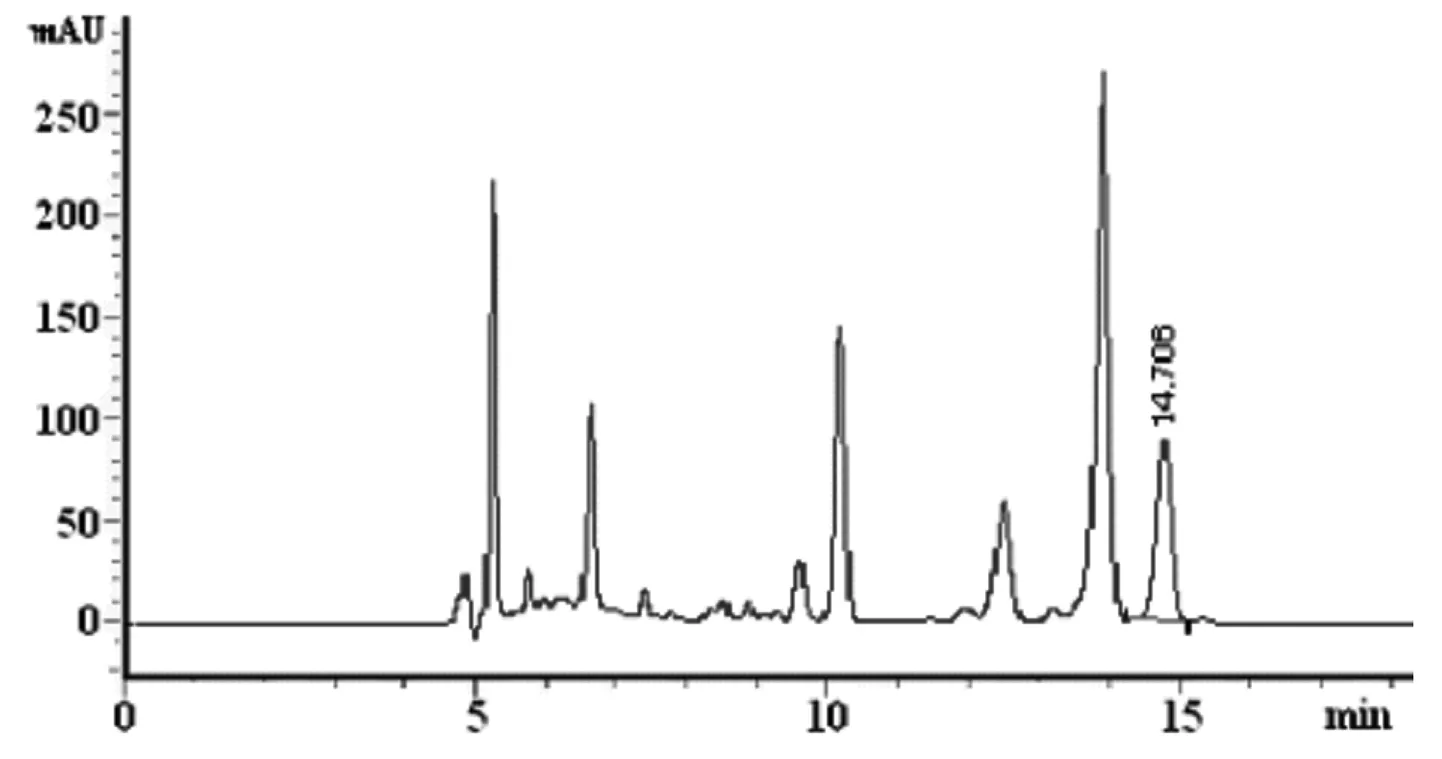
图2 花生样品的液相色谱图Fig.2 Chromatogram of peanut sample
2.4 线性范围
用无水乙醇将β-谷甾醇标准储备液稀释成浓度分别为5.0、10.0、50.0、100.0、250.0mg/L,进行测定,以β-谷甾醇标准系列浓度(X)为横坐标,相应的色谱峰面积为纵坐标(Y),得到的线性方程为Y=21.844X-8.114,R2=0.9999,可知β-谷甾醇在5.0~250.0 mg/L范围内,线性良好。β-谷甾醇的检出限为3.0 mg/kg(信噪比S/N=3)。
2.5 精密度试验
选定浓度为50 mg/L的β-谷甾醇标准工作液,进样量为10 μL,连续进样6次,求得相对标准偏差RSD为2.58%,仪器的精密度良好。
2.6 重复性实验
准确称量花生样品6份,按照“1.4”进行样品前处理,进行测定,求得相对标准偏差(RSD)为3.74 %,方法重复性良好。
2.7 加标回收率
准确称取样品6份,加入β-谷甾醇标准储备液,加标量为50 mg/100 g。按照“1.4”进行处理,采用外标法定量,求得样品加标回收率为90 %~103 %。方法的准确度较好,可满足测定要求。
3 结论
本研究建立了花生中β-谷甾醇的反相高效液相色谱测定方法。该方法适用于花生中β-谷甾醇的提取测定,方法准确性良好,灵敏度高,可为筛选富含β-谷甾醇的花生品种提供方法支持,也可为其它坚果中β-谷甾醇的检测提供技术参考。
[1] 万书波.花生品质学[M].2版.北京:中国农业科学技术出版社,2007.
[2] 张建书,王 强,刘红芝,等.不同地区花生品种VE、植物甾醇组成与含量的分析比较[J]. 食品科学,2012,33(22):191-195.[3] 袁金伟,王 帆,买文鹏,等.β-谷甾醇的结构修饰研究进展[J].河南工业大学学报(自然科 学版),2015,36(2):107-112.
[4] Li W H,Chang S T,Chang S C,et al.Isolation of antibacterial diterpenoids from Cryptomeria japonica bark[J]. Natural Product Research,2008,22(12):1085-1093.
[5] Choi J N, Choi Y H, Lee J M, et al. Anti-inflammatory effects of β-sitosterol-β-D-glucoside from Trachelospermum jasminoides (Apocynaceae) in lipopolysaccharide-stimulated RAW 264.7 murine macrophages[J]. Natural Product Research,2012,26(24):2340-2343.
[6] Liz R, Zanatta L, Dos Reis G O, et al. Acute effect of β-sitosterol on calcium uptake mediates anti-inflammatory effect in murine activated neutrophils[J]. Journal of Pharmacy and Pharmacology, 2013, 65(1):115-122.
[7] Yuk J E, Woo J S, Yun C Y, et al. Effects of lactose-β-sitosterol and β-sitosterol on ovalbumin-induced lung inflammation in actively sensitized mice[J].International Immunopharmacology, 2007, 7(12):1517-1527.
[8] Li R, Jia C S, Yue L, et al. Lipase-catalyzed synthesis of conjugated linoleyl β-sitosterol and its cholesterol-lowering properties in mice[J].Journal of agricultural and food chemistry,2010, 58(3): 1898-1902.
[9] Rosenblat M, Volkova N, Aviram M. Pomegranate phytosterol (β-sitosterol) and polyphenolic antioxidant (punicalagin) addition to statin, significantly protected against macrophage foam cells formation[J]. Atherosclerosis, 2013, 226(1): 110-117.
[10] 全国粮油标准化技术委员会.GB/T 25223-2010 动植物油脂 甾醇组成和甾醇总量的测定 气相色谱法[S].北京:中国标准出版社,2011.
[11] 王多娇,周玮颜,春荣徐,等. 油脂中胆固醇及植物甾醇组成及含量分析[J].中国油脂,2016,41(2):106-109.
[12] 魏玉海,王慧春,刘亚蓉,等.藏药材珠芽蓼中β-谷甾醇含量的超高液相色谱- 蒸发光散 射检测法测定[J].时珍国医国药,2012,23(2):495-497.
[13] 殷冬梅,张幸果,王 允,等.花生主要品质性状的主成分分析与综合评价[J].植物遗传资源学报, 2011,12(4):507-512,518.
(本文文献格式:张志舟,蔡大川,郑家概,等.反相高效液相色谱法测定花生中的β-谷甾醇[J].山东化工,2017,46(5):80-82.)
Determination of β-sitosterol in Peanut by Reversed-Phase High Performance Liquid Chromato Graphy
ZhangZhizhou,CaiDachuan,ZhengJiagai,ZhangFei,WangHeping,XuZequn,DingShaoman,ChenYi,CaiQundi,LiangLiuyong
(Guangdong Provincial Key Laboratory of Emergency Test for Dangerous Chemicals, China National Analytical Center(Guangzhou),Guangzhou 510070,China)
A new method for determination of β-sitosterol in peanut by reversed-phase high performance liquid chromatography.Peanuts were analyzed by high performance liquid chromatography after saponification with KOH- ethanol solution.The separation of β-sitosterol was conducted on a C18column (4.6 mm×250 mm,5μm ) with the mobile phase of acetonitrile and isopropanol(50/50).The flow rate was 1.0 mL/min and injection volume was 10μL. The detection wavelength was 210 nm and quantified by the external standard method.The linearity were obtained in the range of 5.0~250 mg/L with correlation coefficients 0.9999.The average recoveries of samples was in the range of 90%-103% and RSD was 3.74%. The determination of limit was 3.0mg/kg. The results indicate that the method is accurate 、reliable and reproducibility in the analysis of peanut.
β-sitosterol;peanut;high-performance liquid chromatography (HPLC)
2016-01-12
张志舟(1988—),男,广东肇庆人,本科,助理工程师。
O657.7
A
1008-021X(2017)05-0080-03
