基于DISLab定量探究浓度对水解平衡的影响
——以一定物质的量浓度明矾溶液水解平衡为例
2017-09-16赵国斌
赵国斌
(炳辉中学安徽天长239300)
基于DISLab定量探究浓度对水解平衡的影响
——以一定物质的量浓度明矾溶液水解平衡为例
赵国斌
(炳辉中学安徽天长239300)
通过DISLab定量探究加水稀释降低盐溶液浓度或滴加高浓度盐溶液增加盐溶液浓度,两种情况下盐类水解率增大还是减小问题,来判断盐类水解平衡移动方向。文章旨在通过定量实证的“可视性”来突破课堂教学的重难点。
数字化实验技术;定量探究;水解平衡;水解率
在盐类水解平衡教学过程中,加水稀释降低盐溶液浓度或滴加高浓度盐溶液增加盐溶液浓度,两种情况下的水解平衡是正向移动还是逆向移动?盐的水解率是增大还是减小?对该问题的澄清既是教学的难点又是重点。用传统数学分析或口授讲解教学方式,没有定量实验的“可视性”,学生很难完全信服。使用数字化实验可以解决这一重难点,学生从定量实验中体验宏观、微观、符号、图像在学习化学反应原理中的积极作用。
一、实验仪器和试剂
1.仪器:采用朗威®数字化信息系统实验室DISLab配备(pH传感器1个,数据采集器1台),装有DISLab实验软件8.0版的笔记本电脑1台,朗威®DISLab 250mL稀释池1只(实用新型专利:201320572799.2,图2),生化传感器支架1套,磁力搅拌器1台(附磁转子1个),10mL刻度吸管1根,200mL烧杯1只,1mL刻度吸管1根、洗耳球1个、100mL量筒1只等。
2.试剂:0.01mol/L KAl(SO4)2溶液,0.1mol/L KAl(SO4)2溶液,蒸馏水。

图1 注入式添加试剂实验装置

图2250 mL稀释池
二、实验原理
以一定浓度明矾溶液为例,存在水解平衡:Al3++ 3H2O■■■■Al(OH)3+3H+
1.在V1mL 0.01mol/L KAl(SO4)2溶液中滴加V2mL蒸馏水,Al3+水解率H%公式表达式推导如下:
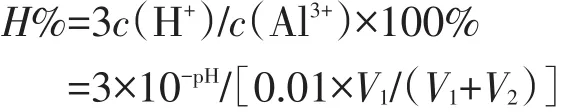
2.在V1mL0.01mol/L KAl(SO4)2溶液中滴入V2mL 0.1mol/L KAl(SO4)2溶液,Al3+水解率H%公式表达式推导如下:

通过朗威®DISLab实验通用软件中的计算表格功能计算KAl(SO4)2溶液水解率H%,计算机[绘图]得到VmL溶液(V近似为V1与V2之和)滴加过程中盐类水解率H%变化曲线(H%-V),从图像上可“直观地看出”试剂滴加过程中,盐类水解率是增大还是减小,以此确定水解平衡移动方向。
三、实验步骤
1.【实验一】探究明矾溶液稀释过程中Al3+水解率变化情况
(1)实验步骤
如图1组建好实验装置。在数据采集器第二通道连接pH传感器(软件显示数据为pH2)。
在250mL稀释池中放入磁转子并加入40mL 0.01mol/L KAl(SO4)2溶液,将稀释池放置在磁力搅拌器上,在KAl(SO4)2溶液中插入pH传感器电极并保持电极玻璃泡位于液面以下。
打开DISLab实验通用软件。在[计算表格]窗口设置变量V1为0.01mol/L KAl(SO4)2溶液体积,数值为40mL;设置变量V2为加入蒸馏水体积;设置自定义公式V为加入蒸馏水后KAl(SO4)2溶液体积,公式表达式输入V1+V2;设置自定义公式代码为H%,公式表达式输入:(3*10^(-pH2))/(0.01*V1/(V1+V2))。
打开磁力搅拌器对溶液进行搅拌,选用10mL刻度吸管取10mL蒸馏水注入稀释池中,待pH数据稳定后,手动点击记录实验数据并输入V2数值(10mL),再次注入10mL蒸馏水,重复实验操作,系统自动采集pH数据(图3)并对数据进行计算。当所有实验数据采集结束后,对实验数据进行[绘图],可得pH随溶液体积V变化曲线(pH-V,图4)和Al3+水解率H%随溶液体积V变化曲线(H%-V,图5)。
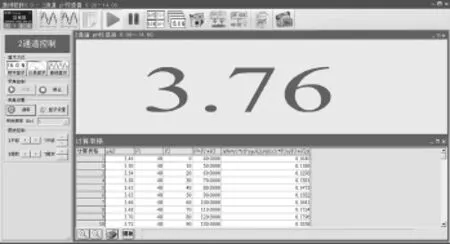
图3 明矾溶液稀释过程中实验数据
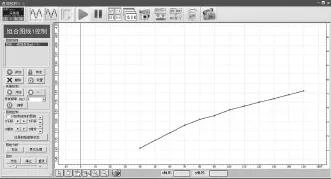
图4 溶液pH值随明矾溶液总体积V变化
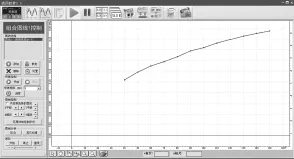
图5 Al3+水解率H%随明矾溶液总体积V变化
(2)实验数据图及结论
从实验数据图可看出:加水稀释来降低明矾溶液浓度过程中,明矾溶液pH和水解率数值都增大。
结论:向明矾溶液中加水降低溶液浓度,Al3+的水解程度增大,说明明矾溶液水解平衡向正方向移动。
分析:一定浓度明矾溶液存在水解平衡:Al3++ 3H2O■■■■Al(OH)3+3H+。根据勒夏特列原理,如果改变影响平衡的一个条件(如浓度、温度、压强等),平衡就向减弱这种改变的方向移动。也就是说,如果增加了溶液的浓度,会抑制水解;相反,减少溶液的浓度,会促进水解。或者用一句话“越稀越水解”概括。这就得出“加水稀释过程,明矾溶液水解平衡一定向正方向移动,而且水解率一定递增”定性结论。
这个定性解释,学生理解起来较困难,很难接受。若辅助运用DISLab,上述实验简单定量验证了盐类水解平衡体系中一条“越稀越水解”规律。学生理解起来就简单的多,很易接受!
2.【实验二】探究明矾溶液浓度增加过程中水解率变化情况
(1)实验步骤
在250mL稀释池中放入磁转子并加入40mL 0.1mol/L KAl(SO4)2溶液,将稀释池放置在磁力搅拌器上,在KAl(SO4)2溶液中插入pH传感器电极并保持电极玻璃泡位于液面以下。
在[计算表格]窗口设置变量V1为0.01mol/L KAl(SO4)2溶液体积,数值为40mL;设置变量V2为加入0.1mol/L KAl(SO4)2溶液体积;设置自定义公式V为加入0.1mol/L KAl(SO4)2溶液后混合溶液体积,公式表达式输入V1+V2;设置自定义公式代码为H%,公式表达式输入:(3*10^(-pH2))/((0.01*V1+0.1*V2)/(V1+V2))。
打开磁力搅拌器对溶液进行搅拌,选用1mL刻度吸管取1mL 0.1mol/L KAl(SO4)2溶液注入稀释池中,待pH数据稳定后,手动点击记录实验数据并输入V2数值(1mL),再次注入1mL 0.1mol/L KAl(SO4)2溶液,重复实验操作,系统自动采集pH数据(图6)并对数据进行计算。当所有实验数据采集结束后,对实验数据进行[绘图],可得pH随溶液体积V变化曲线(pH-V,图7)和Al3+水解率H%随溶液体积V变化曲线(H%-V,图8)。
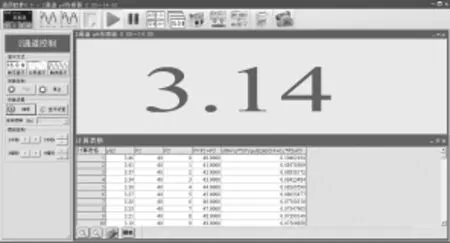
图6 明矾溶液浓度增加过程实验数据
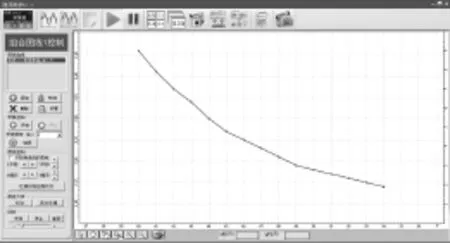
图7 溶液pH值随明矾溶液总体积V变化
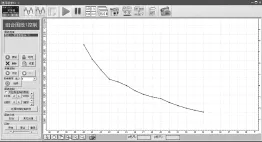
图8 Al3+水解率H%随明矾溶液总体积V变化
(2)实验数据图及结论
从实验数据图可看出:加入高浓度明矾溶液来增加明矾浓度过程中,明矾溶液pH和水解率都减小。
结论:向明矾溶液中加高浓度明矾溶液来增加明矾浓度,水解平衡正向移动,但Al3+的水解程度减小。
分析:根据勒夏特列原理的描述:当平衡因改变外界条件而被破坏,平衡会向减弱这个改变的方向移动,但只能“减弱”不能“消除”。增加反应物浓度,平衡正向移动,只能“减弱”反应物“增多这个改变”,但不能“消除”增加反应物浓度的影响。
用计算的方法证明也是这样,Al3+的水解平衡Al3++ 3H2O■■■■Al(OH)3+3H+,其水解平衡常数表达式为:K= c3(H+)/c(Al3+),水解率表达式为:H%=3c(H+)/c(Al3+),运用K与c(Al3+)来表示水解率为:H%=3K1/3/c2/3(Al3+),其中温度不变,K不变。当增大c(Al3+),会导致c2/3(Al3+)增大,H%值减小。
这就得出盐类水解平衡普通规律:增大盐的浓度,水解将向正方向移动,即水解的绝对程度增大,但水解相对程度反而减小了。
实验二的结论与上述定性分析完全一致。DISLab给出了简单定量实验验证,让人信服!
四、数字实验再探究收获与反思
(1)利用数字化实验有效地解决了《化学反应原理》课堂教学中一个重难点,完成了传统实验无法胜任的工作,数字化实验走进中学化学课堂,对抽象原理的“可视化”带来了定量实证,说服力强,可信度高,学生终生难忘,教学效果明显。
(2)传统教学采用口授定性讲解,学生难以理解,更难以应用相关知识来解决问题。数字化实验将定性实验与定量实验相结合实证,将宏观、微观与变化的曲线相结合,直观明了,可信度强,学生更容易接受。
(3)学生体验到“宏观、微观、符号、图像”四重表征在学习化学反应原理中积极作用,特别是曲线图像表征,在学生脑海中有一种动态的过程美感。
(4)选取明矾溶液作为研究对象,是因为明矾有天然纯净的晶体,其稀溶液为无色透明液体,便于准确配制一定物质的量浓度溶液。用i2000型电子秤(最大量程500g,精确度0.01g)替代中学实验室托盘天平,使明矾药品的称量更为精确。
(5)经过多次实验,所得实验图像与结论经得起重复性验证,该实验为简单高效可操作性实验,可引入中学课堂学生分组探究实验。
结语:随着数字实验在中学课堂教学中开展,其定量思维意识必将培养学生“求真”探究的学习品质,必将潜移默化培养学生终生科学素养。
[1]人民教育出版社课程教材研究所,化学课程教材研究开发中心.化学反应原理[M].北京:人民教育出版社,2007: 54-60
1008-0546(2017)09-0091-03
G633.8
B
10.3969/j.issn.1008-0546.2017.09.031
*本文系滁州市级课题《基于高中化学课堂教学“问题链”设计的研究与实践》(CJG16072)实验研究材料之一。
