家蝇β-葡萄糖苷酶基因的克隆及重组表达
2017-09-16吴建伟修江帆尚小丽
张 姝, 胡 蓉,黄 健*, 吴建伟*,国 果,付 萍,修江帆,尚小丽
(1.贵州医科大学临床基础检验学教研室,贵阳 550004;2.贵州医科大学人体寄生虫学教研室 贵阳 550004)
家蝇β-葡萄糖苷酶基因的克隆及重组表达
张 姝1, 胡 蓉2,黄 健1*, 吴建伟2*,国 果2,付 萍2,修江帆2,尚小丽2
(1.贵州医科大学临床基础检验学教研室,贵阳 550004;2.贵州医科大学人体寄生虫学教研室 贵阳 550004)
克隆家蝇内源性β-葡萄糖苷酶(beta-glucosidase,BG)基因并建立原核表达体系,检测其表达产物的活性,了解家蝇内源性BG酶特点,为进一步解释家蝇极强环境适应能力和发现新的种群控制措施提供分子生物学基础。以草地贪夜蛾等结构信息相对完整且研究较为透彻的6种代表性昆虫的BG酶基因序列为参照对象,利用同源克隆结合RACE-PCR的方法,从家蝇cDNA中克隆得到BG酶基因的全长cDNA序列并对其进行生物信息学分析。分别采用原核表达载体pET-28a(+)构建原核表达体系并在大肠杆菌E.coliBL21(DE3) 中诱导表达BG酶基因的融合蛋白。采用七叶苷平板显色法和DNS法检测表达体系融合蛋白的酶活性,并对其性质进行初步的分析。家蝇体内克隆得到了长度为1933 bp的家蝇BG酶基因全长cDNA序列,推导其为562个氨基酸残基组成的蛋白多肽。重组原核质粒经诱导表达后,在65 kDa附近均出现特异性蛋白条带,证实重组质粒成功表达。重组表达的家蝇BG酶兼具内切β-1,4-葡聚糖酶、外切β-1,4-葡聚糖酶和BG的酶活性。家蝇BG酶是一种新的多功能纤维素酶,是昆虫纤维素酶研究的重要补充。
家蝇;β-葡萄糖苷酶;克隆; 异源性表达; 酶活性
家蝇Muscadomestica,蝇科、家蝇属,属于双翅目,繁殖力极强,是生态环境中的分解者(Shahetal. , 2016;Sacktonetal. , 2017)。观察家蝇在不同生理状态下对食物中纤维素利用情况的研究中,课题组发现饲养家蝇后的饲料比饲养前的质地松软,饲养后的饲料中粗纤维含量较饲养前显著降低,且发现家蝇能够产生内源性纤维素酶(张姝等,2013;胡蓉等,2016)。但家蝇的纤维素酶的分子结构不清楚,国内外其他研究团队也未有报道。因此,对家蝇内源性纤维素酶的分子结构进行研究,不但为深入阐明家蝇在复杂孳生环境中的生理基础和生态功能提供基础数据,而且有望通过对家蝇纤维素酶基因进行改造分子、沉默或阻断家蝇内源性纤维素酶基因从而达到抑制或干扰家蝇纤维素酶活性,为家蝇生态控制提供一条新的途径。β-葡萄糖苷酶(β-Glucosidase)是纤维素酶重要组成部分,能催化水解芳香基或烃基与糖基原子团之间的糖苷键生成葡萄糖,可以消除纤维二糖对纤维素酶的负反馈作用,在农业副产品的降解、利用过程中发挥着关键作用(张文庆等,2008;Jamesetal. , 2010;Singhetal. , 2016;Seddigh et al. , 2016)。综上所述,本研究以家蝇为供试昆虫,选择纤维素酶体系中限速酶-BG酶为研究标示分子,根据与其亲源关系相近物种的BG酶氨基酸序列的保守片段设计简并引物,对家蝇内源性BG酶进行基因克隆、生物信息学分析、进行原核重组表达及其表达产物的活性检测,了解家蝇纤维素酶系的独特性,为发现新的、有效纤维素酶体系提供基础数据,并为进一步解释家蝇的极强环境适应能力以及新的种群控制措施提供分子生物学基础。
1 材料和方法
1.1 材料
1.1.1供试昆虫
家蝇由贵州医科大学人体寄生虫教研室保存。养蝇房恒温25℃,光周期12 L ∶12 D,成虫以水、奶粉和白糖喂食,幼虫以麦麸和水为食料。
1.1.2主要试剂
质粒pMD19-T Vector、PrimeScriptTMOne Step RT-PCR Kit、Ex Taq 酶、MiNiBEST Agarose Gel DNA Extraction Kit Ver.3.0回收试剂盒、dNTP Mixture、TaKaRa MiniBEST Plasmid Purification Kit Ver.3.0、Primer STARTM HS DNA Polymerase(TaKaRa); 大肠杆菌表达载体pET-28a(+)、T4DNA ligase、 EcoRI和XhoI限制性内切酶(NEB);水杨苷、羧甲基纤维素钠、微晶纤维素(Sigma);定性滤纸(杭州特种纸业有限公司);3,5-二硝基水杨酸(DNSA,Genview)。
1.1.3主要仪器
PCR扩增仪(德国Eppendorf公司);稳压稳流电泳仪(美国GE公司);紫外分光光度计(美国GE公司);Millipore 0.22 μm/0.45 μm滤器(美国);Milli-Q超纯水仪(法国Millipore Pharmacia公司);CT15RE高速冷冻离心机(HITACHI公司);μ-Quant酶标分光光度仪(美国Bio-Tek公司);超声波破碎仪(中国新芝公司)。
1.2 方法
1.2.1简并引物设计及筛选
从NCBI数据库搜索昆虫BG酶基因核苷酸序列,确定6个具有代表性的BG酶基因,分别是草地贪夜蛾(AF052729.1),马德拉蜚蠊(AAL40863),大黄粉虫(AF312017.1),台湾乳白蚁(JN565079.1),黑翅大白蚁(GU591172.1),大红斑蝶(AGBW01002988.1)。登陆BLOCK Maker网站,对上述6个序列进行比对,寻找到高度保守的连续核苷酸序列区。从BLOCK Maker Results 网页直接登陆COPEHOP数据库进行引物设计。参数为: Maximum core degeneracy: 64; Targetclamp temperature: 60℃; Genetic code: standard;Codon usage table:Platichthys flesus。用Primer Premier 5.0、DNAman、Oligo 6.0软件进行引物优化。
1.2.2总RNA提取及第一链cDNA的合成
取5 μg采用Trizol法提取的家蝇3龄幼虫的总RNA,按照Invitrogen的SuperScriptTMIII Reverse Transcriptase试剂盒说明进行逆转录,合成cDNA。反应产物于4℃保存备用。
1.2.3RT-PCR扩增家蝇BG酶基因保守区域
以反转录的cDNA为模板,使用TaKaRa公司的Prime STAR HS DNA Polymerase 和简并引物组合对进行PCR扩增,同时以不加模版作为阴性对照。反应体系为25 μL。反应条件: 98℃ 10 sec,65-55℃ 15 sec,72℃ 30 sec , 30个循环。RT-PCR产物用1%琼脂糖凝胶电泳检测后,进行琼脂糖凝胶回收试剂盒回收纯化后。进行蓝白斑筛选,挑取阳性克隆送上海生工测序。
1.2.4家蝇BG酶基因5′RACE 扩增
根据家蝇β-葡萄糖苷酶cDNA的保守区域采用Primer 5.0软件设计用于5′末端扩增的基因特异性引物GSP1、GSP2和GSP3。按照5′RACE System for Rapid Amplification of cDNA Ends,Version 2.0试剂盒说明书进行家蝇BG酶基因的5′RACE 扩增。用GSP1合成第一链cDNA,使用引物GSP2和试剂盒所带的桥连铆钉引物AAP对已经加尾的家蝇cDNA进行PCR第一轮扩增。将第一次的PCR产物用特异引物GSP3和试剂盒里面带的桥连通用扩增引物AUAP进行巢式PCR第二轮扩增。PCR反应条件均为:95℃预变性4 min;94℃变性30 s,57℃退火30 s,72℃延伸2 min,进行34个循环;最后72℃再延伸10 min,4℃进行保存。获得的片段采用与方法1.2.4 相同的步骤进行回收、连接、转化和验证。
1.2.5家蝇BG酶基因的3′RACE 扩增
根据Clontech 的SMARTTM RACE cDNA Amplification Kit 试剂盒说明书构建了家蝇BG酶基因 的3′RACE 片段。第一轮PCR 采用3′GSP1 和UPM 引物,第二轮巢氏PCR 采用3′GSP2 和NUP 引物进行扩增,作为模板第一轮PCR ℃产物稀释50倍;RACE-PCR 扩增的程序均为: 预变性94℃,5 min; 然后30个循环94℃,30 s,50℃,30 s,72℃,1 min。获得的片段采用与方法1. 2. 4 相同的步骤进行回收、连接、转化和验证。
1.2.6家蝇BG酶基因全长cDNA的获得
应用conting Express和DNAman软件将获得保守区域、3′端和5′端进行序列拼接,最终获得全长cDNA。利用NCBI的在线工具OFR Finder查找其开放阅读框(ORF)。采用Premier 5.0 软件对拼接的序列进行引物设计,通过PCR扩增进行家蝇cDNA的基因验证。扩增产物检测、克隆及测序方法同1.2.3。
1.2.7基因核酸序列及其所编码氨基酸序列的生物信息学分析
测序得到的序列运用NCBI的BLAST程序(http://ncbi.nlm.nih.gov)进行分析。用Premier 5.0软件进行家蝇BG酶基因全长氨基酸序列推导。采用DNAman预测其分子量和等电点等基本性质。利用生物信息学网站ExPASy (Expert Protein Analysis System http://www.expasy.org/)中的TMpred对MAF-1进行跨膜区分析,用SignalP 4.0 Server进行信号肽分析,用PSORT Ⅱ server 进行亚细胞定位分析,用SMART进行功能域的预测,用SOPMA进行二级结构的预测分析。利用PredictProtein分析家蝇BG酶基因的功能位点。最后,利用ExPASy中的3D-pssm(Phyre Version 0.2)模建家蝇BG酶基因的三维空间结构图。
1.2.8原核表达体系与鉴定
1.2.8.1 家蝇BG酶基因成熟肽引物的设计与合成
根据家蝇BG酶肽序列和大肠杆菌的表达载体pET-28a(+)多克隆位点,用Primer 5.0软件进行引物设计。上游引物MDbg-F,含有EcoRI酶切位点及保护碱基;下游引物MDbg-R,含有XhoI酶切位点及保护性碱基,引物均委托上海生工技术有限公司合成。用EcoRI和XhoI酶对pET-28a(+)载体及含目的DNA片段的PCR产物进行双酶切,用琼脂糖凝胶回收试剂盒回收酶切产物。将上述回收的pET-28a(+)线性载体质粒与从pMD19-T切下来的重组质粒用T4-DNA连接酶进行连接,转化BL21感受态细胞。挑取阳性克隆进行菌落PCR鉴定后,提取质粒进行酶切鉴定,并送质粒至TaKaRa公司测序。
1.2.8.2 的pET-28a(+)-bg-1连接产物转化宿主菌感受态细胞
分别取两种重组质粒10 μL加入到100 μL的E.ColiBL21感受态细胞,转化产物涂于含25 μg/mL卡那霉素的LB平板上,37℃培养12-14 h。挑取阳性克隆后摇菌培养12 h后,用引物MDbg-F和MDbg-R进行PCR扩增,将PCR产物送到上海生物技术有限公司进行测序。将鉴定正确的质粒命名为的pET-28a(+)-bg-1-BL21/DE。
1.2.8.3 重组蛋白的诱导表达
取的pET-28a(+)-bg-1-BL21于卡那霉素抗性平板上划单克隆,37℃培养过夜。挑单克隆菌落接种于5 mL含有50 μg /mL卡那霉素LB液体培养基中,37℃、250 rpm恒温振荡培养过夜,将空表达载体转入宿主菌中,做为阴性对照,同时做空宿主菌的空白对照。加IPTG至终浓度为1 mmol/L进行诱导表达。将重组菌单克隆按上述方法接种扩大培养,按照HisTag融合蛋白纯化操作手册进行纯化,浓缩蛋白通过SDS-PAGE鉴定并使用分光光度计测定浓度,分装后-80℃保存备用。
1.2.9重组家蝇BG酶的活性鉴定
采用七叶苷平板显色法:I液:称取4 g琼脂置于100 mL,pH值5.6,0.2 mol/L醋酸一醋酸钠缓冲溶液中,高温灭菌20 min,冷却至55 ℃。II液:新鲜配制含质量浓度0.2 g七叶灵和0.6 g FeCl3。用ddH2O定容至100 mL后,水浴加热到50℃。将以上2种溶液混合并立即到入培养皿中,制备平板。冷却,打孔(孔径为0.3-0.6 cm,相互间的两孔距离要适宜),分别将稀释相应浓度的100 μL重组蛋白加入到小孔中。封好培养皿,置于37℃培养箱中保温48 h后,观察显色反应。
1.2.10重组家蝇BG酶融合蛋白底物特异性
采用DNSA法测定,在离心管中分别加入1%水杨苷、2%乳糖、30 Mm纤维二糖、1%蔗糖、1%麦芽糖、1%羧甲基纤维素钠、1%微晶纤维素90 μL后加入30 μL重组蛋白,混匀后在50℃水浴条件下反应60 min,立即加入0.3 mL DNSA显色剂终止反应,在沸水浴显色5 min,冷却至室温后,用0.1 M醋酸-醋酸钠缓冲液定容至5 mL。设阴性对照(以缓冲液代替酶液)。于紫外分光光度计测OD540值,每一个样品3个生物重复,每组做3个重复。计算方法与按照文献进行计算(张姝等,2013)。
2 结果与分析
2.1 简并引物设计和保守区域的扩增
将筛选出的32对简并引物进行PCR扩增和1%琼脂糖凝胶电泳,其中有1对引物(表1)的扩增产物特异性最好。电泳结果显示其片段大小约为402 bp,与预计相符,无非特异性条带出现(图1)。将该片段进行双向测序,测序结果进行BLAST比对,显示该序列属于糖苷水解酶第一家族,与草地贪夜蛾、大红斑蝶、黑翅大白蚁、台湾乳白蚁、黄粉虫、马德拉蜚蠊β-葡糖苷酶氨基酸序列的同源性较高,达到70%以上。因此认定在家蝇体内成功克隆了BG酶基因的保守区域。

表1 筛选出上下游引物
注:引物由5′端非简并夹板区(大写字母)和3′端核心简并区(小写字母)组成。其中R=A/G,Y=C/T, S=C/G, V=A/C/G。Note:The primer is constituted by 5′non-degenerate consensus clamp(capital letters)and 3′degenerate core(lowercase letter),R=A/G,Y=C/T, S=C/G, V=A/C/G.
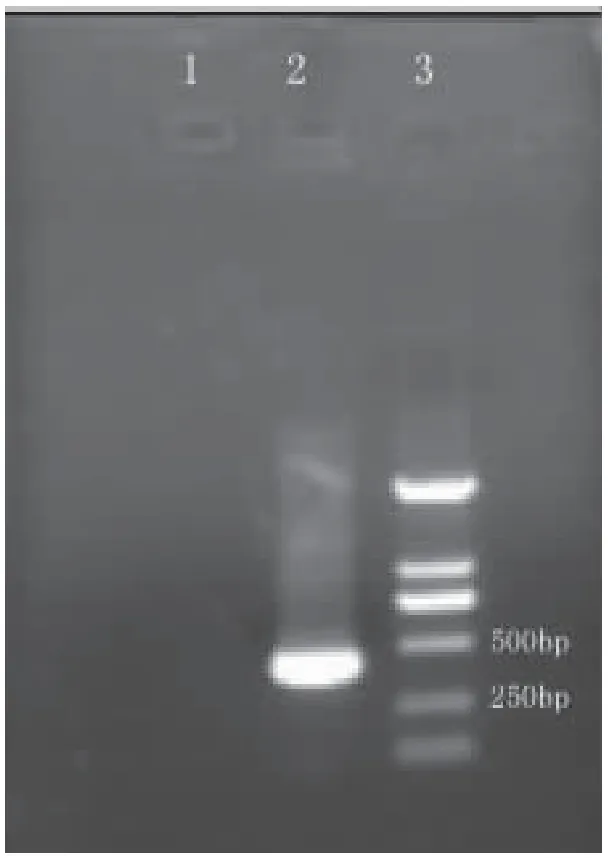
图1 家蝇BG酶基因保守区域PCR的琼脂糖凝胶电泳Fig.1 The conserved domain of Musca domestica BG gene注:1,阴性对照;2,家蝇BG酶基因保守区域PCR产物;3,DL2000 DNA 分子标准。Note:1, negative control.; 2,the conserved domain of M.domestica BG gene;3, DL2000 DNA Marker.
2.2 家蝇BG酶的3′RACE
家蝇3龄幼虫采用Clonetech SMART RACE cDNA Kit经过2次PCR反应后,扩增引物见(表2),反应产物经电泳检测在1000 bp和2000 bp之间可见一条明显的特异性条带(图2),经测序鉴定为1475 bp核苷酸序列。用DNAman和NCBI中Blast软件将3′RACE所得序列与家蝇保守区域序列进行拼接和比对,有连续的117 bp核苷酸序列与保守区域的序列重合。因此认为通过上述实验方法在家蝇幼虫体内成功获得了家蝇β-葡糖苷苷酶基因的3′末端片段。

表2 家蝇β-葡萄糖苷酶cDNA扩增过程中所用引物
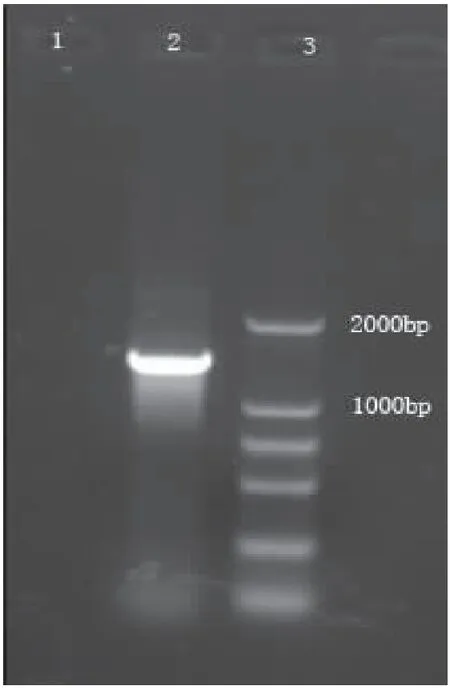
图2 家蝇BG酶3′RACE产物电泳图Fig.2 The conserved domain of Musca domestica BG gene 3′RACE注:1,第一次PCR产物;2,第二次PCR产物; 3, DL2000 DNA分子标准。Note:1,3′RACE product of the first PCR; 2, 3′RACE product of the sond PCR;3, Maker DL2000.
2.3 家蝇BG酶基因的5′RACE
进行两轮扩增,扩增引物见(表2),在315 bp处获得一特异性条带(图3)。经测序鉴定为315 bp核苷酸序列。运用NCBI对该cDNA序列进行Blast分析, 测序结果显示的该序列具有起始密码子为完整的5′端序列。用DNAman和NCBI中Blast软件将5RACE所得序列与家蝇BG保守区域的序列进行拼接和比对,有73个核苷酸与保守区域序列完全吻合。因此认为成功获得了家蝇BG酶基因的5′末端片段。
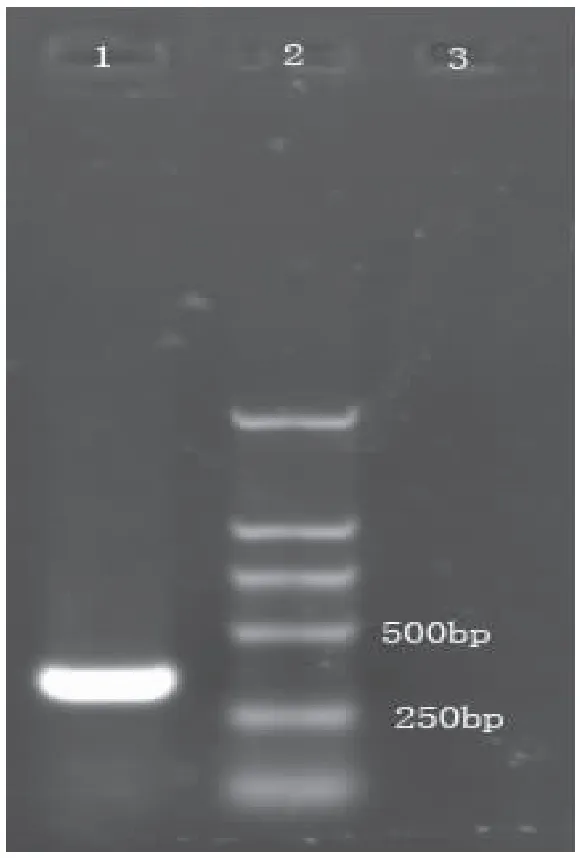
图3 家蝇BG酶5′RACE产物电泳图Fig.3 Electrophoresis pattern of 5′RACE product注:1,第二次PCR产物;2,MakerDL-2000分子标准; 3,第一次PCR产物。Note:1, 5′RACE product of the first PCR; 2,Maker DL2000;3,5′RACE product of the sond PCR.
2.4 家蝇BG酶基因的全长cDNA
用软件将家蝇BG酶基因保守区域、5′端和3′端序列进行序列拼接,去除重复区域,获得全长cDNA序列为1933bp。该基因在5′非翻译区中有34个核苷酸,紧接着为1689个核苷酸的开放性阅读框(ORF),其中起始密码子ATG位于35-37 bp,终止密码子TAA位于1721-1723 bp,随后为210个核苷酸的3′非翻译区,最后为21个核苷酸的ployA尾巴。ORF编码562个氨基酸。以家蝇3龄幼虫总RNA为模板扩增家蝇BG酶基因完整cDNA,扩增引物见(表2),扩增产物经电泳检测,在2000 bp附近有特异条带出现(图4),测序得到1689 bp的核苷酸序列,与软件分析全长cDNA序列一致,与其它昆虫BG酶同源性很高。证实成功获得了家蝇BG酶基因。将其登录到GenBank,获得登录号:JX460804。
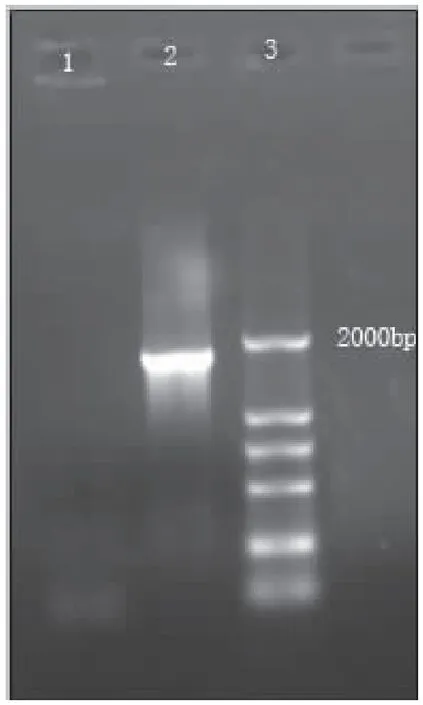
图4 家蝇BG酶全长cDNA扩增产物的琼脂糖凝胶电泳图Fig.4 Aganrose gel electrophoresis of product from BG gene注:1,阴性对照;2,家蝇bg-1基因;3,DL2000分子标准。Note:1,negative control. 2,Musca domestica bg-1 gene; 3, DL2000 DNA Marker.
2.5 家蝇BG酶基因核酸序列及其所编码氨基酸序列的生物信息学分析
2.5.1家蝇BG酶蛋白的基本性质分析
运用ExPASy中ProtParam进行蛋白质性质分析显示,家蝇BG酶成熟肽的理论分子量为65020.6 Da,等电点为8.16,原子总数为9038,分子式为C2941H4441N801O835S20,在组成的家蝇BG酶的氨基酸中,丝氨酸Ser所占比例最高,达到8.0%,其次是亮氨酸Leu(7.5%)、甘氨酸Gly(6.9%)、精氨酸 Arg(6.4%)、天冬酰胺Asn(5.9%)、缬氨酸val(5.7%),半胱氨酸Cys所占比例最低,为0.5%,带正电荷为59,负电荷为61,消光系数为142795,蛋白性质稳定,半衰期大于20h。脂肪族指数:76.83,为亲水性蛋白。运用BioEdit作蛋白质的疏水区域分析显示,在N端位置有一个典型的疏水性区域,大约在540-
560位氨基酸之间。运用ExPASy中的TMpred对家蝇BG酶氨基酸序列进行跨膜区分析,结果表明,该蛋白可能有两个跨膜区域,在该蛋白的第1至27个氨基酸内,出现较弱的跨膜信号,方向由膜内向膜外,在第541至561位氨基酸出现较强的跨膜信号,方向由膜外向膜内。用singIP 4.0分析可见,家蝇BG酶蛋白具有信号肽,且剪切位点可能位于第28与第29位氨基酸之间。与跨膜区域分析的结果相吻合。用TargetP进行亚细胞定位分析可见,目的蛋白是在胞内合成后分泌到胞外(图5-图6)。
2.5.2家蝇BG酶的二级结构分析
采用ExPASy的Smart数据库对家蝇BG酶基因成熟肽的结构域进行分析,其功能结构域可能是第32位氨基酸和第501位氨基酸之间的序列。利用Prosite预测蛋白氨基酸结构功能位点,发现其在位点329-337(VYVTENGVS)处含有糖基水解酶家族 1(GHF-1)的功能位点。通过YinOYangV1.2分析其可能的O-糖基化位点分别为;Thr 26,Ser 126,Ser 266,Thr 300,Thr 348,Thr 378,Thr 411,Thr 484,Thr 525,Thr 526,Ser 527,没有发现N-糖基化修饰(图7-图8)。
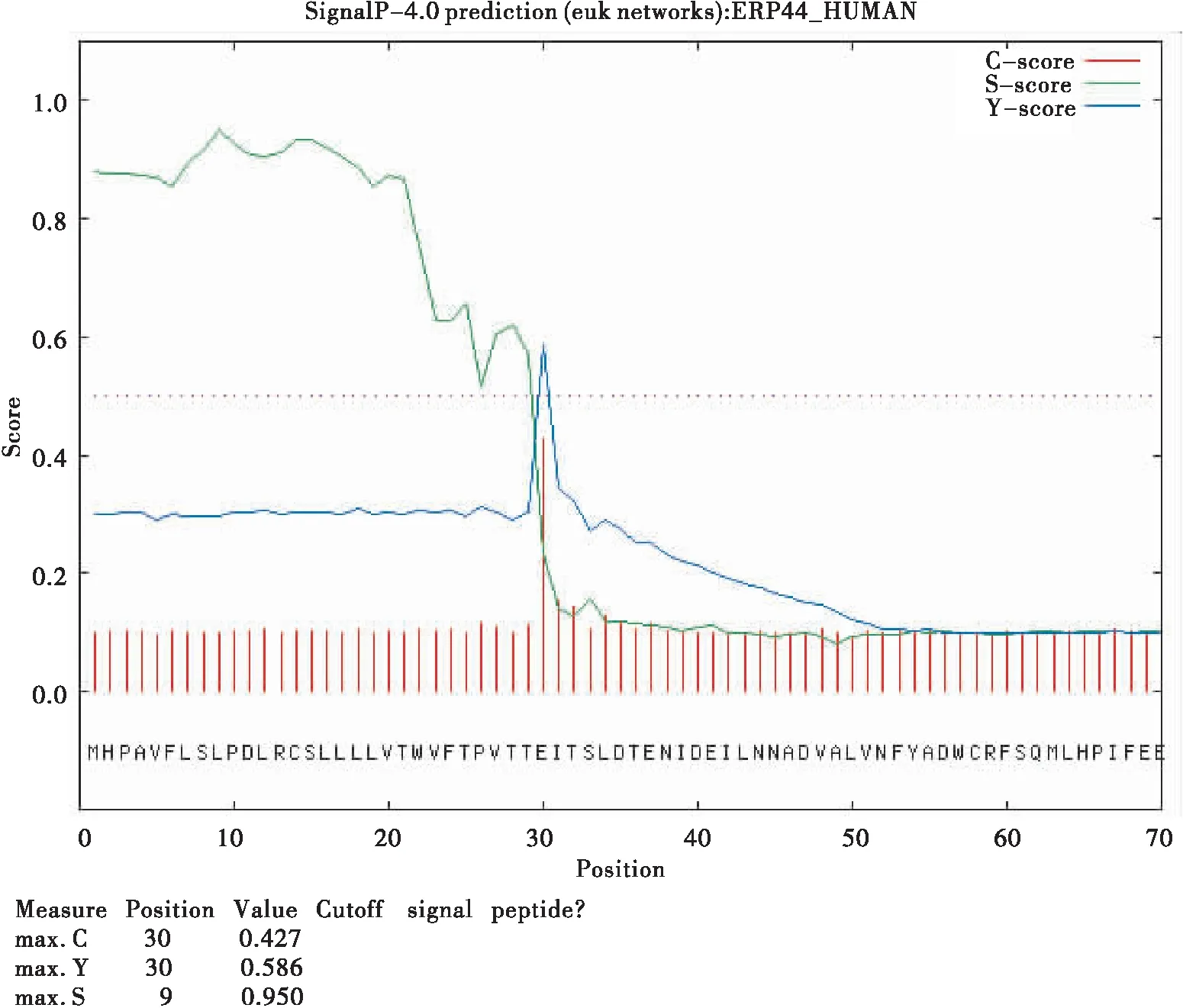
图5 SignalP 4.0分析结果Fig.5 SignalP 4.0 output for bg-1 gen
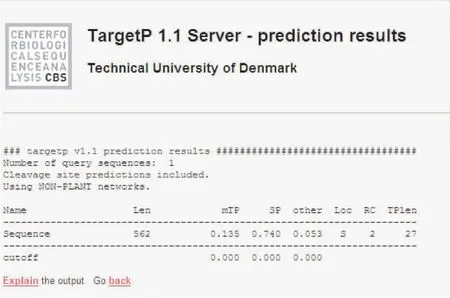
图 6 TargetP1.1 Server 亚细胞定位结果Fig.6 Subcellular loction of TargetP 1.1 Server
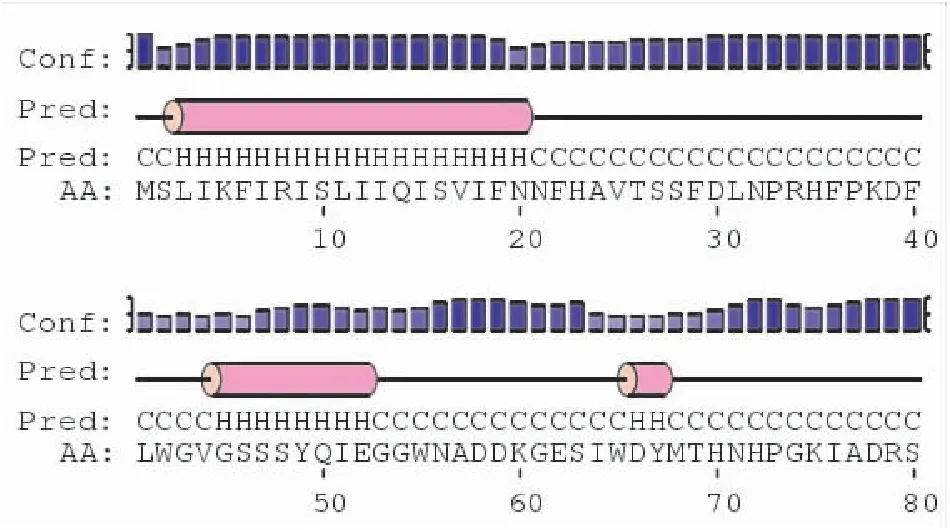
图7 家蝇BG酶二级结构预测结果Fig.7 The sondary structure prediction for Musca domestica BG
图8 家蝇BG酶三级结构Fig.8 The tertiary structure prediction for Musca domestica BG
2.6 家蝇pET-28a(+)-bg-1的构建
重组质粒pET-28a(+)-bg-1经EcoRI和XhoI双酶切鉴定,获得两条条带,一条约1605 bp 的目的条带,和目的条带相符,一条约为5369 bp,与pET-28a(+)质粒的大小相符(图9),重组质粒的测序结果也显示目的基因以正确的读码框插入到pET-28a(+)载体中,且扩增均无任何突变。重组表达质粒含有6个组氨酸编码序列,表明重组表达质粒pET-28a(+)-bg-1 构建成功。
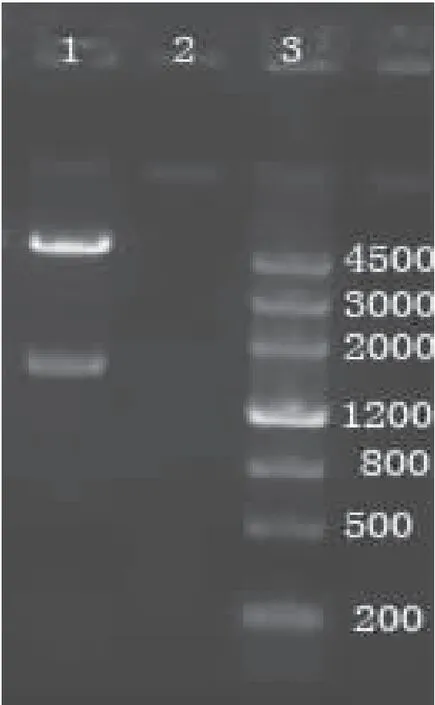
图9 重组质粒pET-28a(+)-bg-1 双酶切鉴定Fig.9 Restriction enzyme digestion identification of pET-28a(+)-bg-1注:1,重组表达质粒pET-28a(+)-bg-1 双酶切鉴定结果; 2,阴性对照;3,MarkerⅢ DNA分子标准。Note:1,The enzyme digestion product of pET-28a(+)-bg-1 by EcoRⅠand XholⅠ; 2, negative control; 3,MarkerⅢ DNA Marker.
2.7 pET-28a(+)-bg-1融合蛋白在大肠杆菌中的表达
重组家蝇pET-28a(+)-bg-1转入BL21(DE3)后,在37℃,1mmol/L IPTG诱导4h后进行SDS-PAGE电泳,与pET-28a(+)空载转化菌组、pET-28a(+)空载诱导组、重组质粒转化菌未经IPTG诱导组为对照,在66 kDa与45 kDa有明显的条带,与目的条带(BG酶基因成熟肽分子量与His标签分子量之和)的大小相符,表明家蝇BG酶基因在大肠杆菌中稳定的表达。且重组质粒转化菌经裂解后的上清中有可溶性的重组BG酶融合蛋白,包涵体中也有大量重组BG酶融合蛋白的表达(图10)。
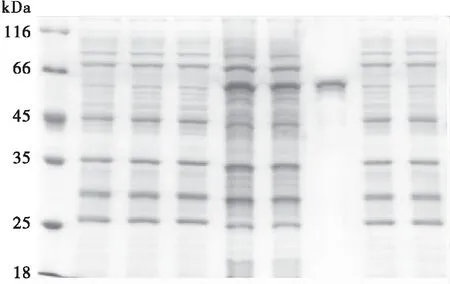
图10 重组BG酶融合蛋白的SDS-PAGE结果Fig.10 SDS-PAGE analysis of the BG fusion protein注:1,蛋白分子量标准; 2,pET28a(+)未诱导; 3, pET28a(+)诱导; 4, 重组蛋白未诱导;5,大量诱导表达后菌液沉淀;6,大量诱导表达后菌液上清 7, 纯化的MDBG-1蛋白; 8,未经诱导的BL21全菌液; 9,经诱导表达后的BL21全菌液. Note:1,Protein Marker; 2, pET-28a(+) trantformants without IPTG induction;3, pET-28a(+) trantformants with IPTG induction;4, Supernatant of pET-28a(+)-bg-1without IPTG induction; 5,Supernatant of pET-28a(+)-bg-1 induced by IPTG; 6, Precipitation of pET28a(+)-bg-1 induced by IPTG; 7, Purified fusion protein of pET28a(+)-bg-1;8, pET-28a(+)-bg-1 trantformants without IPTG induction;9, pET-28a(+)-bg-1 trantformants with IPTG induction.
2.8 重组家蝇BG酶的活性鉴定和底物特异性
将重组家蝇BG酶加入醋酸-醋酸钠缓冲液进行稀释,并各取100 μL分别加入七叶苷固体平板培养基的小孔中,至37 ℃培养箱24 h后,出现黑色的透明圈。由此可见,其是具有β-葡萄糖苷酶活性的重组蛋白。通过DNS显色法检测到两种原核表达体系表达的融合蛋白均具有BG酶、外切-β-1,4-葡聚糖酶、内切-β-1,4-葡聚糖酶三种酶活性(表3)。
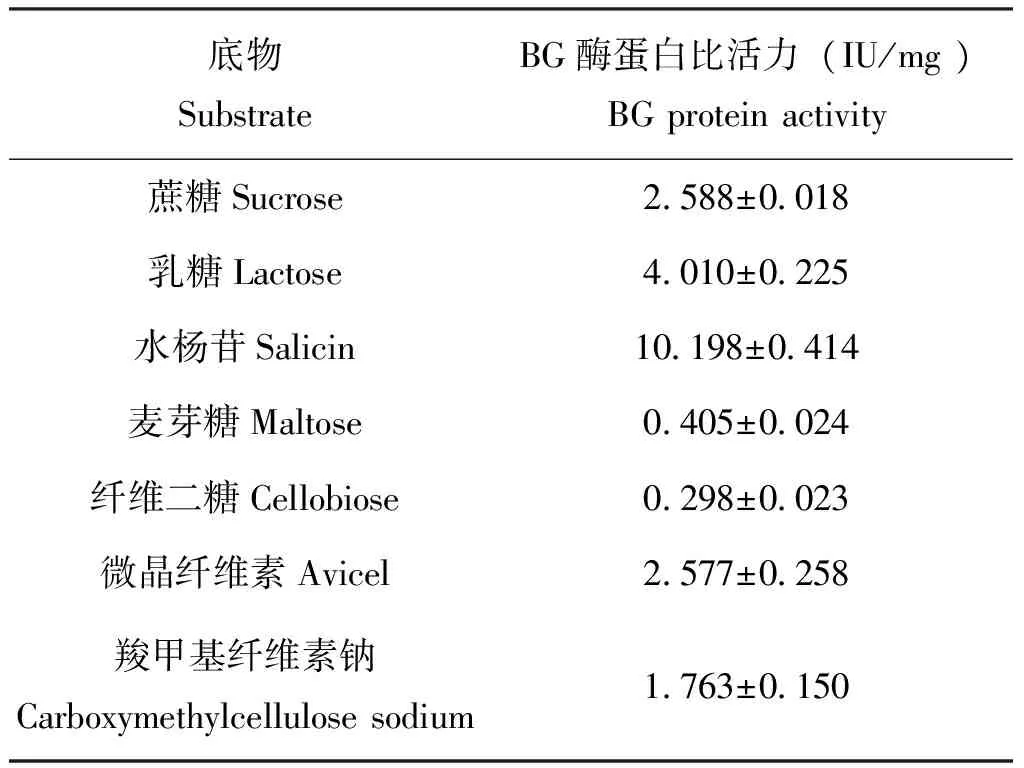
表3 原核表达体系对不同底物的酶活性
3 结论与讨论
家蝇,家蝇科、家蝇属,属于双翅目,其分布广泛,杂食性,极强的环境适应性,其与环境中木质纤维素接触密切,可以通过内源性纤维素酶(胡蓉等,2013)消化纤维素作为食物来源,为自身提供能量。在陆生植物纤维素的生态循环和生物转化中做出贡献的同时也成为了传播疾病的主要媒介昆虫。因此对家蝇内源性纤维素酶的分子结构进行研究,不但可以深入阐明家蝇适应复杂孳生环境的生理基础和生态功能,而且有望通过对家蝇纤维素酶基因进行分子改造或沉默从而使家蝇纤维素酶活性受抑或丧失,为家蝇生态控制提供新的途径(张姝等,2013)。
BG酶作为纤维素酶系的限速酶,在昆虫消化纤维素的过程中发挥着关键作用。研究表明几乎所有的昆虫体内都具有BG酶,仅是由于生存环境的改变,BG酶基因就可能被抑制或沉默(Hirofumi Watanabe and Gaku Tokuda,2010;Sharmaetal., 2016),同时对目前已知的昆虫BG酶基因序列进行同源性分析,发现其在昆虫的种属间存在很高的同源性,较为保守(Shelomietal., 2016;Zhouetal., 2016)。根据这一特点,人们进一步发现和证实其它昆虫也具有BG酶基因,因此本课题以它作为研究家蝇纤维素酶的突破口并展开研究。
早期对BG酶的克隆是通过构建cDNA文库进行活性筛选的方式获得的。随着PCR技术的应用,利用种属保守区域进行扩增,成功克隆了许多BG酶基因(Junetal.,2016;朱世馨等,2016)。本研究采用程序化设计简并引物的方法,先将数据库(NCBI)上找到的若干与家蝇亲缘关系较近的昆虫BG酶氨基酸序列进行BlockMaker,得到其连续氨基酸序列保守区后再用CODEHOP设计多条简并引物,通过夹板区温度进行筛选,再使用生物软件DNAMAN对上、下游引物的匹配情况进行二次筛选,之后再利用Oligo 6.0对引物进行发夹结构、二聚体、退火温度第三次筛选和分析获得最合适的引物对。此法所设计的简并引物简并度相对较低,Tm值较高, 获得PCR产物特异性增加,假阳性率低,本实验扩增出来的产物进行电泳,未出现非特异的条带。为下一步的实验成功奠定扎实的基础。再结合RACE-PCR的方法,成功克隆了家蝇的BG酶基因序列,有助于在分子水平上对家蝇BG酶的结构和作用机制进行分析,同时为后续重组表达家蝇BG酶提供了可能,也为今后的定向进化等技术手段提高酶的活性或者改进酶的催化性质奠定基础。
大肠杆菌Escherichiacoli表达系统是第一个用于重组蛋白的表达系统,同时也是应用最为广泛的经典表达系统。它通过全基因组测序,具有遗传背景清楚、培养操作简单、遗传稳定,生长周期短,成本低,可以快速大规模地生产目的蛋白等优点,因而被美国FDA批准为安全的基因工程受体菌。本研究对已克隆家蝇BG基因进行大肠杆菌异源表达,构建原核表达系统,成功构建了家蝇BG酶的高效、稳定的原核表达载体,通过IPTG诱导,得到了相对分子质量为65 kDa的重组BG酶。对了解家蝇BG基因结构的完整性,生物学信息推导结果的正确性进行验证,有益于对家蝇BG基因在适宜的宿主中进行表达以及基因改造等提供技术储备。
BG酶根据底物特异性分为三类:第一类BG酶专一性地水解芳香基糖苷,如对-硝基-β-D-葡萄糖苷等类似物。第二类β一葡萄糖普酶专一性地水解纤维二糖,也叫纤维二糖酶。第三类β一葡萄糖苷酶能够水解多种糖苷类衍生物以及纤维二糖、纤维寡糖等,称为广底物型β一葡萄糖苷酶(Margollesetal., 1997;Vrieetal.,1999;Strickeretal., 2008)。第三类β一葡萄糖苷酶能裂解C-O糖苷键,C-S键,C-F键等,对底物的糖基部分结构专一性较低,但对所有底物中,BG酶对纤维二糖的活性是最强。家蝇BG酶融合蛋白的酶底物特异性实验显示其能够水解纤维二糖、乳糖、蔗糖等,证实其是一种广底物型BG酶,广泛的底物范围以及特殊的底物水解能力使其具有非常好的工业应用前景。在研究中,发现家蝇BG酶蛋白除了具有BG酶活性以外,还具有水解羧甲基纤维素钠和微晶纤维的能力。这说明家蝇BG酶随着对栖息环境和取食特性的适应,进化成了一个多功能的纤维素酶,在没有其他两种纤维素酶参与下完成纤维素降解或进一步增强家蝇纤维素酶体系对纤维素水解能力。
Reference)
Anish R,Raham MS, Rao M. Application of cellulases from an
alkalothermophilicThermomonosporasp.in biopolishing of denims [J].Biotechnol.Bioeng., 2007,96(1):48-56.
Hu R,Zhang S, Wu JW,etal. Histological research on the third instar larva ofMuscadomesticawith paraffin stion [J].JournalofEnvironmentalEntomology, 2013,35(6): 832-837.[ 胡蓉, 张姝, 吴建伟,等.家蝇3龄幼虫石蜡切片的组织学研究 [J]. 环境昆虫学报,2013,35(6): 832-837]
Hu R,Zhang S,Huang Y,etal. Expression ofMuscadomesticaβ-glucosidase in the organs besides digestive system of Ⅲ instar larvae [J].JouralofRegionalAnatomyandOperativeSurgery, 2016, 25(7):473-477. [胡蓉, 张姝, 黄悦,等. 家蝇β-葡萄糖苷酶在Ⅲ龄幼虫消化系统以外器官的表达 [J]. 局解手术学杂志, 2016, 25(7):473-477]
James R, Ketudat C, Asim E. β-Glucosidases [J].CellularandMolecularLifeSciences,2010,67:3389-3405.
Jun-Jie, M. O, Liang JX, Han Q,etal. Cloning of peroxidase gene in taro [J].GuangdongAgriculturalSciences, 2016,43(9):37-43. [莫俊杰, 梁钾贤, 胡汉桥,等. 芋头过氧化物酶基因克隆 [J]. 广东农业科学, 2016, 43(9):37-43]
Margolles CE, Ihnen M, Penttila M. Expression patterns of ten hemicellulase genes of the filamentous fungusTrichodermareesei, on various carbon sources [J].JournalofBiotechnology, 1997,57(1-3):167-179.
Sackton TB, Lazzaro BP, Clark AG. Rapid expansion of immune-related gene families in the house fly,Muscadomestica[J].MolecularBiology&Evolution, 2017,34(4):857-872.
Seddigh S, Darabi M, Structural and phylogenetic analysis of α-glucosidase protein in insts [J].Biologia, 2016, 70(6), 812-825.
Shah RM, Azhar F, Shad SA,etal. Effects of different.manures on attraction and reproductive behaviors of common house fly,Muscadomestical[J].ParasitologyResearch, 2016,115(9): 1-14.
Sharma A, Tewari R, Rana SS,etal. Cellulases: Classification, methods of determination and industrial applications [J].AppliedBiochemistryandBiotechnology, 2016,179(8): 1-35.
Singh G, Verma AK, Kumar V. Catalytic properties, functional attributes and industrial applications of β-glucosidases [J].Biotech., 2016,6(1): 3.
Shelomi M, Heckel DG, Pauchet Y. Ancestral gene duplication enabled the evolution of multifunctional cellulases in stick insts (Phasmatodea) [J].Inst.Biochemistry&MolecularBiology, 2016, 71: 1-11.
Stricker AR, Mach RL, Graaff LH. Regulation of transcription of cellulases-and hemicellulases-encoding genes in aspergillus niger and hypocrea jecorina (Trichodermareesei) [J].AppliedMicrobiologyandBiotechnology, 2008,78(2):211.
Vries RP, Broeck HC, Dekkers E,etal. Differential expression of three α-galactosidase genes and a single β-galactosidase gene fromAspergillusniger[J].Applied&EnvironmentalMicrobiology, 1999,65(6): 2453.
Watanabe H, Tokuda G. Cellulolytic systems in insects [J].AnnualReviewofEntomology, 2010, 55(1), 609-613.
Zhang S, Hu R, Wu JW,etal. Changes ofMuscadomesticaβ-glycosidase gene expression and enzyme activity after being induced by feeding crude fibre [J].JournalofEnvironmentalEntomology, 2013.35(2): 157-164. [张姝, 胡蓉, 吴建伟等.家蝇取食粗纤维后β-葡萄糖苷酶活性与基因表达量的变化[J]. 环境昆虫学报, 2013,35(2): 157-164]
Zhang S, Hu R, Wu JW,etal. Analysis on the components and enzymatic activity of cellulase in digestive organs fromMuscadomesticalarvae [J].JournalofEnvironmentalEntomology, 2013. 35(1):55-60[张姝, 胡蓉, 吴建伟,等.家蝇幼虫消化器官中纤维素酶的组成及酶活性分析 [J]. 环境昆虫学报, 2013,35(1):55-60]
Zhang WQ, Wang YS, Wang J,etal. Insect resources and social & economic development [J].JournalofEnvironmentalEntomology, 2008,30(4):357-360.[张文庆, 汪延生, 王娟等.昆虫资源与社会经济发展 [J].环境昆虫学报, 2008, 30( 4): 357-360]
Zhou, MB, Zheng Y, Liu ZD. Into the rapid elongation ofPhyllostachysheterocycla, var.pubescens[J].Trees,2016,30(4):1259-1274.
Zhu SX,Geng XY,Wang JC,etal. Cloning and bioinformatics analysis of apisMelliferaligusticaspinhsp90 gene [J].JournalofShanghaiJiaotongUniversity(Agriculture) 2016,34(3): 28-34.[朱世馨, 耿昕颖, 王家祯,等.利用codehop克隆意蜂Hsp90基因及生物信息分析 [J]. 上海交通大学学报(农业科学版), 2016,34(3): 28-34.
Cloningandrecombinantexpressionofβ-glucosidasegenefromMuscadomestica
ZHANG Shu1, HU Rong2, HUANG Jian1*,WU Jian-Wei2*, GUO Guo2,FU Ping2,XIU Jiang-Fan2,SANG Xiao-Li2
(1. Department of Clinical Laboratory, Guizhou Medical University, Guiyang 550004,China;2. Department of Parasitology, Guizhou Medical University,Guiyang 550004,China)
Endogenous β-glycosidase (BG) gene ofMuscadomesticawas cloned to construct a prokaryotic expression system, and the activities of expression products were detected. The characteristics of endogenous BG were explored to provide molecular and biological bases for further explaining the strong adaptive capacity ofM.domesticato the environment and taking new measures for population control. Using the BG gene sequences of 6 representative, well-studied insects such asSpodopterafrugiperdaas references, the whole-length cDNA sequence of BG gene that was cloned from cDNA ofM.domesticawas subjected to bioinformatics analysis by homology-based cloning in combination with RACE-PCR. Afterwards, pET-28(+) vector was used to construct a prokaryotic expression system that was transformed intoE.coliBL21/DE to induce expressions of recombinant proteins. The BG activities of different recombinant proteins were detected by the aesculin plate method and DNS method, and their characteristics were preliminarily analyzed. Whole-length cDNA sequence (1933 bp) of BG gene was cloned fromM.domestica, and deduced to be a polypeptide comprising 562 amino acid residues. After induced expression of recombinant prokaryotic plasmid, a specific band appeared at about 65 kDa, verifying that the recombinant plasmid was successfully expressed. The recombinant BG ofM.domesticasimultaneously had the activities of endo-β-1,4 glucanase (EC 3.2.1.4), exo-β-1,4-glucanase (EC 3.3.1.91) and BG (EC 3.2.1.21). BG fromM.domesticais a novel multifunctional cellulase, as an important supplement for studies on inst cellulases.
Muscadomestica;β-glucosidase;clone; heterogenous express;enzymatic activity.
贵州省教育厅培育项目[(2009)0137];国家科技支撑计划课题(2011BAC06B12);国家自然科学基金(30960343);国家教育部博士点专项基金[(2008)220]
张姝,女,1980年生,博士,副教授,研究方向为昆虫免疫学,E-mail:418611579@qq.com
*通讯作者Author for correspondence, E-mail:31712463@qq.com
Received: 2017-05-22; 接受日期Accepted: 2017-07-14
Q963;S433.89
:A
1674-0858(2017)04-0930-10
张姝, 胡蓉,黄健,等.家蝇β-葡萄糖苷酶基因的克隆及重组表达[J].环境昆虫学报,2017,39(4):930-939.
