光肩星天牛气味结合蛋白AglaOBP1的克隆、表达及结合特性
2017-09-16李广伟陈秀琳尚天翠姚付龙
李广伟,陈秀琳,尚天翠,姚付龙
(伊犁师范学院生物与地理科学学院,新疆伊宁 835000)
光肩星天牛气味结合蛋白AglaOBP1的克隆、表达及结合特性
李广伟*,陈秀琳,尚天翠,姚付龙
(伊犁师范学院生物与地理科学学院,新疆伊宁 835000)
利用RT-PCR技术克隆了光肩星天牛AnoplophoraglabripennisMotschulsky气味结合蛋白(odorant binding proteins,OBPs)基因AglaOBP1(GenBank登录号:KX660670),AglaOBP1的开放阅读框长435 bp,编码144个氨基酸,其中N端有21个氨基酸组成的信号肽序列,成熟蛋白序列具有4个保守的半胱氨酸残基,AglaOPB1属于Minus-C OBP亚家族基因。AglaOBP1主要在成虫触角中表达,且雌虫触角中的表达量显著高于雄虫触角。重组蛋白AglaOBP1与34种气味配体的竞争结合实验表明,AglaOBP1具有广泛的结合谱,能与五角枫挥发物中的醇类、醛类、萜烯类和酮类物质结合,其中与顺-3-己烯-1-醇、顺-2-己烯-1-醇、1-己醇、反-2-己烯醛、反-2-癸烯醛、β-石竹烯、(+)-桧烯、α-蒎烯、1-(2,3-二甲基苯基)-乙酮的结合能力较强,结合常数分别为5.88、8.33、12.29、12.55、11.90、7.47、9.07、10.29和13.12 μM。此外,配体的官能团、碳链长度、空间构型也影响AglaOBP1对气味分子的结合。AglaOBP1基因在成虫触角中高丰度表达,其重组蛋白能够与五角枫挥发物的多种组分结合,表明AglaOBP1在成虫寄主定位选择中起重要作用。
光肩星天牛;气味结合蛋白;嗅觉;荧光竞争结合实验;挥发物
气味结合蛋白(odorant binding proteins,OBPs)是由嗅觉感受神经元(olfactory receptor neurons)周围的副卫细胞分泌的一类小分子量的水溶性胞外蛋白。越来越多的研究者认为昆虫OBPs在选择性地识别和运输气味分子中起着重要作用,OBPs是嗅觉信号传导途径中的第一类关键蛋白(Klein, 1987; Van den Bergetal., 1991; Kriegeretal., 2002; Xuetal., 2005; Laughlinetal., 2008)。根据氨基酸序列中半胱氨酸残基的数量,将昆虫OBPs分为Classical OBPs、Minus-C OBPs和Plus-C OBPs三类(Hekmat-Scafeetal., 2002)。目前,对鞘翅目昆虫OBPs的研究主要集中在嗅觉相关基因的鉴定、组织表达分析及进化关系方面(Lietal., 2015; Liuetal., 2015; Huetal., 2016),对OBPs识别、运输、释放和降解气味分子的机制研究相对较少。与鳞翅目昆虫相比,鞘翅目昆虫OBPs基因家族组成中Minus-C OBPs所占比例较大,探究Minus-C OBPs的生理功能对解析鞘翅目昆虫的嗅觉识别机制至关重要。荧光竞争结合实验是测定OBPs结合气味分子能力的典型方法,以N-苯基-1-萘胺(N-phenyl-1-naphthylamine,1-NPN)为荧光探针,已测定了如鳞翅目、膜翅目、半翅目、直翅目、双翅目、鞘翅目等多个目约200多种昆虫OBPs的结合功能(Zhouetal., 2004; Gongetal., 2007; Vandermotenetal., 2011; Zhangetal., 2011; Dengetal., 2012)。
光肩星天牛AnoplophoraglabripennisMotschulsky是我国林木上重要的一种毁灭性蛀干害虫,国内主要分布于甘肃、陕西、内蒙古、山西、河南、河北、辽宁等省区。自2002年在新疆伊宁市发现光肩星天牛危害以来,已对当地的主要树种如杨、柳、槭、榆、五角枫等造成严重的危害。光肩星天牛以幼虫营钻蛀危害,生活隐蔽,化学防治效果较差。面对日益严重的防控压力,探索防治光肩星天牛的新方法、新技术是目前亟待解决的难题(王爱静等,2010)。光肩星天牛虽然寄主广泛,但成虫对寄主植物有明显的取食和产卵偏好,如明显喜好取食五角枫的嫩梢,更偏好在旱柳枝干上产卵,灵敏的嗅觉系统在成虫寄主定位、产卵场所选择中起着及其重要的作用(张风娟,2006)。前人已对光肩星天牛几种主要寄主植物挥发物的组成进行了鉴定,初步获得了对成虫有电生理活性和行为活性的组分(李建光,2001;金幼菊等,2004;张风娟,2006;杜和芬等,2016),同时也对光肩星天牛成虫触角中的相关基因进行了鉴定(Huetal., 2016)。本文以光肩星天牛成虫嗜食寄主五角枫的主要挥发物为气味配体,通过测定重组蛋白AglaOBP1与气味配体的结合能力,探索AglaOBP1在光肩星天牛嗅觉通讯系统中的生理功能。
1 材料与方法
1.1 供试昆虫
供试虫源采自新疆伊宁市,寄主植物为市区绿化树种五角枫。将光肩星天牛幼虫危害的五角枫枝条截至50-80 cm长的短枝,装入纱网(30目)系紧袋口并喷水保湿,待成虫羽化后将雌雄分开并饲喂五角枫嫩枝补充营养。成虫置于人工气候箱内饲养,温度26℃±1℃,相对湿度40%-60%,光周期15 ∶9(L ∶D)。
1.2 主要试剂和仪器
1.2.1主要试剂
RNAiso Plus、Ex Taq酶、反转录试剂盒、荧光定量试剂盒SYBRRPremix Ex TaqTMII (Tli RNaseH Plus)、DNA 2000 Marker、低分子量蛋白Marker、克隆载体pMD®19-T、限制性内切酶EcoR I和Hind III购自TaKaRa公司;胶回收试剂盒、质粒提取试剂盒购自Omega公司;表达载体pET28a(+)、感受态细胞DH5α和BL21(DE3)购自全式金生物科技有限责任公司;Ni-NTA His·Bind Resin纯化树脂购自七海复泰生物科技有限公司;荧光探针1-NPN购自TCI,其他试剂均为分析纯。
1.2.2主要仪器
PCR仪(GeneAmp PCR system 9700,Gene limited company);实时荧光定量PCR仪(iQ5,Bio-Rad);荧光分光光度计(日立F-4500,日本经营电子电器有限公司);核酸蛋白浓度测定仪(SimpliNano,GE);全波长酶标仪(Bio-Tek,Biotek公司)。
1.3RNA提取及cDNA第一链合成
为测定气味结合蛋白基因的组织表达谱,收集5日龄雌雄成虫的不同组织(触角、头、胸、腹、足和翅)。其中触角、翅和足各20对,头和胸各10枚,腹5枚,每个样品重复3次。将收集的样品立即置于用液氮冷却的小型研钵中研磨,参照Trizol法提取样品的总RNA,RNA浓度及OD260/OD280值用核酸蛋白浓度测定仪测定,RNA的完整性用1.0%琼脂糖凝胶电泳进行检测。将质量合格的总RNA用DNase I去除基因组DNA后用Oligo(dT)18引物和MMLV反转录酶合成第一链cDNA,-80℃保存备用。
1.4 PCR扩增
以光肩星天牛触角cDNA为模板,根据触角转录组测序注释获得的候选AglaOBP1基因序列设计特异性引物扩增编码区(见表1)。PCR反应体系:10×Ex Taq Buffer 2.5 μL,dNTP(10 mM)0.5 μL,MgCl2(25 mM)2 μL,正向引物(10 mM)1 μL,反向引物(10 mM)1 μL,cDNA模板1 μL,Ex Taq 0.3 μL,ddH2O 16.7 μL。PCR扩增条件:95℃预变性5 min;95℃变性30 s,58℃退火30 s,72℃延伸30 s,PCR循环数35个;72℃延伸10 min,PCR产物用1.5%琼脂糖凝胶电泳进行检测,将目的片段纯化后与克隆载体pMD®19-T连接,涂板培养后随机选择5个阳性质粒菌液测序验证。

表1 PCR扩增和原核表达AglaOBP1基因所用引物
1.5 序列分析
利用在线程序Open Reading Frame Finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)预测OBP基因的开放阅读框(ORF);SignalP 4.1 Server(http://www.cbs.dtu.dk/services/SignalP/)预测信号肽序列;Primer premier 5软件翻译蛋白质序列,在线软件Expasy(http://web.expasy. org/protparam/)分析蛋白的理化性质,采用ClustalX 1.8.3进行序列同源比对。
1.6 AglaOBP1基因组织表达谱分析
利用qRT-PCR测定AglaOBP1基因在不同组织中的相对表达量,以Aglaactin1基因(登录号:KX660673)为内参,实时荧光定量PCR所用的特异性引物见表1。反应体系:SYBRRPremix Ex TaqTMII(2×)10 μL,PCR正向引物(10 μmol/L)0.5 μL,PCR反向引物(10 μmol/L)0.5 μL,cDNA模板2.0 μL,ddH2O水补足至20 μL。利用试剂盒说明书推荐的两步法进行扩增:95℃预变性30 s;95℃ 10 s,61℃ 30 s,共40个循环。反应后进行熔解曲线分析,以排除非特异性PCR产物的污染,空白对照模板以超纯水代替cDNA,每个样品3次生物学重复和3次技术重复,利用2-△△Ct法计算AglaOBP1在不同组织中的相对表达量,AglaOBP1在雌、雄虫中表达量的差异显著性用t检验检测。
1.7 AglaOBP1的原核表达及蛋白纯化
根据光肩星天牛AglaOBP1的编码序列及表达载体pET28a(+)设计带有限制性酶切位点的特异性引物(见表1)。以雌虫触角cDNA为模板进行PCR扩增,将扩增产物纯化、回收后连接至克隆载体pMD®19-T并转化DH5α感受态细胞。将测序正确的阳性重组质粒pMD®19-T/AglaOBP1和表达载体pET28a(+)分别进行酶切,并将目的片段与pET28a(+)表达载体相连接,测序验证后将重组表达质粒pET28a(+)/AglaOBP1转入BL21(DE3)感受态细胞进行表达。原核表达,蛋白变性、复性和纯化参照Li等(2016)的方法进行。纯化的重组蛋白经透析、超滤浓缩、BCA法测定浓度后,加入终浓度1 mM DTT和40%甘油后在-20℃保存备用。
1.8 重组AglaOBP1与气味配体的结合能力测定
(1)测定重组蛋白AglaOBP1与荧光探针1-NPN的结合常数。将低温冻存的AglaOBP1蛋白溶液用20 mM Tris-HCl(pH 7.4)缓冲液稀释至2 μM的测试浓度,1-NPN用色谱级甲醇溶解至1 mM的储存液。然后向2 μM的蛋白溶液中依次加入1-NPN储存液,使其终浓度以2 μM的梯度增加,直至蛋白与1-NPN的结合达到饱和,分别记录每个梯度下产生的最大荧光强度值。采用Prism软件及Scatchard方程计算重组蛋白与1-NPN探针的结合常数(K1-NPN)。
(2)测定重组蛋白AglaOBP1和气味配体的解离常数。向2 μM的重组蛋白AglaOBP1溶液中加入1-NPN至浓度为2 μM,在相同的激发光、发射光狭缝宽度(均为10 nm)和波长下记录激发的最大荧光强度值,再以2,4,6,8,12,16,20,24和28 μM的浓度梯度加入气味配体,记录荧光强度值的下降情况。当荧光强度值减弱至初始荧光值的一半时所添加的气味浓度即为荧光强度中浓度(IC50)。蛋白与气味配体的解离常数由方程:Ki=[IC50]/(1+[1-NPN]/K1-NPN)计算得出,其中[1-NPN]表示与重组蛋白未结合的1-NPN的浓度,K1-NPN表示1-NPN与重组蛋白的结合常数。
2 结果与分析
2.1 AglaOBP1基因的克隆及序列分析
对光肩星天牛触角转录组测序、注释获得的候选气味结合蛋白基因AglaOBP1进行克隆,通过DNA测序校正了转录本组装及拼接中出现的错误碱基,最终获得了该基因的完整编码序列,并将基因序列提交至NCBI数据库,GeneBank登录号为:KX660670。AglaOBP1的开放阅读框长435 bp,编码144个氨基酸,N-端有21个氨基酸组成的信号肽序列(图1),AglaOBP1预测的分子量为15.99 kDa,等电点4.76。

图1 AglaOBP1的核苷酸序列和推导的氨基酸序列Fig.1 Nucleotide sequences and deduced aa sequences of AglaOBP1注:起始密码子和终止密码子用方框表示,预测的信号肽用下划线表示,4个保守的半胱氨酸残基用蓝色底纹的圆圈表示。Note: The initiation and termination codons are indicated in boxes, the predicted signal peptide at the N-terminus is underlined, and the four conserved cysteine are marked by a circle with a blue background.
2.2 AglaOBP1多序列比对分析
选取光肩星天牛相同科内物种云斑天牛Batocerahorsfieldi、松墨天牛Monochamusalternatus及其他远缘物种棕榈象甲Rhynchophoruspalmarum、大猿叶甲Colaphellusbowringi、山松大小蠹Dendroctonusponderosae、苜蓿盲蝽Adelphocorislineolatus、中黑盲蝽Adelphocorissuturalis、绿盲蝽Apolyguslucorum和苹果巢蛾ArgyresthiaconjugellaOBP的氨基酸序列进行比对发现,AglaOBP1具有4个保守的半胱氨酸残基,第2、5位的半胱氨酸分别被苏氨酸和谷氨酸所取代(图2),在序列结构上属于Minus-C OBP亚家族基因,保守半胱氨酸残基的分布符合C1-X30-S-X3-C3-X37-C4-X10-E-X8-C6的特征。以AglaOBP1的核苷酸序列为Query序列,Blastx搜索发现AglaOBP1与松墨天牛OBP12(MaltOBP12)的序列相似度最高,达74.0%;与MaltOBP1和MaltOBP22的相似度次之,分别达42.0%和46.0%。与其他昆虫OBPs的相似性较低,均低于40%。
2.3 AglaOBP1基因的组织表达分析
以光肩星天牛Actin1基因为内参,雌、雄虫腹部的表达量为参照,qRT-PCR检测结果表明,AglaOBP1在成虫不同组织中均有表达,但在触角中的表达量最高,显著高于其他组织(P<0.05)(图3)。AglaOBP1在雌虫触角中的表达量分别是头、胸、腹、足和翅表达量的3.92、17.80、4.07、89.18和68.87倍。AglaOBP1在雌虫触角、头部的表达量明显高于雄虫(P<0.05)。鉴于AglaOBP1在成虫主要的嗅觉器官触角中高丰度表达,推测其主要的生理功能与感受、识别信息化学物质有关。

图2 AglaOBP1与其他昆虫OBPs的多序列比对Fig.2 Sequence alignment of OBPs form Anoplophora glabripennis and other insects
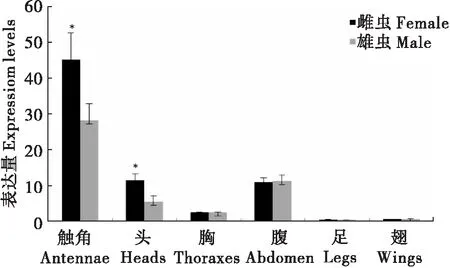
图3 qRT-PCR分析AglaOBP1在成虫不同组织中的表达Fig.3 qRT-PCR analysis of AglaOBP1 expressed in different tissues注:*表示同一组织之间雌雄虫的表达量差异达到显著水平。Note: *Indicated significant difference in expression level of AglaOBP1 in the same tissues of both sexes.
2.4 AglaOBP1重组蛋白的表达及纯化
利用带限制性酶切位点的特异性引物成功扩增到去信号肽的AglaOBP1编码区序列(图4 A),然后转化连接到pMD®119-T克隆载体,并分别利用酶切和DNA测序得到验证(图4 B),将目的片段与表达载体pET28a(+)连接后成功转入BL21感受态细胞并进行诱导表达,通过优化蛋白表达条件(IPTG浓度、诱导温度、转速、培养瓶体积)后经SDS-PAGE检测表明重组蛋白始终以包涵体的形式存在。通过盐酸胍变性,胱氨酸、半胱氨酸及稀释复性后获得了有生物活性的可溶蛋白,经亲和层析柱纯化后,获得大小约16 kDa的单一蛋白条带(图5),BCA法测定重组蛋白的浓度为0.87 mg/mL。
2.5 AglaOBP1与气味配体的结合能力
重组AglaOBP1蛋白溶液自身无明显的荧光现象。当以2 μM浓度梯度的1-NPN滴定稀释后的蛋白溶液时,蛋白溶液在410 nm左右产生强烈的荧光现象。随着1-NPN浓度的不断增大,荧光强度值的增幅逐渐减小,最终激发荧光达到峰值后不再变化,蛋白溶液与1-NPN呈现出饱和效应。以1-NPN浓度及对应的最大荧光强度值进行非线性回归分析,计算出重组蛋白AglaOBP1与1-NPN的结合常数为7.65 μM(图6)。

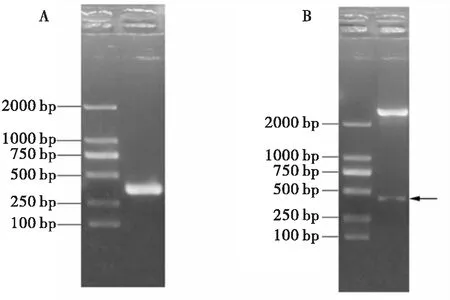
图4 AglaOBP1基因扩增及克隆质粒的酶切鉴定Fig.4 PCR amplification of AglaOBP1 gene and digestion analysis of clone plasmidA,AglaOBP1基因去信号肽的编码区扩增;B,克隆质粒pMD®19-T/AglaOBP1的酶切鉴定。A, PCR amplification of AglaOBP1 gene without signal peptide sequence; B, Digestion analysis of clone plasmid pMD®19-T/AglaOBP1 with restriction enzyme.

图5 重组蛋白AglaOBP1诱导表达的SDS-PAGE分析Fig.5 SDS-PAGE electrophoretic analysis of expressed recombine AglaOBP1注:M,蛋白分子量标准;1,未诱导的pET28a(+)/AglaOBP1复合物;2,诱导的pET28a(+)/AglaOBP1重组蛋白;3,pET28a(+)/AglaOBP1重组蛋白上清;4,pET28a(+)/AglaOBP1重组蛋白包涵体;5,纯化的pET28a(+)/AglaOBP1重组蛋白。Note: M, Standard protein marker; 1, Noninduced pET28a(+)/AglaOBP1; 2, Induced pET28a(+)/AglaOBP1; 3, Supernatant of the induced pET28a(+)/AglaOBP1; 4, Inclusion body of induced pET28a(+)/AglaOBP1; 5, The purified protein of pET28a(+)/AglaOBP1.
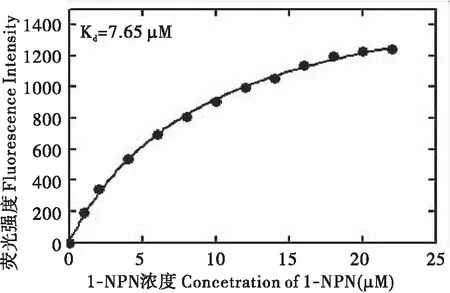
图6 AglaOBP1/1-NPN的结合曲线及Scatchqrd方程Fig.6 Binding curves of 1-NPN and relative Scatchard plots for recombinant AglaOBP1
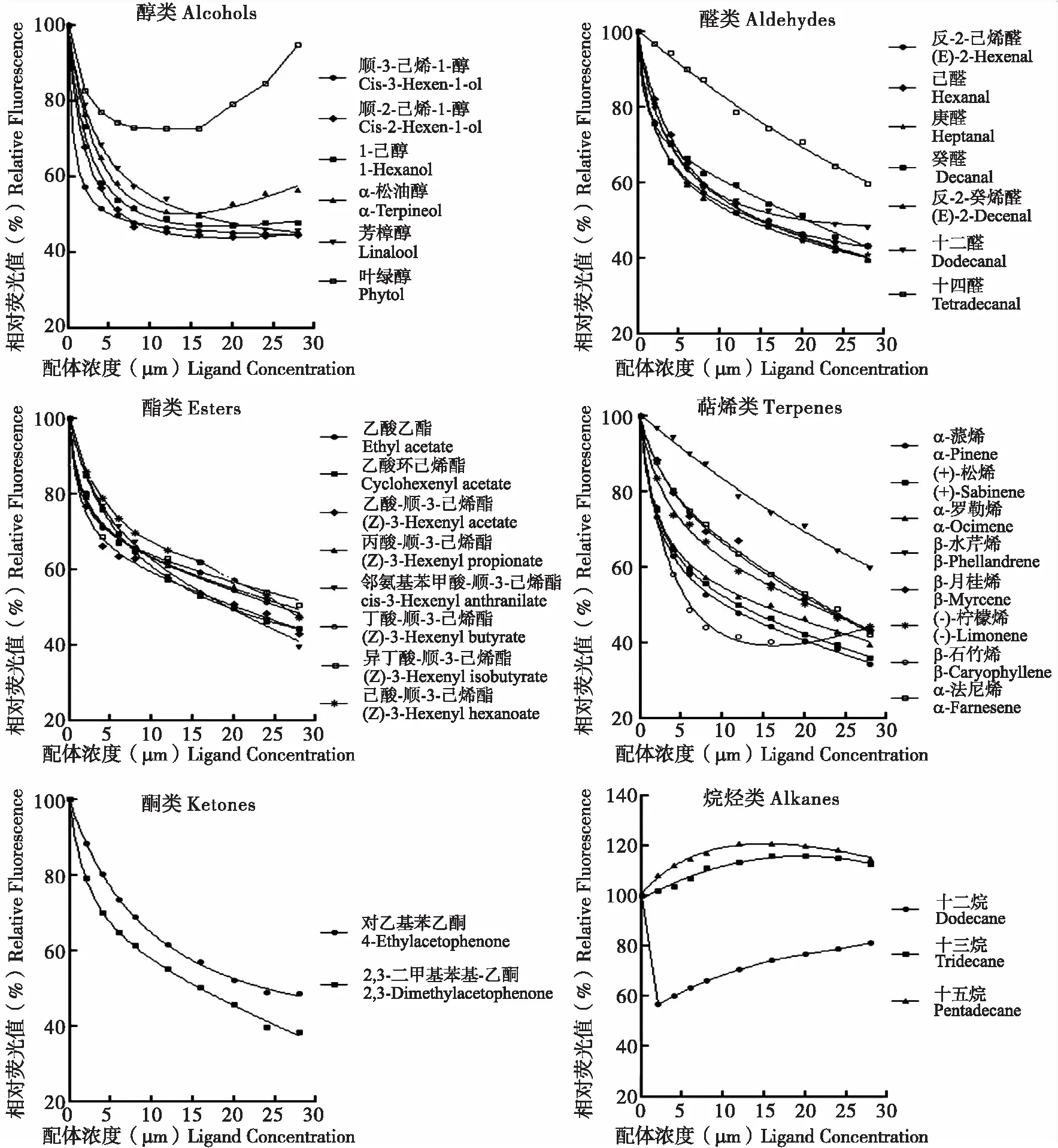
图7 重组AglaOBP1与五角枫主要植物挥发物的竞争结合曲线Fig.7 The competitive binding curves of AglaOBP1 to host plant volatiles

气味配体Ligands分子量Molecularweight分子式Formula纯度(%)PurityIC50(μM)Ki(μM)醇类Alcohols顺⁃3⁃己烯⁃1⁃醇Cis⁃3⁃Hexen⁃1⁃ol10016C6H12O980(AR)665588顺⁃2⁃己烯⁃1⁃醇cis⁃2⁃Hexen⁃1⁃ol10016C6H12O>920(GC)9428331⁃己醇1⁃Hexanol10218C6H14O>980(AR)13901229α⁃松油醇α⁃Terpineol15425C10H18O980(AR)27562437芳樟醇Linalool15425C10H18O>980(GC)16781484叶绿醇Phytol29653C20H40O>980(GC)--醛类Aldehydes反⁃2⁃己烯醛(E)⁃2⁃Hexenal9815C6H10O980(AR)14191255己醛Hexanal10016C6H12O>950(AR)16221435庚醛Heptanal11418C7H14O970(AR)14961323癸醛Decanal15626C10H20O970(AR)20091777反⁃2⁃癸烯醛(E)⁃2⁃Decenal15425C10H18O95013451190十二醛Dodecanal18432C12H24O95020321797十四醛Tetradecanal18428C11H20O2980--酯类Esters乙酸乙酯Ethylacetate8811C4H8O2≥997(GC)27342418乙酸环己烯酯Cyclohexenylacetate14018C8H12O296019351711乙酸⁃顺⁃3⁃己烯酯(Z)⁃3⁃Hexenylacetate14220C8H14O2>970(GC)19951764丙酸⁃顺⁃3⁃己烯酯(Z)⁃3⁃Hexenylpropionate15622C9H16O297029182581邻氨基苯甲酸⁃顺⁃3⁃己烯酯cis⁃3⁃Hexenylanthranilate21928C13H17NO2>980(GC)18871669丁酸⁃顺⁃3⁃己烯酯(Z)⁃3⁃Hexenylbutyrate17025C10H18O298027342418异丁酸⁃顺⁃3⁃己烯酯(Z)⁃3⁃Hexenylisobutyrate17025C10H18O2970--己酸⁃顺⁃3⁃己烯酯(Z)⁃3⁃Hexenylhexanoate19830C12H22O2980--萜烯类Terpenoidsα⁃蒎烯α⁃Pinene13623C10H16980(AR)1026907 + ⁃桧烯 + ⁃Sabinene13623C10H16≥98511641029α⁃罗勒烯α⁃Ocimene13623C10H16≥900(AR)14191255β⁃水芹烯β⁃Phellandrene13623C10H16>650(GC)--β⁃月桂烯β⁃Myrcene13623C10H16>900(GC)21481900(⁃)⁃柠檬烯(⁃)⁃Limonene13623C10H16>950(GC)19351711β⁃石竹烯β⁃Caryophyllene20435C15H24>900(GC)845747α⁃法尼烯α⁃Farnesene20435C15H24mixtureofisomers22121956
续上表
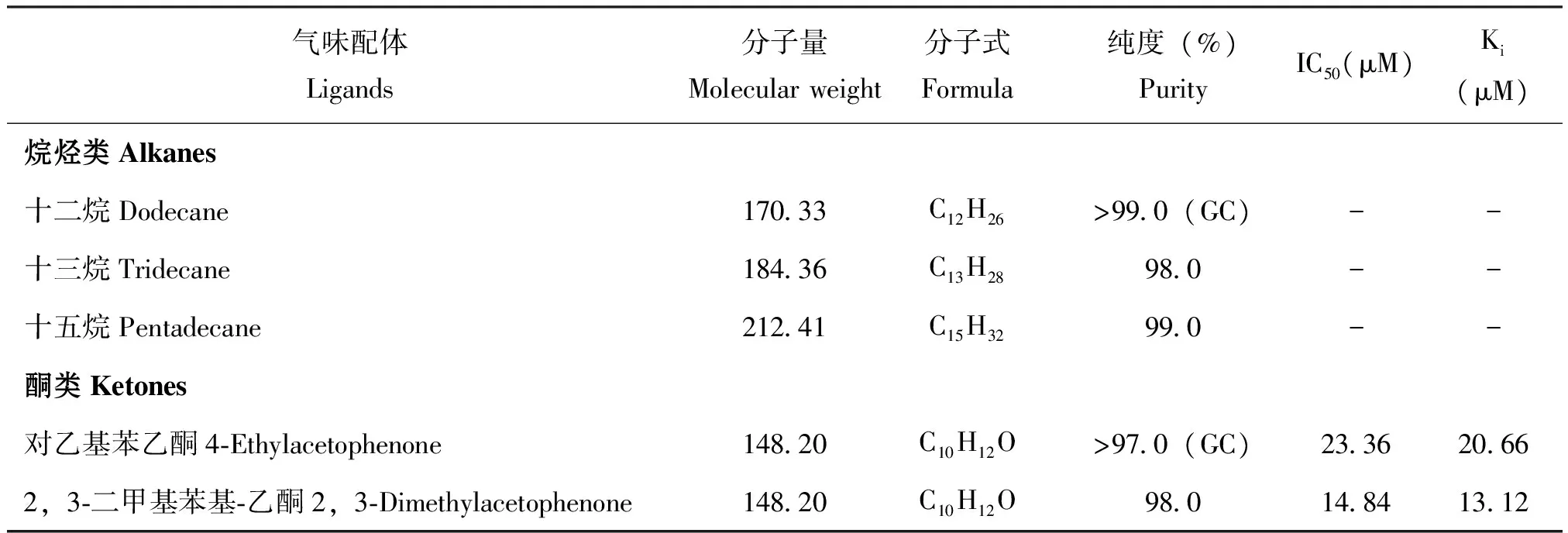
气味配体Ligands分子量Molecularweight分子式Formula纯度(%)PurityIC50(μM)Ki(μM)烷烃类Alkanes十二烷Dodecane17033C12H26>990(GC)--十三烷Tridecane18436C13H28980--十五烷Pentadecane21241C15H32990--酮类Ketones对乙基苯乙酮4⁃Ethylacetophenone14820C10H12O>970(GC)233620662,3⁃二甲基苯基⁃乙酮2,3⁃Dimethylacetophenone14820C10H12O98014841312
3 结论与讨论
本研究从光肩星天牛触角中克隆了一种OBP基因AglaOBP1,序列比对发现AglaOBP1属于OBP家族Minus-C OBP亚家族基因。在天牛科昆虫触角中Minus-C OBP基因种类较多,如李慧(2012)通过构建云斑天牛Batocerahorsfieldi触角cDNA文库并结合ESTs测序,获得9种Minus-C OBPs基因,占鉴定到总OBPs的60%;Hu等(2016)通过转录组测序在光肩星天牛触角中共鉴定到42种OBPs,其中Minus-C OBP占OBPs基因总数的42.5%,且不同Minus-C OBPs序列的相似度较低,在3.3%-55.0%;Gao等(2015)通过构建松墨天牛触角cDNA文库和ESTs测序,共鉴定到4种OBPs,其中2种属于Minus-C OBPs基因。前人通过对不同昆虫基因组及转录组序列所包含的OBP比较发现,Minus-C OBPs更多地存在于比较原始的昆虫中,而Classical OBPs、Plus-C OBPs更多地存在于较为进化的物种中,昆虫OBPs向着产生更多半胱氨酸残基的方向进化(Vieiraetal., 2011)。Minus-C OBPs属于光肩星天牛触角气味结合蛋白的一个大类群,在进化上程度上相对原始,但本实验的测定结果表明光肩星天牛的Minus-C OBP(AglaOBP1)仍具有识别寄主植物挥发物的功能。
本研究构建了重组表达质粒pET28a(+)/AglaOBP1并在BL21(DE3)表达感受态细胞中成功表达。经过对诱导表达条件的优化,如IPTG浓度、诱导温度、诱导时间、转速、培养菌液的容器大小等反复试验后发现,即使在16℃、160 rpm、IPTG浓度为0.05 mM时,重组蛋白AglaOBP1仍以包涵体的形式存在。通过8 M的盐酸胍溶解包涵体,考虑到OBPs属于含有较多半胱氨酸的蛋白,通过依次加入还原剂二硫苏糖醇(DTT)(10 mM)、胱氨酸(5 mM)、半胱氨酸(5 mM)减少分离获得的包涵体中含有链间形成的二硫键和链内的非活性二硫键,提高了蛋白的复性效果。因为复性的蛋白溶液中含有少量的DTT会还原蛋白纯化层析柱中的Ni离子,使镍离子柱的吸附能力降低。本实验在纯化蛋白之前将复性的蛋白溶液经过透析降低了还原剂的浓度,提高了镍离子柱的吸附能力,获得了较高纯度且有生物活性的重组蛋白,为测定气味结合蛋白结合气味分子的生理功能奠定了基础。利用以上蛋白变性、复性方法,已成功获得了如棉铃虫(Zhangetal., 2012)、苜蓿盲蝽(Guetal., 2011)、梨小食心虫Grapholitamolesta(Lietal., 2016)、华北大黑鳃金龟Holotrichiaoblita(庄绪静,2012)、胡蜂Polistesdominulus(Calvelloetal., 2003)等昆虫OBP的重组蛋白。

References)
Calvello M, Guerra N, Brandazza A,etal. Soluble proteins of chemical communication in the social waspPolistesdominulus[J].CellularMolecularLifeSciences, 2003, 60 (9): 1933-1943.
Deng SS, Yin J, Zhong T,etal. Function and immunocytochemical localization of two novel odorant-binding proteins in olfactory sensilla of the scarab beetleHolotrichiaoblitaFaldermann (Coleoptera: Scarabaeidae)[J].ChemicalSenses, 2012, 37 (2): 141-150.
Du HF, Wang PX, Xu HC,etal. EAG responses of asian longhorn beetleAnoplophoraglabripennis(Coleoptera: Cerambycidae)to volatiles of hickory [J].JournalofZhejiangA&FUniversity, 2016, 33 (1): 166-171. [杜和芬, 王佩星, 徐华潮, 等. 光肩星天牛对山核桃挥发物组分的触角电位分析[J]. 浙江农林大学学报, 2016, 33 (1): 166-171]
Fan LQ, Yan SC, Cheng H,etal. Antennal activity and EAG responses of asian longhorn beetleAnoplophoraglabripennis(Coleoptera: Cerambycidae)to plant terpenes [J].JournalofNortheastForestryUniversity, 2012, 40 (11): 143-146. [范丽清, 严善春, 程红, 等. 光肩星天牛对寄主植物萜烯类化合物触角活性和电位反应[J]. 东北林业大学学报, 2012, 40 (11): 143-146]
Fan LQ, Yan SC, Sun ZH,etal. EAG and behavioral responses of Asian longhorn beetleAnoplophoraglabripennis(Coleoptera: Cerambycidae)[J].ChineseJournalofEcology, 2013, 32 (1): 142-148. [范丽清, 严善春, 孙宗华, 等. 光肩星天牛对植物源挥发物的触角电位和行为反应[J]. 生态学杂志, 2013, 32 (1): 142-148]
Gao X, Wang MQ. A cDNA library from the antenna ofMonochamusalternatusHope and binding properties of odorant-binding proteins [J].JournalofAppliedEntomology, 2015, 139 (3): 229-236.
Gong DP, Zhang HJ, Zhao P,etal. Identification and expression pattern of the chemosensory protein gene family in the silkworm,Bombyxmori[J].InsectBiochemistryandMolecularBiology, 2007, 37 (3): 266-277.
Gu SH. Exploration and Functional Analysis of Olfactory Related Genes in the Lucerne Plant Bug,Adelphocorislineolatus(Goeze)[D]. Beijing: Chinese Academy of Agricultural Sciences, 2010. [谷少华. 苜蓿盲蝽嗅觉相关基因的发掘及功能分析[D]. 北京: 中国农业科学院, 2010]
Gu SH, Wang WX, Wang GR,etal. Functional characterization and immunolocalization of odorant binding protein 1 in the lucerne plant bug,Adelphocorislineolatus(Goeze)[J].ArchivesofInsectBiochemistryPhysiology, 2011, 77 (2): 81-98.
Hekmat-Scafe DS, Scafe CR, Mckinney AJ,etal. Genome-wide analysis of the odorant-binding protein gene family inDrosophilamelanogaster[J].GenomeResearch, 2002, 12 (9): 1357-1369.
Hu P, Wang JZ, Cui MM,etal. Antennal transcriptome analysis of the Asian longhorned beetleAnoplophoraglabripennis[J].ScientificReports, 2016, 6: 26652.
Jin FJ, Li JQ, Li JG,etal. Olfactory response ofAnoplophoraglabripennisto volatile compounds from Ash-leaf Maple (Acernegundo)under drought stress [J].ScientiaSilvaeSinicae, 2004, 40 (1): 99-105. [金幼菊, 李继泉, 李建光, 等. 光肩星天牛对干旱胁迫下复叶槭挥发物的嗅觉反应[J]. 林业科学, 2004, 40 (1): 99-105]
Klein U. Sensillum-lymph proteins from antennal olfactory hairs of the mothAntheraeapolyphemus(Saturniidae)[J].InsectBiochemistry, 1987, 17 (8): 1193-1204.
Krieger MJ, Ross KG. Identification of a major gene regulating complex social behavior [J].Science, 2002, 295 (5553): 328-332.
Laughlin JD, Ha TS, Jones DNM,etal. Activation of pheromone-sensitive neurons is mediated by conformational activation of pheromone binding protein [J].Cell, 2008, 133 (7): 1255-1265.
Li GW, Du J, Li YP,etal. Identification of candidate olfactory genes inGrapholitamolestaby antennal transcriptome analysis [J].PLoSONE, 2015, 10 (11): e0142193.
Li H. Construction and Analysis of cDNA Libraries from the Antenna of theBatocerahorsfieldi(Hope)and Cloning, Expression and Functional Analysis of Olfactory Related Proteins [D]. Wuhan: Huazhong Agricultural University, 2012. [李慧. 云斑天牛触角cDNA文库的构建及相关嗅觉蛋白的表达及功能分析[D]. 武汉: 华中农业大学, 2012]
Li JG. Behavioral Responses and Mechanism ofAnoplophoraglabripennis(Motschulsky)to Host Volatile Compounds [D]. Beijing: Beijing Forestry University, 2001. [李建光. 光肩星天牛对寄主植物挥发性物质的行为反应及作用机理的研究[D]. 北京: 北京林业大学, 2001]
Li X, Ju Q, Jie WC,etal. Chemosensory gene families in adult antennae ofAnomalacorpulentaMotschulsky (Coleoptera: Scarabaeidae: Rutelinae)[J].PLoSONE, 2015, 10 (4): 1-22.
Liu S, Rao XJ, Li MY,etal. Identification of candidate chemosensory genes in the antennal transcriptome ofTenebriomolitor(Coleoptera: Tenebrionidae)[J].ComparativeBiochemistryandPhysiology-PartD:GenomicsandProteomics, 2015, 13: 44-51.
Spinelli S, Lagarde A, Iovinella I,etal. Crystal structure ofApismelliferaOBP14, a C-minus odorant-binding protein, and its complexes with odorant molecules [J].InsectBiochemistryandMolecularBiology, 2012, 42 (1): 41-50.
van den Berg MJ, Ziegelberger G. On the function of the pheromone binding protein in the olfactoryhairs ofAntheraeapolyphemus[J].JournalofInsectPhysiology, 1991, 37 (1): 79-85.
Vandermoten S, Francis F, Haubruge E,etal. Conserved odorant-binding proteins from aphids and eavesdropping predators [J].PLoSONE, 2011, 6 (8): e23608.
Vieira FG, Rozas J. Comparative genomics of the odorant-bindingand chemosensory protein gene families across the arthropoda: Origin and evolutionary history of the chemosensory system [J].GenomeBiologyandEvolution, 2011, 3 (1): 476-490.
Wang AJ, Sangbaye, Shi YJ. Study on prediction of occurrence ofAnoplophoraglabripennisin Xinjiang [J].XinjiangAgriculturalSciences, 2010, 47 (7): 1360-1364. [王爱静, 桑巴叶, 史彦江. 新疆黄斑星天牛的发生期预测预报方法研究[J]. 新疆农业科学, 2010, 47 (7): 1360-1364]
Wei D, Ye ZF, Gao JQ,etal. Molecular cloning and functional identification of a Minus-C odorant binding protein from the rice striped stem borer, (Lepidoptera: Pyralidae)[J].ActaEntomologicaSinica, 2013, 56 (7): 754-764. [魏丹, 叶占峰, 高建清, 等. 二化螟Minus-C气味结合蛋白的分子克隆及功能鉴定[J]. 昆虫学报, 2013, 56 (7): 754-764]
Xu P, Atkinson R, Jones DNM,etal. Drosophila OBP LUSH is required for activity of pheromone-sensitive neurons [J].Neuron, 2005, 45 (2): 193-200.
Yin J, Feng HL, Sun HY,etal. Functional analysis of general odorant binding protein 2 from the meadow moth,LoxostegesticticalisL. (Lepidoptera: Pyralidae)[J].PLoSONE, 2012, 7 (3): e33589.
Zhang FJ. Study on the Response ofAnoplophoraglabripennis(Motschulsky)to the Volatiles from Maples and Herbivore-induced Signals [D]. Beijing: Beijing Forestry University, 2006. [张风娟. 光肩星天牛对槭树挥发物的响应及虫害诱导信号物质研究[D]. 北京: 北京林业大学, 2006]
Zhang S, Chen LZ, Gu SH,etal. Binding characterization of recombinant odorant-binding proteins from the parasitic wasp,Microplitismediator(Hymenoptera: Braconidae)[J].JournalofChemicalEcology, 2011, 37 (2): 189-194.
Zhang TT, Mei XD, Feng JN,etal. Characterization of three pheromone-binding proteins (PBPs)ofHelicoverpaarmigera(Hübner)and their binding properties [J].JournalofInsectPhysiology, 2012, 58 (7): 941-948.
Zhou JJ, Zhang GA, Huang W,etal. Revisiting the odorant-binding protein LUSH ofDrosophilamelanogaster: Evidence for odour recognition and discrimination [J].FebsLetters, 2004, 558 (1): 23-26.
Zhuang XJ. Prediction to the Key Binding Site of Odorant Binding Protein ofHolotrichiaoblitaFaldermann (Coleoptera: Scarabaeida)[D]. Beijing: Chinese Academy of Agricultural Sciences, 2012. [庄绪静. 华北大黑鳃金龟气味结合蛋白特异性结合位点探讨[D]. 北京: 中国农业科学院, 2012]
Cloning,expression,andbindingpropertiesofodorantbindingprotein1fromAnoplophoraglabripennisMotschulsky(Coleoptera:Cerambycidae)
LI Guang-Wei*, CHEN Xiu-Lin, SHANG Tian-Cui, YAO Fu-Long
(College of Biology & Geography, Yili Normal University, Yining 835000, Xinjiang Uygur Autonomous Region, China)
Odorant binding protein geneAglaOBP1 fromAnoplophoraglabripenniswas cloned via reverse-transcription PCR, The sequence ofAglaOBP1 has ORF of 435 bp that encodes 144 amino acids, including signal peptides of 21 amino acids at the N-terminal. The matured protein possessed four conserved cysteine and can classified Minus-C OBP subfamily genes. The results of RT-qPCR showed thatAglaOBP1 was highly expressed in antennae, and the expression quantity in female antennae was significantly higher than that in male antennae. Recombinant AglaOBP1 (rAglaOBP1)was successfully expressed in a prokaryotic expression system and purified via Ni-NTA His·Bind Resin. The results of fluorescence competitive binding assays demonstrated that rAglaOBP1 exhibited broad binding properties and can bind aliphatic alcohols, aldehydes, terpenes and ketones. rAglaOBP1 showed higher binding abilities to Cis-3-Hexen-1-ol, Cis-2-Hexen-1-ol, 1-Hexanol, (E)-2-Hexenal, (E)-2-Decenal, β-Caryophyllene, (+)-Sabinene, α-Pinene, and 2,3-Dimethylacetophenone with theKivalue of 5.88, 8.33, 12.29, 12.55, 11.90, 10.29, 7.47, 9.07 and 13.12 μM, respectively. Besides, the functional group, the length of carbon chain and space isomerism of ligands were all influence the binding affinities of AglaOBP1.AglaOBP1 was highly expressed in antennae, and the recombinant protein showed high binding affinities with components emitted fromAcermono, illuminating AglaOBP1 play an important role in seeking host plants of the adults.
Anoplophoraglabripennis; odorant binding protein; olfactory; fluorescence binding assay; volatiles
新疆维吾尔自治区高校科研计划项目(XJEDU2014S062);新疆维吾尔自治区自然科学基金(2015211C299)
李广伟,男,1982年生,甘肃会宁人,博士,助理研究员,研究方向为农业害虫综合治理,E-mail:xbbjb2010@sina.com
*通讯作者Author for correspondence, E-mail: xbbjb2010@sina.com
Received: 2016-11-13; 接受日期Accepted: 2017-03-12
Q966;S433.5
:A
1674-0858(2017)04-0919-11
李广伟,陈秀琳,尚天翠,等.光肩星天牛气味结合蛋白AglaOBP1的克隆、表达及结合特性[J].环境昆虫学报,2017,39(4):919-929.
