印楝素A和印楝素B对棉铃虫生长发育的影响
2017-09-16李佳琪邝鹏昆肖绍伟王茂源郭永超徐汉虹
路 伟,李佳琪,邝鹏昆,肖绍伟,王茂源,郭永超,徐汉虹
(1.新疆农业大学农学院,乌鲁木齐 830052;2.华南农业大学亚热带农业生物资源保护与利用国家重点实验室,广州 510642)
印楝素A和印楝素B对棉铃虫生长发育的影响
路 伟1**,李佳琪1*,邝鹏昆1,肖绍伟1,王茂源1,郭永超1,徐汉虹2
(1.新疆农业大学农学院,乌鲁木齐 830052;2.华南农业大学亚热带农业生物资源保护与利用国家重点实验室,广州 510642)
为了明确印楝素A和印楝素B生物活性的差异,选用印楝素A和印楝素B对棉铃虫生长发育的影响进行了比较研究。结果表明:印楝素A和印楝素B对棉铃虫3龄幼虫具有良好的拒食活性,5 μg/mL处理48 h对棉铃虫3龄幼虫的拒食率分别为85.17%和69.02%。分别用含有药剂(1 μg/mL)的饲料饲喂棉铃虫5龄幼虫,结果表明:印楝素A和印楝素B能够明显抑制棉铃虫5龄幼虫的体重增长,处理14 d后幼虫的体重分别下降50.28%和43.08%,仅有少量个体化蛹,化蛹率分别为26.67%和13.33%。进一步的羽化结果表明:经印楝素A和印楝素B处理的虫蛹均未能完成羽化。综合各阶段试验结果来看,印楝素A和印楝素B的生物活性存在差异,印楝素B对棉铃虫生长发育的抑制作用高于印楝素A。
印楝素A;印楝素B;棉铃虫;生物活性;作用机理
印楝素(azadirachtin)是从印楝树种子里提取的一种植物源杀虫剂,属于四环三萜类化合物,其化学结构大体可分为十氢化萘和三环呋喃左右两部分(徐汉虹,2001),对400多种农、林、卫生害虫具有拒食、抑制昆虫生长发育、忌避、胃毒和绝育等生物活性,且害虫不易产生抗药性(Morgan,2009)。印楝素是当前世界公认的广谱、高效的环境友好型杀虫剂(陈小军等,2010)。印楝素及其类似物繁多、结构复杂,目前已分离出印楝素A、B、D、E、F、G、H、I、K、L、M、N、O、P、Q 15种印楝素类似物(Kouletal.,2003;Kanokmedhakuletal.,2005;徐汉虹等,2017),在印楝素10多种类似物中,印楝素A(AZA-A)的含量最高、拒食活性最强(徐汉虹等,2017)。另一个重要成分是印楝素B(AZA-B,3-tigloylazadirachtol),AZA-B的含量为AZA-A的1/3~1/2(张志祥等,2007)。一般认为印楝素直接或间接地通过破坏昆虫口器上的化学感受器,刺激其特异性抑制型感觉细胞,或者阻断对取食刺激物起反应的感受器受体细胞的信号输入,从而抑制昆虫的取食行为(Luoetal.,1995;Mordueetal.,1998);干扰昆虫内分泌系统,影响促前胸腺激素(PTTH)的合成与释放,使幼虫不能正常蜕皮和化蛹而导致死亡(李晓东和赵善欢,1995;Laietal.,2014)。目前国内外对AZA-B的研究较少,本文对比研究了AZA-A和AZA-B对棉铃虫Heliothisarmigera生长发育的影响,以期为进一步明确印楝素及其类似物的作用机理提供科学依据。
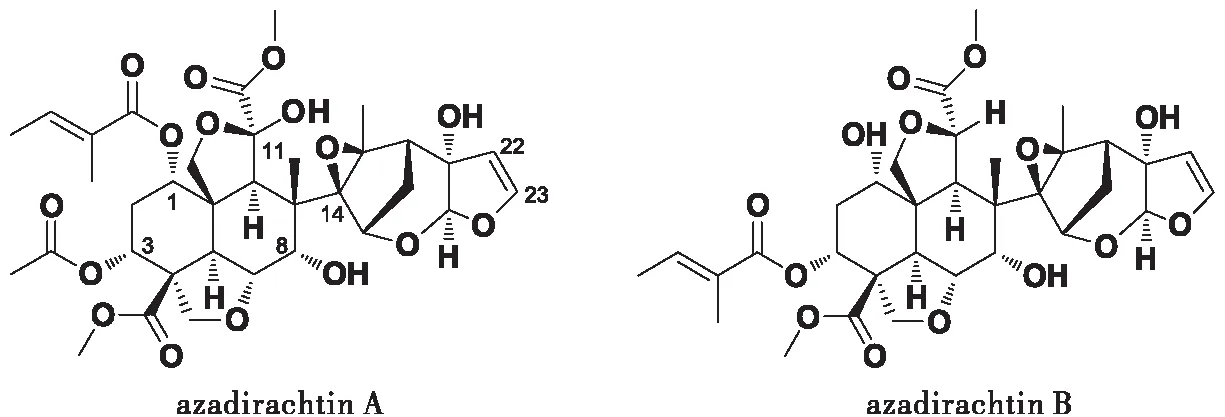
图1 印楝素A和印楝素B的化学结构式(徐汉虹,2001)Fig.1 Chemical structural formula of azadirachtin A and azadirachtin B(Xiu HH,2001)
1 材料与方法
1.1 供试材料
AZA-A(纯度97.0%)、AZA-B(纯度95.2%)均由华南农业大学亚热带农业生物资源保护与利用国家重点实验室提供。
1.2 供试昆虫
敏感品系的棉铃虫由中国农科院植物保护研究所棉花害虫研究组养虫室室内人工饲料饲养。
1.3 试验方法
1.3.1拒食活性测定
参考张志祥等(2007)的方法。将新鲜洁净的常规棉花叶片,用打孔器打成直径2 cm的叶碟。将AZA-A、AZA-B用丙酮-水(1 ∶3,v/v)配制成5 μg/mL的供试药液,将叶碟在供试药液中浸3 s后取出,室温晾干后将叶碟放入垫有保湿滤纸的培养皿(Φ=9 cm)中,每个皿放入3片叶碟、接1头饥饿处理6 h的棉铃虫3龄幼虫,每个处理10个重复,超纯水作为空白对照。48 h后测定剩余叶面积,计算非选择性拒食率。非选择性拒食率计算公式如下:

1.3.2对试虫体重和化蛹率的影响
选取棉铃虫5龄幼虫,将1 μg/mL AZA-A、AZA-B的药剂分别添加至饲料中,每个指型管内1头5龄幼虫、并放入含有药剂的饲料,每个处理15个重复。正常饲料作为空白对照。每2 d称重记录棉铃虫的体重,并观察棉铃虫的化蛹历期、化蛹率。
1.3.3对试虫蛹重和羽化率的影响
每2 d称重记录棉铃虫的蛹重,继续观察1.3.2每组处理试虫的蛹重变化及羽化情况。
2 结果与分析
2.1 AZA-A和AZA-B的拒食活性比较
AZA-A和AZA-B处理48 h后对棉铃虫3龄幼虫的非选择性拒食活性结果见表1。结果表明:AZA-A和AZA-B对棉铃虫3龄幼虫均表现出良好的拒食活性,在5 μg/mL的剂量下处理48 h,对棉铃虫3龄幼虫的拒食率分别为85.17%和69.02%,与对照处理差异显著,AZA-A和AZA-B处理之间差异不显著。
2.2 AZA-A和AZA-B对棉铃虫幼虫体重和化蛹率的影响
试验结果(见表2)表明,对照组棉铃虫5龄幼虫经过15.67 d的化蛹历期后蜕皮化蛹,化蛹率达到86.67%。而AZA-A和AZA-B对棉铃虫幼虫的体重增长具有明显抑制作用,与对照组相比,1 μg/mL剂量处理4 d后,棉铃虫5龄幼虫的体重分别下降33.15%和30.54%;处理14 d后,棉铃虫5龄幼虫的体重分别下降50.28%和43.08%,少量个体死亡,AZA-A对棉铃虫体重抑制作用优于AZA-B。与对照组相比,AZA-A和AZA-B处理组化蛹率仅为26.67%和13.33%,大部分高龄幼虫的发育停滞在幼虫阶段,未能完成蜕皮化蛹,与对照组相比差异显著。AZA-A和AZA-B处理组中少量的化蛹个体平均化蛹历期也呈现滞后推迟,分别为17.63 d和18.50 d,说明AZA-B对棉铃虫幼虫化蛹的抑制作用高于AZA-A。
2.3 AZA-A和AZA-B对棉铃虫蛹重和羽化率的影响
继续观察每组处理试虫的蛹重变化及羽化情况,试验结果见表3。结果表明:棉铃虫蛹期的蛹重呈逐渐下降的趋势,对照组棉铃虫虫蛹经过8.56 d羽化,羽化率为75.00%。而AZA-A和AZA-B处理组的虫蛹均未能完成羽化。

表1 AZA-A和AZA-B对棉铃虫3龄幼虫的非选择性拒食活性(48 h)
注:采用邓肯氏多重比较进行显著性分析(P<0.05)。Note: Duncan’s multiple comparisons were used for significance analysis (P<0.05).

表2 AZA-A和AZA-B对棉铃虫5龄幼虫体重的影响
注:采用邓肯氏多重比较进行显著性分析(P<0.05)。Note: Duncan’s multiple comparisons were used for significance analysis (P<0.05).

表3 AZA-A和AZA-B对棉铃虫蛹重和羽化率的影响
注:采用邓肯氏多重比较进行显著性分析(P<0.05)。Note: Duncan's multiple comparisons were used for significance analysis (P<0.05).
3 结论与讨论
在印楝素类似物中,AZA-B的含量和拒食活性低于AZA-A,但两者在印楝素杀虫剂中都具有重要的作用。印楝素对鳞翅目、膜翅目、鞘翅目、半翅目、同翅目和缨翅目等400多种农、林、仓储和卫生害虫具有拒食、忌避等生物活性(徐汉虹等,2017)。Liner等(1995)研究发现印楝素对大菜粉蝶Pierisbrassicae幼虫中间的栓锥感觉器的抑制型感受细胞有很强的刺激作用,但是对两侧的栓锥感觉器的蔗糖、氨基酸和芥子糖苷感受细胞没有作用。Mordue等(1998)发现印楝素及其大部分类似物都刺激了化学感受器的抑制型神经元细胞,并且指出鳞翅目昆虫草地贪夜蛾Spodopterafrugiperda、烟蚜夜蛾Heliothisvirescens、灰翅夜蛾Spodopteralittoralis和棉铃虫对印楝素的拒食活性与化学感受器的神经活性有关。张志祥等(2007)研究发现AZA-A和AZA-B对小菜蛾Plutellaxylostella、斜纹夜蛾Spodopteralitura3龄幼虫都具有良好的的拒食活性,拒食率均达80%以上,两者对棉铃虫的拒食活性达到差异显著水平。Qiao等(2014)利用电生理膜片钳技术研究了印楝素对果蝇的拒食作用,发现印楝素可以显著降低果蝇食道下神经节(Suboesophageal ganglion,SOG)Ca2+通道电流的峰值和振幅,并引起SOG兴奋性突触后电流(mEPSCs)频率的降低,进而抑制SOG的自发乙酰胆碱能的释放。昆虫大多数味觉神经元投射于SOG,与取食行为密切相关,推测印楝素通过抑制昆虫SOG兴奋性胆碱能突触传递和Ca2+通道,干扰昆虫神经中枢系统,从而起到对昆虫的拒食作用。
印楝素另一主要的作用机理是调节昆虫生长发育活性,表现为抑制幼虫生长发育,导致幼虫体质量减轻、不能正常发育,幼虫蜕皮受阻而死亡,或蜕皮后形成幼虫-蛹中间体,造成多种器官畸形而致死(Yanetal.,2012;Laietal.,2014)。Koolman等(1988)通过放射免疫法发现印楝素并不能直接与蜕皮激素受体结合;对前胸腺合成蜕皮激素也没有直接作用(Barnbyma & Klocke,1990)。说明蜕皮激素合成量的下降很可能是印楝素作用于靶器官后间接调控的结果。Lai等(2014)研究发现果蝇成虫盘是印楝素的重要靶器官,印楝素通过诱导幼虫成虫盘发生细胞凋亡,上调胰岛素样肽dilp8表达,进而降低PTTH的分泌,印楝素可能通过果蝇幼虫营养-胰岛素信号途径调控蜕皮激素、抑制幼虫生长发育。
印楝素所引发的生理效应也可能是印楝素作用于细胞生长发育、细胞骨架或其细胞信号通路后引起的效应(Huangetal.,2011;Yanetal.,2012)。Garcia等(1991)发现印楝素A可以抑制长红猎蝽Rhodniusprolixus细胞的有丝分裂。Huang等(2010)研究发现印楝素可以诱导粉纹夜蛾TrichoplusianiBTI-Tn-5B1-4细胞程序性死亡,并且AZA-A对粉纹夜蛾BTI-Tn-5B1-4细胞增殖抑制率、细胞形态和细胞膜电位的影响大于AZA-B;但AZA-B对细胞核的破损率和破损程度要显著高于AZA-A,这表明AZA-A和AZA-B在作用机理上具有一定的差异性。Huang等(2011)发现p53蛋白参与了印楝素A对Sl-1细胞周期的阻滞,抑制细胞增殖过程和诱导细胞凋亡,印楝素A通过调控Sl-1细胞中线粒体凋亡通路中Ca2+信号,诱导Sl-1细胞发生凋亡。Shao等(2016)发现印楝素A通过抑制斜纹夜蛾Sl-1细胞信号通路PI3K-AKT-Tor的磷酸化水平而诱导自噬产生,同时通过线粒体途径激活Caspase-3引发细胞凋亡,且印楝素诱导的自噬信号先于凋亡发生,并通过激活tAtg5分子开关促发细胞自噬向凋亡转化。
AZA-A和AZA-B虽然结构相似,但在母体分析碳环上C-1、C-3取代基丁烯酯键的位置存在差异,环氧环C-11取代基也存在“-H”与“-OH”的不同(张志祥等,2005)。Simmonds等(1995)认为印楝素母体分子碳环上C-7、C-11、C-22和C-23是决定生物活性的关键位置,基团取代能明显影响其活性。体重变化、化蛹率和羽化率是昆虫生长发育的几个重要指标,本试验中AZA-A和AZA-B对棉铃虫幼虫都具有良好的拒食活性,并能够显著抑制棉铃虫幼虫的蜕皮发育、化蛹率和羽化率,综合各阶段的试验结果来看,AZA-B对棉铃虫生长发育的抑制作用要高于AZA-A,引起两者差异的分子生物学机制还有待更深入的研究。
References)
Barnby MA, Klocke JA. Effects of azadirachtin on levels of ecdysteroids and prothoracicotropic hormone-like activity inHeliothisvirescens(Fabr.)larvae [J].JournalofInsectPhysiology, 1990, 36 (2): 125-131.
Chen XJ, Yang YZ, Zhang ZX,etal. Progress on safety evaluation of azadirachtin and neem insecticide [J].EcologyandEnvironmentalSciences, 2010, 19 (6): 1478-1484. [陈小军, 杨益众, 张志祥, 等. 印楝素及印楝杀虫剂的安全性评价研究进展[J]. 生态环境学报, 2010, 19 (6): 1478-1484]
Garcia ES, Gonzales MS, Azambuja P. Effects of Azadirachtin inRhodniusprolixus: Data and hypotheses [J].MemoriasdoInstitutoOswaldoCruz, 1991, 86 (Supplement 2): 107-111.
Huang JF, Shui KJ, Li HY,etal. Antiproliferative effect of azadirachtin A onSpodopteralituraSl-1 cell line through cell cycle arrest and apoptosis induced by up-regulation of p53 [J].PesticideBiochemistryandPhysiology, 2011, 99 (1): 16-24.
Huang XY, Li OW, Xu HH. Induction of programmed death and cytoskeletal damage onTrichoplusianiBTI-Tn-5B1-4 cells by Azadirachtin [J].PesticideBiochemistryandPhysiology, 2010, 98 (2): 289-295.
Kanokmedhakul S, Kanokmedhakul K, Prajuabsuk T,etal. Azadirachtin derivatives from seed kernels ofAzadirachitaexcelsa[J].JournalofNaturalProducts, 2005, 68 (7): 1047-1050.
Koolman J, Bidmon HJ, Lehmann M,etal. On the mode of action of azadirachtin in blowfly larvae and pupae [C]. Sehnal F, Zabza A, Denlinger DL. Endocrinological Frontiers in Physiological Insect Ecology, Wroclaw: Wroclaw Technical University press, 1988: 55-67.
Koul O, Multani JS, Goomber S,etal. Activity of some nonazadirachtin limonoids fromAzadirachtaindicaagainst lepidopteran larvae [J].AustralianJournalofEntomology, 2004, 43 (2): 189-195.
Lai D, Jin XY, Wang H,etal. Gene expression profile change and growth inhibition inDrosophilalarvae treated with azadirachtin [J].JournalofBiotechnology, 2014, 18 (5): 51-56.
Lin-er L, Van Loon JJA, Schoonhoven LM. Behavioural and sensory responses to some neem compounds byPierisbrassicaelarvae [J].PhysiologicalEntomology, 1995, 20 (2): 134-140.
Li XD, Zhao SH. The toxic effects and mode of azadirachtin on insects [J].JournalofSouthChinaAgriculturalUniversity, 1995, 17 (1): 118-122. [李晓东, 赵善欢. 印楝素对昆虫的毒理作用机制[J]. 华南农业大学学报, 1995, 17 (1): 118-122]
Luo L, Van Loon JJA, Schoonhoven LM. Behavioral and sensory responses to some neem compounds byPierisbrassicaelarvae [J].PhysiologicalEntomology, 1995, 20 (2): 134-140.
Mordue AJ, Simmonds MSJ, Ley SV,etal. Actions of azadirachtin, a plant allelochemical, against insects [J].PesticideScience, 1998, 54 (3): 277-284.
Morgan ED.Azadirachtin, a scientific gold mine [J].BioorganicandMedicinalChemistry, 2009, 17 (12): 4096-4105.
Qiao JD, Zou XL, Lai D,etal. Azadirachtin blocks the calcium channel and modulates the cholinergic miniature synaptic current in the central nervous system ofDrosophila[J].PestManagementScience, 2014, 70 (7): 1041-1047.
Shao XH, Lai D, Zhang ZX,etal. Induction of autophagy and apoptosisviaPI3K/AKT/TOR pathways by azadirachtin A inSpodopteralituracells [J].ScientificReports, 2016, 6: 35482.
Simmonds MSJ, Blaney WM, Ley SV,etal. Azadirachtin: Structural requirements for reducing growth and increasing mortality in Lepidopterous larvae [J].EntomologiaExperimentalisetApplicata, 1990, 55 (2): 169-181.
Xu HH. Insecticidal Plants and Botanical Insecticides [M]. Beijing: China Agriculture Press, 2001: 159-184. [徐汉虹. 杀虫植物与植物源杀虫剂[M]. 北京: 中国农业出版社, 2001: 159-184]
Xu HH, Lai D, Zhang ZX. Research and application of botanical pesticide azadirachtin [J].JournalofSouthChinaAgriculturalUniversity, 2017, 38 (4): 1-11. [徐汉虹, 赖多, 张志祥. 植物源农药印楝素的研究进展[J]. 2017, 38 (4): 1-11]
Yan C, Zhang ZX, Xu HH. An SSH library responsive to azadirachtin A contructed inSpodopteralituraFabricius cell lines [J].JournalofBiotechnology. 2012, 159 (1-2): 115-120.
Zhang ZX, Cheng DM, Xu HH. A comparative study on the bioactivity of azadirachtin A and azadirachtin B [J].PlantProtection, 2007, 33 (3): 80-82. [张志祥, 程东美, 徐汉虹. 印楝素A和印楝素B生物活性比较[J]. 植物保护, 2007, 33 (3): 80-82]
Zhang ZX, Tian YQ, Cheng DM,etal. Stability comparison of azadirachtin A and azadirachtin B [J].JournalofNanjingAgriculturalUniversity, 2005, 28 (1): 125-127. [张志祥, 田永清, 程东美, 等. 印楝素A和印楝素B的稳定性比较[J]. 南京农业大学学报, 2005, 28 (1): 125-127]
In order to confirm the bioactivity differences, azadirachtin A and azdirachtin B were used to study the effects on growth and development ofHelicoverpaarmigera. The results showed that: Azadirachtin A and azadirachtin B revealed favorable antifeedant activity against 3rdinstar larvae ofH.armigera, when the 3rdinstar larvae ofH.armigerawere treated with 5 μg/mL of azadirachtin A and azadirachtin B for 48 h, the antifeedant rates were 85.17% and 69.02%. The growing development results showed that azadirachtin A and azadirachtin B can inhibit the growth of 5thinstar larvae ofH.armigeraafter 14 d at 5 μg/mL, and larval weight were decreased by 50.28% and 43.08%, respectively. Only a few individuals completed pupation, pupation rate were 26.67% and 13.33%. The further results showed that the pupae ofH.armigeratreated by azadirachtin A and azadirachtin B were failed to complete eclosion. According to the test results at various stages, the conclusion was that the bioactivities of azadirachtin A and azadirachtin B were different, and inhibition of azadirachtin B on the growth ofH.armigerawas higher than azadirachtin A.
Azadirachtin A; azadirachtin B;Helicoverpaarmigera; bioactivity; mechanism
新疆农业大学大学生创新项目(DXSCX92016001)
路伟,男,1984年生,博士,硕士生导师,研究方向为农药安全性评价,E-mail:teerakon@sina.com
*并列第一作者:李佳琪,男,1994年生,本科生,E-mail: 458534582@qq.com
Received: 2017-06-23; 接受日期Accepted: 2017-07-17
Q965.9;S448
:A
1674-0858(2017)04-0945-05
路 伟,李佳琪,邝鹏昆,等.印楝素A和印楝素B对棉铃虫生长发育的影响[J].环境昆虫学报,2017,39(4):945-949.
**通讯作者Author for correspondence, E-mail: teerakon@sina.com
EffectsofazadirachtinAandazadirachtinBonthegrowthanddevelopmentofHeliothisarmigera
LU Wei1**, LI Jia-Qi1*, KUANG Peng-Kun1, XIAO Shao-Wei1, WANG Mao-Yuan1, GUO Yong-Chao1, XU Han-Hong2(1. College of Agronomy, Xinjiang Agricultural University, Urumqi 830052, China; 2. State Key Laboratory for Conservation and Utilization of Subtropical Agro-bioresources, South China Agricultural University, Guangzhou 510642, China)
