甜樱桃斑果病研究进展及其防治
2017-09-16刘庆忠
刘庆忠
(山东省果树研究所,山东泰安 271000)
甜樱桃斑果病研究进展及其防治
刘庆忠
(山东省果树研究所,山东泰安 271000)
类病毒是一类单链、闭合环状低分子量的致病性RNA,大小为246~463bp,无蛋白质外壳包裹,是目前发现的最小病原物。类病毒侵染性强,可导致被侵染的细胞或组织发生异常,侵染后造成类似病毒感染的矮化、斑驳、叶变形、裂皮、斑果和坏死等症状。从类病毒的危害症状、检测及鉴定、致病机理、传播及防治等方面介绍了引起甜樱桃斑果病的啤酒花矮化类病毒。
啤酒花矮化类病毒;甜樱桃;斑果病;鉴定;症状;防治

随着甜樱桃新品种、新砧木和高效栽培技术在生产上的广泛应用,甜樱桃种植在中国取得了快速发展。2016年中国甜樱桃栽培面积达18万hm2,产量70万t,种植面积在近几年翻了两翻。在生产快速发展的同时,新的病害不断出现,如叶片退绿黄化、花而不实、果实畸形、皱缩、果实出现斑点、果实变小、丛枝、枯枝死树等,严重影响了甜樱桃的产量和品质。
1971年美国科学家Diener在研究马铃薯纺锤块茎病的过程中,提出了“类病毒”的概念[1]。类病毒(Viroid)是一类单链、闭合环状低分子量的致病性RNA,大小为246~463bp,无蛋白质外壳包裹,是目前发现的最小病原物。类病毒侵染性强,通常可导致被侵染的细胞或组织发生异常。侵染后造成类似病毒感染的矮化、斑驳、叶变形、裂皮、斑果和坏死等症状。笔者主要介绍由啤酒花矮化类病毒(Hop stunt viroid,HSVd)引起的甜樱桃斑果病(Dapple fruit)。
1 HSVd在樱桃上的危害症状
2008年土耳其研究者首次报道了啤酒花矮化类病毒侵染甜樱桃和酸樱桃,研究者在26个果园收集了127株树上的样品,采集样品均无症状表现,经RT-PCR检测甜樱桃HSVd感病率为13.5%,酸樱桃感病率为45.5%[2]。中国于2017年首次报道了啤酒花类病毒能引起“红灯”甜樱桃果实出现深红色斑点,即“Dapple fruit”的症状[3]。进一步田间调查发现,该病害在山东、辽宁、山西、甘肃、北京、陕西等甜樱桃产区普遍存在。甜樱桃品种红灯、早大果、红蜜、雷尼、美早、萨米特、桑提娜、先锋、芝罘红和布鲁克斯等均有发生。发病严重的树体不仅出现斑果,而且果实变小、皱缩,成熟期变晚,失去商品价值。有的还表现出枯枝、树势衰退甚至整枝死亡等症状。嫁接树结果后2~3年,即表现典型的斑果症状(图1)。目前,中国樱桃还未见染病现象。
2 甜樱桃HSVd的检测及其鉴定
类病毒分为马铃薯纺锤块茎类病毒科(Pospiviroidae)和鳄梨日斑类病毒科(Avsunviroidae)2个科。至今发现的30多种类病毒,其中大部分属于马铃薯纺锤块茎类病毒科,其科下分为5个属28个种,引起甜樱桃斑果病的HSVd是该科啤酒花矮化类病毒属(Hostuviroid)的唯一成员,无蛋白质外壳包裹,又无编码蛋白的功能,不能采用酶联免疫吸附反应(ELISA)等血清学方法进行检测。目前,常用的检测方法主要有生物学检测及分子生物学技术检测两种。

图1 甜樱桃斑果病田间症状
2.1 指示植物法
HSVd检测采用四叶黄瓜(CucumissativusL. cv Suyo)作为指示植物。具体的做法是:将营养土装入塑料营养钵内,用水均匀灌溉,无积水时将黄瓜种整齐的播种于营养钵内,置于温室条件下生长。待黄瓜长至二叶期时,将待检测的各样品低分子RNA溶液与接种缓冲液(100mM Tris-base,10mM EDTA,pH7.5)以1∶100的比例混合后,用棉棒蘸取摩擦接种于黄瓜叶片上,以不接种的四叶黄瓜作为阴性对照,每个样品接种10株。待黄瓜长出第四片真叶时,将每株分别移栽于营养钵内,温室保持在28~32℃。观察记录黄瓜生长情况。接种3~4周后接种植株发生植株明显矮化,节间缩短,叶片翻卷等现象(图2),健康植株未出现任何症状。生物学鉴定能够提供类病毒繁殖和致病的证据,是一种重要的检测方法。
2.2 RT-PCR扩增
逆转录-聚合酶链式反应(RT-PCR)是目前非常成熟、应用广泛,灵敏度较高的检测方法,已成功用于检测多种类病毒。HSVd检测具体操作为:选取健康植株和具有斑果症状的甜樱桃叶片作为试材,提取总RNA,利用引物R1 (5′-GCTGGATTCTGAGAAGAGTT-3′)进行反转录合成cDNA,然后用R2 (5′-AAACCCGGGGCTCCTTTCTCA-3′) 和 F1 (5′-AAACCCGGGGCAACTCTTCTC-3′) 进行 PCR扩增[4]。对获得的产物进行连接转化、测序。测序结果与Genebank数据库中已有序列比对,构建系统进化树。结果表明导致甜樱桃(Prunusavium)斑果病的HSVd与李属(Prunussalicina)HSVd亲缘关系最近(图3)。

图2 接种四叶黄瓜发病植株与健康植株
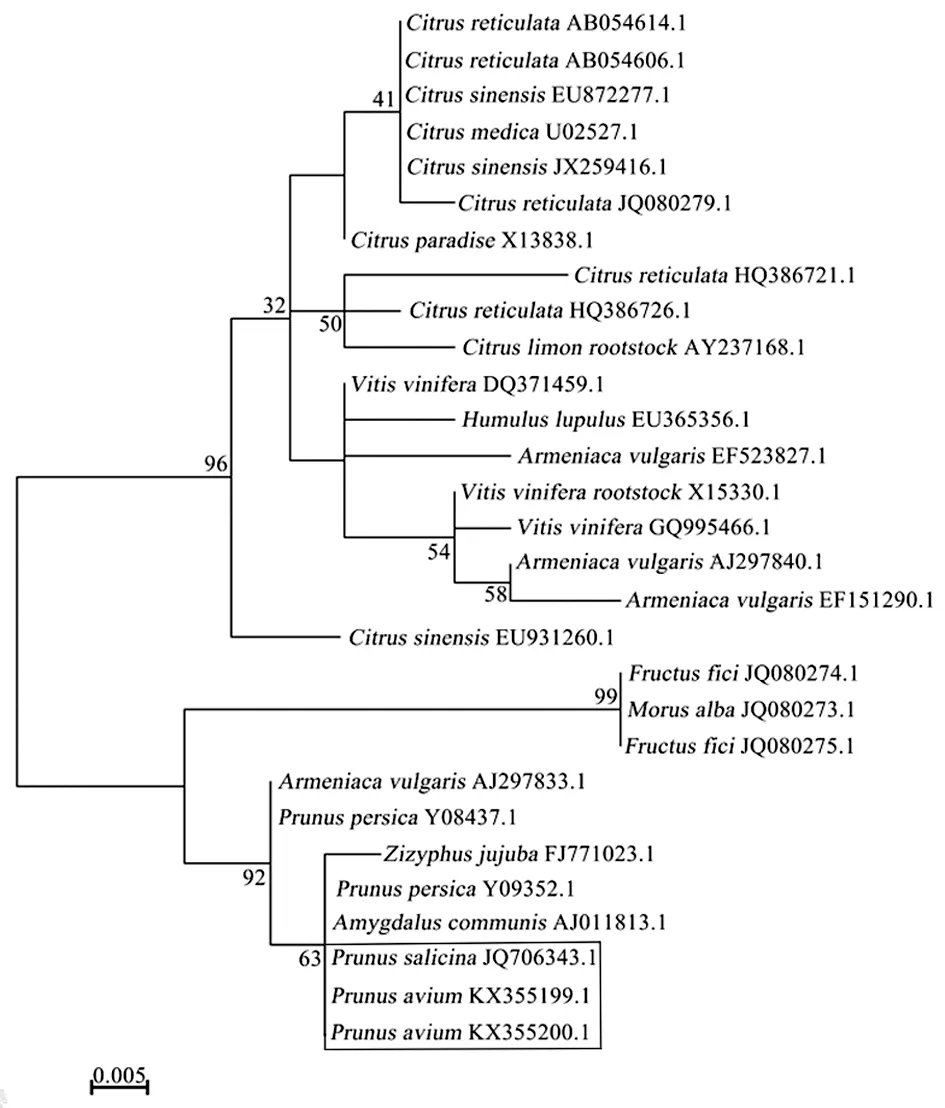
图3 甜樱桃HSVd序列与下载HSVd序列系统进化关系
2.3 高通量深测序技术(NGS)
高通量深测序技术具有非序列依赖性,能同时检测植物样品中可培养和不可培养的、含量高及含量低的所有DNA病毒、RNA病毒以及类病毒。通过高通量测序可对一个物种的转录组和基因组进行全面的分析,然后利用生物信息学软件进行基因组组装,完成病毒或类病毒的全基因组测序。相对于其他的植物病毒类病毒检测方法,NGS具有其优势,主要表现在5个方面:①NGS能快速检测病毒、类病毒,传统方法检测周期长,而NGS一般一个测序反应需要2~3天即可完成,后期的数据分析和病毒或类病毒的确认一般也可在短时间内完成,因此,NGS能够快速诊断生产实践上的疑难杂症和一些爆发性病害的病原,可为病害防治提供依据。②NGS可广谱的检测病毒或类病毒的寄主,无论是DNA病毒、RNA病毒还是类病毒,都能在一个测序反应中被检测到,不受病毒基因组类型的限制。③NGS检测病毒或类病毒灵敏度高。NGS测定的是在RNA沉默这个寄主防卫反应过程中抵抗病毒或类病毒侵染产生的高度冗余的小RNA或病毒的转录本,所以即使极低效价的病毒或类病毒也能被鉴定出来。④NGS能够对多个不同来源的样品同时进行病毒或类病毒检测。由于每个植物样品的cDNA都带有特异的标签,因此序列来源可以追溯到原始地理带的不同植物间,能快速比较病毒的分布和变异进化等特征。⑤NGS能够通过非序列同源性的方式发现病毒或类病毒。传统方法对于那些与已知的病毒或类病毒序列完全缺乏同源性的新序列在认定上存在困难,目前已经通过NGS测定siRNA和新的逐渐过滤重叠siRNA的数据分析方法,在葡萄等植物上发现了与已知的类病毒序列完全缺乏同源性的新类病毒。
3 HSVd的致病机理
HSVd是由294~303个核苷酸序列组成的RNA片段,二级结构如图所示(图4)。病毒侵入寄主敏感细胞后,通过细胞质到达相应的细胞核,在细胞核内寄主DNA依赖的RNA聚合酶(DNA dependent RNA Polymerase)作用下复制,新合成的类病毒个体又反向细胞质,通过胞间连丝进入相邻的细胞,然后进入韧皮部维管系统,长距离运输到植株的各个部位,侵入植株其他的健康细胞。类病毒本身的RNA序列,RNA二级结构和高级结构与寄主细胞内的RNA分子互作,通过RNA沉默,激素调节,特定基因的表达,调控基因细胞的蛋白质合成,干扰寄主正常的新陈代谢,导致植株表现出明显的发育障碍,出现矮化、皱缩、花叶、病斑等症状。据报道,HSVd能够影响植株体内MYB,bHLH和WRKY转录因子的表达[5]。
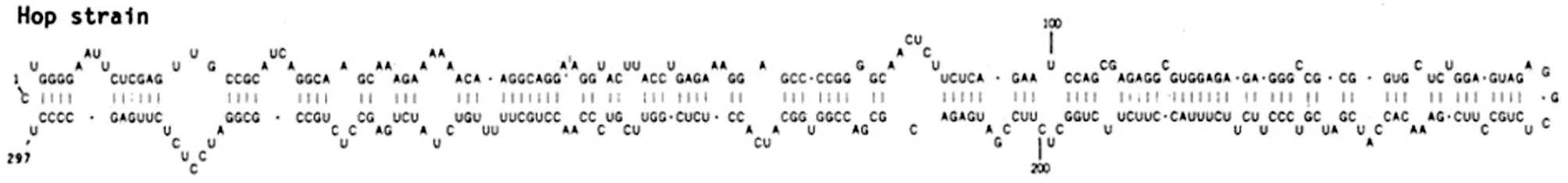
图4 HSVd类病毒二级结构图(Ohno et al., 1983)
4 HSVd的传播与防治
HSVd首次在日本啤酒花上分离得到,自然寄主范围十分广泛,包括啤酒花、黄瓜、石榴、柑桔、梨、苹果、桃、李、扁桃、樱桃、枣和无花果等草本和木本植物,世界各国均有发生。类病毒可以通过带毒材料的无性繁殖、机械摩擦、带毒的种子或者花粉以及昆虫介体等方式进行传播[6]。主要传播途径是采用带毒植物材料的无性繁殖。一旦母体材料被感染,通过快速扩繁,短时间内类病毒就能大规模扩散。20世纪六、七十年代,啤酒花矮化病害在日本突然大规模流行,给日本的啤酒花生产和啤酒酿造业造成了严重的冲击[7]。田间农事操作过程中,类病毒能够通过被污染的操作工具进行传播。尤其是对果树来说,嫁接和修剪也是类病毒传播的重要途径之一。类病毒还能够通过被感染的种子或者花粉进行传播[8]。此外,类病毒还可以通过昆虫及相邻植株间的汁液进行传播。如野生寄主中的类病毒可经蚜虫、桃蚜传播到实验寄主中。然而大量实验证明,昆虫虽可作为类病毒传播的介体,但其传播效率较低且持久性比较弱。
HSVd在杏、枣、梨和苹果等植物中呈潜伏侵染,在某些寄主上可造成严重的病害,如啤酒花矮化病、柑桔矮化裂皱病、李和桃斑果病等。HSVd侵染寄主植物后是否有症状表现与地区、品种有关,如HSVd在土耳其侵染甜樱桃,感染率达13.8%,但未见有症状报道。而在中国HSVd侵染甜樱桃引起严重斑果病、缩果病、小果病、枝枯病、植株流胶、整株死亡等现象,个别果园100%植株感染发病,危害十分严重。应当加强综合防治。首先应制定法律法规,建立严格的检疫制度,防止病害扩散。其次,生产上要使用无毒苗木。第三,建立健全果园巡视制度,及时淘汰果园病株。第四,甜樱桃生产园、苗圃必须与生产樱花及其他核果类、枣、葡萄、柑桔类和仁果类等果树的果园隔离。第五,及时清除果园杂草,防止交叉感染。第六,加强热处理、组织培养、超低温冷冻脱毒技术研究、培育无病毒苗,加强弱株系交叉防护、开展转基因抗类病毒病研究、培育抗病品种。
值得注意的是,类病毒相对于病毒病来说,虽然类病毒的寄主范围相对较窄,但近来研究发现类病毒的寄主范围有逐渐扩大的趋势[9]。如长期以来认为马铃薯纺锤块茎类病毒(PSTVd)只侵染马铃薯和番茄,但有报道表明鳄梨也是其自然寄主;开始HSVd只在啤酒花中被发现,后续研究表明其还能侵染黄瓜、苹果、桃、李、枣、无花果和梨等草本和木本植物。此外,有研究表明与马铃薯和啤酒花生长在同一农田的野草,虽不是PSTVd和HSVd的自然寄主,接种类病毒cDNA后,却能够支持类病毒在其体内进行复制。因此,如果条件合适,类病毒可能会侵染一些新的植物,所以应该严格防控类病毒传播。
[1] Diener, T.O. Potato spindle tuber "virus":IV. A replicating, low molecular weight RNA[J]. Virology, 1971, 45:411-428.
[2] Gazel M, Ulubas C, CAg Layan K, et al. Detection of Hop stunt viroid in sweet and sour cherry trees in Turkey by RT-PCR[J].Acta Horticulturae, 2008, 795(795):955-958.
[3] Xu L.javascript:popRefFull('aff1'), Wangjavascript:popRefFull('aff1') J.W., Zhu D Z.javascript:popRefFull('aff1'), et al. First Report of Hop stunt viroid From Sweet Cherry With Dapple Fruit Symptoms in China[J]. Plant disease, 2017, 101(2):394.
[4] Hassan M., Zouhar M., Rysanek P. Development of a PCR method of each latent mosaic viroid and hop stunt viroid detection for certification of planting material. Acta Horti., 2004, 675: 391-5.
[5] Zoltán Füssya, Josef Patzakc, Jan Stehlíkb, et al. Imbalance in expression of hop (Humulus lupulus) chalcone synthase H1 and itsregulators during hop stunt viroid pathogenesis[J]. Journal of Plant Physiology, 2013, 170:688-695.
[6] 张志想. 啤酒花矮化类病毒寄主适应性和致病性研究 [D]. 北京:中国农业科学院, 2012.
[7] Yamamoto, H., Kagami, Y., Kurokawa, M., et al. Studies on hop stunt disease in Japan[J]. Pharmaceutical Research Laboratory, Kirin Brewery Co., Ltd 1973, 16: 49.
[8] Mink, G. Pollen- and seed-transmitted viruses and viroids. Ann. Rev. Phytopath., 1993, 31, 375-402.
[9] Ding, B. The biology of viroid-host interactions[J]. Annual Review of Phytopathology 2009, 47: 105-131.
2017-02-13
“十二五”国家科技支撑计划(2013BAD02B03-3-2); 山东省现代农业产业技术体系果品创新团队(SDAIT-06-04)。
刘庆忠(1963-),男,山东莒南人, 研究员,主要从事果树种质资源与生物技术育种工作。E-mail: qzliu001@126.com
S662.5
A
1002-2910(2017)05-0001-04
