刺角瓜营养成分及抗氧化活性的分析与评价
2017-09-16谢红旗何英杰谢丙炎康信聪张志旭刘东波
谢红旗 何英杰 杨 甜 谢丙炎 王 蕾 康信聪 张志旭 刘东波*
(1湖南农业大学园艺园林学院,湖南长沙 410128;2国家中医药管理局亚健康干预技术实验室,湖南长沙 410128;3湖南省作物种质创新与资源利用重点实验室,湖南长沙 410128;4湖南省植物功能成分利用协同创新中心,湖南长沙 410128;5中国农业科学院蔬菜花卉研究所,农业部园艺作物生物学与种质创制重点实验室,北京 100081;6辽宁晟启昊天生物医药科技有限公司,辽宁沈阳 110000)
刺角瓜营养成分及抗氧化活性的分析与评价
谢红旗1,2,3,4何英杰1,2,4杨 甜1谢丙炎5王 蕾6康信聪1,2,4张志旭2,3,4刘东波1,2,3,4*
(1湖南农业大学园艺园林学院,湖南长沙 410128;2国家中医药管理局亚健康干预技术实验室,湖南长沙 410128;3湖南省作物种质创新与资源利用重点实验室,湖南长沙 410128;4湖南省植物功能成分利用协同创新中心,湖南长沙 410128;5中国农业科学院蔬菜花卉研究所,农业部园艺作物生物学与种质创制重点实验室,北京 100081;6辽宁晟启昊天生物医药科技有限公司,辽宁沈阳 110000)
利用高效液相色谱仪、紫外分光光度计及全自动氨基酸分析仪等对甜瓜属新种质刺角瓜的营养成分含量进行了测定,并对其抗氧化活性进行了评价。结果表明:刺角瓜富含VC、多酚、多糖及氨基酸等营养成分,其中VC含量为125 mg·kg-1,多酚含量为314 mg·kg-1,可溶性总糖、可溶性多糖含量分别为2.7%、0.5%,游离总氨基酸、必需氨基酸含量分别为9 908、3 120 mg·kg-1,水分及灰分分别占鲜质量的95.0%、0.6%;刺角瓜具有一定的抗氧化活性,其对DPPH半清除率IC50为0.060 g·mL-1,对羟自由基半清除率IC50为0.036 g·mL-1。
刺角瓜(非洲角南瓜);抗坏血酸;多酚;多糖;氨基酸;抗氧化
刺角瓜(Cucumis metuliferus)又名非洲角黄瓜,为葫芦科甜瓜属一年生蔓性草本植物,原产于非洲喀拉哈里沙漠,现今美国和新西兰等地均有种植(Weng,2010);其适应性较强,在适于黄瓜、西葫芦种植的地方均能较好生长,2010年从非洲引入我国,现以江西鄱阳刺角瓜种植规模为最大(杨运良 等,2017)。刺角瓜外皮坚硬有刺,表面凹凸不平;果肉翠绿色,形态呈凝胶状或半凝胶状;肉质细腻多汁,在国外尤其是非洲地区作蔬菜食用;同时,也常用于家庭装饰和园艺观赏。在对病虫害的抗性研究中发现,刺角瓜具有良好的抗性,不仅对根结线虫表现为高抗,能有效防止南方根结线虫、花生根结线虫和爪哇根结线虫的侵染(马金慧 等,2014),而且对环斑花叶病毒(PRSV)(Lin et al.,2013)、番木瓜环斑病毒(PRV)(Yeh & Chen,1989)、马铃薯Y病毒组(Potyviruses)(Lin et al.,2015)有抵抗作用。在药用价值方面,刺角瓜对艾滋病等疾病具有有益的影响(Yagi et al.,2014);同时还存在降血糖的潜在能力,对高血压和伤寒疾病也有治疗效果,其种子具有驱虫功效等(Jimam et al.,2010)。本文系统地分析了刺角瓜中抗坏血酸(ascorbic acid)、多酚(polyphenols)、氨基酸 (amino acids)和多糖(polysaccharide)等营养成分含量,并与文献报道的同科属蔬菜营养成分进行了比较,同时对其抗氧化能力——DPPH自由基、羟自由基清除能力进行了评价,以期为刺角瓜作为葫芦科新种质蔬菜的开发利用提供科学参考。
1 材料与方法
1.1 试验材料
试验于2016年4月在国家中医药管理局亚健康干预技术实验室完成。刺角瓜由中国农业科学院蔬菜花卉研究所谢丙炎研究员提供,为成熟鲜果,果皮呈黄色,果肉翠绿并粘附有白色种子;黄瓜购于湖南农业大学东芝源超市。
抗坏血酸(VC)、没食子酸、葡萄糖均为标准品;磷酸二氢钾、甲醇、乙醇、苯酚、蒽酮、硫酸、福林酚、碳酸钠、DPPH、硫酸亚铁、双氧水、水杨酸均为国产分析纯。
KM5200DV超声波仪,昆山超声仪器有限公司生产;1200Indinitely series高效液相色谱仪,美国安捷伦公司生产;2-16R高速离心机,湖南恒诺仪器设备有限公司生产;UV-1800紫外分光光度计,日本岛津公司生产;XS205分析天平,梅特勒-托利多国际贸易有限公司生产;RE-52A旋转蒸发仪,上海雅荣生化设备仪器有限公司生产;FD-1B冷冻干燥仪,北京博医康实验仪器有限公司生产;L-8900全自动氨基酸测定仪,日本日立公司生产。
1.2 试验方法
1.2.1 VC含量测定
1.2.1.1 供试品溶液制备 参照熊卫东等(2005)、宁德生等(2010)的方法,并加以改进。均匀取刺角瓜内翠绿色果肉5.00 g,加入10倍量0.02 mol·L-1磷酸二氢铵溶液(pH=3)作为提取溶剂(PBS),在冰水浴避光条件下进行研磨提取5 min,抽滤,滤渣继续加8倍量提取溶剂研磨提取3 min,避光静置12 min;抽滤,润洗滤渣,合并滤液,用PBS定容至100 mL容量瓶中,制备成0.05 g·mL-1的供试品溶液。
1.2.1.2 标准品溶液制备 准确称量VC标准品1.0 mg,用PBS溶解并定容于50 mL容量瓶中,制成浓度为20 μg·mL-1的VC标准品溶液,即用。
1.2.1.3 VC标准曲线 分别取制备好的标准品溶液1.0 mL,用PBS等度稀释0、2、4、6、8、10倍,混匀制成20.0、10.0、5.0、3.3、2.5、2.0 μg·mL-1的标准溶液,按照1.2.1.5色谱检测条件进样,以VC浓度为横坐标、色谱峰面积为纵坐标制作标准曲线。
1.2.1.4 VC含量测定 随机取3个刺角瓜样品,每一样品平行试验2次。将制成的供试品溶液和标准品溶液按照1.2.1.5色谱检测条件进样,计算刺角瓜VC含量。
1.2.1.5 高效液相色谱条件 Agilent-ZORBAX SBC18色谱柱(250 mm×4.6 mm,5 μm);流动相为 0.02 mol·L-1磷酸二氢铵溶液(用磷酸调节pH=3)∶甲醇=95∶5(V∶V),等梯度洗脱;柱温30 ℃,流速0.7 mL·min-1,进样量20 μL,检测波长246.5 nm。
1.2.2 多酚含量测定 采用福林酚法测定刺角瓜多酚含量。
1.2.2.1 没食子酸标准曲线 参考李静等(2008)的方法,称取没食子酸标准品0.10 g,蒸馏水溶解并定容于100 mL容量瓶中,制成1.0 mg·mL-1标准品溶液,分别移取1.0、2.0、3.0、4.0、5.0 mL定容于100 mL容量瓶中,得到10、20、30、40、50 μg·mL-1的标准品溶液;各取1.0 mL不同浓度的标准品溶液于比色管中,依次加入蒸馏水5.0 mL、福林酚试剂1.0 mL和 7.5%碳酸钠溶液3.0 mL,避光、室温条件下显色2 h,以没食子酸标准品溶液作为参比溶液,采用紫外分光光度计于765 nm波长下测定吸光度,以没食子酸浓度为横坐标、吸光度为纵坐标制作标准曲线。
1.2.2.2 刺角瓜样品处理 取5.00 g刺角瓜果肉,加入40 mL蒸馏水充分研磨,并置于100 ℃水浴下加热30 min,抽滤,冷却滤液,定容至50 mL容量瓶中,移取1.0 mL,按照1.2.2.1的方法进行测定。
1.2.3 多糖含量测定 采用蒽酮—硫酸法测定刺角瓜多糖含量。
1.2.3.1 葡萄糖标准曲线 参照张媛媛和张彬(2016)的方法干燥葡萄糖标准品,精密称量12.35 mg,定容于100 mL容量瓶中;分别取0、0.2、0.4、0.6、0.8、1.0、1.2 mL葡萄糖溶液于比色管中,加蒸馏水补足至2.0 mL,并迅速加入新配制的蒽酮—硫酸溶液(0.1 g蒽酮定容于100 mL量瓶)6 mL,摇匀放置10 min后置于冰水浴冷却5 min;以蒸馏水做参比溶液,于625 nm波长下测定其吸光度,以葡萄糖浓度为横坐标、吸光度为纵坐标制作标准曲线。
1.2.3.2 可溶性总糖含量测定 取5.00 g刺角瓜果肉,充分研磨后加入50 mL蒸馏水,加热回流2 h,抽滤,滤渣加40 mL蒸馏水继续加热回流1.5 h,合并滤液,定容至100 mL容量瓶中,取滤液按照1.2.3.1的方法测定其吸光度;以黄瓜作为对照进行相同操作,计算总糖含量。
1.2.3.3 可溶性多糖含量测定 按照1.2.3.2提取方法得到滤液,减压浓缩成浸膏,加入8倍乙醇沉淀多糖,4 ℃静置24 h,8 000 r·min-1高速离心5 min,弃上清液,用蒸馏水将沉淀溶解定容至100mL量瓶中,取滤液按照1.2.3.1的方法测定其吸光度,计算多糖含量。
1.2.4 氨基酸含量测定 根据国家标准GB/T 5009.124—2003《食品中氨基酸的测定》,利用日立L-8900全自动氨基酸测定仪检测刺角瓜中氨基酸含量,结果均以鲜果计量。
1.2.5 水分及灰分测定
1.2.5.1 水分检测 在国家标准GB 5009.3—2010《食品中水分的检测》基础上加以改进,利用冷冻干燥仪测定刺角瓜水分含量。环切,取刺角瓜样品5.00 g,置于真空冷冻干燥仪中,压力3 MPa,温度-27 ℃,干燥6 h后检测,取出样品称量;然后继续冷冻干燥6 h,两次干燥后样品质量之差小于1.0 mg为恒重。
1.2.5.2 灰分检测 根据国家标准GB 5009.4—2010《食品中灰分的检测》测定刺角瓜灰分含量。环切,取刺角瓜样品5.00 g,放在大小适宜的石英坩埚中,置马弗炉中(550±25)℃下灼烧0.5 h,冷却至200 ℃左右,取出,放入干燥器中冷却30 min,准确称量;重复灼烧至前后两次称量相差不超过0.5 mg为恒重。
1.2.6 抗氧化能力评价
1.2.6.1 供试品溶液制备 取5.00 g刺角瓜果肉,加入9倍体积蒸馏水于研钵内充分研磨成匀浆,在8 000 r·min-1条件下高速离心5 min,分别取上清液0、0.5、1.0、1.5、2.0、2.5、3.0 mL置于试管中,用蒸馏水补足至3.0 mL,摇匀,制成浓度分别为 0、0.017、0.033、0.050、0.067、0.083、0.100 g·mL-1供试品溶液。
1.2.6.2 DPPH自由基清除试验 参考韦献雅等(2014)的方法,称取4.0 mg DPPH试剂,溶于5.0 mL甲醇,再用50%乙醇定容至100 mL容量瓶中,制成40 μg·mL-1DPPH溶液,移取3.0 mL,等量加入提取液,摇匀,在37 ℃水浴条件下反应30 min;以VC标准品溶液作阳性对照,以供试品提取溶液作空白对照,采用紫外分光光度计于517 nm波长下测定吸光度。取1.2.6.1已制备好的各浓度供试品溶液,分别加入制备好的DPPH溶液3.0 mL,在暗光、37 ℃水浴条件下反应30 min;以VC标准品作阳性对照,采用紫外分光光度计于517 nm波长下测定其吸光度。

1.2.6.3 羟自由基清除试验 参考Guo等(2010)的方法,量取2 mmoL·mL-1FeSO43.0 mL、0.01% H2O23 mL,摇匀,加入6.0 mmoL·mL-1水杨酸(50%乙醇配制)3.0 mL,置于37 ℃水浴加热15 min,移出,分别加入1.2.6.1已制备好的各浓度供试品溶液1.0 mL,摇匀,继续加热15 min;以VC标准品溶液作阳性对照,以供试品提取溶液作空白对照,采用紫外分光光度计在510 nm波长下测定吸光度。

2 结果与分析
2.1 刺角瓜营养成分分析
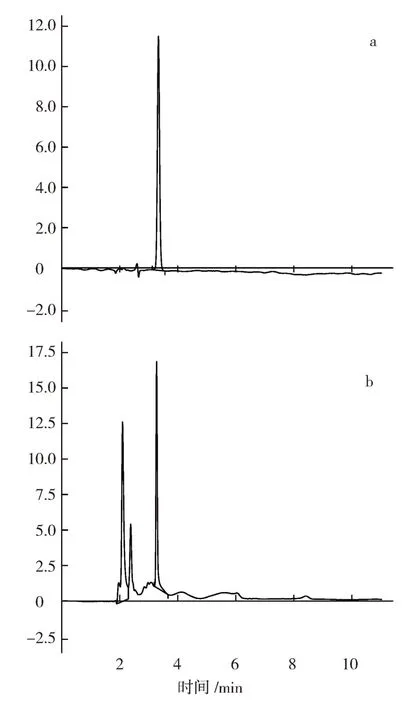
图1 HPLC色谱图
2.1.1 VC含量 VC标准品色谱图见图1-a,按照1.2.1.3的方法绘制标准曲线,VC标准曲线方程为Y=130.39X+1.510 1,R2=0.998 9(X表示标准品浓度,Y表示峰面积),VC含量在2~20 μg·mL-1之间呈良好的线性关系,最低检测限为0.05 μg·mL-1;供试品连续进样6次,RSD为1.26%。根据标准曲线计算,刺角瓜中VC含量为125 mg·kg-1(图1-b)。与葫芦科5种常见蔬菜(方敏 等,2008)相比,刺角瓜VC含量分别是黄金瓜的6.3倍、丝瓜的2.5倍、南瓜的1.6倍、黄瓜的1.4倍、稍低于冬瓜。
2.1.2 多酚含量 按照1.2.2.1的方法绘制标准曲线,没食子酸标准曲线方程为Y=0.001 8X-0.010 5,R2=0.999 2(X表示标准品浓度,Y表示吸光度);RSD为2.33%,表明多酚含量测定结果稳定。与李文仙等(2011)报道的几种常见葫芦科蔬菜多酚含量进行对比,刺角瓜多酚含量为314 mg·kg-1(表1),是西葫芦(92 mg·kg-1)的3.4倍、黄瓜 (230 mg·kg-1)的1.4倍。

表1 刺角瓜多酚含量
2.1.3 可溶性多糖含量 按照1.2.3.1的方法绘制标准曲线,葡萄糖标准曲线方程为Y=4.962X+0.033 8,R2=0.999 0,(X表示标准品浓度,Y表示吸光度),刺角瓜可溶性总糖和可溶性多糖含量分别为2.7%、0.5%,与市售黄瓜相近(表2)。

表2 刺角瓜可溶性总糖和可溶性多糖含量FW
2.1.4 氨基酸含量 从表3可以看出,刺角瓜总氨基酸含量为9 908 mg·kg-1,必需氨基酸含量为3 120 mg·kg-1;其中异亮氨酸、缬氨酸、亮氨酸、苯丙氨酸、赖氨酸等5种必需氨基酸含量分别为370、470、790、440、610 mg·kg-1,明显高于其他常见果蔬。与黄艳(2013)报道氨基酸含量较高的香蕉、哈密瓜、黄瓜作对比,刺角瓜总氨基酸、必需氨基酸及非必需氨基酸含量都较高(图2)。2.1.5 水分及灰分 本试验结果表明,刺角瓜含水量较高,占鲜质量的95.0%(RSD=0.12%);灰分占鲜质量的0.6%(RSD=0.06%)。

表3 刺角瓜氨基酸含量
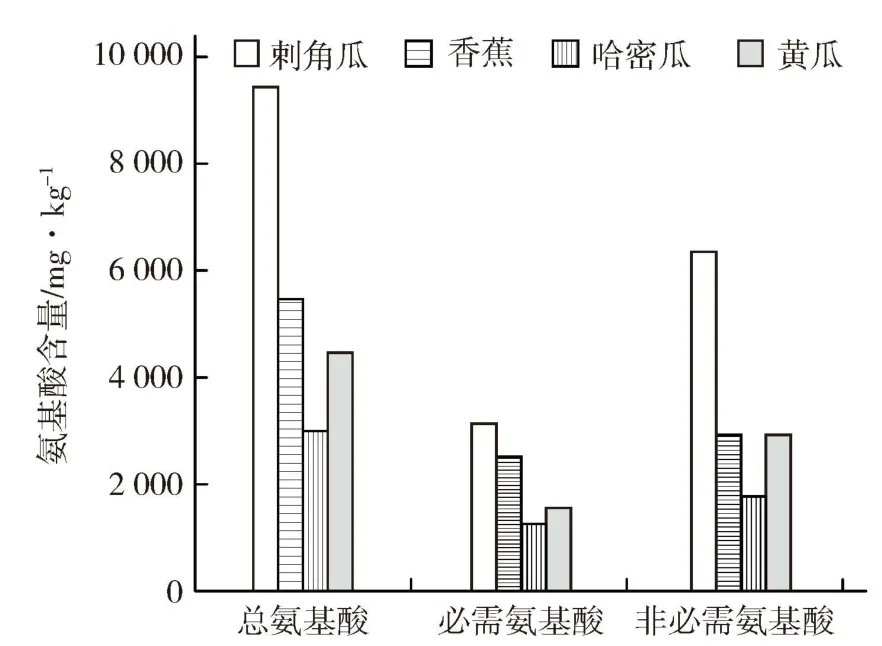
图2 刺角瓜与3种果蔬氨基酸含量对比结果
2.2 刺角瓜抗氧化活性
2.2.1 DPPH自由基清除能力 由图3可知,刺角瓜DPPH自由基清除能力与提取液浓度呈正相关,并具有良好的线性关系,R2=0.910 4;未加蒸馏水稀释的刺角瓜提取液对DPPH自由基清除率为67.7%,半清除率IC50为0.060 g·mL-1,VC对DPPH自由基的半清除率IC50为6.5 μg·mL-1。

图3 刺角瓜对DPPH自由基清除能力
2.2.2 羟自由基清除能力 由图4可知,未加蒸馏水稀释的刺角瓜提取液对羟自由基清除率达到98.0%,R2=0.868 3,线性关系较好,半清除率IC50为0.036 g·mL-1,VC对羟自由基的半清除率IC50为5.2 μg·mL-1。

图4 刺角瓜对羟自由基清除能力
3 结论与讨论
刺角瓜VC、多酚、多糖含量与黄瓜等葫芦科蔬菜作物相比较基本一致,但其异亮氨酸(Ile)、缬氨酸(Val)、亮氨酸(Leu)、苯丙氨酸(Phe)、赖氨酸(Lys)等5种必需氨基酸的含量明显高于香蕉、哈密瓜、西瓜、黄瓜等常见蔬果(黄艳,2013),占总氨基酸含量的28.5%;同时,门冬氨酸(Asp)、谷氨酸(Glu)、甘氨酸(Gly)、酪氨酸(Tyr)、精氨酸(Arg)、脯氨酸(Pro)等6种非必需氨基酸含量也较高,占总氨基酸含量的57.9%。刺角瓜整体抗氧化能力受多种内在抗氧化物的影响,如多酚、VC、多糖等,本试验从自由基清除能力方面对刺角瓜进行抗氧化活性评价,刺角瓜对DPPH自由基清除能力的VC当量为108.3 μg·g-1,羟自由基清除能力的VC当量为144.4 μg·g-1,说明刺角瓜具有一定的抗氧化能力;按照我国居民对VC的平均推荐摄入量100 mg·d-1计算(顾景范 等,2009),需分别食用刺角瓜鲜果923.3、692.5 g,即每日平均摄入807.9 g才能够达到较为理想的效果。
人体对氨基酸吸收有定量要求,其摄入量影响到人体各方面生理活动的代谢调节,氨基酸对人体生长发育、生理调节、代谢调控等方面具有重要作用。摄取食物蛋白质中的氨基酸,需要有一个比例搭配模式,模式越接近人体蛋白质的氨基酸模式,越易被吸收利用,其营养价值也越高。世界卫生组织和联合国粮农组织根据食物蛋白消化吸收和利用特点,推出理想蛋白质的标准(WHO & FAO,1973):必需氨基酸含量与总氨基酸含量的比值(E/ T)在0.40左右,与非必需氨基酸含量的比值(E/N)在0.60以上,刺角瓜E/T及E/N分别为0.31、0.46,表明其蛋白质含量接近理想含量。与氨基酸模式谱比较(王彬 等,2009),刺角瓜中苏氨酸含量、亮氨酸含量、苯丙氨酸+酪氨酸含量以及赖氨酸含量与总氨基酸含量的相对比值依次为4.14、7.97、7.47、6.16,均高于必需氨基酸模式谱(4.0、7.0、6.0、5.5);缬氨酸含量以及异亮氨酸含量与总氨基酸含量的相对比值分别为4.74、3.73,则与之接近(5.0、4.0);仅蛋氨酸+胱氨酸含量与总氨基酸含量的相对比值为0.79,低于标准模式(3.5)。表明刺角瓜中各必需氨基酸含量占总氨基酸含量的比例总体上符合氨基酸模式谱比值的要求,表现出较高的营养价值。
目前对刺角瓜的研究主要集中在种植条件探索(杨运良 等,2017)、基因表达调控(魏偲 等,2016)等方面。本试验对刺角瓜营养成分含量进行测定、评价其抗氧化活性,填补了刺角瓜营养成分分析的空白。结果表明:刺角瓜与葫芦科蔬菜作物相比,营养成分丰富,具有较高的营养价值。且由于刺角瓜具有多种优势特性(抗性),今后经大面积适应性引种后,可以考虑作为葫芦科蔬菜的潜在替代性农业经济作物。
方敏,王耀峰,宫智勇.2008.15种水果和33种蔬菜的抗氧化活性研究.食品科学,29(10):97-100.
顾景范,杜寿玢,郭长江.2009.现代临床营养学.北京:科学出版社:148.
黄艳.2013.常见果蔬中游离氨基酸含量的测定.安徽农业科学,41(9):4088-4089.
李静,聂继云,李海飞,徐国峰,王孝娣,毋永龙,王贞旭.2008. Folin-酚法测定水果及其制品中总多酚含量的条件.果树学报,25(1):126-131.
李文仙,俞丹,林玲,孙静,兰中伟,霍军生.2011.Folin-Ciocalteu比色法应用于蔬菜和水果总多酚含量测定的研究.营养学报,33(3):302-307.
马金慧,茆振川,李惠霞,谢丙炎.2014.刺角瓜对南方根结线虫的抗性及特征分析.园艺学报,41(1):73-79.
宁德生,梁小燕,方宏.2010.高效液相色谱法对罗汉果中VC含量的检测.食品科学,31(20):311-313.
王彬,蔡永强,郑伟.2009.火龙果果实氨基酸含量及组成分析.中国农学通报,25(8):210-214.
魏偲,史倩倩,马玉琴,马金慧,茆振川,凌键,杨宇红,谢丙 炎.2016.不同温度下刺角瓜过氧化物酶基因的表达及其对抗南方根结线虫作用的影响.园艺学报,43(8):1537-1544.
韦献雅,殷丽琴,钟成,章明海,牛应泽.2014.DPPH法评价抗氧化活性研究进展.食品科学,35(9):317-322.
熊卫东,郝莉花,郝亚勤,南海娟.2005.水果还原型VC和氧化型VC的含量及稳定性研究.中国农学通报,21(6):129-132.
杨运良,李建勋,马革农.2017.刺角瓜田间栽培技术.北方园艺,(1):61-62.
张媛媛,张彬.2016.苯酚-硫酸法与蒽酮-硫酸法测定绿茶茶多糖的比较研究.食品科学,37(4):158-163.
Guo X F,Yue Y D,Meng Z F,Tang F,Wang J,Yao X,Xun H,Sun J.2010.Detection of antioxidative capacity of bamboo leaf extract by scavenging hydroxyl free radical.Spectroscopy & Spectral Analysis,30(2):508-511.
Jimam N,Wannang N,Omale S,Gotom B.2010.Evaluation of the hypoglycemic activity of Cucumis metuliferus(Cucurbitaceae)fruit pulp extract in Normoglycemic AlloxanInduced Hyperglycemic Rats.Journal of Young Pharmacists,2(4):384-387.
Lin C W,Su M H,Lin Y T,Chung C H,Ku H M.2015.Functional characterization of Cucumis metuliferus proteinase inhibitor gene(CmSPI)in Potyviruses Resistance.Viruses,7(7):3816-3834.
Lin Y T,Jan F J,Lin C W,Chung CH,Chen J C,Yeh S D,Ku H M,Zhang J F.2013.Differential gene expression in response to papaya ringspot virus infection in Cucumis metuliferus using cDNA-amplified fragment length polymorphism analysis.PLoS One,8 (7):e68749.
Weng Y Q.2010.Genetic diversity among Cucumis metuliferus populations revealed by cucumber microsatellites.Hortscience Publication of the American Society for Horticultural Science,45 (2):214-219.
WHO,FAO.1973.Food and agriculture organization of the gaited nation/world heal organization:energy and protein requirement.Grieve:Report of joint FAO/WHO:61-62.
Yagi K,Siedlecka E,Pawełkowicz M,Wojcieszek M,Przybecki Z,Tagashira N,Hoshi Y,Malepszy S,Pl der W.2014.Karyotype analysis and chromosomal distribution of repetitive DNA sequences of Cucumis metuliferus using fluorescence in situ hybridization.Cytogenetic & Genome Research,144(3):237-242.
Yeh S D,Chen Y H.1989.Use of resistant Cucumis metuliferus for selection of nitrous-acid induced attenuated strains of papaya ringspot virus.Phytopathology,79(11):1033-1039.
Analysis and Evaluation of Nutritional Component and Antioxidant Activity of Cucumis metuliferus
XIE Hong-qi1,2,3,4,HE Ying-jie1,2,4,YANG Tian1,XIE Bing-yan5,WANG Lei6,KANG Xin-cong1,2,4, ZHANG Zhi-xu2,3,4,LIU Dong-bo1,2,3,4*
(1College of Horticulture and Landscape,Hunan Agricultural University,Changsha 410128,Hunan,China;2State Key Laboratory of Subhealth Intervention Technology,Changsha 410128,Hunan,China;3Hunan Provincial Key Laboratory of Crop Germplasm Innovation and Utilization,Changsha 410128,Hunan,China;4Hunan Co-innovation Center for Utilization of Botanical Functional Ingredients,Changsha 410128,Hunan,China;5Institute of Vegetables and Flowers,Chinese Academy of Agricultural Sciences,Key Laboratory on Genetic Improvement for Vegetable Germplasm,Ministry of Agriculture,Beijing 100081,China;6Liaoning Shengqihaotian Biomedical Science and Technology Co.,Ltd.,Shenyang 110000,Liaoning,China)
This paper tested the nutritional components of the novel germplasm resource Cucumis metuliferus,and evaluated its antioxidant activities by series of methods,including high performance liquid chromatography,ultraviolet spectrophotometer and full-automatic amino acid analyzer.The results showed that Cucumis metuliferus was rich in nutrients containing with VC, polyphenols,saccharides and amino acids.The VC content was 125 mg·kg-1,the polyphenols content was 314 mg·kg-1,the total soluble saccharides and soluble polysaccharides content were 2.7% and 0.5%,respectively.The total free amino acid and essential amino acid content were 9 908、3 120 mg·kg-1,respectively.The weights of moisture and ash were determined as 95.0% and 0.6% of their fresh weights, respectively.Antioxidant ability of Cucumis metuliferus was detected.Half scavenging capacity of DPPH free radical and hydroxyl radical in Cucumis metuliferus was measured as 0.060 g·mL-1and 0.036 g·mL-1,respectively.
Cucumis metuliferus;Ascorbic acid;Polyphenols;Polysaccharides;Amino acid;Antioxidant
谢红旗,男,博士,副教授,专业方向:天然产物分离分析,E-mail:xiehongqi2006@sohu.com
*通讯作者(Corresponding author):刘东波,男,博士,教授,专业方 向:药用植物资源评价,E-mail:chinasaga@163.com
2017-02-28;接受日期:2017-05-09
国家国际科技合作专项(2013DFA31790,2013DFG32060),湖南省研究生科研创新项目(CX2016B311)
